蔺 婷,熊 静,兰 超,田道法,,吴 婷,周振峰
(1.湖南中医药大学中医药防治眼耳鼻咽喉疾病湖南省重点实验室,湖南中医药大学湖南省中医药防治眼耳鼻喉疾病与视功能保护工程技术研究中心,湖南 长沙 410208;2.岳阳市中医医院,湖南 岳阳 414000)
鼻窦炎(nasosinusitis)是发生在鼻黏膜及鼻窦黏膜的炎症性疾病,属于耳鼻咽喉科的常见病[1],以鼻塞、流脓涕为主要症状,可伴有头面部疼痛、嗅觉减退或丧失等症状,临床根据病程长短分为急性和慢性[2]。欧洲和美国鼻窦炎的发病率分别高达11%和12%[3];而我国的鼻窦炎发病率也高达8%[4-5]。以上数据表明,全球范围内鼻窦炎的发病率日趋上升。
鼻窦炎在中医学中属于“鼻渊”“脑漏”范畴,中医对鼻渊的认识历史悠久。如《素问·气厥论篇》就有“胆移热于脑,则辛頞鼻渊。鼻渊者,浊涕下不止也”的记载[6-7],指出鼻渊为胆移热于脑所致。这是中医对鼻渊病因病机最早的描述。《普济方卷五十六》记载“夫脑为髓海……令胆移邪热,上入于脑,则阴气不固,而藏者泄矣,故脑液下渗于鼻,其证浊涕出不已”。随后后世医家在此基础上对本病的认识有了较完善的认识。如清代医家费伯雄所着的《医醇賸义》记载:“脑漏者,鼻如渊泉,滑涓流涕,致病有三,曰风也、火也、宠也。”提示鼻渊的风、火、宠三因,火者多为肝胆热盛所致。同时也指出“阳邪外烁,肝火内燔,鼻窍半通,时流黄水,此火伤之脑漏也”。上诉医书中详尽地论述了鼻渊与胆腑的密切关系。纵观古今,众多医家治疗鼻渊以“胆热犯鼻,湿郁窍闭”立论,以清泄胆热,利湿通窍为治法[8]。
湖南省岳阳市中医医院耳鼻咽喉科的自制药藿胆鼻渊丸(湘药制备字Z20190109000,曾用名龙胆通窍丸[9])临床治疗鼻窦炎效果显着[10-11]。藿香-龙胆草作为藿胆鼻渊丸中的君药,发挥了重要的治疗作用。藿香,味辛、性微温,属升浮之品,具有辛温通窍、祛湿化浊、除秽行气之功效,是中医临床治疗鼻渊的常用药。如《外科正宗》中有关于“脑漏”的记载:“脑漏又名鼻渊……奇授藿香汤治鼻渊,黄水浊涕长流,致脑户虚眩不已。用藿香连枝带叶五钱,水一碗,煎七分,加公猪胆汁一枚和匀,食后通口服之,至重不过三服。如此药苦甚不堪服用,藿香末一两,公猪胆汁熬稠膏为丸,每服二钱食后白滚汤送下亦效。”近年来,很多医家[12-14]在临床治疗鼻渊时都将芳香化浊之品藿香作为方中主药。《本草纲目》中记载“相火寄在肝胆,有泻无补,故龙胆之益肝胆之气,正以其能泻肝胆之邪热也”。《本经逢原》记载“龙胆草……专泻肝胆之火……凡属肝经邪热为患,用之神妙。……善清下焦湿热”。龙胆草,味苦,性寒,归肝、胆经,既能泻肝胆实火,又能利肝经湿热,泻火除湿,两善其功,切中鼻渊病机。本研究通过网络药理学结合体内实验探讨霍胆鼻渊丸中君药藿香-龙胆草的有效成分和作用靶点,旨在揭示霍胆鼻渊丸治疗慢性鼻窦炎的药效机制。
1 材料
1.1 网络药理学数据库和软件 中草药系统药理学平台TCMSP(http://lsp,nwu.edu.cn/tcmsp.php);有机小分子生物活性数据库Pubchem(https://pubchem.ncbi.nlm.nih.gov);结构相似度预测靶点数据库SwissTargetPrediction(http://www.swisstargetprediction.ch);全球蛋白质资源数据库Uniprot(http://www.uniprot.org/);基因数据库GeneCards(https://www.genecards.org/)、人类在线孟德尔遗传数据库OMIM(https://www.omim.org/)、人类疾病相关基因和突变数据库DisGent(https://www.disgenet.org)平台;绘图软件Venny(https://bioinfogp.cnb.csic.es/tools/venny/);检索已知蛋白和预测蛋白互作关系平台String(https://string-db.org/);Cytoscape3.8.2软件;Metascape(http://metascape.org/)平台;R语言软件。
1.2 实验动物 4周龄SPF级雄性SD大鼠24只,体质量(200±20)g,购于湖南斯莱克景达动物有限公司,动物质量合格证编号:202302210009;动物生产许可证号:SCXK(湘)2019-0004;实验期间大鼠均饲养于同一环境下,保持室温(24.0±1.0)℃,空气湿度为55%~65%,环境安静,大鼠自由进食进水,明、暗12 h循环饲养。动物实验的大鼠均为麻醉后脱颈椎处死,实验操作符合动物实验伦理学原则,经湖南中医药大学实验动物伦理委员会批准,伦理批号:LL2023022210。
1.3 药物与试剂 藿香(批号:221102)、龙胆草(批号:2208099)均由岳阳市中医医院中药房提供,经药剂科张禹主任药师鉴定为药物成分完全的道地药材。克拉霉素片(山东新华制药股份有限公司,0.25 g/片,批号:H19990225)。脂多糖(lipopolysa ccharide,LPS)(批号:L2880)购自美国sigma公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号:E-EL-R2856c)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(批号:E-EL-M0037c)、白细胞介素-6(IL-6)ELISA试剂盒(批号:E-EL-R0015c)均购自武汉伊莱瑞特生物科技股份有限公司;白介素-17(IL-17)ELISA试剂盒(批号:ml059373)购自上海酶联生物科技有限公司;IL-17C一抗(批号:ER1911-25)、NF-κB p65一抗(批号:ET1603-12)、TNF-α一抗(批号:ER65189)和IL-6一抗(批号:R1412-2)均购自杭州华安生物技术有限公司;IL-1β一抗(批号:SAB5700678)购自美国Sigma Aldrich公司;二抗IRDye 680RD Goat anti-Rabbit IgG(H+L)(批号:D30110-05)购自美国Licor公司;三氯乙醛水合物(批号:C804539)购自上海麦克林生化科技有限公司。
1.4 主要仪器 Odyssey CLX型多功能荧光成像仪(美国Licor公司);ELX800型全自动酶标分析仪(美国BioTek公司);JY-ZY5型蛋白转印电泳槽(北京君意东方电泳设备有限公司);WD-9405B型水平摇床(北京六一仪器厂)。
2 方法
2.1 网络药理学预测
2.1.1 药物化学成分与靶点搜集 通过TCMSP平台搜寻藿香成分,设置口服生物利用度(Oral Availability,OB)≥30%,类药性(Drug-likeness,DL)≥0.18,得到有效成分后通过其MOL.ID号搜寻药物成分作用靶点。同时,将龙胆草成分名称导入Pubchem数据库获得成分SMILES(Simplified Molecular Input Line Entry System)及化学结构式,将所得到的结构式导入到结构相似度预测靶点数据库Swiss Target Prediction预测靶点。
2.1.2 “成分-靶点”网络分析 利用Uniprot数据库下载化合物Excel数据表格,运用“TRIM”函数优化数据,使用“VLOOKUP”函数匹配靶点基因名,并通过查阅文献补充未匹配到的基因名称,对得到的药物化学成分相关靶点蛋白进行注释。将化合物基因“Network”文件和“Type”文件导入Cytoscape3.8.2软件进行网络拓扑学分析,根据Degree值(基因的连接数量)调整靶点图形、颜色、透明度和大小,构建“成分-靶点”网络。
2.1.3 疾病靶点的预测 以鼻窦炎的英文“nasosinusitis”作为关键词,在GeneCards、OMIM、DisGent平台获取疾病相关靶点,设置对象为“human”,使用“VLOOKUP”函数匹配靶点基因名。应用Venny软件获取中药活性化合物作用靶点与疾病的交集靶点,作为药物治疗鼻窦炎的潜在靶点。
2.1.4 蛋白互作网络(PPI)构建及网络拓扑分析 将交集基因导入String平台,得到蛋白互作关系。结果导入Cytoscape3.8.2软件中进行网络拓扑分析。随后,把下载好的TSV文件导入Cytoscape软件作蛋白互作网络图(protein-protein interaction,PPI)。
2.1.5 GO和KEGG富集分析 运用R语言软件对核心药物作用靶点进行GO功能和KEGG信号通路富集分析。设置H. sapiens,选择P<0.05,按P值绘制成柱状图,作可视化分析。同时,根据所属通路将各靶点进行归类,将信息导入Cytoscape 3.8.2软件中进行可视化处理,构建“成分-靶点-通路-疾病”网络图。
2.2 动物实验验证
2.2.1 药物制备 根据藿胆鼻渊丸[9]的处方组成,每剂处方中藿香8 g、龙胆草10 g,即人的剂量约为257 mg/kg。称取藿香40 g、龙胆草50 g,加蒸馏水煎煮2次,将2次的煎煮液混匀,纱布过滤药渣,放于冷冻干燥器中得到生药质量浓度为1 g/mL的浓缩液。克拉霉素临用时以生理盐水溶解并配制成相应浓度。
2.2.2 动物分组与造模 将24只SPF级雄性SD大鼠按随机数字表法分为对照组、模型组、藿香-龙胆草组、阳性药组,每组6只。对照组常规饲料和蒸馏水饲养,不作其他处理。其余各组大鼠建立鼻窦炎模型[15-16],腹腔注射10%三氯乙醛水合物(0.01 mL/kg)使大鼠麻醉,用镊子取2.0 cm×1.0 cm×0.5 cm大小的鼻腔止血海绵塞入大鼠一侧鼻腔内,随后同侧鼻腔内滴入1 mg/L的LPS 100 μL;对照组大鼠鼻腔内滴生理盐水200 μL。
2.2.3 动物给药与取材 根据人与动物间等效剂量[17]换算出各组给药剂量。造模4周后,藿香-龙胆草组大鼠灌胃1 586 mg/kg藿香-龙胆草药液2 mL;阳性药组大鼠灌胃43 mg/kg克拉霉素片溶液2 mL;对照组和模型组大鼠灌胃2 mL生理盐水。1次/d,连续给药4周。末次给药后12 h,10%三氯乙醛水合物麻醉大鼠,用血清分离管收集大鼠全血标本,并取新鲜鼻黏膜组织,备用。
2.2.4 观察指标
2.2.4.1 ELISA法检测血清TNF-α、IL-1β、IL-17、IL-6水平将收集的大鼠全血标本放于室温静置2 h,1 000×g,离心20 min,取上清液,将上清液置于-80 ℃保存,备用。按照TNF-α、IL-1β、IL-17和IL-6的ELISA试剂盒说明书分别测定大鼠血清中TNF-α、IL-1β、IL-17、IL-6的含量。本次实验重复3次。
2.2.4.2 Western blotting法检测TNF-α、IL-1β、IL-6、NF-κB p65和IL-17C蛋白相对表达量 新鲜大鼠鼻黏膜组织研磨成粉末状后,加组织蛋白裂解液处理30 min,获取组织蛋白,参考胡晶等[18]的实验方法进行蛋白定量、电泳、转膜、显影,检测并分析信号值,TNF-α(抗体稀释比例1∶1 000)、IL-1β(抗体稀释比例1∶1 000)、NF-κB p65(抗体稀释比例1∶1 000)和IL-17C(抗体稀释比例1∶1 000)表达。二抗使用IRDye 680RD Goat anti-Rabbit IgG(H+L)(抗体稀释比例1∶20 000)。本次实验重复3次。
2.3 统计学方法 采用SPSS 22.0统计分析软件,计量资料采用“均数±标准差”()表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
3 结果
3.1 中药有效成分筛选及基因名的转换 通过TCMSP数据库和Swiss Target Prediction数据库筛选,删除未匹配到靶点的成分,得到10个中药活性成分,其中龙胆草3个,藿香7个,最后共得到相关作用靶点258个,去除重复值后,得到163个药物作用靶点。(见表1)

表1 中药“成分-靶点”表
3.2 疾病和交集基因的获取 经GeneCards、OMIM、Durgback平台获取鼻窦炎靶点3 852个,其中最大score评分为94.51,最小评分为0.14,最后得到2 644个疾病靶点。(见图1)中药靶点和疾病靶点取交集,删除重复值,得到交集基因110个。
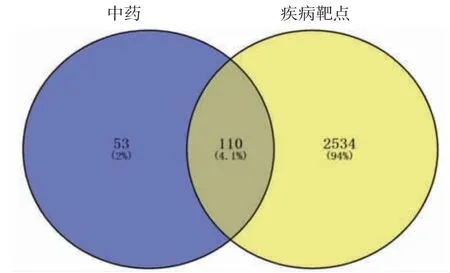
图1 “中药-疾病靶点”韦恩图
3.3 构建“中药成分-靶点”网络及关键化合物筛选 将基因数据导入Cytoscape3.8.2软件,得到“中药成分-靶点”网络图,共421个节点(nodes),730条边(edges)。(见图2)根据Degree值得到排名靠前的主要成分化合物为槲皮素、龙胆碱、龙胆苦苷。(见表2)

图2 “中药成分-靶点”网络图

表2 药物关键化合物
3.4 PPI网络制作和核心蛋白的获取 将交集基因导入String平台,设置对象为(homo sapiens)、取最高置信度0.900,隐藏游离基因节点,得到247个节点,1 110条边,平均节度点为9.28。下载TSV文件导入Cytoscape3.8.2后经网络拓扑学分析,把Degree值的二倍中位数以上,介度中心值(Betweenness Centrality,BC)和紧密中心值(Closeness Centrality,CC)的中位数上靶点作为中药药对的核心作用靶点,排名前6靶点基因分别为AKT1、TP53、IL-6、VEGEA、TNF、IL-1β。随着Degree值和连接分数的增高,节点的形状越大,颜色越鲜明、线条越粗,蛋白越重要。(见图3)

图3 PPI 蛋白互作图
3.5 GO与KEGG Pathway富集分析 经Metascape平台分析,GO分析结果显示:生物过程(biological processes,BP)4 893条,通过LogP值和基因数的百分数比重对数据进行排名,排名靠前的为对营养水平的反应、对脂多糖的反应、对细菌来源分子的反应、对药物的反应等。分子功能(molecular function,MF)668条,主要涉及核受体活性、配体激活的转录因子活性、血红素结合、DNA结合转录因子结合、受体配体活性、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。细胞成分(cellular components,CC)共379条,主要由膜筏、突触后膜、受体复合体、细胞质核周区域、转录因子复合体等构成。(见图4)
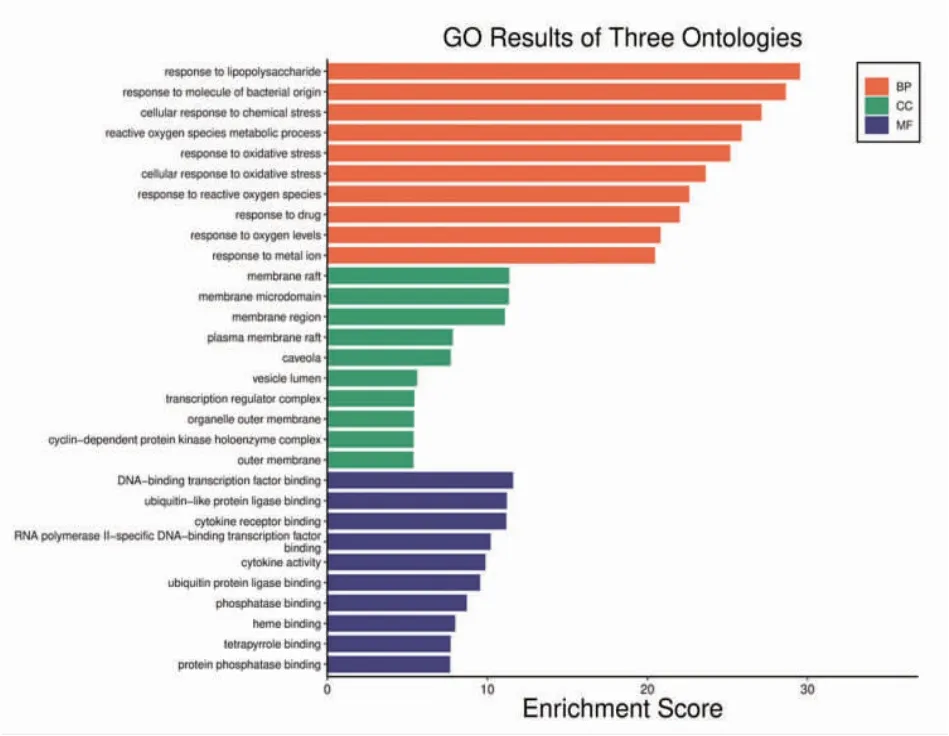
图4 GO 富集分析图
将交集基因导入Matescape平台进行分析,得到279条KEGG信号通路富集结果,设置FDR<0.01筛选前20条途径。(见图5)根据所属通路将各靶点进行归类,将信息导入Cytoscape 3.8.2软件中构建“中药成分-靶点-通路-疾病”网络图。(见图6)

图5 KEGG 信号通路富集分析图

图6 “中药成分-靶点-通路-疾病”网络图
KEGG通路富集分析结果表明,主要涉及的通路有脂质与动脉粥样硬化通路、糖尿病并发症中的AGE-RAGE信号通路、IL-17信号通路、TNF信号通路等。IL-17信号通路是介导多种炎症疾病的发生经典信号通路,与鼻窦炎的炎症反应过程密切相关[19]。根据PPI蛋白互作图可知,排名前6的中药核心靶点中有3个是IL-17信号通路中的关键靶点(IL-6、TNF、IL-1β)。上述结果提示,藿胆鼻渊丸中藿香-龙胆草药对可能影响炎症反应过程来发挥治疗作用,因此后续实验将选取IL-17信号通路相关指标进行验证。IL-17信号通路详细信息见图7。

图7 IL-17 信号通路详解图
3.6 各组大鼠血清中TNF-α、IL-1β、IL-6和IL-17水平比较 与对照组比较,模型组大鼠血清TNF-α、IL-1β、IL-6、IL-17水平明显升高,差异均有统计学意义(P<0.01);与模型组比较,藿香-龙胆草组和阳性药组大鼠血清TNF-α、IL-1β、IL-6、IL-17水平明显降低,差异均有统计学意义(P<0.05或P<0.01);与阳性药组比较,藿香-龙胆草组大鼠血清TNF-α、IL-1β、IL-6、IL-17水平升高,差异均有统计学意义(P<0.05)。(见图8)

图8 各组大鼠血清中TNF-α、IL-1β、IL-6 和IL-17水平比较 (,n=6)
3.7 各组大鼠鼻黏膜组织中IL-17/NF-κB信号通路关键蛋白表达比较 与对照组比较,模型组大鼠鼻黏膜组织中TNF-α、IL-1β、NF-κB p65、IL-6、IL-17C蛋白相对表达量明显升高,差异均有统计学意义(P<0.01);与模型组比较,藿香-龙胆草组和阳性药物组大鼠TNF-α、IL-1β、IL-6、IL-17C蛋白相对表达量明显降低,差异均有统计学意义(P<0.01);与阳性药组比较,藿香-龙胆草组大鼠TNF-α、IL-1β、IL-6、IL-17C蛋白相对表达量明显升高,NF-κB p65蛋白相对表达量明显降低,差异均有统计学意义(P<0.01)。(见图9~10)

图9 各组大鼠鼻黏膜组织中IL-17/NF-κB 信号通路关键蛋白表达Western blotting 图

图10 各组大鼠鼻黏膜组织中IL-17/NF-κB 信号通路关键蛋白相对表达量比较 (,n=6)
4 讨论
本研究通过网络药理学对藿胆鼻渊丸中藿香-龙胆草药对治疗鼻窦炎的靶点和潜在机制进行了分析,得到10个中药有效活性成分,其中3个核心活性成分分别为槲皮素、龙胆碱、龙胆苦苷。彭炜等[20]研究发现,槲皮素能通过调节大鼠变应性鼻炎Th1/Th2细胞因子的平衡减轻大鼠变应性鼻炎鼻部症状,改善鼻黏膜炎症程度。卢志宾等[16]证实了槲皮素具有改善鼻窦炎症状的作用,并发现脂多糖(LPS)诱导形成的副鼻窦炎模型小鼠经过槲皮素治疗后,副鼻窦炎病理形态学明显改善,其机制是调节高尔基应激抑制TNF-α和IL-6等炎症因子表达。此外,槲皮素还可通过负调节TLR4信号通路抑制脂多糖诱导的细胞表面分子(CD80、CD86和MHCI/II类)和促炎性细胞因子(TNF-α、IL-1β、IL-6和IL-12p70)的表达,达到抗炎作用[21]。龙胆碱和龙胆苦苷都是龙胆草的主要活性成分。龙胆苦苷属于环烯醚萜苷类,分子式为C16H20O;龙胆碱属于吡啶类生物碱,分子式为C10H9NO2。研究表明,龙胆碱和龙胆苦苷均具有显着的抗炎作用[22]。KWAK W J等[23]以雄性SD大鼠为实验对象,发现龙胆碱可以抑制LPS诱导的促炎性细胞因子TNF-α、IL-6的表达。龙胆碱还可以通过抑制IL-8、TNF-α等炎症因子的表达调节机体免疫[24]。ZHAO L等[25]研究表明龙胆苦苷可以通过调节IL-1β信号通路中p38、ERK和JNK蛋白的表达,抑制IL-1β诱导的大鼠关节软骨细胞的炎症反应。龙胆苦苷可以抑制大鼠体内TNF-α、IL-1β释放达到减轻大鼠急性胰腺炎的作用,其作用机制与抑制NF-κB p65蛋白的表达有关[26]。葛珊等[27]研究发现,龙胆苦苷、木兰花碱可以通过降低炎症因子TNF-ɑ、IL-1β分泌,抑制IKKβ/NF-κB/COX-2信号通路异常激活而发挥抗炎作用。龙胆苦苷也可显着降低C57BL/6小鼠血清中IL-1β、IL-6、IL-18和TNF-α等促炎性细胞因子的释放水平[28]。李鑫波等[29]研究发现,龙胆苦苷可通过抑制NF-κB信号通路发挥抗炎活性。槲皮素、龙胆碱、龙胆苦苷均是藿香-龙胆草治疗鼻窦炎的核心成分,提示藿香-龙胆草药对治疗疾病具有多成分发挥药效的特点。
本研究通过对藿香-龙胆草药对治疗鼻窦炎的PPI网络分析,发现丝氨酸/苏氨酸激酶1(AKT)、猴肿瘤蛋白p53(TP5)3、白细胞介素-6(IL-6)、血管内皮生长因子A(vascular endothelial growth factor a,VEGFA)、TNF等靶点是主要作用靶标。这些靶点蛋白在鼻窦炎的发生发展过程扮演着重要的角色。AKT1是丝氨酸/苏氨酸激酶(AKT)中的其中一个亚型,参与细胞多种生物过程。ZHOU X C等[30]通过生物信息学和qRT-PCR实验验证了AKT1与慢性鼻窦炎伴鼻息肉的发病机制密切相关;TP53 GOF突变体异位表达在炎症反应中起着关键作用[31]。据叶帆[32]报道,MiR-155可以通过靶向TP53INP1 3’UTR抑制TP53INP1表达,从而调节变应性鼻炎中免疫细胞ILC2的功能。VEGFA作为效果突出的促血管生成因子,在参与新血管的调节和生成过程中释放多种生长因子和炎症因子[33]。如范隽等[34]发现慢性鼻-鼻窦炎患者的炎症因子IL-6表达水平显着升高,且HIF-1α及VEGF在组织中同时呈高表达,其机制与p38MAPK密切相关。近年来,随着对鼻窦炎发病机制的进一步探索,众多研究[35-43]均表明,IL-6、TNF在急慢性鼻窦炎的发病过程中均为重要的促炎性细胞因子,其发病机制涉及到多种信号通路。
KEGG富集主要涉及的通路有脂质与动脉粥样硬化通路、糖尿病并发症中的AGE-RAGE信号通路、IL-17信号通路、TNF信号通路等。其中IL-17信号通路在急性和慢性鼻窦炎症中都起着至关重要的作用。多个研究[44-46]已证实,IL-17最显着的作用是其参与诱导和介导促炎症反应。IL-17通过相应受体激活下游通路,包括核转录因子NF-κB、MAPK、AP-1,以诱导许多细胞因子、趋化因子的表达(例如IL-6、G-CSF、GM-CSF、IL-1β、TNF-α)。本研究以大鼠鼻窦炎为模型,采用ELISA和Western blotting方法对网络药理学筛选结果进行实验验证。实验结果表明,模型组大鼠血清TNF-α、IL-1β、IL-6、IL-17水平明显高于对照组,提示这些炎症相关因子在鼻窦炎发生发展过程中具有重要作用;经藿香-龙胆草治疗后,大鼠血清TNF-α、IL-1β、IL-6、IL-17水平明显降低,表明藿香-龙胆草可以抑制炎症相关因子(TNF-α、IL-1β、IL-6、IL-17)的表达。Western blotting结果显示,模型组大鼠鼻黏膜组织中TNF-α、IL-1β、NF-κB p65、IL-6、IL-17C蛋白相对表达量明显高于对照组(P<0.01),藿香-龙胆草组和阳性药物组大鼠TNF-α、IL-1β、IL-6、IL-17C蛋白相对表达量明显低于模型组(P<0.01);同时NF-κB p65蛋白水平也发生了变化;然而,藿香-龙胆草组大鼠鼻黏膜组织中TNF-α、IL-1β、IL-6、IL-17蛋白相对表达量高于阳性药组,而NF-κB p65蛋白相对表达量低于阳性药组。藿香-龙胆草和阳性药物均可能对IF-17/NF-κB信号通路有调控作用。
综上所述,藿香-龙胆草可能是通过IL-17激活NF-κB,抑制TNF-α、IL-1β、IL-6炎症因子的产生,从而达到治疗鼻窦炎的效果。



