李玉秋,王景会,李铁柱,张 莉,杨贞耐*
重组微小毛霉凝乳酶的发酵条件及其酶学性质
李玉秋,王景会,李铁柱,张 莉,杨贞耐*
(吉林省农业科学院农产品加工研究中心,吉林 长春 130033)
通过对重组微小毛霉凝乳酶(recombinant Mucor pusillus rennet,RMPR)发酵条件的研究,确定甲醇诱导体积分数1%、初始OD600nm0.5、装瓶量100mL/500mL摇瓶、诱导时间96h为发酵最适条件。培养液离心取上清用硫酸铵分级沉淀获得粗酶液,并对其酶学性质进行研究,经测定该酶的最适反应温度为60℃,30~45℃酶较稳定,保温90min,剩余凝乳酶活力达86.5%;酶在pH5.5~7.0范围内,随pH值升高,凝乳酶活力逐渐降低,pH5.5时凝乳酶活力最高。当Ca2+浓度为0.03mol/L时凝乳酶活力最高,Na+浓度对凝乳酶活力没有明显影响,Ni2+和Fe2+对酶有抑制作用,Mn2+、K+、Mg2+对酶有一定的促进作用。
微小毛霉;凝乳酶;酶学性质;发酵;重组
小牛皱胃酶(calf rennet)主要用于干酪等制品的生产,但世界市场需求量日益增长,每年宰杀4000万头犊牛,仍不能满足需要[1-2]。目前各国都在不断寻找替代品,植物蛋白酶、其他动物蛋白酶和微生物蛋白酶,虽然起到凝乳作用,但各有弊端,动物源凝乳酶所制干酪风味差、品质低;植物蛋白酶和微生物蛋白酶表现出专一性不强、凝乳活性与分解活性比值低、对热稳定、在乳中残留量高等问题,常常引起加工的干酪产量降低,成熟后出现苦味或其他不良风味[3]。利用基因工程技术,将凝乳酶原的基因克隆并在适当的宿主细胞中表达,并可以按照人们的意愿改造凝乳酶,使其具有牛凝乳酶的优良特性,从而拓宽了凝乳剂的来源,解决凝乳剂不足的现象[4-6]。
毕赤酵母表达系统是近年来发展很快的一个真核表达系统,它既具有原核表达系统操作简单、易于培养、生长速度快、表达量高、成本低等优点,还具有真核生物表达系统的对外源蛋白的翻译后修饰等特点,如糖基化、蛋白磷酸化等[7]。此研究利用毕赤酵母表达系统表达微小毛霉凝乳酶,对其发酵条件进行优化,并从温度、pH值、底物质量分数、金属离子浓度对酶活力的影响对其进行研究,为工业化发酵生产重组微小毛霉凝乳酶提供参考。
1 材料与方法
1.1 材料与试剂
脱脂乳奶粉、新西兰进口脱脂乳粉 金财公司分装。
酵母提取物、蛋白胨、葡萄糖、甘油、生物素、甲醇 北京化工厂;酵母氮源(YNB) 美国BD公司。
1.2 菌种与培养基
毕赤酵母工程菌GS115/pPICZαA-MPR由本实验室构建保存。
种子培养基(YPD,g/100mL):酵母提取物1、蛋白胨2、葡萄糖2[8];发酵基础培养基(BMGY):酵母提取物1g/100mL、蛋白胨2g/100mL、YNB 1.34g/100mL、生物素0.5g/100mL、甘油体积分数1%、0.1mol/L磷酸钾(pH6.0)[7];发酵诱导培养基(BMMY):酵母提取物1g/100mL、蛋白胨2g/100mL、YNB 1.34g/100mL、生物素0.5g/100mL、甲醇体积分数0.5%、0.1mol/L磷酸钾(pH6.0)。
1.3 方法
1.3.1 重组菌的培养
挑取单菌落加入100mL YPD培养基中30℃、240r/min培养16h,获得种子培养液,1:100(V/V)转接入BMGY中,30℃、240r/min培养至OD600nm值达2~6之间,按不同接种量、不同装瓶量接入BMMY,以不同甲醇体积分数开始诱导,每24h补加甲醇1次,并每隔24h取样1次,测定酶活性[9]。
1.3.2 粗酶液的制备
取1000mL诱导表达的酵母培养液离心后取上清,先加入硫酸铵164g,4℃搅拌沉淀过夜(16h),4℃、8000 r/min离心10min,取上清液再加入硫酸铵181g,4℃搅拌沉淀过夜(16h),4℃、8000r/min离心10min,沉淀溶于0.05mol/L磷酸钠缓冲液中,即粗酶液。
1.3.3 凝乳酶活力测定
根据改进的Magda等[10]方法,将脱脂乳用0.01mol/L CaCl2配制成质量分数为10%的复原脱脂乳溶液。35℃条件下,取待测酶液0.2mL加入2mL质量分数为10%的复原脱脂乳中,充分混匀,开始计时,至絮状凝集颗粒出现为止。在35℃、40min,凝固1mL 10%脱脂奶粉的酶量为一个酶活力单位。
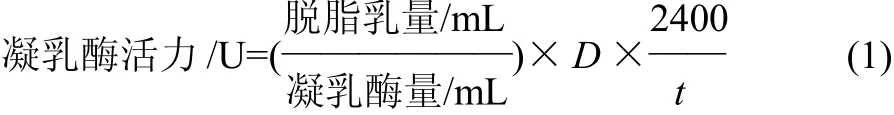
式中:D为酶液稀释倍数;t为凝乳时间/s;2400为时间2400s即40min。
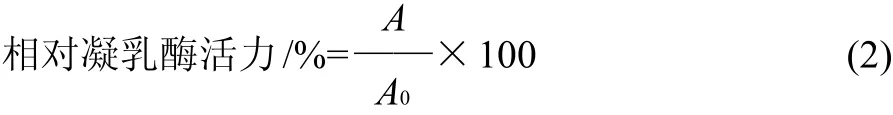
式中:A为所测的凝乳酶比活力/(U/mL);A0为对照的凝乳酶比活力/(U/mL)。
1.3.4 酶学性质测定方法
1.3.4.1 凝乳酶的最适温度和热稳定性
分别取复原脱脂乳2mL,加入0.2mL待测酶液,分别在30、35、40、45、50、55、60、65、70、75、80℃条件下测定凝乳酶活力,脱脂乳和酶液预先在相应的温度下保温2min,然后测定凝乳酶活力,以最大凝乳酶活力为100%作为对照,确定凝乳酶的最适反应温度。
将待测酶液分别在30、35、40、45、50、55、60、65℃条件下保温10、20、30、40、50、60、90、120min后,吸取0.2mL加入2mL 35℃预热的复原脱脂乳中,测定凝乳酶活力。以未处理前测得的凝乳活力为100%作为对照,测定凝乳酶的热稳定性。
1.3.4.2 凝乳酶的最适pH值及不同pH值下的稳定性
分别取复原脱脂乳10mL装入三角瓶中,用0.1mol/L HCl溶液和0.1mol/L NaOH溶液分别调pH值至5.0、5.5、6.0、6.5、7.0、7.5、8.0[11]。取2mL上述脱脂乳,加入0.2mL待测酶液在35℃条件下测定凝乳酶活力[10],以最高凝乳活力为100%作为对照,测定凝乳酶反应的最适pH值。
分别取10mL待测酶液,用柠檬酸钠缓冲液调pH值至3.0、4.0,用磷酸缓冲液调pH值至6.0、7.0,用Tris-HCl缓冲液调pH值至8.0、9.0、10.0[12]。室温放置20h后,用HCl溶液和NaOH溶液将pH值调至6.0,35℃条件下测定凝乳酶剩余酶活力,以未经处理酶液测得的酶活力为100%作为对照,确定凝乳酶在不同pH值下的稳定性。
1.3.4.3 底物质量分数对凝乳酶活力的影响
分别取待测酶液加入到质量分数5%、10%、12%、15%、20%的复原脱脂乳中,35℃条件下测定凝乳酶活力,以最高凝乳酶活力为100%作为对照。
1.3.4.4 钙离子和钠离子浓度对凝乳酶活力的影响
分别用不同浓度的CaCl2(5~500mmol/L)配制10%复原脱脂乳[13],取2mL加入0.2mL待测酶液,35℃条件下测定凝乳酶活力,以未添加Ca+离子的脱脂乳测得的酶活力为100%作为对照。分别用不同浓度的NaCl溶液(10~300mmol/L )配制10%复原脱脂乳[13],取2mL加入0.2mL待测酶液,35℃条件下测定凝乳酶活力,以未添加Na+离子的脱脂乳测得的酶活力为100%作为对照。
1.3.4.5 其他金属离子对凝乳酶活力的影响
将复原脱脂乳配制成含各种金属离子(Ni2+、Mn2+、Cu2+、K+、Fe3+、Fe2+、Mg2+)浓度为5mmol/L;在35℃条件下测定酶的相对凝乳酶活力,以未添加金属离子的脱脂乳测得的酶活力为100%作为对照。
2 结果与分析
2.1 重组菌发酵条件优化
2.1.1 初始光密度值对产凝乳酶活力的影响
将种子液接于BMMY(pH6.0)中,OD600nm分别为0.5112、1.073、1.538、2.037、2.568,装瓶量为100mL/500mL摇瓶,30℃、240r/min,甲醇诱导体积分数为1%,每24h补加1次并取样测定凝乳酶比活力,72、96、120h分别取样测定凝乳酶比活力,结果见图1。
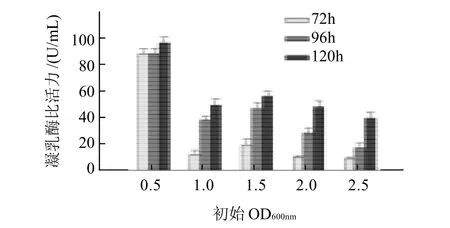
图1 初始光密度值对凝乳酶活力的影响Fig.1 Effect of initial OD600nmvalue on rennet activity
如图1所示,起始OD600nm为0.5时,诱导72h后RMPR即可达到较高的凝乳酶比活力,诱导120h凝乳酶比活力达最大。起始OD600nm为1.0、1.5、2.0、2.5时诱导72h,RMPR活力较低,当诱导120h后凝乳酶比活力最佳,但仍显着低于起始OD600nm为0.5、诱导120h的RMPR达到的凝乳酶比活力,可见重组菌OD600nm为0.5时为最佳起始光密度值。
2.1.2 装瓶量对凝乳酶活力的影响
将种子液接入BMMY中,OD600nm为1.085,500mL摇瓶装量分别为50、100、200、300mL,30℃、240 r/min培养144h,甲醇体积分数为1%,每24h补加一次并取样测定凝乳酶比活力,连续培养144h,每隔24h取样并测定凝乳酶比活力,结果见图2。
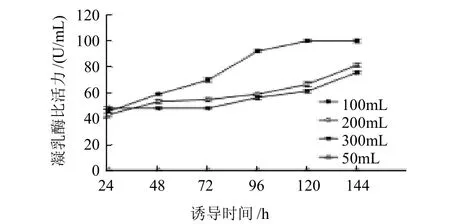
图2 装瓶量对凝乳酶活力的影响Fig.2 Effect of volume of medium contained in 500 mL flask on rennet activity
如图2所示,装瓶量为100mL效果最佳,诱导144h后凝乳活力最高。50mL装瓶量诱导144h,每隔24h取样一次,均没有检测到凝乳活力,可能由于装瓶量低,菌体溶氧量过高,菌株生长过于旺盛,分泌其他水解蛋白酶类,降解其表达的外源蛋白,致使外源蛋白水解不表现活性。装瓶量为100、200、300mL时,诱导24h酶比活力大致相同;随诱导时间增加,装瓶量200mL和300mL发酵重组酶活力明显低于100mL装瓶量RMPR的比活力。装瓶量过高,致使酵母溶氧量过低,菌体生长速度较慢,菌体状态不佳,影响重组蛋白表达。
2.1.3 甲醇体积分数对凝乳酶活力的影响
将种子液接入BMMY中,OD600nm为1.102,装瓶量为100mL/500mL摇瓶,30℃、240r/min,甲醇体积分数分别为0.5%、1.0%、1.5%、2.0%,每24h补加1次,诱导144h,每隔24h取样测定凝乳酶比活力。
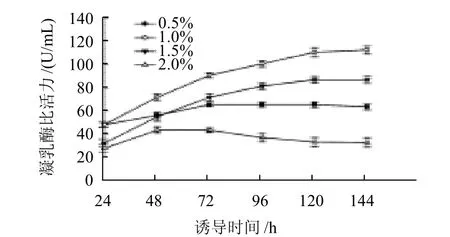
图3 甲醇体积分数对凝乳酶活力的影响Fig.3 Effect of methanol concentration on rennet activity
如图3所示,当甲醇体积分数为1%时,重组凝乳酶比活力最佳,明显高于其他甲醇体积分数诱导的凝乳酶比活力。当用1.5%的甲醇时,重组凝乳酶活力稍低,但明显高于0.5%和2.0%的甲醇时的凝乳酶比活力。当用2.0%甲醇时对凝乳酶比活力有较大的影响,诱导72h以后重组凝乳酶比活力逐渐降低,可见甲醇体积分数过高影响酵母的生长状态,对酵母产生一定毒害的作用,抑制酵母生长,所以甲醇体积分数不易过高。
2.1.4 最佳诱导时间的确定
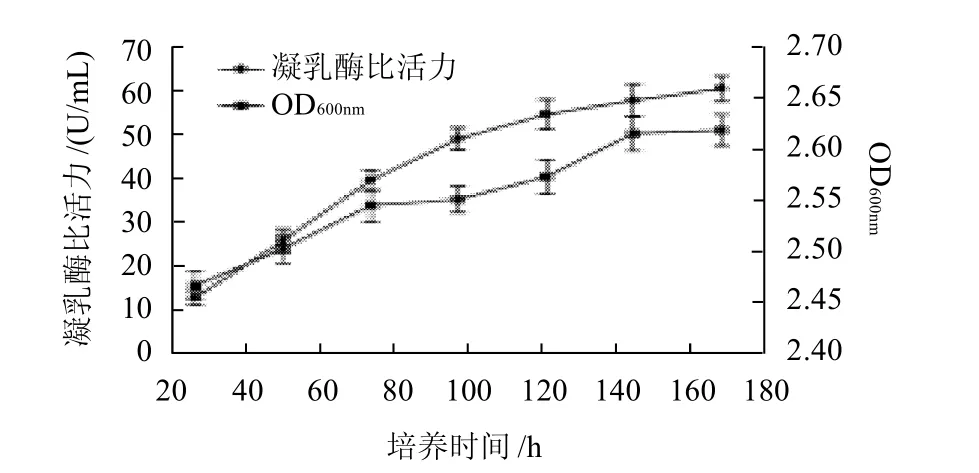
图4 产酶最佳诱导时间对凝乳酶活力的影响Fig.4 Effect of incubation time on rennet activity
将种子液接种于BMMY(pH6.0)中,OD600nm为1.102,装瓶量为100mL/500mL摇瓶,甲醇体积分数1.0%,每24h补加1次,每隔24h取样测定凝乳酶比活力,连续诱导168h,结果见图4。
如图4所示,重组凝乳酶比活力随诱导时间的增加酶比活力不断增大,光密度值也随之不断的增大,96h后趋于平稳,光密度值不再变化,凝乳酶比活力仍不断增大,但增大幅度较小,所以从经济价值角度考虑,用时短,用料省,产酶活力较高为宜,确定最佳诱导时间为96h。
2.2 酶学性质
2.2.1 凝乳酶的最适温度

图5 温度对凝乳酶活力的影响Fig.5 Effect of incubation temperature on rennet activity
如图5所示,凝乳酶的最适反应温度为60℃;凝乳酶在35~60℃之间,凝乳酶活力随温度的升高而增大;当温度高于70℃时,酶活力明显下降,到85℃时酶失活。与Megada[10]、Kumar[14]等报道的Bacillus sphaericus和Rhizopus oryzae凝乳酶的最适温度55℃和60℃相近。
2.2.2 凝乳酶的热稳定性
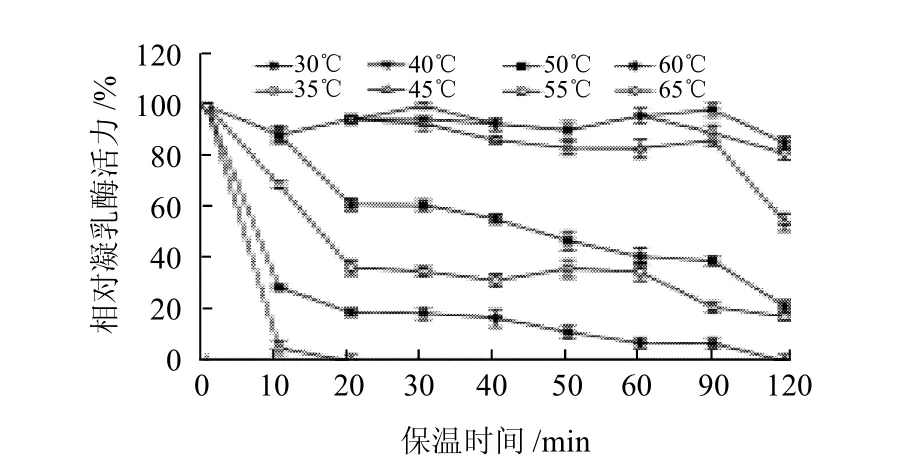
图6 凝乳酶的热稳定性Fig.6 Thermal stability of RMPR
如图6所示,凝乳酶在30~45℃之间有较好的稳定性,此温度区间保持90min后,相对凝乳酶活力仍在80%以上。但随着温度的升高,温度达到55℃保持20min,凝乳酶活力明显降低,相对凝乳酶酶活力仅为36.5%,65℃、20min后凝乳酶活力完全丧失。韦薇等[1]报道的小牛凝乳酶55℃保温90min相对酶活力为36.7%,60℃、60min完全失活。Megada[10]和Kumar[14]等报道的Bacillus sphaericus和Rhizopus oryzae凝乳酶60℃保温20min,相对酶活力仍为30%和48%。说明RMPR与牛凝乳酶的热稳定性相当,具有较高的热不稳定性。
2.2.3 凝乳酶反应最适pH值的确定
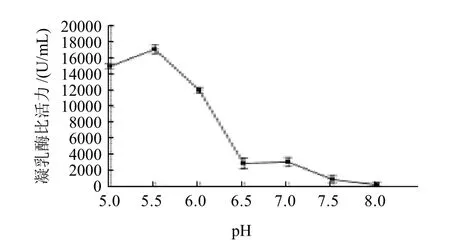
图7 pH值对凝乳酶活力的影响Fig.7 Effect of pH on RMPR activity
如图7所示,pH值小于7.0时,凝乳酶活力随pH值降低而增大,pH5.5时达到最大,pH值大于7.0时酶活力明显减低,并逐渐失去酶活,与大多数凝乳酶pH值在5.0~7.0之间,随pH值升高酶活力逐渐降低有所不同。但与Raposo等[13]报道的Centaurea calcitrapa细胞悬液中提取的凝乳酶最适pH值为5.1,pH值低于5.1时,凝乳酶活力有所降低的趋势相一致。
2.2.4 凝乳酶在不同pH值下的稳定性

图8 凝乳酶在不同pH值下的稳定性Fig.8 pH stability of RMPR
如图8所示,凝乳酶在pH5.0~8.0之间相对较稳定,pH6.0时酶活力最稳定,长时间放置后活力没有任何损失;该酶在pH值小于4的情况下很不稳定,几乎失去凝乳活力。Kumar等[14]报道的Rhizopus oryzae凝乳酶在pH5.5~7.5之间较稳定,pH7.5凝乳酶剩余活力仍达96%。
2.2.5 底物(复原脱脂乳)质量分数对凝乳酶活力的影响如图9所示,脱脂乳质量分数为10%时凝乳酶活力最高,随质量分数升高凝乳酶活力逐渐降低,当复原脱脂乳质量分数为20%时,凝乳酶的相对活力仅为36.5%。Megada[10]、Kumar[14]等曾报道Bacillus sphaericus和Rhizopus oryzae凝乳酶在底物(复原脱脂乳)为8%和9%时,酶活力最高,底物(复原脱脂乳)质量分数逐渐升高凝乳活力略有降低。

表1 金属离子对凝乳酶活力的影响Table 1 Effects of other metal ions on RMPR activity
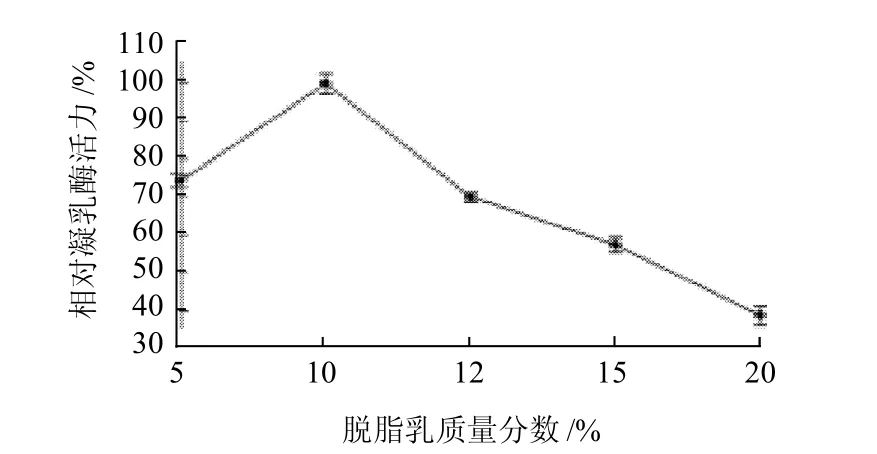
图9 底物质量分数对凝乳酶活力的影响Fig.9 Effect of substrate concentration on RMPR activity
2.2.6 不同CaCl2对凝乳酶活力的影响
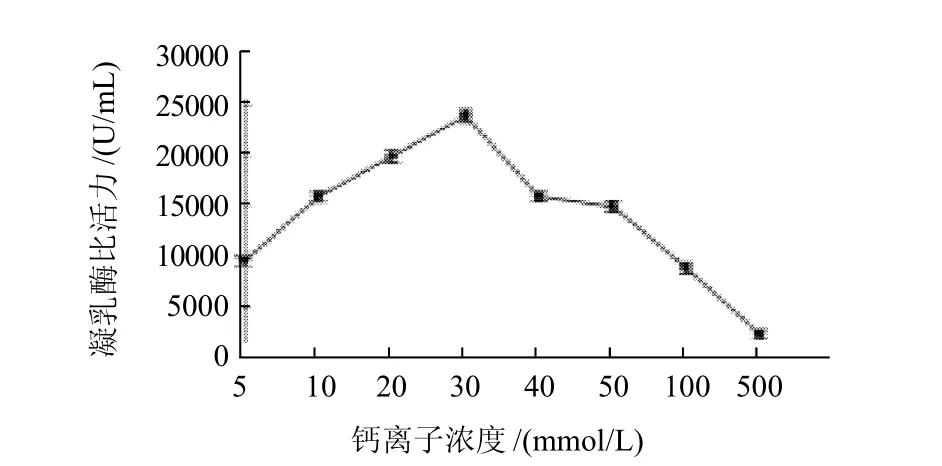
图10 钙离子浓度对凝乳酶活力的影响Fig.10 Effect of Ca2+concentration on RMPR activity
如图10所示,酶的凝乳活力随Ca2+浓度增加而增大,当达到30mmol/L时为最佳浓度,钙促酶反应达最高值,这一结果与Megada等[10]报道的Bacillus sphaericus凝乳酶最适Ca2+浓度25mmol/L相一致;随着Ca2+浓度不断增加凝乳酶活力逐渐降低,但仍然对凝乳酶反应有促进作用,只是促进作用有所降低,Ca2+浓度达到300mmol/L时凝乳酶的相对活力仍为355%(数据未列出)。当Ca2+浓度达到500mmol/L时,凝乳酶相对活力为94.5%,表明过高的Ca2+浓度对凝乳酶有一定的抑制作用。说明Ca2+浓度对凝乳酶有显着的促进作用。
2.2.7 不同NaCl浓度对酶活力的影响
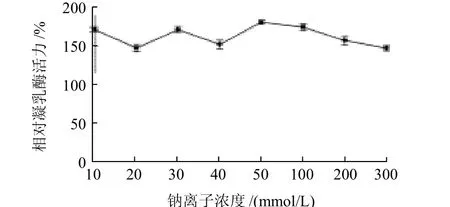
图11 NaCl浓度对凝乳酶活力的影响Fig.11 Effect of Na+concentration on RMPR activity
如图11所示,NaCl在10~300mmol/L范围内对凝乳酶活力没有明显影响,同时都有一定的促进作用。
2.2.8 其他金属离子对凝乳酶活力的影响
金属离子是酶反应过程中重要的因子,一些金属离子对酶反应起到促进作用,一些金属离子对凝乳酶有抑制作用。从表1可以看出,Ni2+对凝乳酶有较强的抑制作用,Fe3+、Fe2+对凝乳酶的抑制力较弱,Mn2+、Mg2+等离子对该凝乳酶起促进作用,Cu2+对凝乳酶活力没有影响。
3 结 论
毕赤酵母作为生产外源蛋白的优良宿主已经得到广泛应用,目前已有400多种蛋白在此体系中得到成功表达,其中包括抗原、抗体、酶、膜蛋白和调节蛋白等。不同蛋白在毕赤酵母中的表达水平有很大区别,同一蛋白在不同发酵条件下的表达水平也有显着差异。常规发酵条件是满足一般重组蛋白发酵所需的最基本条件,对表达某个具体的重组蛋白而言不一定是最佳条件,需要作适当调整以最大限度地提高重组蛋白的表达量[15]。本实验重组微小毛霉凝乳酶在毕赤酵母中表达的最佳时间为96h,最佳装瓶量为100mL/500mL摇瓶,甲醇诱导体积分数为0.5%,初始光密度值为0.5时为宜。
微小毛霉凝乳酶是酸性蛋白酶,属天冬氨酸蛋白酶家族,可特异切开κ-酪蛋白Phe105-Met106肽键,而具有较高凝乳活性,被广泛用于乳酪制造业。不同来源的凝乳酶对温度和pH值稳定性不同,其中以微生物来源的凝乳酶最不敏感,稳定性强。徐速[16]研究表明,凝乳酶的活性在25~70℃之间随温度的上升而升高,60℃处理10min酶活损失68%,pH值在2~7之间保持稳定;韦薇等[1]报道的小牛凝乳酶的最适温度为50℃,60℃保温10min酶活损失96%;本实验中RMPR的最适温度为60℃,60℃保温10min酶活力损失72%,说明PMPR性质与小牛凝乳酶性质相近,可以作为牛凝乳酶的替代品,应用于干酪生产中。
[1]韦薇, 韩刚, 徐凤彩. 小牛凝乳酶的分离及部分特性研究[J]. 中国乳品工业, 1997, 25(4): 21-24.
[2]周俊清, 林亲录, 赵谋明. 微生物源凝乳酶的研究进展[J]. 中国食品添加剂, 2004(2): 6-9.
[3]CHITPINTYOL S, CRABBE M J C. Chymosin and aspartic proteinase [J]. Food Chemistry, 1998, 61(4): 395-418.
[4]杨宝进, 罗军. 重组凝乳酶的研究进展[J]. 现代食品科技, 2005, 21 (2): 186-189.
[5]张建忠, 徐笔峰, 胡斌斌. 基因工程凝乳酶的研究开发[J]. 食品研究与开发, 1998, 19(3): 43-45.
[6]姜峰, 张兰威. 我国凝乳酶特性及其替代品的研究现状[J]. 食品研究与开发, 2003, 24(6): 3-6.
[7]丁月娣, 刘天会, 陈蕴, 等. 人脑钠肽融合蛋白(HAS-(BNP)2)在毕赤酵母中的发酵条件及纯化研究[J]. 药物生物技术, 2009, 16(2): 113-117. [8]杨国武, 袁保红, 何国平, 等. 人DNA拓扑异构酶Ⅰ在毕赤酵母中的表达及发酵条件优化[J]. 生物工程学报, 2004, 20(2): 181-186.
[9]洒荣波, 石贵阳, 王正祥. 基因工程菌Pichia pastoris高密度培养条件的摇瓶研究[J]. 食品研究与开发, 2005, 26(2): 52-57.
[10]MAGADA A, BENDARY E L, MAYSA E M, et al. Purification and characterization of milk clotting enzyme produced by Bacillus sphaericus [J]. Journal of Applied Sciences Research, 2007, 3(8):695-699.
[11]苏光宇. 影响凝乳酶活性的研究[J]. 内蒙古科学与经济, 2006(11): 120-121.
[12]CHAZARRA S, SIDRCH L, LOPEZ-MOLINA D, et al. Characterization of the milk-clotting properties of extracts from artichoke (Cynara scolymus L.) flowers[J]. International Dairy Journal, 2007, 17(12): 1393-1400.
[13]RAPOSO S, DOMINGOS A. Purification and characterization milkclotting aspartic proteinases from Centaurea calcitrapa cell suspension cultures[J]. Process Biochemistry, 2008, 43(2): 139-144.
[14]KUMAR S, SHARMA N S, SAHARAN M R, et al. Extracellular acid protease from Rhizopus oryzae: purification and characterization[J]. Process Biochemistry, 2005, 40(5): 1701-1705.
[15]杨金玲, 黄镇太, 朱平, 等. 重组人凝集素样氧化型低密度脂蛋白受体-1在毕赤酵母中表达条件的优化[J]. 药物生物技术, 2007, 14(3): 178-181.
[16]徐速. 影响微小毛霉凝乳酶活力的因素[J]. 生物技术, 1996, 6(4): 28-30.
Fermentation Conditions for the Production of Recombinant Mucor pusillus Rennet and Its Enzymological Characterization
LI Yu-qiu,WANG Jing-hui,LI Tie-zhu,ZHANG Li,YANG Zhen-nai*
(Center of Agro-Food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China)
The aims of this study were to investigate the fermentation conditions for the production of recombinant Mucor pusillus rennet (RMPR) and to enzymologically characterize the enzyme obtained. An optimum enzyme activity was obtained after 96 h of induction with 1% methanol as the inducer under the following conditions: initial OD600 nm, 0.5; and volume of medium contained in 500 mL flask, 100 mL.The incubation both obtained was centrifugated, and the supernatant was then salted out with ammonium sulfate to prepare crude enzyme solution, and enzymological characterization was carried out for the crude enzyme solution. The optimal reaction temperature of the enzyme was 60 ℃, and it kept stable in the temperature range from 30 to 45 ℃ and the residual enzyme activity was still 86.5% after 90 min of incubation at 45 ℃. As pH increased from 5.5 to 7.0, the activity of the enzyme presented a gradual decrease and the highest enzyme activity was observed at pH 5.5. At a Ca2+concentration of 0.03 mol/L, the enzyme had the highest activity to clot milk, and Na+had no notable effect on the enzyme, and Ni+and Fe2+were both an enzyme inhibitor, while Mn2+, K+and Mg2+all had promoting effect on the enzyme.
Mucor pusillus;rennet;enzymological characterization;fermentation;recombinant
Q814.3
A
1002-6630(2010)19-0225-06
2010-01-09
国家“863”计划项目(2006AA10Z306);国家现代农业产业技术体系建设专项(nycytx-0502)
李玉秋(1979—),女,研究实习员,硕士,研究方向为乳品生物技术。E-mail:lyqhb1@126.com
*通信作者:杨贞耐(1965—),男,研究员,博士,研究方向为乳品生物技术与乳品工艺。E-mail:zyang@cjaas.com



