涂绍勇,李凤娇,杨爱华
微生物转化沙棘黄酮苷生成黄酮苷元的研究
涂绍勇1,李凤娇1,杨爱华2
(1.武汉生物工程学院生物工程系,湖北 武汉 430415;2.武汉生物工程学院化学与环境工程系,湖北 武汉 430415)
探讨微生物转化沙棘黄酮苷生成黄酮苷元的工艺条件。选取1株黑曲霉菌株进行试验,考察发酵产物中主要黄酮苷元异鼠李素、槲皮素的含量变化。通过单因素和正交试验分别研究最佳氮源和转化条件,微生物转化后用HPLC法测定。结果表明:以黄豆粉为氮源可得到最高的黄酮苷元含量;最优发酵条件为发酵温度30℃、装液量体积分数40%、转速180r/min、发酵时间96h,在此条件下,转化得到的异鼠李素为78mg/g,槲皮素为22mg/g。
沙棘;黄酮苷;黄酮苷元;黑曲霉;微生物转化
沙棘(Hippophae rhamnoides L.),又名酸刺、醋柳,系胡颓子科(Elaeagnaceae)沙棘属植物,为落叶灌木,小乔木或乔木,常有枝刺,雌雄异株,主要分布在欧亚两大陆温带地区。我国是本属植物分布面积最大,种类最多的国家[1]。沙棘果中含有丰富的黄酮类物质[2],现代药理学研究发现,沙棘黄酮具有抗心肌缺血[3]、抗心率失常[4]、提高免疫功能[5]、抗癌[6]、抗过敏[7]、抗氧化[8]、抑制血小板聚集[9]、抗溃疡、抗衰老、抗辐射和抗菌、抗病毒[10-11]功能等广泛的药理作用。
苷(glycosides),又称配糖体,是由糖或糖的衍生物,如氨基酸、糖醛酸等与另一非糖物质通过糖的端基碳原子连接而成的化合物,其中非糖部分称为苷元(aglycone)或配基。苷的药效由苷元决定的,苷元与糖结合成苷后,其理化性质改变,影响了药代动力学过程、药效强度[12-13]。持续时间药物代谢动力学研究证明,苷类化合物不易被肠道吸收,在人体内难以直接发挥药效作用,因而导致生物利用度低下,它们必须在肠道内被微生物转化成苷元,才能经肠道吸收从而发挥药物作用[14-15]。
黄酮苷转化为苷元的途径有化学法及生物法。化学法由于在强烈的化学反应中苷类物质的结构和构型会发生改变,导致其产物不稳定或药效消失;生物转化既可增加目标产物产量,克服化学合成的缺点,又因其大多数是在室温、中性环境中作用,减少了产物分解、异构、消旋和重排反应等不利因素,因此,具有位置选择性和立体选择性,以及无毒、无污染、低成本、高收率等优点,因此,开展有关这方面的研究具有重要的价值和意义。本研究利用微生物直接进行沙棘黄酮苷转化为黄酮苷元的研究,从而简化了工艺条件,为相关的研究工作提供一定的参考。
1 材料与方法
1.1 材料与试剂
野生沙棘果,品种为乌兰格木,采自内蒙古;槲皮素、异鼠李素标准品(批号为110860-200406)由中国药品生物制品检定所提供;黑曲霉A166由江西农业大学提供;其他试剂均为分析纯,均由武汉生物工程学院酶工程实验室提供。
1.2 培养基
种子培养基(PDA培养基):马铃薯200g、蔗糖20g、琼脂20g,加水定容至1L,pH值自然,121℃灭菌20min。
发酵培养基:在含有基本碳源和氮源的培养液中添加0.1g/100mL的CaCl2、ZnSO4、K2HPO4、MgSO4· 7H2O,pH6.5~7.0,121℃灭菌20min。
1.3 仪器与设备
LC-10Avp高效液相色谱仪:配有色谱柱(SHIMADZU VP-ODS (150mm×4.6mm,5μm) 日本岛津;RE-52旋转蒸发仪 上海亚荣生化仪器厂;HQ 45Z恒温摇床 武汉中科科技技术发展有限责任公司。
1.4 方法
1.4.1 产物苷元异鼠李素和槲皮素的高效液相色谱分析
高效液相色谱条件与系统适用性实验:以十八烷基硅烷键合硅胶为填充剂;以甲醇-体积分数0.4%磷酸溶液(58:42,V/V)为流动相,流速为lmL/min,检测波长为360nm,理论板数按异鼠李素峰计算应不低于3000。
1.4.2 氮源的选择
分别在发酵培养基中添加2%的氯化铵、大豆粉、酵母膏、豆渣(湿)作为氮源,装液量体积分数30%,灭菌前调pH6.5~7.0,180r/min、30℃摇床发酵培养5d。加无水乙醇终止反应,后将乙醇和水全部蒸干,进行定量分析,测定黄酮苷元含量,以最高苷元含量确定氮源。
1.4.3 正交试验优化发酵条件
分别在发酵培养基中添加2%的豆渣(湿)作为氮源,调节pH6.5~7.0,将菌种以菌丝体形式接入发酵培养基中进行发酵,采用正交试验法对发酵温度、发酵时间、转速、装液量4个发酵条件进行优化(表1)。发酵完成后加无水乙醇终止反应,后用旋转蒸发仪将乙醇和水全部蒸干,进行定量分析,通过高效液相色谱检测发酵前后沙棘黄酮苷元的主要成分:槲皮素、异鼠李素的含量,以两者含量之和为考察指标,确定菌种转化沙棘苷的最适条件。

表1 沙棘黄酮苷元发酵条件的正交试验因素及水平设计表Table 1 Factors and levels in the orthogonal array design
2 结果与分析
2.1 标准样品及沙棘果泥发酵前黄酮苷元高效液相色谱分析
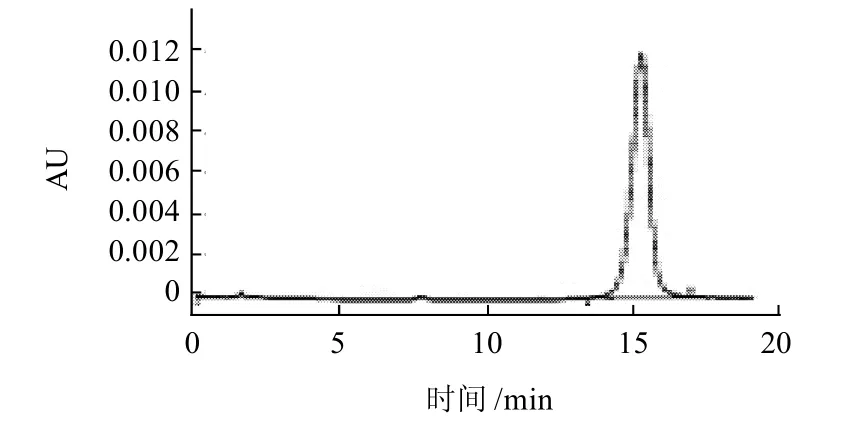
图1 异鼠李素标准品HPLC图Fig.1 HPLC chromatogram of isorhannetin standard
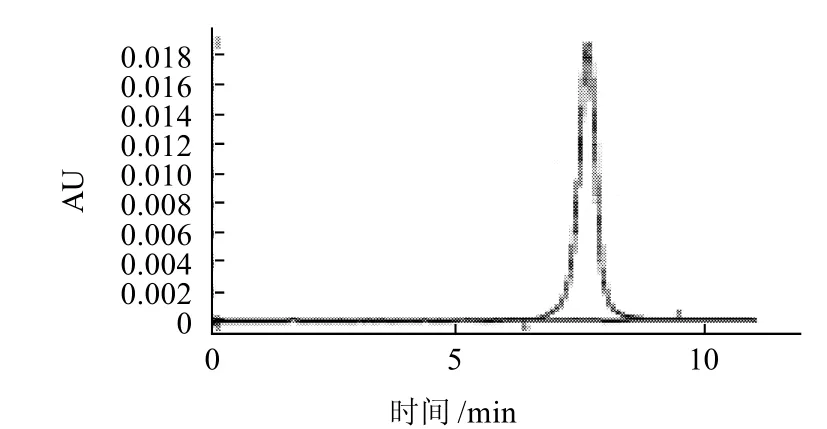
图2 槲皮素标准品HPLC图Fig.2 HPLC chromatogram of quercetin standard
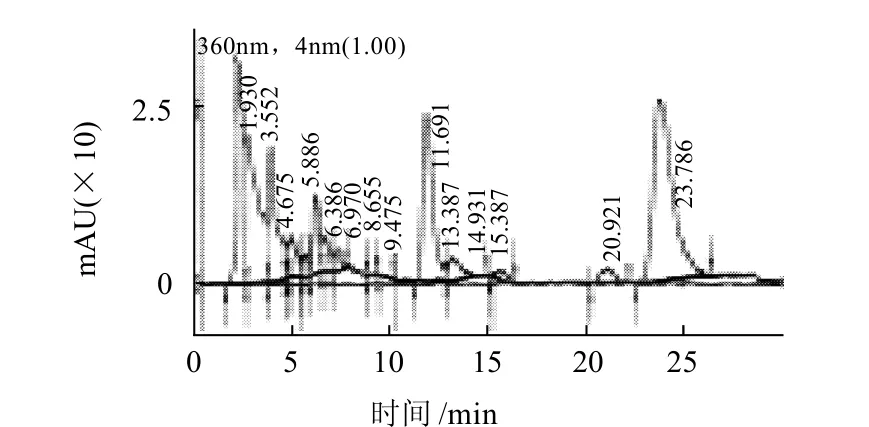
图3 发酵前黄酮苷元HPLC图Fig.3 HPLC chromatogram of flavonoid glycosides in sea-buckthorn fruit before fermentation
由图1得知,异鼠李素的保留时间为15.215min。由图2可知,槲皮素的保留时间为7.590min。图3为发酵前黄酮苷元色谱图。由图1~3可知,每克样品发酵前含异鼠李素0.36mg和槲皮素0.28mg。
2.2 不同氮源对发酵的影响
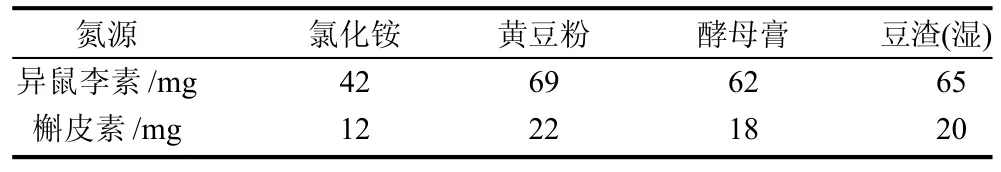
表2 不同氮源对沙棘黄酮苷元发酵的影响Table 2 Effect of nitrogen source type on the contents of isorhannetin and quercetin in fermentation broth
从表2可以看出,以黄豆粉为氮源时,异鼠李素和槲皮素的含量最高,分别达到69mg/g和22mg/g,两者合计91mg/g,因此确定黄豆粉为最佳氮源。图4为以黄豆粉作为氮源发酵后高效液相色谱法检测图谱。但如果从经济方面考虑,黄豆粉为农产品加工品,成本较高,市场价格为4000元/t左右,不利于工业化生产;采用豆渣为发酵氮源,异鼠李素和槲皮素的总含量可以达到85mg/g,而豆渣为豆制品加工过程中的副产物,市场价格为500元/t左右,不仅降低了成本,还能对废弃物进行回收利用,同时也能保证较高的转化率,是很好的选择。时间为96h,装液量体积分数为40%,温度为30℃,转速为180r/min,在此条件下,苷元含量达到100mg/g。图5为沙棘果泥发酵因素A2B1C2D3的HPLC图。
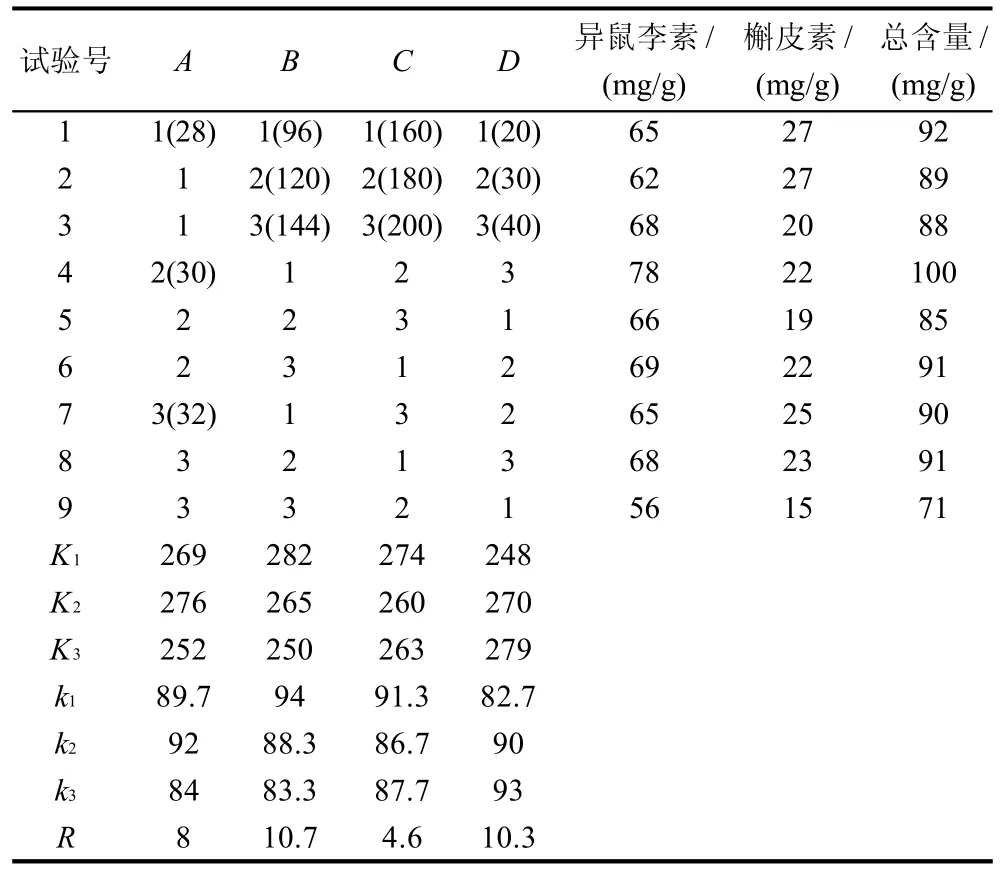
表3 沙棘果泥生成的培养条件正交试验结果Table 3 Orthogonal array design matrix and experimental results
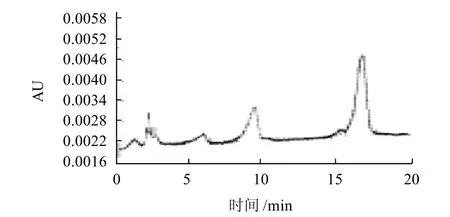
图4 黄豆粉为氮源发酵后HPLC图Fig.4 HPLC chromatogram of flavonoid glycosides in sea-buckthorn fruit after fermentation with added soybean dregs as nitrogen source
2.3 培养条件的正交试验结果
按表1设计的研究因素及水平进行试验,研究黑曲霉A166发酵沙棘果泥的最适培养条件。通过高效液相色谱检测得知发酵后每克发酵产物含异鼠李素、槲皮素的质量见表3,最佳试验条件下产物的HPLC分析见图5。
从表3可以看出,本研究以异鼠李素和槲皮素的总含量为考察指标,最佳组合为A2B1C1D3,第4试验组A2B1C2D3,在该条件下总含量达到100mg/g。在实验范围内,根据极差分析,各因素影响大小依次为B>D>A>C,即时间起主导作用,装液量和温度次之,转速的影响相对较小,所以C因素的选择对于生成苷元含量的大小并未产生什幺影响,且考虑到某些条件的限制等,故C因素选择第2水平。综上,黑曲霉A166转化沙棘黄酮苷生成苷元的最佳条件是A2B1C2D3,即发酵
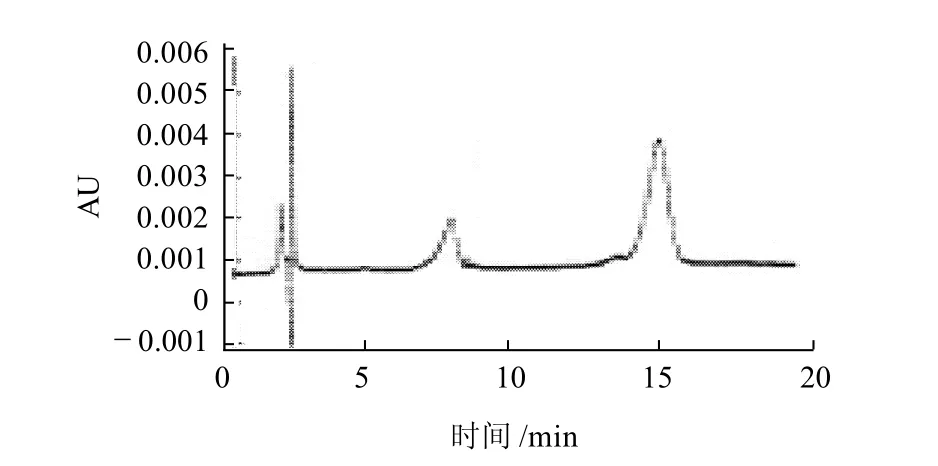
图5 沙棘果泥发酵因素最佳组合条件下的HPLC图Fig. 5 HPLC chromatogram of fermented sea-buckthorn fruit slurry under optimized conditions
3 结 论
微生物在发酵过程中可以分泌多种胞外酶到培养基中,所产生的胞内酶数量更多。这些种类丰富而活性显着的酶系可将黄酮苷成分分解转化为苷元。其中,柚苷酶表现有促进黄酮苷转化为苷元的生物活性,而黑曲霉具有产柚苷酶的能力,因此,本实验选择1株高产柚苷酶的生产菌株黑曲霉A166为发酵菌株,对沙棘果泥黄酮苷的发酵过程进行了实验。首先采用单因素试验考察了氮源对沙棘果泥中黄酮苷转化为苷元的效果,以确定最适合此菌种发酵的氮源种类,进而采用正交试验考察发酵温度、发酵时间、装液量、转速等发酵条件对发酵过程的影响,目的为寻求一种最优发酵条件。
沙棘黄酮的微生物转化国内尚未见研究报道,本研究以黑曲霉为出发菌株,探讨微生物转化沙棘黄酮苷成为苷元的发酵条件,并考察了生物转化后的活性成分的HPLC分析。通过成分的HPLC分析,得出微生物转化黄酮苷成为苷元是非常有效的手段。
通过单因素试验,确定以大豆粉为氮源的培养基最有利于黄酮苷的转化,异鼠李素和槲皮素的总含量达到91mg/g,但如果从生产成本来考虑,在转化效果相差不大的情况下,笔者认为以豆渣为氮源比较合理(以豆渣为氮源时两者的总含量为85mg/g),可能更有利进行工业化生产。
通过发酵条件的正交试验分析,黑曲霉A166转化沙棘黄酮苷生成苷元的最佳条件是:发酵时间96h、装液量为体积分数40%、温度30℃、转速180r/min,在此条件下,转化得到的异鼠李素为78mg/g,槲皮素为22mg/g,相对于发酵前的含量(异鼠李素0.36mg和槲皮素0.28mg)大大提高。
黑曲霉菌是国际公认的可用于食品的安全菌株,使用该菌建立的发酵工艺,安全可靠,可以作为后续研究和工业化生产的参考菌株。
[1]杨建华, 刘丹赤, 邵长明. 沙棘研究与开发的进展[J]. 沙棘, 2007, 20 (3): 19-21.
[2]慷健, 王爱芹, 顾晶晶, 等. 新疆沙棘生产性能和主要营养成分的研究[J]. 食品科学, 2009, 30(4): 99-102.
[3]吴英, 王毅, 王养生, 等. 沙棘总黄酮对大鼠心肌再灌注损伤的影响[J]. 沙棘, 2008, 21(1): 1-3.
[4]雷鸣鸣, 沈异, 周建全, 等. 沙棘的药用成分及其对心血管系统影响的研究进展[J]. 四川中医, 2004, 22(9): 26-28.
[5]刘超, 叶存奇, 徐婧, 等. 沙棘的药理功能初探[J]. 中华中医药杂志, 2006, 21(6): 365-367.
[6]章平, 毛玉昌, 孙斌, 等. 沙棘籽渣黄酮诱导人乳腺癌细胞凋亡相关基因的表达谱变化[J]. 癌症, 2005, 24(4): 91-96.
[7]钟飞, 蒋韵. 沙棘总黄酮的抗过敏作用[J]. 中草药, 1990, 21(12): 6-8.
[8]GEETHA S, SAI RAM M, MONGIA S S, et al. Evaluation of antioxidant activity of leaf extract of Seabuckthorn (Hippophae rhamnoides L.) on chromium(Ⅵ) induced oxidative stress in albino rats[J]. Journal of Ethnopharmacology, 2003, 87(2): 247-251.
[9]CHENG J Y, KONDO K, SUZUKI Y, et al. Inhibitory effects of total flavones of Hippophae rhamnoides L. on thrombosis in mouse femoral artery and in vitro platelet aggregation[J]. Life Sciences, 2003, 72(20): 2263-2271.
[10]赵玉真, 武福亨. 沙棘中黄酮类化合物及其药用价值[J]. 沙棘, 1997, 10(1): 39-41.
[11]周张章, 周才琼, 阚健全. 沙棘的化学成分及保健作用研究进展[J].粮食与食品工业, 2005, 12(2): 15-18.
[12]KANAZE F I, BOUNARTZI M I, GEORGARAKIS M, et al. Pharmacokinetics of the citrus flavanone aglycones hesperetin and naringenin after single oral administration in human subjects[J]. European Journal of Clinical Nutrition, 2007, 61(4): 472-477.
[13]ZHONG Qiuliu, ZHI Hongjiang, LIANG Liu, et al. Mechanisms responsible for poor oral bioavailability of paeoniflorin: Role of intestinal disposition and interactions with sinomenine[J]. Pharm Res, 2006, 23 (12): 2768-2780.
[14]徐萌萌, 王建芳, 徐春, 等. 微生物转化苷类中药的机理及应用[J].世界科学技术-中医药现代化, 2006, 8(2): 24-27.
[15]NEMETH K, PLUMB G W, BERRIN J G, et al. Deglycosylation by small intestinal epithelial cell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans [J]. Eur J Nutr, 2003, 42(1): 29-42.
Microbial Conversion of Flavonoid Glycosides in Sea-buckthorn Fruit into Aglycones
TU Shao-yong1,LI Feng-jiao1,YANG Ai-hua2
(1. Department of Bioengineering, Wuhan Bioengineering Institute, Wuhan 430415, China;2. Department of Chemistry and Environment Engineering, Wuhan Bioengineering Institute, Wuhan 430415, China)
This paper reports the optimization of Aspergillus niger fermentation of sea-buckthorn (Hippophae rhamnoides) fruit slurry for the conversion of flavonoid glycosides into aglycones. The effect of nitrogen source type on the contents of isorhannetin and quercetin in fermentation broth was examined and fermentation temperature and duration, shaking speed and volume percentage of medium occupying fermentor were optimized using orthogonal array design for obtaining maximum sum of the contents of isorhannetin and quercetin in fermentation broth. Soybean dregs were the best choice for maximum aglycone content. The optimal levels of fermentation temperature and duration, shaking speed and volume percentage of medium occupying fermentor were 30 ℃, 96 h, 180 r/min and 40%, respectively, and the resultant contents of isorhannetin and quercetin 78 mg/g and 22 mg/g.
Hippophae rhamnoides;flavonoid glycosides;aglycone;Aspergillus niger;microbial conversion
TS201.1;S793.6
A
1002-6630(2010)19-0221-04
2010-01-03
涂绍勇(1979—),男,讲师,硕士,主要从事酶制剂的生产和应用研究。E-mail:303837684@qq.com



