刘丽莎,王 锐,旭日花,尚 楠,王 洋,樊 秦,李平兰*
白术多糖对益生菌的促生长作用及结构分析
刘丽莎,王 锐,旭日花,尚 楠,王 洋,樊 秦,李平兰*
(中国农业大学食品科学与营养工程学院,北京 100083)
对白术、枸杞、太子参、五味子、党参、地黄、陈皮、灵芝的筛选结果表明,白术浸提液对婴儿双歧杆菌体外促生长效果最为明显。白术经水提(1:20)、醇沉(1:3)、透析(3500D)、脱蛋白(Saveg法)后经DEAE阴离子交换柱层析分离得到中性白术多糖(AMP)。AMP对两大类益生菌的促生长结果表明:AMP具有良好的促生长效果,其中对婴儿双歧杆菌(Bifidobacterium infantis)、青春双歧杆菌(Bifidobacterium adolesentis)、动物双歧杆菌(Bifidobacterium animalis)、植物乳杆菌(Lactobacillus plantarum)的促生长效果最佳,且AMP的促生长作用与其添加浓度有关。AMP经红外光谱分析具有多糖特征吸收峰;经多角度激光散射仪结合凝胶渗透色谱(GPC-MALLS)法测得其重均分子质量(Mw)为5527g/mol,分子质量分布(Mw/Mn)为1.726;酸水解法及高效阴离子交换色谱-脉冲安培检测(HPAEC-PAD)分析表明:AMP为杂多糖,单糖组成为阿拉伯糖、半乳糖、葡萄糖和甘露糖,其物质的量比为13.8:11.8:70.2:4.1。
白术多糖;促生长作用;分子质量;单糖组成;益生菌
白术(Atractylodes macrocephala Koidz)为菊科(Compositae)植物白术的干燥根茎,性温,味甘苦,具有补脾、益胃、燥湿、和中等功效,主要产于我国浙江、安徽等地。已有研究表明,白术有抗衰老、治疗胃肠功能紊乱、抗肿瘤、免疫调节、抗菌消炎等诸多作用,这与白术中的多种生物活性成分有关[1]。目前白术活性成分的研究主要集中在苍术酮和白术内酯类方面,少数报道了白术多糖可以增加溶血素及调节脾淋巴细胞作用[2],但没有关于白术多糖对益生菌的作用方面的报道。
本研究旨在从常见药食同源性中草药中筛选出对双歧杆菌具有良好促生长作用的中草药,并对该中草药的多糖进行提取纯化,结构分析及体外促生长研究,为研制与开发新型功能性益生元提供新的思路与途径。
1 材料与方法
1.1 材料与试剂
白术、枸杞、太子参、五味子、党参、地黄、陈皮、灵芝均购自北京同仁堂百旺山药店。
青春双歧杆菌CICC6070(Bifidobacterium adolesentis)、婴儿双歧杆菌CICC6069(Bifidobacterium infantis)、长双歧杆菌CICC6068(Bifidobacterium longum)购于中国工业微生物菌种保藏管理中心;两歧双歧杆菌1.5091(Bifidobacterium bifidum)购自中科院微生物研究所;动物双歧杆菌01(Bifidobacterium animalis)、嗜酸乳杆菌2La-12(Lactobacillus acidophilus)、植物乳杆菌T1-1(Lactobacillus plantarum)为中国农业大学食品科学与营养工程学院微生物实验室保存菌株。
L-鼠李糖、L-阿拉伯糖、D-半乳糖、D-葡萄糖、D-甘露糖、D-果糖(纯度≥99%) Sigma公司;NaOH Dionex公司;Millipore超纯水,其他试剂均为国产分析纯。1.2仪器与设备
DIONEX ICS-3000高效离子色谱仪 美国戴安公司;HITACHI L-2000型凝胶渗透色谱仪 日本日立公司; DAWN HELEOS-II型激光光散射仪、Optilab rEX型示差折光仪 美国怀雅特技术公司;NEXUS-470傅里叶红外光谱仪 美国Nicolet公司;UV-2102PC型紫外可见分光光度计 尤尼柯公司;DHL-A电脑恒流泵、TH-500梯度混合器、BS-100A自动部分收集器 上海青浦沪西仪器厂公司;ML54/02电子天平 梅特勒-托利多仪器有限公司;玻璃离子交换柱(2.6cm×20cm)填装DEAE-Sepharose Fast Flow、玻璃凝胶过滤柱(1.6cm× 80cm)填装Sepharose CL-6B Pharmacia公司; FD-1D冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 益生中草药筛选
1.3.1.1 中草药浸提液及其促生长培养基制备
各取10g中草药,分别加入200mL蒸馏水浸泡24h,煎煮30min后过滤,滤渣加同量水再煎30min,合并滤液蒸发浓缩至100mL得到8种10%中草药浸提液,按体积比1:9加入液体MRS培养基中,充氮后121℃灭菌20min置于冰箱备用[3]。
1.3.1.2 不同中草药浸提液对双歧杆菌的增殖作用
将活化好的B. infantis分别按1%(约106CFU/mL)的接种量接种于含不同中草药浸提液的培养基中,同时以不加药液的MRS培养基为对照,37℃培养12h后,进行样品10倍系列梯度稀释至合适浓度,采用Hungate厌氧滚管技术[4],37℃培养48h后计数。
1.3.2 白术多糖的提取纯化及纯度鉴定
1.3.2.1 水提醇沉法制备白术粗多糖
将白术浸提液(制备方法见1.2.1.1节)浓缩后加入3倍体积的95%的乙醇,置于4℃冰箱醇沉过夜,8000r/min离心10min收集沉淀,沉淀复溶后,对水透析48h,除去乙醇、小分子糖、蛋白质、盐等。浓缩透析液,真空冷冻干燥,得白术粗多糖。
1.3.2.2 Saveg法除蛋白[5]
白术粗多糖热水复溶后,将Saveg液(氯仿与正丁醇体积比4:1)与糖液以2:1体积比混合摇匀脱蛋白,重复4次,至紫外测定在260、280nm波长处无蛋白质和核酸的吸收峰。糖液对水透析48h,除去氯仿和正丁醇,浓缩,冷冻干燥得到不含蛋白质的白术多糖。
1.3.2.3 DEAE-Sepharose Fast Flow阴离子柱层析纯化
将除蛋白后的白术多糖配制成10mg/mL溶液,0.45μm微孔滤膜过滤后上样,50mmol/LTris-HCl和0~1.0mol/L Tris-HCl-NaCl线性梯度混合洗脱,流速4.0mL/min,2min/管,收集40管,部分收集器收集洗脱液。以苯酚-硫酸比色法[6]跟踪检测每管多糖含量。收集含多糖的峰对去离子水透析24h,浓缩后冷冻干燥,得到白术多糖纯品并命名为AMP(Atractylodes macrocephala polysaccharides)。
1.3.2.4 多糖纯度鉴定
常压凝胶色谱层析:将AMP冻干样品复溶,配制成10mg/mL溶液,0.45μm微孔滤膜过滤后上样,0.05mol/L NaCl洗脱,流速30mL/h,12min/管,自动部分收集器收集洗脱液。苯酚-硫酸比色法跟踪检测每管多糖含量,绘制曲线图。
紫外(UV)检测:将纯品AMP制备成0.5mg/mL样品待测液,以去离子水为空白对照,在波长220~580nm范围内利用紫外分光光度计进行紫外全波长扫描,以确定AMP中是否含有核酸和蛋白质。
1.3.3 白术多糖对双歧杆菌体外促生长实验
1.3.3.1 白术多糖对双歧杆菌体外生长的影响
将活化好的5株双歧杆菌分别以1%接种量(约106CFU/ mL)接种于AMP,添加量为0、0.5%、1.0%、1.5%、2.0%、2.5%的MRS培养基中,各添加量重复3组,37℃培养24h后,于600nm波长处测定各培养液的OD值。
1.3.3.2 白术多糖对乳杆菌的体外生长影响
将活化好的2株乳杆菌分别以1%接种量(约106CFU/mL)接种于AMP,添加量为0、0.5%、1.0%、1.5%、2.0%、2.5%的MRS培养基中,各添加量重复3组,37℃培养24h后测定OD600nm。
1.3.4 白术多糖的结构分析
1.3.4.1 分子质量测定
多角度激光散射仪结合凝胶渗透色谱(GPC/MALLS)法检测AMP重均分子质量。色谱条件:色谱柱Shodex OHpak SB-806M HR (8.0mm×300mm);检测器:激光光散射仪、示差折光仪;dn/dc值为0.135;流动相:0.1mol/L NaNO3;流速:0.5mL/min;柱温:35℃;进样体积:200μL;样品质量浓度:0.2mg/mL。
1.3.4.2 红外光谱分析
采用KBr压片法,NEXUS-470 FTIR红外检测器在400~4000cm-1检测范围扫描32次。
1.3.4.3 单糖组成测定
准确称取AMP纯品干粉5mg,加入200μL 浓H2SO4静置,添加800μL蒸馏水,100℃恒温水解2.5h,冷却后定容至2mL,水解液以固体BaCO3中和,离心除去杂质,将上清液稀释20倍并过滤后进行单糖定性检测。
选择不同质量浓度(0.2、0.5、1.0、4.0、10.0μg/mL)的混合单糖标准品,以单糖浓度(μg/mL)为横坐标,以峰面积(nC×min)为纵坐标绘制每种单糖的标准曲线进行单糖定量检测。
HPAEC-PAD色谱条件:糖分析柱(CarboPacTMPA10,4mm×250mm);糖保护柱(CarboPacTMPA10,4mm×50mm);流动相:H2O和200mmol/L NaOH,线性梯度洗脱;ED50A电化学检测器;进样体积:25μL;流速:1.0mL/min;柱温:30℃。
2 结果与分析
2.1 益生中草药的筛选
不同中草药浸提液按1.0%添加到MRS培养基中,对B. infantis生长影响的结果见图1。

图1 1.0%中草药浸提液对B. infantis 体外生长的影响Fig.1 Promoting effects of 1.0% water extracts from eight common medicinal and edible Chinese herbs on the growth of B. infantis
图1 显示,8种中草药浸提液对B. infantis生长的影响有较大差异,其中白术浸提液的促生长效果最为明显,与空白对照相比,达到了极显着水平(P<0.01);而枸杞、五味子则有一定的抑制作用,其余中草药浸提液对B. infantis生长无明显促进作用(P>0.05),这可能与药液添加浓度、处理方式及受试菌株有关。
许多研究报道中草药浸提液及中草药多糖可以促进双歧杆菌的增殖[7-9],但到目前为止,还没有关于白术多糖对益生菌促生长作用的报道。因此,本研究进一步分离纯化该白术多糖,并对其促生长作用进行考察与验证。
2.2 白术多糖提取纯化
白术浸提液经水提醇沉后获得粗多糖,得率为1g/10g白术,呈灰白色,片状或粉末状,水溶性良好。粗多糖经DEAE Sepharose F F柱层析(Tris-HCl和Tris-HCl-NaCl线性梯度混合洗脱)结果见图2。
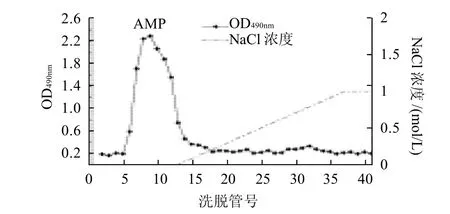
图2 白术多糖的DEAE阴离子交换柱洗脱曲线Fig.2 Elution profile of crude polysaccharides from Rhizoma Atractylodis Macrocephalae on DEAE Sepharose FF column
由图2的DEAE阴离子交换柱洗脱曲线可以看出,白术粗多糖在Tris-HCl洗脱时得到一个中性多糖洗脱峰,峰形单一对称,将此峰命名为AMP。
2.3 纯度鉴定
采用常压凝胶色谱层析和紫外检测对AMP的纯度进行鉴定,结果见图3、4。
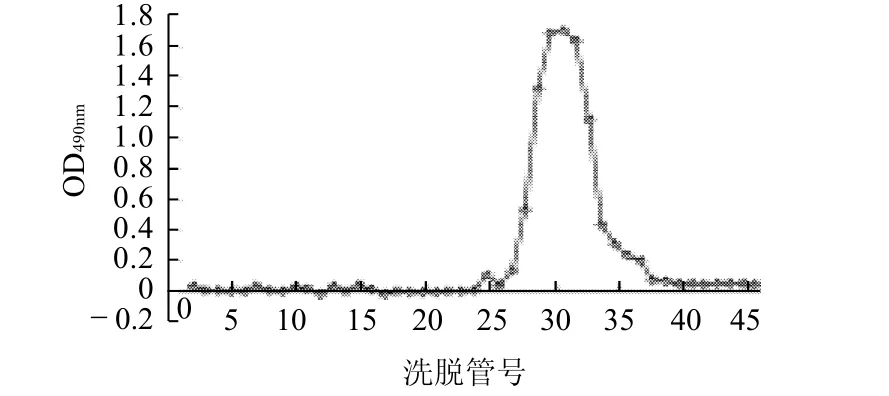
图3 AMP的Sepharose CL-6B凝胶层析洗脱曲线Fig.3 Elution profile of the neutral polysaccharide fraction of crudepolysaccharides from Rhizoma Atractylodis Macrocephalae on Sepharose CL-6B column
图3 显示,AMP经Sepharose CL-6B分子筛柱层析,苯酚-硫酸法跟踪多糖含量时在26~35管处得到一峰,峰形单一对称,无杂峰,表明经此方法纯化获得的白术多糖为均一多糖。
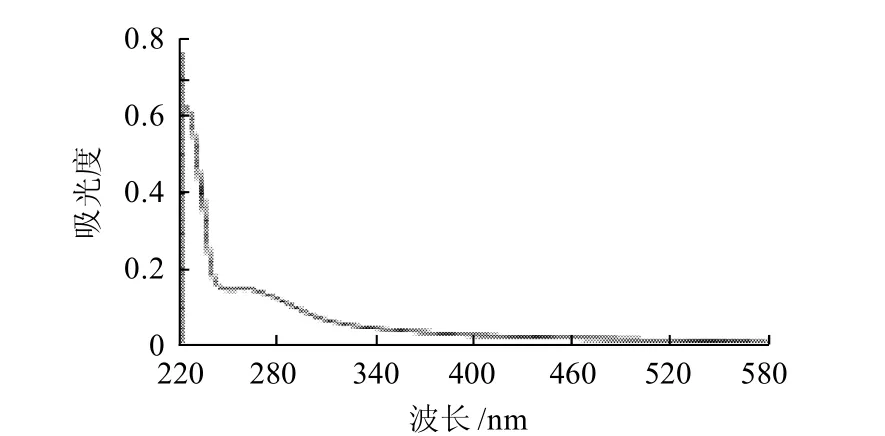
图4 AMP的紫外扫描图Fig.4 UV scanning spectrum of the purified neutral polysaccharide from Rhizoma Atractylodis Macrocephalae
从图4对白术多糖进行的紫外全波长扫描(220~580nm)结果可以看出,白术多糖在280nm附近没有蛋白质的特征吸收峰,在260nm附近没有核酸特征吸收峰,说明该多糖中不含蛋白质和核酸。
2.4 白术多糖对益生菌促生长作用
2.4.1 不同添加量白术多糖对双歧杆菌促生长作用
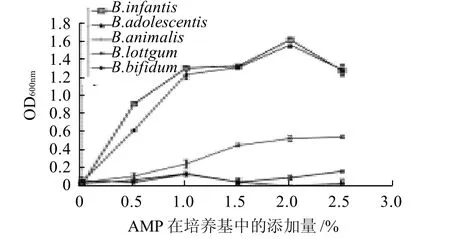
图5 不同添加量AMP对双歧杆菌生长的影响Fig.5 Effect of amount of the purified neutral polysaccharide from Rhizoma Atractylodis Macrocephalae added to medium on the growth of Bifidobacterium
由图5可知,随着AMP添加量的增加,B. adolescentis、B. infantis和B. animalis的生长表现为逐渐增加的趋势,在2.0%添加量时达到了饱和,其中对B. adolescentis、B. infantis的促生长效果尤为显着。当AMP添加量高于2.0%时,促生长效果反而减弱,这可能是由于高浓度的糖引起了渗透压、pH值改变及代谢产物的积累等限制了双歧杆菌的生长。而不同添加量的AMP对B. longum及B. bifidum的促生长作用均不显着,促进效果不明显。
2.4.2 不同添加量白术多糖对乳杆菌的促生长作用
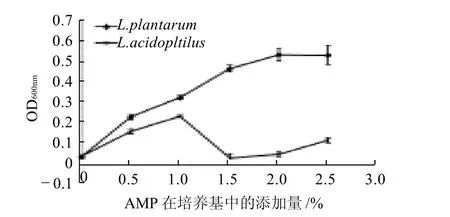
图6 不同添加量AMP对乳杆菌生长的影响Fig.6 Effect of amount of the purified neutral polysaccharide from Rhizoma Atractylodis Macrocephalae added to medium on the growth of Lactobacillus
由图6可知,AMP对2株乳杆菌的促生长作用与其添加量密切相关。在2.0%的添加量范围内,随着AMP添加量的增加,对L. plantarum的促生长作用显着增强,添加量为2.0%时达饱和。但对L. acidophilus而言,仅在1.0%的范围内,促生长效果随AMP添加量增加而增强,但明显低于对L. plantarum的促生长效果。2.5AMP摩尔质量测定

表1 白术多糖AMP的摩尔质量Table 1 Results of determining the neutral polysaccharide from Rhizoma Atractylodis Macrocephalae by GPC-MALLS
由表1可知,AMP的Mw为5.527×103g/mol,Mn为3.203×103g/mol,Mw/Mn比值为1.726。Mw/Mn比值为多糖摩尔质量多分散系数(d),其大小可作为判断样品摩尔质量分布是否均匀的指标。如果样品分子大小比较均一,d值应比较小或接近1.0,本结果显示AMP的d值为1.726,说明AMP的摩尔质量分布较均一。
池玉梅等[10]将水提醇沉后经DEAF纤维素柱分离得到的两个水溶性白术多糖,经高效液相(HPLC)测得平均相对分子质量分别为1.36×105和1.04×105。梁中焕等[1]将Sephadex G-75层析柱制得的水溶性白术粗多糖经HPLC测得相对分子质量为8374。黄海英[11]用HPLC法测得生白术中性多糖相对分子质量为5896.43。侯轩等[12]采用复合酶法提取白术多糖经DEAE纤维素柱层析纯化后经凝胶渗透色谱法测得其重均分子质量(Mw)为4360 D。而本实验分离纯化的白术多糖(AMP)重均分子质量为5527g/mol。
2.6 AMP红外光谱
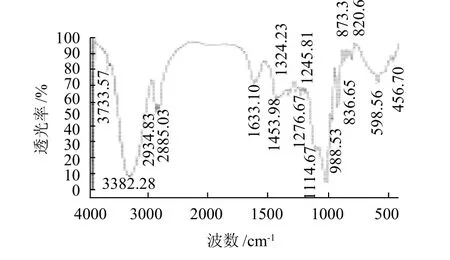
图7 白术多糖AMP的FT-IR谱图Fig.7 FT-IR spectrum of the neutral polysaccharide from Rhizoma Atractylodis Macrocephalae
由图7可知,3382.28cm-1处的极强而宽的吸收峰归属于羟基,是O-H伸缩振动峰;2934.83cm-1和2885.03cm-1处的中强峰是C-H伸缩振动峰;1453.98cm-1处是C-H弯曲振动峰;在1114.67、1033.69cm-1和988.53 cm-1处的强峰是C-O伸缩振动峰,并表明糖环形式为吡喃糖苷;这些特征峰都是典型的多糖特征吸收峰,说明该物质为多糖类化合物;1633.10cm-1处的强吸收峰是C=O键伸缩振动峰;1342.23cm-1处出现的是O-H键的弯曲振动峰;1280~1240cm-1处是环醚的不对称伸缩振动峰。
2.7 AMP单糖组成
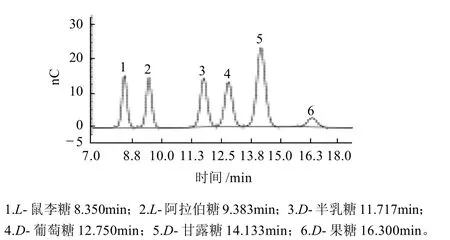
图8 单糖标品(1.0g/mL)HPAEC-PAD色谱图Fig.8 HPAEC-PAD chromatogram of standard monosaccharides
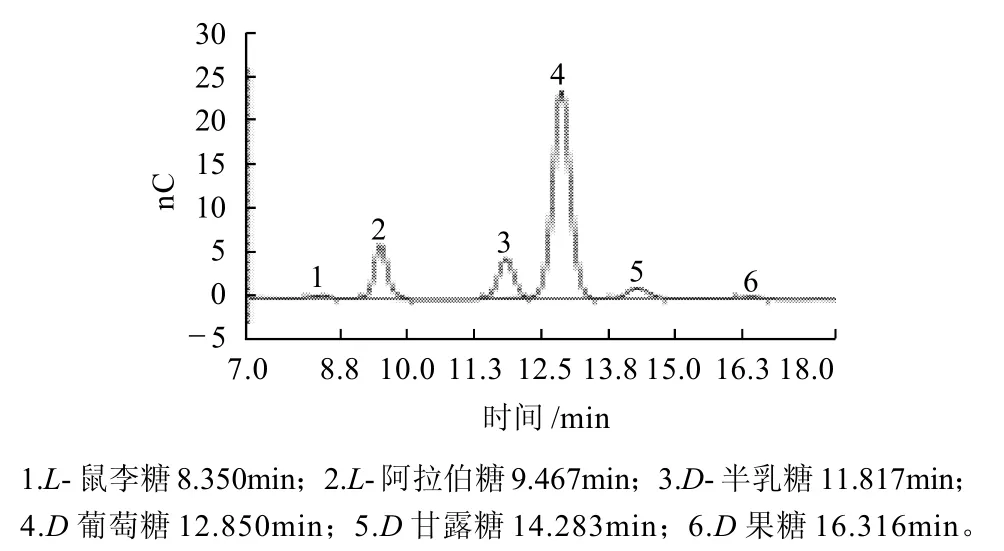
图9 AMP的HPAEC-PAD色谱图Fig.9 HPAEC-PAD chromatogram of the neutral polysaccharide from Rhizoma Atractylodis Macrocephalae
由图8、9可以看出,图谱基线平稳,杂质干扰少,各单糖的分离效果好,峰型单一且对称。根据标准谱图和各单糖的回归方程,得到了样品的单糖组成和比例。结果显示,AMP是一种杂多糖,主要含有阿拉伯糖、半乳糖和葡萄糖,并含有少量的甘露糖。阿拉伯糖、半乳糖、葡萄糖和甘露糖的含量摩尔比为13.8:11.8:70.2:4.1。
目前已报道的白术多糖都是杂多糖,单糖组成中通常含有葡萄糖、半乳糖、鼠李糖、甘露糖、阿拉伯糖和木糖中的3~4种单糖。池玉梅等[10]分离得到的两个水溶性白术多糖中,一个由半乳糖、鼠李糖、阿拉伯糖、甘露糖组成;另一个由木糖、阿拉伯糖、半乳糖组成。梁中焕等[1]报道的白术水溶性多糖的单糖组成为葡萄糖、半乳糖、鼠李糖和甘露糖,物质的量比为7.36:1.00:3.05:1.52。本实验中AMP由阿拉伯糖、半乳糖、葡萄糖和少量甘露糖组成,其中葡萄糖的含量较高,与已报道的白术多糖的单糖组成结果不完全一致,这也有可能与该白术的来源和分离纯化方法不同有关。
3 结 论
本研究从8种中草药中筛选出具有明显益生作用的白术,并从中分离提取了活性成分白术多糖(AMP),分析测定了AMP的分子质量与单糖组成等结构特点,考察了AMP对益生双歧杆菌和乳杆菌的促生长效果。结果表明AMP是一个杂多糖,由阿拉伯糖、半乳糖、葡萄糖和少量甘露糖组成,在MRS培养基中以2.0%的添加量加入后,对B. adolescentis、B. infantis、B. animalis和L. plantarum具有明显的促生长效果;1.0%的添加量对L.acidophilus具有良好的促生长作用。显示出该AMP具有作为新型益生元开发的巨大潜力和应用前景。
[1]梁中焕. 硫酸化修饰对白术多糖理化性质及生物活性影响的研究[D].长春: 东北师范大学, 2008.
[2]汤新慧. 白术多糖对小鼠免疫功能的影响[J]. 中医研究, 1998, 11(2): 7-9.
[3]李平兰, 时向东, 吕燕妮. 常见中草药对两种肠道有益菌体外生长的影响[J]. 中国农业大学学报, 2003, 8(5): 33-36.
[4]HUNGATE R E. A roll tube method for cultivation of strict anaerobes[J]. Methods in Microbiology, 1969, 3B: 117-132.
[5]欧阳清波, 李平兰, 李伟欣, 等. 双歧杆菌22-5胞外多糖(EPS)的分离、纯化及纯度鉴定[J]. 食品与发酵工业, 2005, 31(6): 127-130.
[6]徐斌, 董英, 林琳, 等. 改良苯酚-硫酸法测定苦瓜多糖含量[J]. 食品科学, 2005, 26(7): 79-82.
[7]邱宏端, 林娟, 宋智晶, 等. 植物多糖的提取及对双歧杆菌的增殖作用[J]. 农业工程学报, 2002, 18(2): 96-100.
[8]张火云. 枸杞及其他中药对双歧杆菌(Bifidobacteria)增殖和发酵影响的研究[D]. 成都: 四川大学, 2004.
[9]张耀, 朱伟云. 中草药对消化道微生物的影响[J]. 微生物学通报, 2007, 34(3): 569-571.
[10]池玉梅, 李伟, 文红梅, 等. 白术多糖的分离纯化和化学结构研究[J].中药材, 2001, 24(9): 647-648.
[11]黄海英. 白术活性成分的提取、纯化及功能性研究[D]. 南昌: 南昌大学, 2006.
[12]侯轩, 周家容, 田允波. 白术多糖的提取、分离纯化及分子量测定[J]. 仲恺农业工程学院学报, 2009, 22(2): 18-21.
Promoting Effect of Polysaccharides Isolated from Rhizoma Atractylodis Macrocephalae on the Growth of Probiotics and Structure Analysis
LIU Li-sha,WANG Rui,XU Ri-hua,SHANG Nan,WANG Yang,FAN Qin,LI Ping-lan*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Among eight common medicinal and edible Chinese herbs, namely Rhizoma Atractylodis Macrocephalae, Fructus Lycii Chinensis, Radix Pseudostellariae, Fructus Schisandrae Chinensis, Radix Codonopsitis, Radix Rehmanniae, Pericarpium Citri Reticulatae and Glossy Ganoderma), the water extract from Rhizoma Atractylodis Macrocephalae had the most obvious promoting effect on the in vitro growth of Bifidobacterium infantis. A neutral polysaccharide fraction was obtained from Rhizoma Atractylodis Macrocephalae after water extraction (1:20 raw material/water ratio), absolute ethanol precipitation (1:3 concentrated crude extract/absolute ethanol), dialysis (through a membrane with a molecular weight cut-off of 3500 D), Sevag deproteinization and DEAE anion exchange column chromatographic separation. The polysaccharide fraction had a promoting effect on the growth of Bifidobacterium and Lactobacillus, especially on B. infantis, B. animalis, B. adolescentis and Lactobacillus plantarum in a concentration-dependent fashion. The infrared spectral analysis showed that the fraction had characteristic absorption peaks of polysaccharides, and its weight-average molecular weight (Mw) was measured to be 5527 g/mol using GPC coupled with a multiangle laser light scattering photometer (GPC-MALLS) and its molecular weight distribution (Mw/Mn) was 1.726. The analysis using acidic hydrolysis followed by high-performance anion exchange chromatography with pulsed amperometric detection (HPAEC-PAD) revealed that the polysaccharide was a hetero polysaccharide and its monosaccharide composition consisted of rabinose, galactose, glucose and mannose in a molar ratio of 13.8:11.8:70.2:4.1.
Rhizoma Atractylodis Macrocephala polysaccharide;growth promoting effect;molecular weight;monosaccharide composition;probiotics
TS201.4;R282.6
A
1002-6630(2010)19-0124-05
2010-06-23
国家大学生创新性实验计划项目(091001924);国家“863”计划项目(2008AA10Z324)
刘丽莎(1989—),女,本科生,研究方向为益生菌与益生元的开发与利用。E-mail:liulisha0616@sina.com *通信作者:李平兰(1964—),女,教授,博士,研究方向为食品微生物与发酵工程。E-mail:plli@sohu.com



