陆剑锋,林 琳,张伟伟,翁世兵,叶应旺,姜绍通
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
水酶法提取斑点叉尾鮰内脏油的工艺研究
陆剑锋,林 琳,张伟伟,翁世兵,叶应旺,姜绍通
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
为提高鱼类加工废弃物的综合利用率,以斑点叉尾鮰内脏为原料,采用水酶法制备鱼油。结果表明:水酶法提取鱼油的最佳工艺条件为初始pH7.5、料液比1:1、加酶量3500U/g、酶解温度55℃、酶解时间0.5h,该条件下鱼油的提取率达到80.94%;提取到的鱼油(即粗鱼油)外观呈黄褐色,具有鱼腥味和轻微的酸败味,其过氧化值较低,而酸值相对较高;粗鱼油中的饱和脂肪酸相对含量为19.42%,单不饱和脂肪酸和多不饱和脂肪酸分别为61.76%和16.83%,∑n-3/∑n-6的脂肪酸比值达到3.63。表明斑点叉尾鮰内脏是生产鱼油的良好来源。
斑点叉尾鮰;内脏;鱼油;水酶法
斑点叉尾鮰(Ictalurus punctatus),又称沟鲇,属于鲇形目、鮰科鱼类,原产于北美洲,是一种经济价值较高的大型淡水鱼[1]。斑点叉尾鮰具有抗病力强、生长迅速、肉味鲜美、风味独特等优点,我国于1984年从美国将其引入湖北,近年来被大规模推广养殖,特别是在湖北、湖南、江西、安徽等省,2007年产量达14万吨左右,现已被农业部列为重点产业化开发对象[2]。
目前,我国斑点叉尾鮰的销售市场主要是以加工冷冻鮰鱼片出口为主,在加工过程中产生了大量的下脚料,包括鱼头、鱼排、鱼皮和内脏等,其中内脏平均达到鱼体重的10%左右[3]。相对于海水鱼而言,淡水鱼的内脏体积大,组成复杂,易腐败变质,但脂肪含量较高,因此可以对其进行高值化利用,从中提取可食用鱼油,这样不仅避免了环境污染,而且对于合理利用资源,提高水产品加工产业的附加值具有重要意义。
生产鱼油的方法主要有压榨法[4]、淡碱水解法[5]、溶剂法[6]、水法[7]、蒸煮法[8]、超临界流体萃取[9]、水酶法[10]等。相比较而言,水酶法提取油脂的工艺条件较为温和,不仅有利于增加油脂提取率和提高油脂的品质(即有利于提高油脂产量和减轻精炼过程的负担),同时也能够有效利用内脏中的蛋白质资源[11]。本研究以斑点叉尾鮰内脏为原料,对水酶法提取鱼油的工艺路线进行研究,旨在为斑点叉尾鮰下脚料的综合开发利用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
斑点叉尾鮰(一龄鱼)内脏由明光市永言水产食品有限公司提供,先将内脏去除胆囊、鳔及肠道内消化物,在组织捣碎机中捣碎,然后分装于封口袋中,-24℃冷冻贮藏备用。所用试剂均为分析纯。
1.2 仪器与设备
CT15RT台式高速冷冻离心机 上海天美生化仪器设备工程有限公司;FSH-2A可调高速匀浆机 江苏金坛市荣华仪器制造有限公司;YB-1A真空恒温干燥箱 天津市鑫洲科技有限公司;PHS-3C精密pH计 上海大普仪器有限公司;Saturn2200气质联用仪 美国Varian公司。
1.3 方法
1.3.1 水酶法提取鱼油工艺
将一定量经过匀浆的斑点叉尾鮰内脏解冻后,放入具塞锥形瓶中,加水调整液料比(g/mL),用4mol/L的NaOH溶液或HCl溶液调节酶解液的初始pH值,然后加入一定量的蛋白酶,并向锥形瓶中填充氮气(抗氧化),在一定的温度条件下,保温水解一段时间,随后在5000×g的条件下趁热离心10min,分离出上层鱼油。

1.3.2 原料基本营养成分的测定
水分含量:直接干燥法,参照GB/T 5009.3—2003《食品中水分的测定》;灰分:灼烧称重法,参照GB/T 5009.4—2003《食品中灰分的测定》;粗蛋白:凯氏定氮法,参照GB/T 5009.5—2003《食品中蛋白质的测定》;粗脂肪:索氏抽提法,参照GB/T 5009.6—2003《食品中脂肪的测定》,并将粗脂肪的含量定为原料中鱼油的含量。
1.3.3 蛋白酶活力测定
蛋白酶活力的测定采用紫外分光光度法。酶活力定义:1g固体酶粉或1mL液体酶,在一定温度和pH值条件下,1min水解酪蛋白产生1μg酪氨酸为1个活力单位,以U/g或U/mL表示[12]。
1.3.4 水解蛋白酶的筛选
由于不同蛋白酶的酶切位点不一致,在提取斑点叉尾鮰内脏油中的水解作用也不同,为了得到最佳的提取效果,有必要对蛋白酶进行筛选。在参考大量文献的基础上,本实验选择5种蛋白酶(中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶、动物蛋白酶)对斑点叉尾鮰内脏分别进行酶解,同时也按照酶制剂产品的使用说明,确定蛋白酶的适宜水解条件见表1。
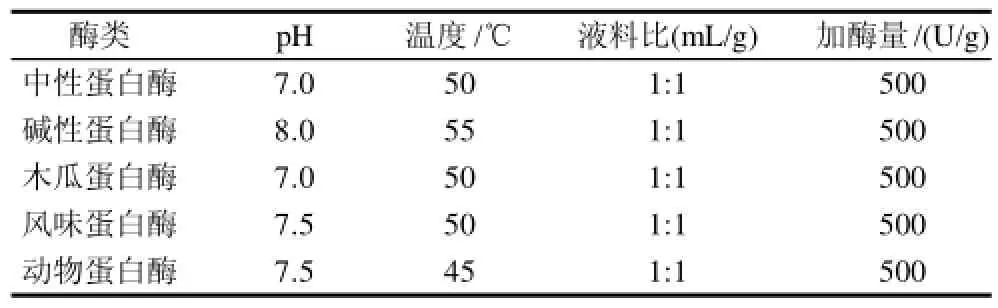
表1 各种蛋白酶的水解条件Table1 Hydrolysis conditions of various enzymes
1.3.5 鱼油的理化性质测定
感官评定:参照SC/T 3502-2000《中华人民共和国水产行业标准:鱼油》;水分及挥发物含量:参照GB/T 5528-2008《动植物油脂水分及挥发物含量测定》中的直接干燥法;不溶性杂质含量:参照GB/T 15688-2008《动植物油脂不溶性杂质含量的测定》中的坩埚式过滤器法;酸值:参照GB/T 5530-2005《动植物油脂酸值和酸度测定》中的热乙醇测定法;碘值:参照GB/T 5532-2008《动植物油脂碘值的测定》中的硫代硫酸钠滴定法;过氧化值:参照GB/T 5538-1995《油脂过氧化值测定》中的硫代硫酸钠滴定法。
1.3.6 脂肪酸组成分析
样品甲酯化[2]:称取样品0.5g置于具塞试管中,加入0.5mol/L氢氧化钾-甲醇溶液4mL,置于60℃水浴锅上皂化30min(油珠完全消失),冷却后加入12.5%硫酸-甲醇溶液40mL,于60℃水浴上酯化5min,冷却,将之倒入盛有45mL蒸馏水的分液漏斗中,加入正己烷2mL,放掉下层,用饱和氯化钠水溶液2mL洗涤至少3次,取上清液再加入2g无水硫酸钠,取上清液在3000~4000r/min条件下离心10min,用0.22μm微孔过滤膜过滤后,待GC-MS分析。
鱼油脂肪酸组成的测定采用气质联用仪。GC条件:CP5860石英毛细管柱(30m×0.25mm);载气:高纯氦;流速:0.9mL/min;进样口温度:260℃;柱温:起始温度160℃,保持3min,以5℃/min升温至200℃,再以10℃/min升温至240℃,保持5min;MS条件:EI离子源,电离能量70eV;离子阱温度150℃;传输线温度280℃;电子倍增管电压2400V。通过对NIST(2001版)谱库检索,对脂肪酸进行定性,并采用面积归一化法确定其相对含量。
2 结果与分析
2.1 斑点叉尾鮰内脏基本组成
由表2可知,斑点叉尾鮰内脏中的粗蛋白含量仅占8.58%,而粗脂肪含量达到28.14%,因此斑点叉尾鮰内脏可以作为鱼油提取的良好原料,而且鱼油提取的废液
中含有大量的氨基酸和活性多肽,今后也可以进一步加工利用。

表2 斑点叉尾鮰内脏的基本成分(x±s)Table2 Basic component of the viscera of channel catfish (x±s)
2.2 酪氨酸溶液最大吸收波长的确定
NE向断裂组:这组断裂在区内最为发育,带内主要发育角砾岩或糜棱岩,该组断裂被后期断裂带切穿,构成网格状,带内具有硅化、碳酸盐化及弱钾化,平面上呈舒缓波状,产状倾向60°~90°,倾角30°~60°。
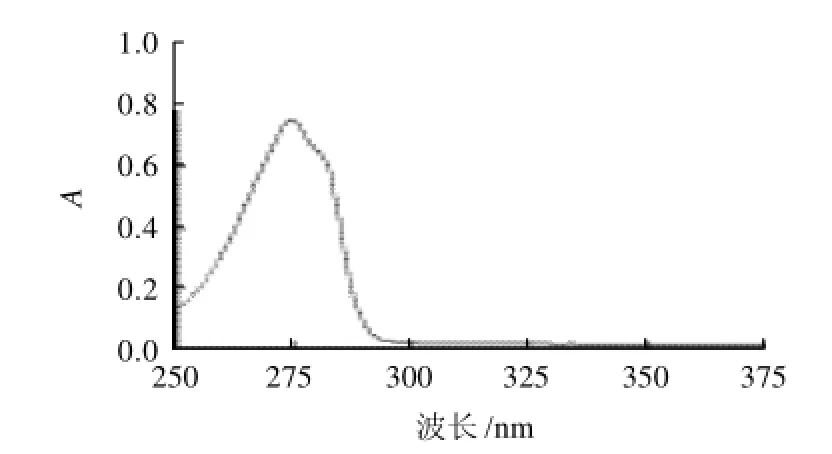
图1 酪氨酸标准溶液的吸收光谱曲线Fig.1 UV absorbency spectrum of tyrosine standard solution
由于酪氨酸带有芳香环侧链,所以在近紫外区(200~400nm)内对一定波长的光具有选择性吸收作用。取酪氨酸标准溶液,在250~375nm的范围内扫描,得到吸收光谱曲线,见图1。酪氨酸在275nm的紫外光下具有最大吸收峰,因此,选择在波长275nm处测定不同浓度的酪氨酸溶液的吸光度,并绘制标准曲线。
2.3 蛋白酶的筛选
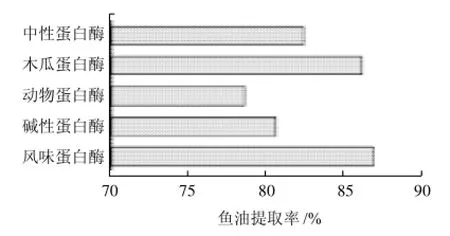
图2 不同种类的酶对鱼油提取率的影响Fig.2 Effect of enzyme on the extraction rate of fish oil
蛋白酶水解能力的差异主要是由蛋白酶对肽键的专一性不同引起的。将5种蛋白酶的添加量都确定在500U/g、酶解时间都选择在3h,按表1条件进行酶解,从图2对鱼油提取率的影响可以看出,木瓜蛋白酶和风味蛋白酶的效果较好,其中风味蛋白酶的提油率最高,达到了86.81%左右,而木瓜蛋白酶的提油率也高达86.07%。相比之下,木瓜蛋白酶是一种纯天然的生物酶制剂,且酶活相对较高、来源丰富、价格低廉,能充分满足工业化生产的需要,因此本实验选用木瓜蛋白酶作为鮰鱼内脏鱼油的提取酶。
2.4 单因素试验
2.4.1 酶解时间的确定
以酶解时间为横坐标、鱼油提取率为纵坐标,绘制酶解时间与提取率值关系曲线,如图3所示。随酶解时间的延长(<1h),鱼油提取率也随之增加,这主要是酶解时间的增加,使得酶与底物的作用更加彻底,破坏了脂肪和蛋白质的关系,充分释放出脂肪。但随酶解时间延长(即加热时间越长),鱼油多不饱和脂肪酸氧化生成深色物质,鱼油的颜色出现很大变化,由淡黄色变为红棕色。当酶解时间大于1h后,延长酶解时间已不能大幅度提升鱼油的提取率,因此综合各方面条件,酶解时间选择1 h。
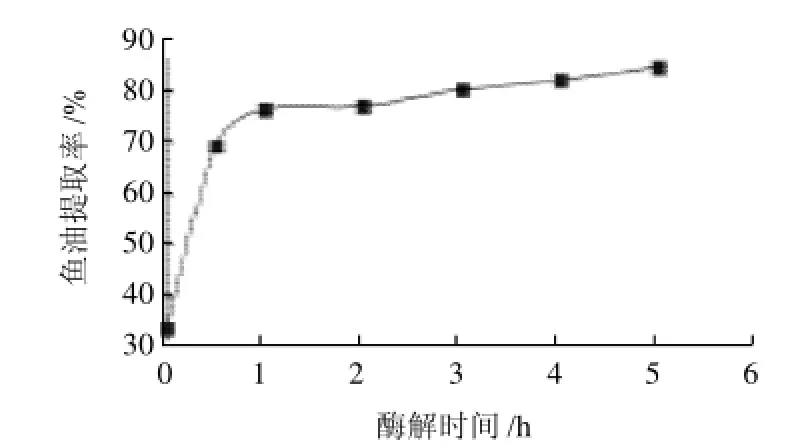
图3 酶解时间对鱼油提取率的影响Fig.3 Effect of hydrolysis time on the extraction rate of fish oil
2.4.2 初始pH值的确定

图4 初始pH值对鱼油提取率的影响Fig.4 Effect of initial pH on the extraction rate of fish oil
响,有时随着底物种类和浓度的改变也会发生变化。从图4可以看出,当初始pH值在7.0时,鱼油提取率达到最大,因此,把水解液的最适初始pH值确定为7.0。
2.4.3 酶解温度的确定
以酶解温度为横坐标、鱼油提取率为纵坐标,绘制酶解温度与鱼油提取率关系曲线,如图5所示。在酶解过程中,随着温度的逐渐升高,酶促反应速率加快,而且在温度较高的情况下,有利于破乳,鱼油容易分离。另一方面,当温度继续升高时,酶蛋白逐渐变性而失活,引起酶反应速率下降[13],而且温度过高也不利于鱼油的品质。由图5可以看出,当酶解温度在55℃时,鱼油提取率最大,因此把酶解温度确定在55℃。
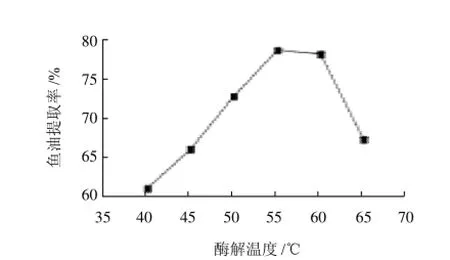
图5 酶解温度对鱼油提取率的影响Fig.5 Effect of hydrolysis temperature on the extraction rate of fish oil
2.4.4 加酶量的确定
以加酶量为横坐标、鱼油提取率为纵坐标,绘制加酶量与提油率的关系曲线,如图6所示。随着加酶量的增加,鱼油提取率逐渐上升,当加酶量达到3000U/g以后,由于底物浓度的下降,鱼油提取率增加趋于平缓。考虑到生产成本和反应速率等综合因素,酶的添加量确定在3000U/g。
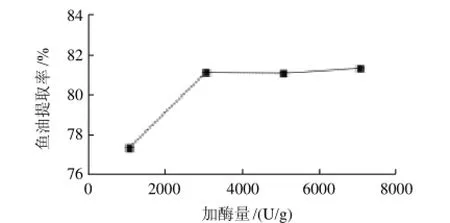
图6 加酶量对鱼油提取率的影响Fig.6 Effect of enzyme dosage on the extraction rate of fish oil
2.4.5 液料比的确定
以液料比为横坐标、鱼油提取率为纵坐标,绘制液料比与鱼油提取率关系曲线,如图7所示。当液料比较小时,底物浓度高,物料黏稠,分散不均匀,过多底物聚集于酶的活力中心,从而影响酶催化速度,使鱼油提取率下降[14];液料比过大的话,导致酶和底物的浓度降低,不利于反应的进行,鱼油提取率下降,而且增加后期离心分离的难度,因此将液料比确定为1:1。
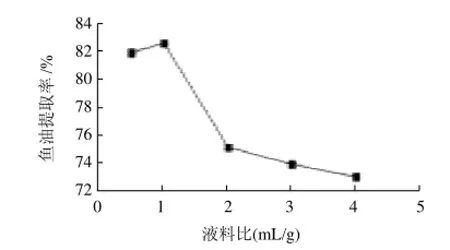
图7 液料比对鱼油提取率的影响Fig.7 Effect of water-to-material ratio on the extraction rate of fish oil
2.5 水酶法提油工艺条件的优化
在单因素试验的基础上,确定液料比为1:1,以鱼油提取率为评价指标,采用L9(34) 正交试验考察加酶量(A)、酶解时间(B)、酶解温度(C)和初始pH值(D)4个因素对鱼油提取率的影响,以确定最佳的提油工艺条件。正交试验设计及结果分别见表3、4。
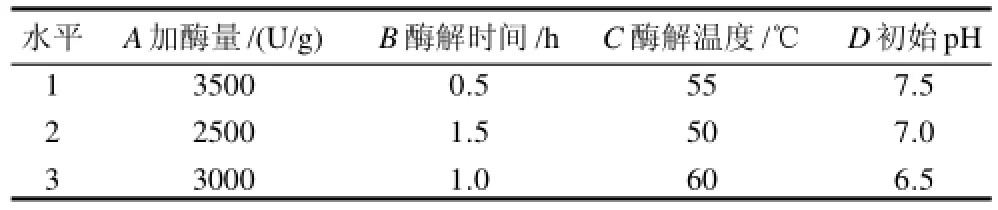
表3 工艺条件优化正交试验因素水平表Table3 Factors and levels of orthogonal test
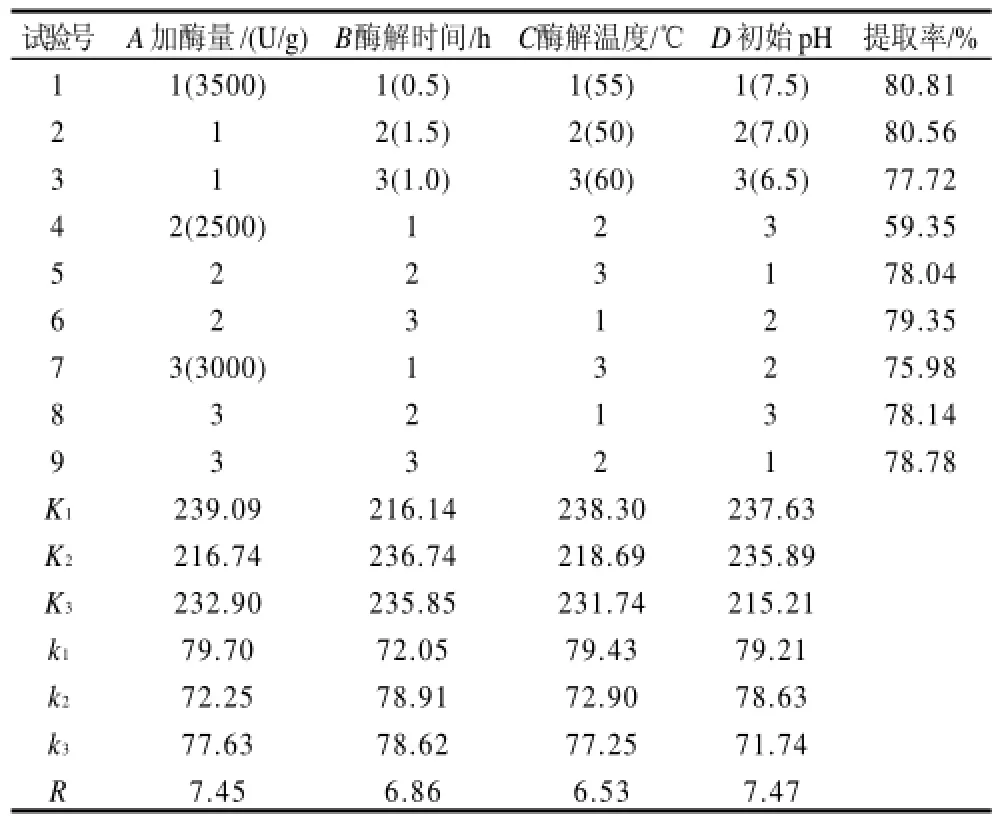
表4 工艺条件优化正交试验结果与分析Table4 Results and analysis of orthogonal test
由正交试验结果的极差分析(表4)可知,4因素对酶
法提取斑点叉尾鮰内脏油工艺的影响大小依次为初始pH值>加酶量>酶解时间>酶解温度,极差分析得到的最优水平组合为A1B2C1D1,而由正交试验的直接结果来看,最优水平组合是第一组A1B1C1D1。对A1B2C1D1和A1B1C1D1进行验证对比实验,验证结果为:A1B2C1D1和A1B1C1D1的鱼油提取率分别为84.47%和80.94%,两者不存在显着差异,但对比这两种提取工艺,A1B2C1D1酶解时间较长(需要1.5h),而A1B1C1D1的酶解时间较短(仅需0.5h),因此从提高工艺能效和鱼油质量的角度考虑,选择最佳工艺条件为A1B1C1D1,即料液比为1:1、加酶量3500U/g、酶解时间0.5h、酶解温度55℃,初始pH7.5。
2.6 粗鱼油理化性质测定
最佳提取条件下得到的粗鱼油外观呈黄褐色,具有鱼腥味和轻微的酸败味,理化性质分析见表5。由表5可知,粗鱼油的过氧化值较低,达到粗油的一级标准,但酸值相对较高(35.95mg/g),超出粗油的二级标准,可能是鱼油提取过程中,部分鱼油发生水解而导致酸值过大。另外,粗鱼油中还含有一定量的水分,蛋白质、胆固醇及色素等非甘油酯成分,这些杂质成分不仅影响鱼油的稳定性,而且还会影响鱼油的深加工,因此还需要进一步通过精炼工艺(如脱胶、脱酸、脱色、脱臭和冬化等)进行精制,从而提高鱼油的质量,以达到工业或食用的目的。
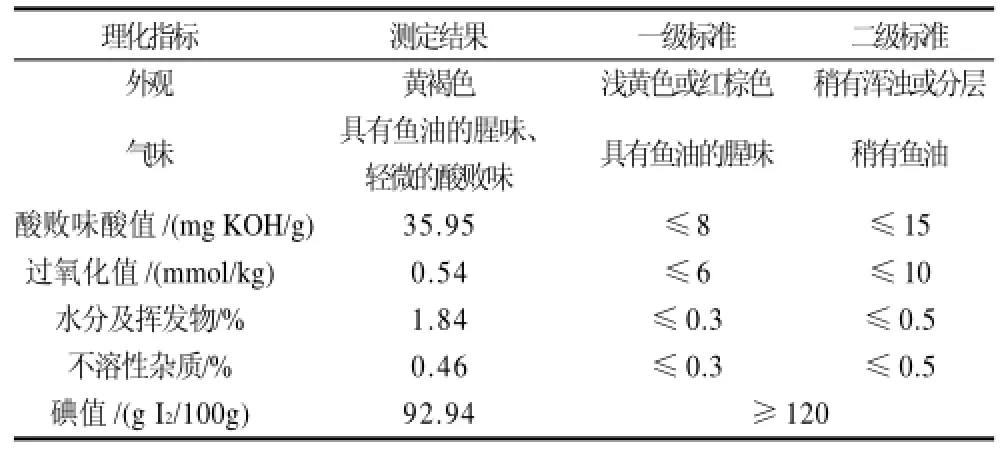
表5 鮰鱼内脏粗鱼油的理化性质Table5 Physics and chemistry indexes of crude fish oil from channel catfish
2.7 斑点叉尾鮰鱼油脂肪酸组成分析
对提取的鱼油进行气相色谱分离,并采用质谱仪分析,结果见表6。斑点叉尾鮰内脏鱼油主要由C14~C22,共19种脂肪酸组成,其中SFA(饱和脂肪酸)6种、MUFA (单不饱和脂肪酸)5种、PUFA(多不饱和脂肪酸)8种。粗鱼油中的UFA(不饱和脂肪酸)含量较高,达到78.59%,其中PUFA含量达到16.83%,而EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)含量较低,分别为0.63%、 0.93%,这主要是因为斑点叉尾鮰属于一种淡水鱼类(淡水鱼体内EPA和DHA的含量一般均较低),此外其体内的EPA和DHA含量还与其生活的水体环境及摄食的饲料有关[15]。
海水鱼油中的C18、C20、C22脂肪酸含量相对较高,而淡水鱼油中的C20、C22不饱和脂肪酸较少,但含有较多的C16饱和脂肪酸和C18不饱和酸[16]。与之相似,斑点叉尾鮰内脏鱼油中主要的脂肪酸种类是C16:0、C18:2n-7、C18:1n-9、C18:0,其含量分别为11.88%、13.24%、54.36%、5.86%。n-3系与n-6系多不饱和脂肪酸含量的比值(∑n-3/∑n-6)是比较鱼油相对营养价值的一个重要指标,通常认为达到1:1以上为好[17],而斑点叉尾鮰内脏鱼油中的∑n-3/∑n-6的比值达到3.63,远高于鲢鱼、草鱼和罗非鱼等其他淡水鱼类[18]。

表6 斑点叉尾鮰鱼油的脂肪酸组成Table6 Fatty acids composition of fish oil from channel catfish
3 结 论
斑点叉尾鮰内脏的粗蛋白含量仅为8.58%,而脂肪含量达到28.14%,是加工鱼油的良好来源。酶法提取斑点叉尾鮰内脏油的最佳的工艺条件为初始pH7.5、料液比1:1、加酶量3500U/g、酶解温度55℃、酶解时间
0.5h,在此条件下,鱼油提取率达到80.94%。在最佳提取条件下得到的粗鱼油外观呈黄褐色,具有鱼腥味和轻微的酸败味,对其理化性质进行分析表明,酸值相对较高,因此还需要进一步的精炼,以达到工业化或食用的目的。经GC-MS检测分析,酶法提取的粗鱼油中至少含有19种脂肪酸,饱和脂肪酸和不饱和脂肪酸分别为19.42%和78.59%,单不饱和脂肪酸和多不饱和脂肪酸分别为61.76%和16.83%,EPA和DHA的含量分别为0.63%、0.93%,而∑n-3/∑n-6的值达到3.63。
[1]李承林. 鱼类学[M]. 北京: 中国农业出版社, 2002: 148.
[2]张伟伟, 陆剑锋, 焦道龙, 等. 钾法提取斑点叉尾鮰内脏油的工艺研究[J]. 食品科学, 2009, 30(24): 42-46.
[3]SATHIVEL S, PRINYAWIWATKUL W, KING J M, et al. Oil production from catfish viscera[J]. Journal of the American oil Chemists Society, 2003, 80(4): 377-382.
[4]吴时敏. 功能性油脂[M]. 北京: 中国轻工业出版社, 2004: 145-146.
[5]杨官娥, 杨琦, 赵建滨, 等. 钾法提取鱼油工艺的研究[J]. 山西医科大学学报, 2001, 32(1): 31-32.
[6]黄志斌. 水产品综合利用工艺学[M]. 北京: 中国农业出版社, 1996: 89.
[7]陈英乡. 水法提取鱼油的生产工艺研究[J]. 食品科学, 1996, 17(3): 15-18.
[8]CHANTACHUM S, BENJAKUL S, SRIWIRAT N. Separation and quality of fish oil from precooked and non-precooked Tuna heads[J]. Food Chemistry, 2000, 69(3): 289-294.
[9]DAVARNEJAD R, KASSIM K M, ZAINAL A, et al. Extraction of fish oil by fractionation through supercritical carbon dioxide[J]. Journal of Chemical and Engineering Data, 2008, 53(9): 2128-2132.
[10]唐峰, 许学勤, 李珏. 水酶法提取鲢鱼内脏油脂的工艺研究[J]. 食品科技, 2007, 23(11): 216-218.
[11]ROSENTHAL A, PYLE D L, NIRANJAN K. Aqueous and enzymatic processed for edible oil extraction[J]. Enzyme and Microbial Technology, 1996, 19(1): 402-420.
[12]张寒俊, 刘大川, 杨国燕. 紫外光谱法定量测定不同种蛋白酶活力的研究[J]. 粮食与饲料工业, 2004(9): 44-45.
[13]王镜岩, 朱圣庚, 徐长法. 生物化学: 上册[M]. 3版. 北京: 高等教育出版社, 2002: 378-379.
[14]粟桂娇, 阎欲晓. 酶法制取罗非鱼动物蛋白水解液的研究[J]. 食品研究与开发, 2004, 25(4): 70-73.
[15]郝记明, 刘书成, 张静, 等. 利用罗非鱼下脚料提取鱼油的工艺研究[J]. 农产食品科技, 2008, 2(3): 14-16.
[16]林洪, 曹立民, 刘春娥, 等. 水产品资源有效利用[M]. 北京: 化学工业出版社, 2007: 59.
[17]SIMOPOULOS A P. Summary of the NATO advanced research workshop on dietaryω-3 andω-6 fatty acids: biological effects and nutritional essentiality[J]. Journal of Nutrition, 1989, 199(4): 521-528.
[18]张立坚, 杨会邦, 张俊杰, 等. 淡水鱼油中脂肪酸的气相色谱-质谱分析[J]. 质谱学报, 2009, 30(増刊1) : 181-182.
Aqueous Enzymatic Extraction of Fish Oil from Viscera of Channel Catfish (Ictalurus punctatus)
LU Jian-feng,LIN Lin,ZHANG Wei-wei,WENG Shi-bing,YE Ying-wang,JIANG Shao-tong
(College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Fish oil was extracted from the viscera of channel catfish (Ictalurus punctatus) by aqueous enzymatic extraction method. The optimum extraction parameters were as follows: initial hydrolysis pH 7.5, ratio of viscera to water 1:1, amount of papain 3500 U/g, hydrolysis temperature 55 ℃, hydrolysis time 0.5 h. Under these conditions, the extraction ratio of fish oil was up to 80.94%. The extracted fish oil (namely crude fish oil) was yellow-brown in appearance with fishy smell and light rancidity odor, and it had a lower peroxide value and high acid value. The relative content of the saturated fatty acids accounted for 19.42% of the total fatty acids. The relative content of monounsaturated fatty acids and polyunsaturated fatty acids were 61.76% and 16.83%, respectively. The ratio of n-3 to n-6 polyunsaturated fatty acids is 3.63. The above results show that the viscera of channel catfish are a good resource for fish oil production.
Ictalurus punctatus;viscera;fish oil;aqueous enzymatic extraction method
TQ460.6
A
1002-6630(2010)22-0075-06
2010-07-15
安徽省重大科技攻关专项(08010301078);国家星火计划项目(2008GA710021)
陆剑锋(1976—),男,副研究员,博士,主要从事水生动物资源的保护和综合利用研究。E-mail:lujf@sibs.ac.cn



