王卫东,杨万根,付湘晋*
(1.徐州工程学院食品学院,江苏 徐州 221008;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
白鲢鱼肌肉脂肪氧合酶的分离纯化与鉴定
王卫东1,2,杨万根1,2,付湘晋2,3,*
(1.徐州工程学院食品学院,江苏 徐州 221008;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.中南林业科技大学食品科学与工程学院,湖南 长沙 410004)
采用硫酸氨沉淀和羟基磷灰石柱层析法分离白鲢鱼肌肉脂肪氧合酶(lipoxygenase,LOX),同时采用反相高效液相(RP-HPLC)检测其反应产物,对鲢鱼肌肉LOX进行鉴定,并研究鲢鱼肌肉LOX的底物特异性。结果表明:白鲢鱼肌肉LOX催化花生四烯酸主要形成12-氢过氧化物,12-LOX是鲢鱼肌肉中主要的LOX;白鲢鱼LOX的最适底物是亚麻酸。
白鲢鱼;脂肪氧合酶;分离纯化;鉴定;反相高效液相
脂肪氧合酶(lipoxygenase,LOX,EC 1.13.11.12)催化不饱和脂肪酸的加氧反应,生成的氢过氧化物裂解生成挥发性的醛类和醇类,从而对食品的风味产生很大影响。LOX是大豆产生豆腥味以及禽肉在冻藏过程中产生酸败的重要催化剂[1]。不同的LOX催化不同的脂肪酸产生的风味完全不同,在鱼油中添加LOX可以产生鱼肉风味[2]。Josephson等[3]发现,当鱼肉中添加LOX抑制剂S n C l2后,鱼肉挥发性风味物质的总量降低。所以,LOX在形成鱼肉独特风味的过程中具有重要作用。
在鸡肉[1]、南美对虾[2]、鲑鱼(trout)[4]、猪肉[5-6]、灰鲻鱼(gray mullet)[7]和大西洋鲭鱼(Atlantic mackerel)[8]等肉类食品及水产品中都检测到LOX酶活力,但白鲢鱼中还未见到有关LOX的报道。本研究从鲢鱼肌肉中提取LOX,采用硫酸铵沉淀和羟基磷灰石柱层析法初步分离纯化LOX,并采用反相高效液相(RP-HPLC)对鲢鱼肌肉LOX的类型进行鉴定,为鲢鱼的资源利用和鲢鱼风味形成机制研究提供参考。
1 材料与方法
1.1 材料、试剂与仪器
鲜活鲢鱼 市购。
亚油酸、亚麻酸、花生四烯酸、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA) 美国Sigma公司;花生四烯酸过氧化物(HETE)标样 美国Caymen试剂公司;其他试剂均为分析纯。
Agilent1200高效液相色谱仪 美国安捷伦公司;
LC-B自动液相色谱电脑层析分离系统 上海康华生化仪器制造有限公司。
1.2 鲢鱼肌肉LOX的分离纯化
参照Gata等[5]的方法对鲢鱼肌肉中的LOX进行了分离纯化。手工采集新鲜鱼肉,添加4倍体积50mmol/L磷酸盐缓冲液(含1mmol/L二硫代苏糖醇、1mmol/L EDTA)匀浆(10000r/min,1min);再10000×g冷冻离心60min。上清液用研磨细的无水硫酸氨沉淀。沉淀用磷酸盐缓冲液(50mmol/L、pH7.4)溶解,用羟基磷灰石柱(hydroxyapatite,HA,1.5cm×30cm)除血色素蛋白(如血红蛋白、肌红蛋白)。HA柱用50mmol/L磷酸盐缓冲液(含5mmol/L还原型谷胱甘肽)平衡,流速为1.0mL/min。用0.3mol/L磷酸盐缓冲液(含5mmol/L还原型谷胱甘肽)洗脱,流速1.0mL/min。收集有LOX酶活力的组分,并用截留分子质量为3×104D的超滤膜过滤浓缩,浓缩液保存在4℃冰箱,并在两天内使用。所有操作温度控制在5℃以下。
1.3 白鲢鱼肌肉LOX酶活力测定
用紫外分光光度法测定LOX活力。以Tween-20 (最终体积分数0.1%)为乳化剂,将亚油酸(最终浓度10mmol/L)分散在10mmol/L硼酸缓冲液(pH9.0)中。250μL上述亚油酸底物和50μL LOX酶(蛋白质质量浓度2mg/mL)添加到1.7mL反应介质中(50mmol/L磷酸缓冲液,pH7.4),立刻计时,测定其在234nm波长处的吸光度的增加。以每分钟吸光度增加0.001定义为1个酶活力单位(U),比活力为每分钟每毫克蛋白的活力单位数[9]。
1.4 白鲢鱼肌肉LOX鉴定
按照Saeed等[8]的方法鉴定从白鲢鱼肌肉中分离纯化到的LOX的类型。以Tween-20(最终体积分数0.1%)为乳化剂,将花生四烯酸(最终浓度100μmol/L)分散在0.05mol/L磷酸盐缓冲液(pH7.4)中。把LOX (最终浓度42.6U/mL) 和还原型谷胱甘肽(最终浓度1mmol/L)加入到花生四烯酸乳化液中,25℃反应15min。反应产物用两倍体积乙酸乙酯萃取,有机相减压旋转蒸发浓缩(30℃),残余液体再用混合溶剂(醋酸-甲醇-水体积比为0.1:65:35)稀释后用于高效液相分析。高效液相色谱条件为:C18柱,234nm检测,流动相为醋酸-甲醇-水体积比为0.1:65:35,流速1mL/min。
1.5 白鲢鱼肌肉LOX底物特异性测定
采用与制备亚油酸分散液相同的方法制备亚麻酸、花生四烯酸、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)分散液;测定LOX催化亚油酸、亚麻酸、花生四烯酸、EPA、DHA氧化时的酶活力,以其中最高酶活力为100%,计算白鲢鱼LOX催化不同脂肪酸氧化时的相对酶活力,即为白鲢鱼LOX的底物特异性[2]。
2 结果与分析
2.1 白鲢鱼肌肉中LOX分布

表1 白鲢鱼组织中LOX酶活力分布(n=3)Table 1 LOX activities (U/g meat) in different tissues of silver carp (n=3)
由表1可知,红肉中LOX酶活力最高为(104.20± 2.01)U/g鱼肉,白肉中LOX酶活力最低,为(42.65±0.20)U/g鱼肉;而猪肉中LOX活力约为4.87~12.55U/g蛋白[6],所以白鲢鱼肉中LOX活力是较高的。
2.2 白鲢鱼肌肉中LOX分离纯化
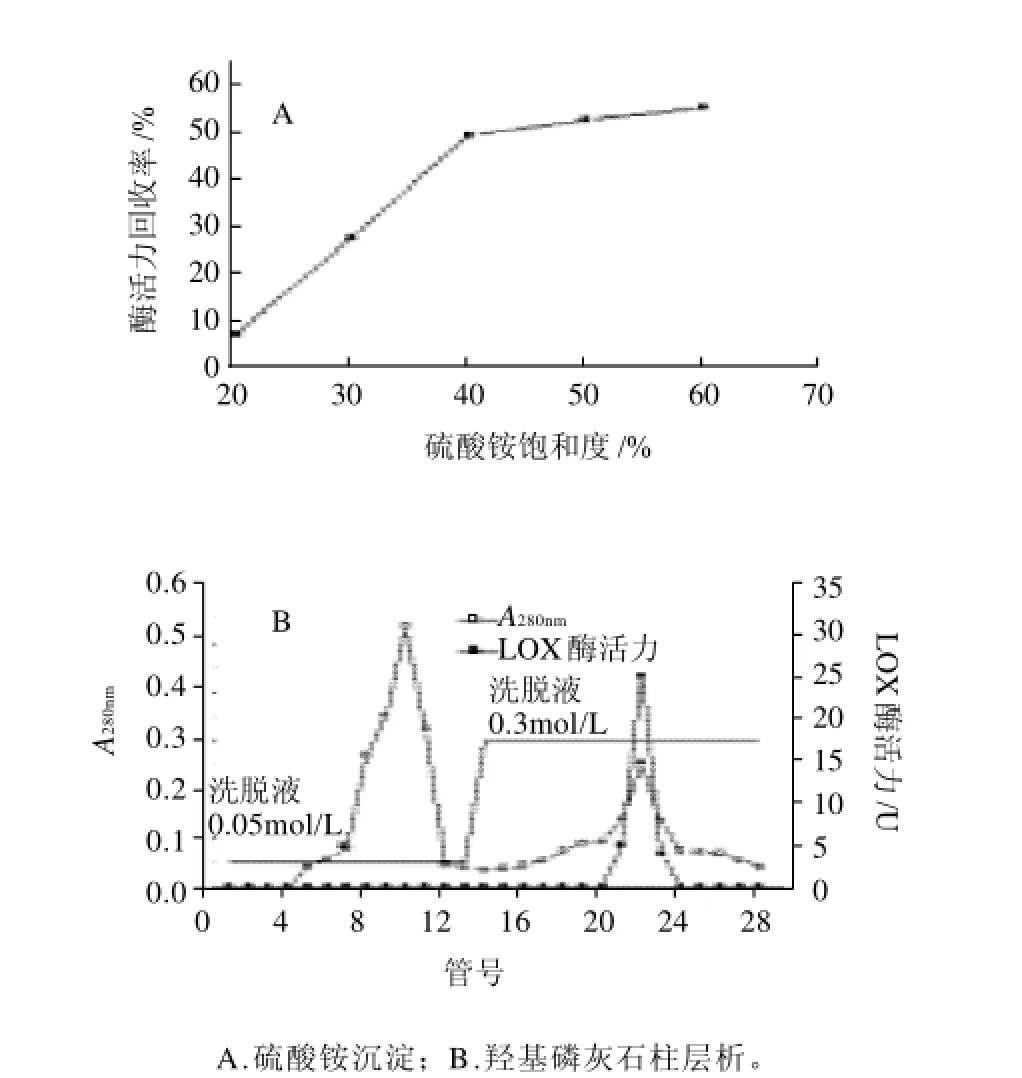
图1 鲢鱼肌肉脂肪氧合酶的分离纯化Fig.1 Ammonium sulfate precipitation and hydroxylapatite column chromatographic fractionation of LOX from silver carp muscle
在脂肪氧合酶性质研究中最主要的干扰蛋白是血红蛋白,可以采用羟基磷灰石柱分离LOX和血红蛋白[2,5]。从图1A可以看出,在硫酸铵饱和度高于40%后,酶活力回收率增加速度降低明显,所以收集硫酸铵饱和度40%的组分比较合适,酶活力回收率在50%左右。从图1B可以看出,LOX活力主要集中在0.3mol/L盐洗脱液中,这与前人的研究结果一致[2,5]。
2.3 白鲢鱼肌肉LOX的鉴定
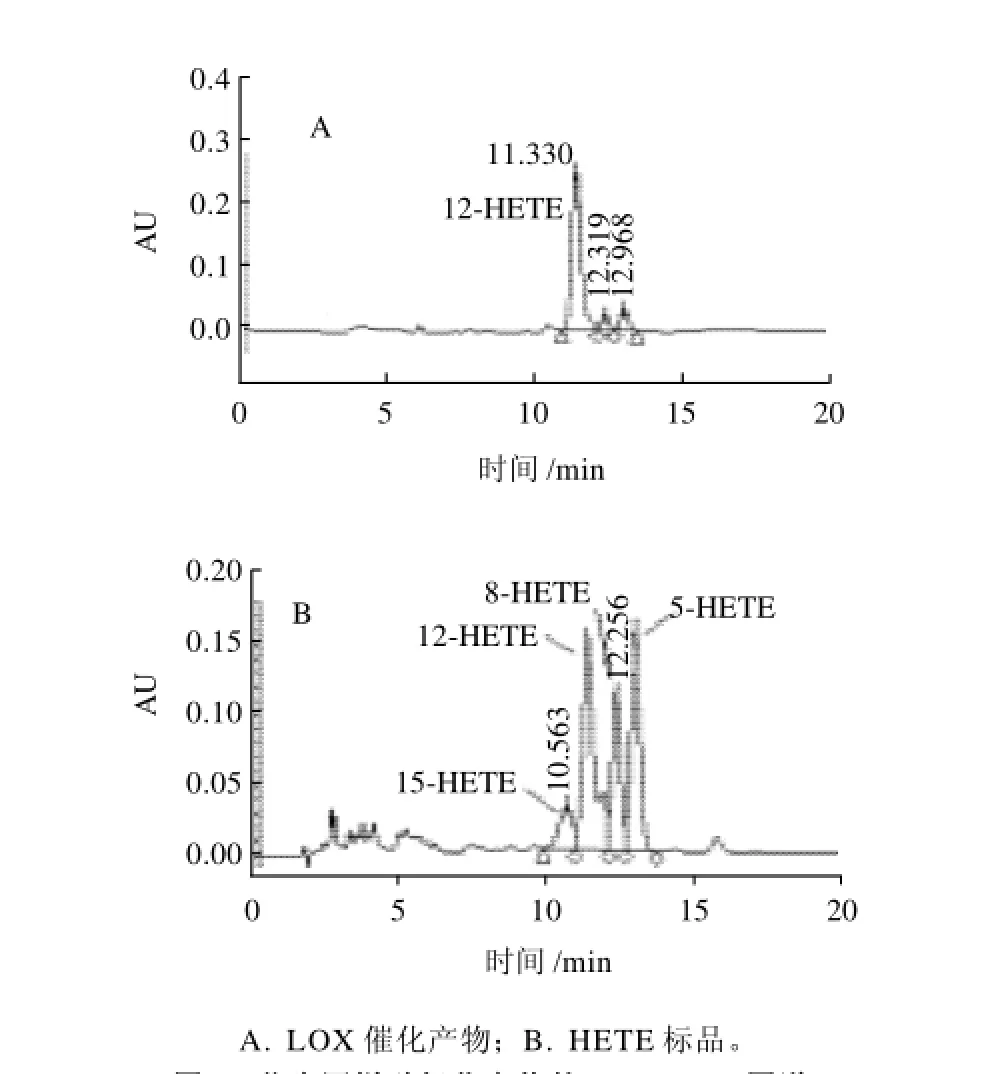
图2 花生四烯酸氧化产物的RP-HPLC图谱Fig.2 RP-HPLC chromatographic profiles of oxidation products of arachidonic acid under the catalysis of silver carp LOX and oxidized arachidonic acid standard
LOX特异催化含有cis,cis-1,4-戊二烯结构的多元不饱和脂肪酸的加氧反应,动物来源的LOX根据其催化花生四烯酸氧化时加氧位置进行分类,分成5-LOX、12-LOX、15-LOX等[10]。反相高效液相(RP-HPLC)是检测花生四烯酸氧化产物异构体的有效方法。经过羟基磷灰石柱层析纯化后的白鲢鱼肌肉LOX,催化花生四烯酸氧化的产物用RP-HPLC检测结果如图2所示。LOX催化花生四烯酸氧化产物的RP-HPLC图谱为一个大峰和两个小峰(图2A);根据HETE标准品的RP-HPLC图谱(图2B),白鲢鱼LOX催化花生四烯酸的氧化产物主要是12-HETE。另外,LOX图谱中的两个小峰分别是8-HETE和5-HETE。
花生四烯酸自动氧化产物在RP-HPLC图谱上有5个峰,分别是5-HETE、8-HETE、11-HETE、12-HETE、15-HETE[8]。与此不同,白鲢鱼肉中LOX催化花生四烯酸氧化产物主要是12-HETE(图2A),所以,白鲢鱼肉中的LOX主要是12-LOX。不同肉中LOX的类型不同,如鲑鱼(trout)[4]和大西洋鲭鱼[8]是12-LOX,而鸡肉中是15-LOX[1]。
2.4 白鲢鱼肌肉LOX底物特异性
由表2可知,白鲢鱼LOX的最适底物是亚麻酸。不同来源的LOX的底物特异性各不相同,如植物中的LOX的最适底物一般是亚油酸,哺乳动物的LOX的最适底物一般是花生四烯酸;但鱼类的LOX的最适底物变化较大,如鲑鱼(trout)的LOX的最适底物是DHA[4],而沙丁鱼的LOX的最适底物是亚麻酸[11]。

表2 白鲢鱼LOX底物特异性Table 2 Substrate specificity of silver carp LOX
3 结 论
通过实验证明,白鲢鱼肌肉中存在脂肪氧合酶(LOX)。羟基磷灰石柱层析法能有效分离白鲢鱼肌肉LOX,反相高效液相(RP-HPLC)检测其反应产物证明白鲢鱼肌肉中的LOX主要是12-LOX,白鲢鱼红肉中LOX的活力最高,白鲢鱼肌肉LOX最适底物是亚麻酸。LOX能催化脂肪氧化、产生特征风味和腥味,其对鲢鱼品质的影响需要进一步研究。
[1]GROSSMAN S, BERGMAN M, SKLAN D. Lipoxygenase in chicken muscle[J]. J Agric Food Chem, 1988, 36(6): 1268-1270.
[2]杨文鸽, 薛长湖, 何雄, 等. 南美白对虾血淋巴脂肪氧合酶的分离纯化及其生化特性研究[J]. 中国食品学报, 2006, 6(3): 31-37.
[3]JOSEPHSON D B, LINDSAY R C, STUIBER D A. Biogenesis of lipid-derived volatile aroma compounds in the emerald shiner (Notropis atherinoides)[J]. J Agric Food Chem, 1984, 32(6): 1347-1352.
[4]GERMAN J B, CREVELING R K. Indentification and characterization of a 15-lipoxygenase from fish gills[J]. J Agric Food Chem, 1990, 38 (12): 2144-2147.
[5]GATA J L, PINTO M C, MACIAS P. Lipoxygenase activity in pig muscle: purification and partial characterization[J]. J Agric Food Chem, 1996, 44(9): 2573-2577.
[6]郇延军, 周光宏, 徐幸莲, 等. 金华火腿生产过程中脂质氧化及脂肪氧合酶变化特点研究[J]. 食品科学, 2008, 29(3): 60-65.
[7]HSU H H, PAN B S. Effect of protector and hydroxypatite partial purification on stability of lipoxygenase from gray mullet gill[J]. J Agric Food Chem, 1996, 44(3): 741-745.
[8]SAEED S, HOWELL N K. 12-Lipoxygenase activity in the muscle tissue of Atlantic mackerel (Scomber scombrus) and its prevention by antioxidants[J]. J Sci Food Agric, 2001, 81(8): 745-750.
[9]YOSHIE-STARK Y, WASCHE A. Characteristics of crude lipoxygenase from commercially de-oiled lupin flakes for different types of lupins (Lupinus albus, Lupinus angustifolius)[J]. Food Chemistry, 2004, 88 (2): 287-292.
[10]BRUCE GERMAN J, CHEN S E, KINSELLA J E. Lipid oxidation in fish tissue. Enzymatic initiation via lipoxygenase[J]. J Agric Food Chem, 1985, 33(4): 680-683.
[11]MOHRI S, CHO S Y, ENDO Y, et al. Linoleate 13(S)-Lipoxygenase in sardine skin[J]. J Agric Food Chem, 1992, 40(4): 573-576.
Separation, Purification and Identification of Lipoxygenase from Silver Carp Muscle
WANG Wei-dong1,2,YANG Wan-gen1,2,FU Xiang-jin2,3,*
(1. College of Food Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China;2. State Key Labarotory of Food Science and Technology, Jiangnan University, Wuxi 214122, China ;3. School of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China)
The separation and purification of lipoxygenase (LOX) from silver carp muscle were achieved by using ammonium sulfate precipitation and subsequent hydroxylapatite column chromatographic fractionation. Besides, the oxidation products of arachidonic acid under the catalysis of this enzyme were analyzed by reversed-phase HPLC (RP-HPLC) with the aim of identification, and its substrate specificity was also explored. Arachidonic acid was mainly transformed into 12-hydroxyeicosatetraenoic acid (12-HETE) under the catalysis of the LOX enzyme, suggesting that the main type of LOX in silver carp muscle is 12-LOX. Furthermore, the optimal substrate for this enzyme was linolenic acid.
silver carp;lipoxygenase;purification;identification;RP-HPLC
TS251.5
A
1002-6630(2010)23-0157-03
2010-03-21
中南林业科技大学人才引进基金项目(104-0107)
王卫东(1975—),男,讲师,博士,研究方向为食品酶学。E-mail:yangtzfu@yahoo.com.cn
*通信作者:付湘晋(1980—),男,讲师,博士,研究方向为水产品加工。E-mail:yangtzfu@yahoo.com.cn



