回 晶,李其久,边媛媛,尤 田,庞 冲,吴 娜,胡风庆
(1.辽宁大学生命科学院,辽宁 沈阳 110036;2.辽宁省中医药研究院,辽宁 沈阳 110034)
桑黄总黄酮超声提取工艺及其生物活性研究
回 晶1,李其久1,边媛媛1,尤 田2,庞 冲1,吴 娜1,胡风庆1
(1.辽宁大学生命科学院,辽宁 沈阳 110036;2.辽宁省中医药研究院,辽宁 沈阳 110034)
目的:优化提取桑黄总黄酮的最佳工艺条件,测定其体外抗氧化活性和对癌细胞的生长抑制作用。方法:以样品中总黄酮的提取率为指标,采用L9(34)正交试验对桑黄的超声辅助提取工艺参数进行优化;通过测定桑黄黄酮对·OH、O2·的清除能力等指标,探讨其抗氧化活性;采用MTT法测定桑黄黄酮对大肠癌细胞CX-1增殖反应的影响,研究其体外抗肿瘤活性。结果:桑黄总黄酮的最佳提取工艺为乙醇体积分数55%、料液比1:20(g/ mL)、提取温度70℃、超声提取时间1.5h。桑黄黄酮可以有效清除·OH、O2·,对Fe2+诱发卵黄低密度脂蛋白(LDL)多不饱和脂肪酸(PUFA)过氧化反应具有抑制作用。桑黄黄酮提取物能够有效地抑制大肠癌细胞CX-1的生长。结论:该工艺提取桑黄总黄酮,方法简单、耗时短。桑黄黄酮抗氧化能力强,有抑制癌细胞的作用,是一种有效的天然抗氧化剂。
桑黄;总黄酮;正交试验;抗氧化;生长抑制
桑黄(Phellinus igniarius)是担子菌亚门(Basidiomycota)、层菌纲(Hymenomycetes)、非褶菌目(Aphyllophorales)、锈革孔菌科(Hymenochaetaceae)、针层孔菌属(Phellinus)的药用真菌[1]。现代研究表明桑黄具有抗肿瘤,增强免疫力、抗发炎、抗氧化、预防和治疗关节炎、保护肝脏、抗糖尿病、抗胃溃疡等多种药理活性[2-5]。其特有的抗肿瘤活性及低毒性使其成为研究热点[6-7],因此该菌是一种极具研究和开发价值的食药用真菌。本研究对桑黄黄酮的提取工艺及生物活性进行研究,以期为进一步开发利用桑黄提供一定参考。
1 材料与方法
1.1 材料与试剂
桑黄子实体购于东北食药用真菌研究所,由本院微生物系郭叔凡副教授鉴定,粉碎过筛备用。芦丁标准品(纯度99%,批号TCM027-080118) 南京替斯艾幺中药研究所;大肠癌细胞系CX-1 中国医科大学;DMEM高糖培养基 HyClone公司;四甲基偶氮唑盐(MTT) BBI公司;其余化学试剂均为国产分析纯。
1.2 仪器与设备
BS223S型电子天平 德国赛多利斯公司;KQ2200DB型数控超声波清洗器;RE52CS-2旋转蒸发仪 上海亚荣生化仪器厂;BB15 CO2培养箱 Heraeus公司;Multiskan MK3酶标仪 Thermo Labsystems公司;分光光度计。
1.3 方法
1.3.1 标准曲线绘制[8]
精密称取芦丁标准品20mg,置50mL容量瓶中,加70%乙醇稀释至刻度,摇匀,即得0.4mg/mL芦丁标准液备用。准确吸取标准芦丁溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7mL,置于试管中。加70%乙醇至5mL,再加入5mL显色液(硼酸0.4g、乙酸钠0.5g、用70%乙醇稀释至50mL),混匀,加相应试剂做空白,处理后置比色杯中,在波长385nm处测定其吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程y=19.796x+0.0153,R2=0.9967。
1.3.2 超声提取总黄酮工艺优化
根据黄酮提取工艺的文献报道[9-11],选择影响桑黄总黄酮提取的4个因素,即料液比、提取温度、提取时间和乙醇体积分数,每个因素取3个水平,超声频率固定为90Hz,以提取率作为评价指标对超声提取工艺进行正交试验优化(表1)。

表1 超声提取总黄酮正交试验因素水平Table 1 Factors and levels of orthogonal experiments for optimizing the extraction processing of total flavonoids from Phellinus igniarius
1.3.3 总黄酮的鉴别
盐酸-镁粉反应:取桑黄总黄酮提取液1mL于试管中,加入少量镁粉振摇,再滴入几滴浓盐酸,1min后溶液均显紫红色。
三氯化铝显色反应:取桑黄总黄酮提取液适量和1%三氯化铝乙醇溶液通过纸斑反应后,置于紫外灯下,均显鲜黄色荧光。
1.3.4 桑黄总黄酮含量的测定及提取率
取正交试验各桑黄提取液,抽滤,定容到100mL。精密吸取上述溶液0.2mL,按照1.3.1节方法测其吸光度,按照回归方程计算提取液中的总黄酮含量。

1.3.5 桑黄总黄酮的体外抗氧化活性研究
按正交试验最优提取工艺提取桑黄总黄酮,进行体外抗氧化实验和肿瘤细胞增殖抑制实验。
1.3.5.1 对羟自由基清除率的测定[12]
利用H2O2对Fe2+混合产生·OH,在体系内加入水杨酸捕捉·OH并产生有色物质,该物质在波长510nm处有最大吸收。反应体系中含有2mL 9mmol/L FeSO4、2mL 9mmol/L水杨酸-乙醇、不同浓度的桑黄黄酮溶液2mL,最后加2mL 8.8mmol/L H2O2启动反应,37℃反应0.5h,以蒸馏水为参比,在波长510nm处测量各浓度的吸光度。考虑到本身的吸光度,以2mL 9mmol/L FeSO4、2mL 9mmol/L水杨酸-乙醇、不同浓度的桑黄黄酮溶液2mL为黄酮的本底吸收。
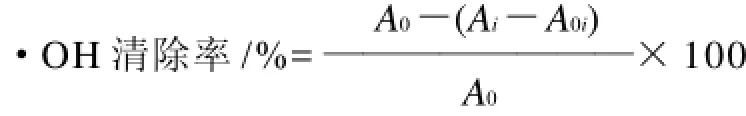
式中:A0为对照(以蒸馏水代替黄酮样品)的吸光度;Ai为加不同浓度黄酮样品时的吸光度;A0i为无H2O2时黄酮样品的吸光度。
1.3.5.2 对超氧阴离子自由基清除率的测定[12]
采用邻苯三酚自氧化法,取4.5mL pH8.2 50mmol/L Tris-HCl缓冲溶液,混匀后在25℃水浴中保温20min,先加入不同浓度的黄酮溶液,用蒸馏水补足到8.7mL,取出后立即加入在25℃预热过的0.3mL 3mmol/L邻苯三酚(以10mmol/L HCl配制,空白管用10mmol/L HCl代替邻苯三酚的HCl溶液),迅速摇匀后倒入比色杯,325nm波长处每隔30s测定吸光度,计算线形范围内每分钟吸光度的增加。然后按下述方法计算清除率。
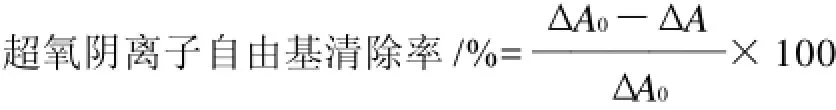
式中:ΔA0为邻苯三酚的自氧化法速率差;ΔA为加入黄酮溶液后邻苯三酚自氧化法速率差。
1.3.5.3 对Fe2+诱发卵黄低密度脂蛋白(LDL)多不饱和脂肪酸(PUFA)过氧化反应的抑制作用[13]
取7支具塞刻度试管,分别加入0.2mL 1:25稀释的卵黄悬浊液(卵黄用等体积pH7.4的磷酸缓冲液配成,用前进行磁力搅拌10min),再分别加入1mL不同浓度的桑黄黄酮样液、0.2mL 25mmol/L FeSO4·7H2O溶液,用磷酸缓冲液补足2mL,置37℃恒温水浴中振荡30min,取出后加入0.5mL质量分数20%三氯乙酸溶液和1mL质量分数0.85%硫代巴比妥酸(TBA),混匀,置100℃水浴保温20min,冷却后于3500r/min离心15min,取3mL上清液测定532nm处的吸光度。用VC标准液作对照。
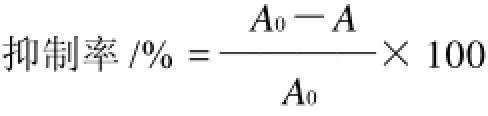
式中:A0为对照品(以蒸馏水代替黄酮样品)的吸光度;A为加不同浓度黄酮样品时的吸光度。
1.3.6 桑黄总黄酮对大肠癌细胞生长的抑制作用
将CX-1肿瘤细胞以2×105个/mL接种于96孔板中,每孔100μL。实验组分别加入100μL质量浓度10、5、2.5、1.25、0.625μg/mL桑黄黄酮溶液,以5μg/mL 5-氟尿嘧啶(5-Fu)作为阳性对照,以质量浓度5μg/ mLBSA作为阴性对照,空白对照组用培养基代替受试药物,每组设6个平行孔,于5% CO2、37℃细胞培养箱中培养24h,换液,继续培养48h后,弃上清液,每孔加入50μL 5mg/mLMTT溶液,于5% CO2、37℃细胞培养箱中继续培养4h,终止培养后离心96孔板,去上清液,每孔加150μL DMSO溶解10min,酶联免疫检测仪振荡,于波长570nm测定OD值。并计算细胞抑制率。
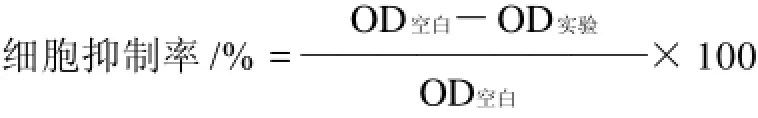
2 结果与分析
2.1 桑黄总黄酮提取工艺优化
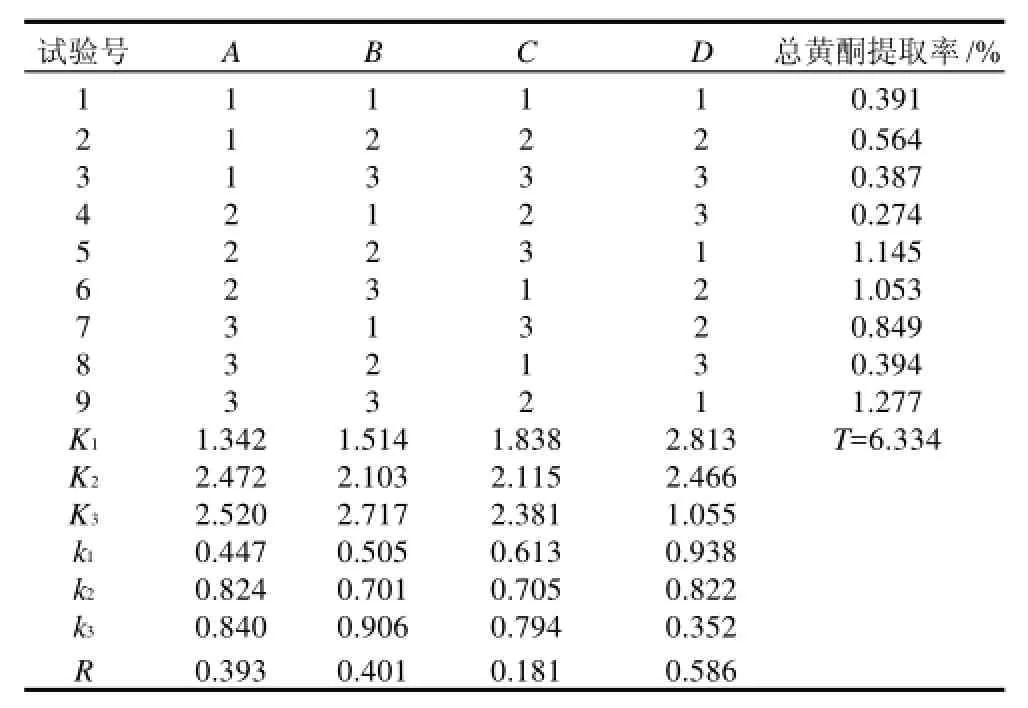
表2 正交试验设计及结果Table 2 Design and results of orthogonal experiments for optimizing the extraction processing of total flavonoids from Phellinus igniarius
由表2极差值可以看出,各因素对桑黄总黄酮的提取影响程度为D>B>A>C,即乙醇提取溶剂的体积分数是影响桑黄总黄酮提取的主要因素,其次是温度,再次是料液比,对黄酮提取含量影响最小的是提取时间。
结果表明,桑黄总黄酮提取的最佳条件组合为A3B3C3D1,即料液比1:20(g/mL)、提取温度70℃、提取时间1.5h、乙醇体积分数55%。
2.2 验证实验
最优的提取工艺为A3B3C3D1,并未在正交试验中进行,需进行验证实验。按1.3.4节方法测得总黄酮提取率为1.614%,结果与正交试验结论一致。
2.3 桑黄总黄酮的体外抗氧化研究
2.3.1 桑黄总黄酮清除羟自由基能力测定
表3 桑黄总黄酮清除羟自由基能力测定(±s, n=3)Table 3 Scavenging capability of total flavonoids from Phellinusigniarius on hydroxyl free radicals (±s, n=3)
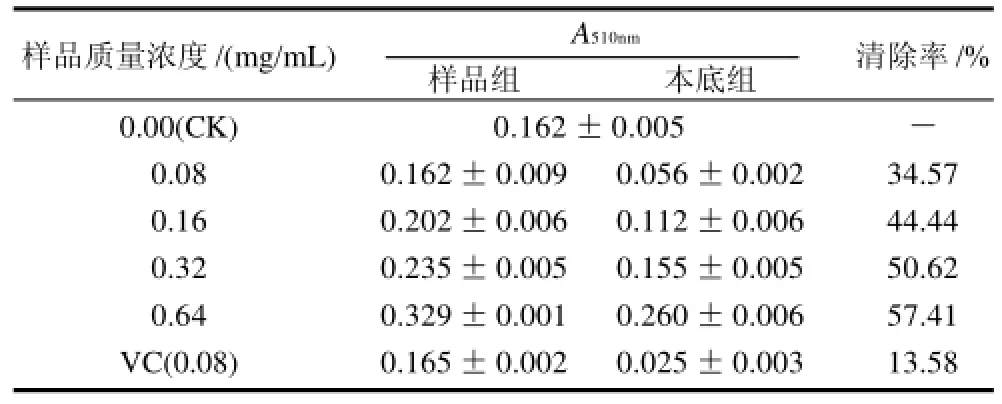
表3 桑黄总黄酮清除羟自由基能力测定(±s, n=3)Table 3 Scavenging capability of total flavonoids from Phellinusigniarius on hydroxyl free radicals (±s, n=3)
样品质量浓度/(mg/mL) A510nm清除率/%样品组本底组0.00(CK) 0.162±0.005-0.080.162±0.0090.056±0.00234.57 0.160.202±0.0060.112±0.00644.44 0.320.235±0.0050.155±0.00550.62 0.640.329±0.0010.260±0.00657.41 VC(0.08)0.165±0.0020.025±0.00313.58
采用水杨酸法,固定反应时间测定桑黄黄酮样品对·OH的清除作用。结果见表3,在实验测定的质量浓度范围内,桑黄黄酮对羟自由基的清除能力随黄酮质量浓度的增大而增大。在质量浓度0.64mg/mL时,对羟自由基的清除率达到57.41%以上,清除效果较好。
2.3.2 桑黄总黄酮清除超氧阴离子自由基能力的测定
表4 桑黄总黄酮清除超氧阴离子自由基能力的测定 (±s, n=3)Table 4 Scavenging capability of total flavonoids from Phellinus igniarius on superoxide anion free radicals (±s,n=3)
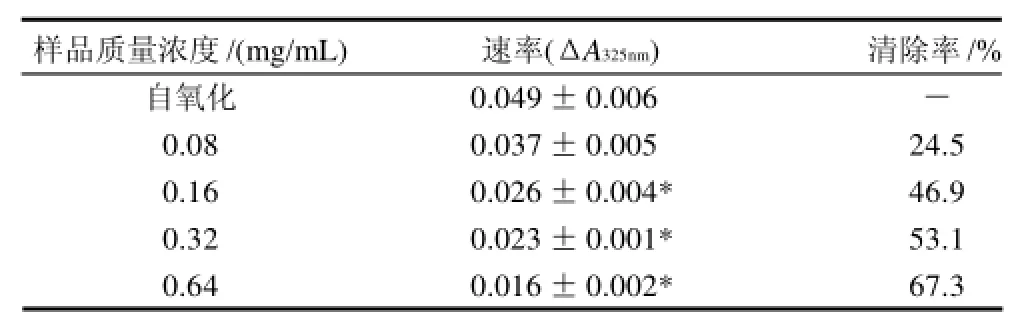
表4 桑黄总黄酮清除超氧阴离子自由基能力的测定 (±s, n=3)Table 4 Scavenging capability of total flavonoids from Phellinus igniarius on superoxide anion free radicals (±s,n=3)
注:*.P<0.05,与对照组相比差异显着。
?
从表4可以看出,在实验测定的质量浓度范围内,桑黄黄酮对超氧阴离子自由基的清除能力随质量浓度的增加呈增大的趋势,在质量浓度0.64mg/mL时,对超氧阴离子自由基的清除能力已达到67.3%以上。除0.08mg/ mL样品组与对照组相比无差异外,其他组与对照组相比差异显着。桑黄黄酮提取物具有很好的清除超氧阴离子自由基能力。
2.3.3 对Fe2+诱发卵黄低密度脂蛋白多不饱和脂肪酸(PUFA)过氧化反应的抑制作用
由表5可以看出,桑黄黄酮提取物和VC对Fe2+诱发卵黄低密度脂蛋白多不饱和脂肪酸(PUFA)过氧化具有明显的抑制作用,抑制作用随样品质量浓度的升高而增强。其中桑黄黄酮提取物0.04、0.08mg/mL组与空白组相比差异显着,0.016、0.32、0.64mg/mL组与空白组相比差异极显着。但同浓度条件下桑黄黄酮提取物实验组与VC相比无显着性差异。
表5 桑黄总黄酮提取物对PUFA过氧化反应的抑制结果(±s, n=3)Table 5 Inhibitory effect of total flavonoids from Phellinus igniarius on peroxidation reaction of PUFA in yolk induced by Fe2+±s, n=3)
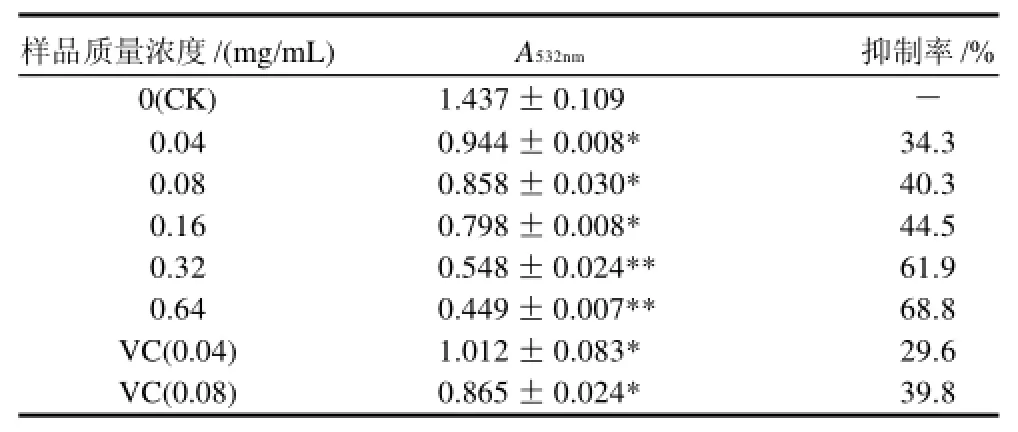
表5 桑黄总黄酮提取物对PUFA过氧化反应的抑制结果(±s, n=3)Table 5 Inhibitory effect of total flavonoids from Phellinus igniarius on peroxidation reaction of PUFA in yolk induced by Fe2+±s, n=3)
注:*.P<0.05,与对照组相比差异显着;**.P<0.01,与对照组相比差异极显着。
?
2.4 桑黄总黄酮对大肠癌细胞CX-1的增殖抑制作用
表6 桑黄总黄酮对大肠癌CX-1的增殖抑制作用(±s, n=4)Table 6 Inhibitory effect of total flavonoids from Phellinus igniarius on the growth of human colorectal cancer CX-1 cells (±s, n=4)
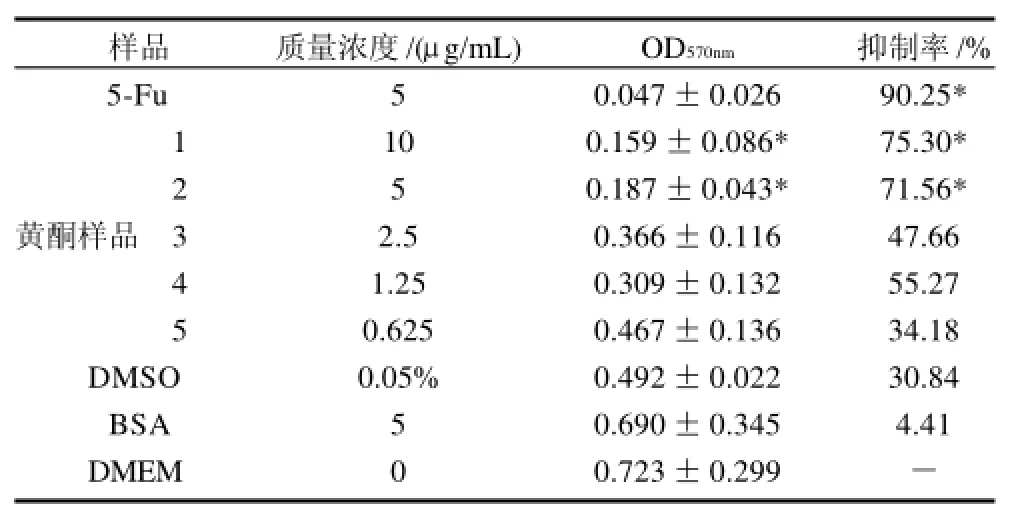
表6 桑黄总黄酮对大肠癌CX-1的增殖抑制作用(±s, n=4)Table 6 Inhibitory effect of total flavonoids from Phellinus igniarius on the growth of human colorectal cancer CX-1 cells (±s, n=4)
注:*.P<0.05,与对照组相比差异显着。
?
由表6可知,空白对照组细胞体外生长良好,5种质量浓度的桑黄黄酮溶液对大肠癌细胞都表现出抑制作用,随着桑黄黄酮提取物质量浓度的升高,其抑制细胞生长的能力越强,剂量效应关系明显。通过方差分析可知,样品1、样品2与空白对照组相比,差异显着;DMSO、BSA与空白对照组相比,无差异;样品3与样品4相比较,无差异。
3 结 论
超声波辅助提取桑黄黄酮方法简单,时间短,最佳提取工艺条件:料液比1:20(g/mL),提取温度70℃、提取时间1.5h、乙醇体积分数55%。
桑黄黄酮对碱性邻苯三酚自氧化产生的超氧阴离子自由基、Fenton反应产生的羟自由基和Fe2+诱发卵黄低密度脂蛋白(LDL)多不饱和脂肪酸(PUFA)过氧化产生的烷氧基(LO·)和烷过氧基(LOO·)均有明显的抑制作用,且均呈现一定的量效关系。其清除自由基的原理是该化合物具有酚羟基,能与自由基反应,形成共振稳定的半醌式自由基而中断链式反应。共振半醌式自由基的稳定性越大,黄酮类化合物的抗氧化活性越强。桑黄总黄酮抗脂质过氧化的机理可能与Gulcin等[14]的报道相一致。其抗脂质过氧化机理主要分为两部分,其一是通过供氢与氧化过程中产生的氧自由基(ROS)结合,终止脂质过氧化的链式反应,达到抑制氧化的作用。其二是与Fe2+螯合。金属离子Fe2+、Cu2+等是脂质过氧化的重要促进剂,其主要作用是促进过氧化脂(ROOH)和脂分子(RH)的分解和氧分子活化产生自由基,从而可以进入脂质氧化链式反应,促进反应发生。
桑黄黄酮提取物对人大肠癌细胞CX-1有明显的生长抑制作用,且呈一定量效关系。
通过生物体外实验表明,桑黄总黄酮具有体外抗氧化活性及癌细胞生长抑制作用,为其在生物体内实验奠定了实验基础,为其作为抗氧化药物、保健品提供了参考。下一步的研究工作将对提取物中的黄酮作进一步的分离、纯化和鉴定,探讨各黄酮组分在抗氧化活性和对癌细胞生长抑制中所起的作用及其机制,为进一步揭示桑黄黄酮提取物抗氧化活性和抗癌机理提供理论依据。
[1]张小青, 戴玉成. 中国真菌志[M]. 北京: 科学出版社, 2005: 117-191.
[2]SASAKI T, FUJII K, SUGURA M, et al. Antitumor polysaccharides from some polyporaceae, Ganderma. Applanatum (Pers.) Pat and Phellinus linteus (Berk.&Curt) Teng[J]. Chem Pharm Bull, 1971, 19: 821.
[3]AJITH T A, JANARDHANAN K K. Cytotoxic and antitumor activities of a polypore macrofungus, Phellinus rimosus (Berk) Pilat[J]. Ethnopharmacol, 2003, 84(2): 157-162.
[4]张万国, 胡晋红, 蔡溱, 等. 桑黄抗大鼠肝纤维化作用实验研究[J].中医药学刊, 2001, 19(5): 518-519.
[5]SHON M Y, KIM T H, SUNG N J. Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenochaetaceae) extracts[J]. Food Chemistry, 2003, 82: 593-597.
[6]RAYNUD C M, SABATIER L, PHILIPOT O, et al. Telomere length, telomeric proteins and genomic instability during the multistep carcinogenic process[J]. Crit Rev Oncol Hematol, 2008, 66(2): 99-117.
[7]CAIRNEY C J, KEITH W N. Telomerase redefined: integrated regulation of hTR and hTERT for telomere maintenance and telomerase activity [J]. Biochimie, 2008, 90(1): 13-23.
[8]刘艳芳, 杨焱, 贾薇, 等. 药用真菌桑黄总黄酮测定方法研究[J]. 食用菌学报, 2006, 13(2): 45-48.
[9]舒馨, 刘雄民, 王巧. 八角和八角残渣总黄酮提取工艺优化[J]. 食品科学, 2010, 31(6): 65-69.
[10]刘亚敏, 刘玉民, 马明, 等. 枫香树叶总黄酮提取工艺优化及含量动态变化[J]. 食品科学, 2010, 31(4): 35-38.
[11]夏国华, 戈延茹, 傅海珍, 等. 超声法提取桑黄总黄酮的工艺研究[J].江苏大学学报: 医学版, 2010, 20(1): 40-41.
[12]莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学, 2006, 27(9): 110-115.
[13]张海生, 陈锦屏. 蜂蛹黄酮的提取及体外抗氧化作用的研究[J]. 食品科学, 2008, 29(2): 158-162.
[14]GULCIN I, BEYDEMIR S, ALICI H A, et al. In vitro antioxidant properties of morphine[J]. Pharmacological Research, 2004, 49: 59-66.
Ultrasound-assisted Extraction and Biological Activity of Total Flavonoids from Phellinus igniarius
HUI Jing1,LI Qi-jiu1,BIAN Yuan-yuan1,YOU Tian2,PANG Chong1,WU Na1,HU Feng-qing1
(1. Faculty of Life Sciences, Liaoning University, Shenyang 110036, China;2. Liaoning Province Academic of Traditional Chinese Medicine, Shenyang 110034, China)
Objective: To optimize the extraction conditions of total flavonoids from Phellinus igniarius and determine its antioxidant activity and inhibition effect on the growth cancer cells. Methods: The ultrasound-assisted extraction processing parameters for total flavonoids from Phellinus igniarius were optimized by orthogonal experiments through evaluating the extraction rate of total flavonoids. The antioxidant activity of total flavonoids was explored by evaluating the scavenging capability on hydroxyl and superoxide anion free radicals. The anti-tumor activity of total flavonoids was evaluated by MTT assays through determining the inhibition effect on the proliferation of human colorectal cancer CX-1 cells in vitro. Results: The optimal extraction processing parameters were ethanol concentration of 55%, extraction temperature of 70 ℃, material-liquid ratio of 1:20 (g/mL) and extraction time of 1.5 h. The total flavonoids from Phellinus igniarius exhibited strong scavenging capability on hydroxyl and superoxide anion free radicals. Meanwhile, the total flavonoids could effectively inhibit the peroxidation of polyunsaturated fatty acids. Moreover, the total flavonoids had strong inhibitory effect on the growth of human colorectal cancer CX-1 cells. Conclusion: This extraction processing for total flavonoids is sample and convenient. The total flavonoids from Phellinus igniarius have strong antioxidant activity and strong inhibitory effect on the growth of cancer cells. Therefore, The total flavonoids from Phellinus igniarius have a promising potential as the effective natural antioxidant and anticancer components.
Phellinus igniarius;total flavonoids;orthogonal experiment;antioxidation;growth inhibition
O623.54
A
1002-6630(2010)24-0195-04
2010-09-26
辽宁省教育厅科学基金项目(L2010150);沈阳发改委高技术研发基金项目(2010-16);辽宁大学青年科研基金项目(2008LDQN25)
回晶(1977—),女,讲师,博士,研究方向为功能性食品。E-mail:huijing@lnu.edu.cn



