宋家乐
(釜山国立大学食品科学和营养学科,韩国 釜山 609735)
大叶紫薇叶水提物对氧化损伤下胰腺细胞的保护作用
宋家乐
(釜山国立大学食品科学和营养学科,韩国 釜山 609735)
探讨大叶紫薇叶水提物对氧化损伤下HIT-T15细胞的保护作用及其对胰岛素分泌量的影响。通过检测细胞内Akt蛋白质表达量并结合ELISA法检测大叶紫薇叶水提物对HIT-T15细胞胰岛素分泌量的影响。同时,结合细胞内线粒体膜电位改变程度和抗凋亡蛋白质Bcl-2表达量以研究其分子层面的抗凋亡机制。结果提示,大叶紫薇叶水提物可抑制氧化损伤下HIT-T15细胞的凋亡,并可改善受损细胞自身的胰岛素分泌能力。
大叶紫薇;氧化损伤;抗凋亡;胰岛素分泌
大叶紫薇(Lagerstroemia specious L.)又名巴拿巴(banaba),属千屈菜科蔷薇属落叶乔木。该植物的花、茎、果、叶皆具有传统中药的保健功效[1]。研究表明,巴拿巴水提物可显着降低糖尿病小鼠血糖及改善小鼠体内胰岛素水平[2],促进脂肪细胞的葡萄糖利用,抑制脂肪细胞分化[3],减轻糖尿病小鼠体质量[4]。近年来,巴拿巴独特的抗糖尿病功效日益引起各国科学家的关注,其主要抗糖尿病活性成分为单宁酸、科罗索酸、熊果酸及三萜类化合物等[5-8],但其抗糖尿病机理还不甚清楚。近年研究表明,氧化应激损伤是糖尿病的病因之一,氧化应激损伤可导致胰腺β细胞凋亡并影响其正常的胰岛素分泌功能,进而影响机体的代谢[9-10]。HIT-T15叙利亚仓鼠胰腺β细胞为常用的研究胰岛素分泌机制的细胞模型[11]。 3-morpholinosydnonimine(SIN-1)又名3-玛琳-斯得酮亚胺,为一类含亚胺的过氧化硝基化合物,可在体内代谢生成NO和O2·。而后两者又可生成ONOO-这一毒性自由基。为研究体内胰腺细胞氧化应激损伤机制,本实验以SIN-1诱发叙利亚仓鼠胰腺细胞氧化应激损伤造模,通过观察大叶紫薇叶水提物(BWE)对氧化损伤下HIT-T15细胞的保护作用,并通过测定其对胰岛素分泌量的影响,对其分子层面上抗糖尿病的机理进行研究。
1 材料与方法
1.1 材料与试剂
大叶紫薇叶购自于韩国大邱广域市韩药市场。
HIT-T15叙利亚仓鼠胰腺β细胞购自美国ATCC。
RPMI 1640细胞培养液、青-链霉素双抗、0.05% Trypsin-EDTA、胎牛血清 美国Invitrogen公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、SIN-1、RIPA缓冲液、JC-1荧光染料 美国Sigma公司。本实验中所有抗体均购自美国CELL Signal公司,其他试剂均为分析纯。
1.2 仪器与设备
R-114旋转蒸发仪 瑞士Buchi公司;MCO96二氧化碳细胞培养箱 日本三洋电机株式会社;VS-15CFN冷冻离心机 韩国Vision科学株式会社;PM-10AK倒置显微镜、BX 51 荧光显微镜 日本奥林巴斯光学株式会社;BIO-RAD 680酶标仪、BIO-RAD MicroRoTofor电泳仪 美国Bio-Rad公司;CYTOMICS FC500流式细胞仪 美国Beckman Coulter公司。
1.3 方法
1.3.1 大叶紫薇叶水提物制备
取160g大叶紫薇叶加入1L蒸馏水,沸腾提取2h。0.45μm针式滤器滤过,经旋转蒸发制得大叶紫薇叶水提物。将该水提物溶于磷酸缓冲液(PBS)制备成质量浓度为50mg/mL的储备液,-4℃保存备用。
1.3.2 叙利亚仓鼠胰腺β细胞培养及氧化损伤造模
HIT-T15细胞接种于含10%胎牛血清和1%双抗(青-链霉素)的RPMI 1640细胞培养液中,每3d更换培养基一次,待用。取适量生长期细胞,按5 × 103个/mL,每孔100μL接种于96孔细胞培养板,37℃、5% CO2湿化培养24h。待细胞完全贴壁后,用浓度为50μmol/L的SIN-1处理细胞24h,即制备得氧化损伤细胞模型。
1.3.3 MTT法测定细胞生存率
HIT-T15细胞按5 × 103个/mL,每孔100μL接种于96孔细胞培养板,37℃、5% CO2湿化培养24h。细胞完全贴壁后,设立空白组和样品组进行实验。连续培养48h后,吸出孔内培养基并加入150μL MTT溶液(终质量浓度 0.5mg/mL)继续培养4h。待培养结束后吸弃上清液,每孔加入150μL DMSO-乙醇(体积比1:1)混合液,避光振荡30min,用多孔酶标仪于540nm波长处测定O D值,计算细胞生存率。
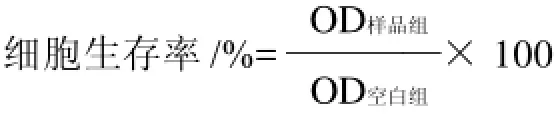
1.3.4 胰岛素分泌量测定
HIT-T15细胞按5 × 103个/mL 接种于96孔板内。细胞贴壁后,设空白组和样品组,连续培养48h后,取10μL上清液按照试剂盒说明书操作,于450nm波长处测定OD值并计算胰岛素分泌量。
1.3.5 线粒体膜电位测定
适量细胞按5×105个/mL接种于6孔细胞培养板中。待完全贴壁后,设立空白组、样品组,加入JC-1(5μg/mL)荧光染料,37℃孵育20min。PBS冲洗两次后,置于Beckman CYTOMICS FC500流式细胞仪并结合Beckman Coulter CXP2.0分析软件测定细胞线粒体膜电位,
1.3.6 West-Blotting测定
取适量细胞,用冷PBS缓冲液冲洗两次后,置于冰上,用RIPA细胞裂解缓冲液抽取细胞总蛋白质。经Bio-Rad蛋白定量试剂盒定量后,取30μg细胞总蛋白,10% SDS-PAGE分离胶分离,湿法电转蛋白至硝酸纤维膜上,5%脱脂奶粉封闭,一抗4℃振荡过夜,T-PBS洗膜,二抗室温孵育1h。T-PBS洗膜后,ECL增强型化学发光法曝光并拍照分析。
2 结果与分析
2.1 BWE对HIT-T15细胞的毒性作用。
MTT法检测经不同质量浓度BWE处理24、48h后HIT-T15细胞生存率。如图1所示,BWE对HIT-T15细胞无明显的细胞毒性作用。
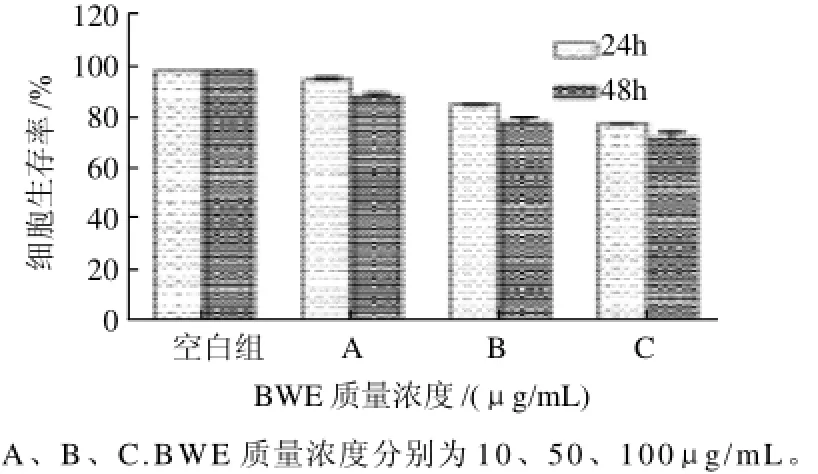
图1 大叶紫薇叶水提物对HIT-T15细胞的细胞毒性作用Fig.1 Effect of BWE on cell viability of HIT-T15 cells
2.2 BWE对HIT-T15细胞氧化损伤保护的影响
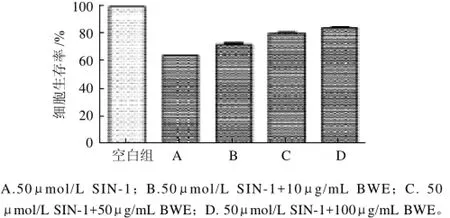
图2 BWE对HIT-T15细胞氧化损伤保护的影响Fig.2 Effect of BWE on cell viability of oxidation-damaged HIT-T15 cells
MTT法检测不同浓度大叶紫薇叶水提物对氧化损伤(经50μmol/L SIN-1处理)下HIT-T15细胞模型的保护作用,结果如图2所示。大叶紫薇叶水提物可有效保护氧化损伤下HIT-T15细胞,提高其生存率。且作用效果随提取物质量浓度的增加而增强。50μg/mL的BWE即可有效改善氧化损伤下HIT-T15细胞的生存率(本实验中,经样品处理后氧化损伤组细胞生存率大于80%视为对氧化损伤有改善作用)。
2.3 BWE对HIT-T15细胞胰岛素分泌能力的影响
以50μg/mL的BWE处理HIT-T15细胞48h后,观察其对胰腺细胞胰岛素分泌能力的影响,结果如图3A示。BWE不仅可促进正常状态下HIT-T15细胞胰岛素的分泌,同时也可改善氧化应激损伤(50μmol/L SIN-1处理)所致胰腺细胞胰岛素分泌能力的降低。此外,在细胞分子调控层面上,BWE也可降低胰岛素分泌信号通路中负调节因子丝氨酸/苏氨酸激酶Akt蛋白的表达(图3 B),进而促进细胞胰岛素的分泌[12]。
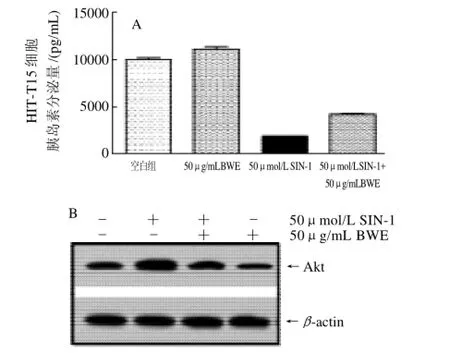
图3 BWE对HIT-T15细胞胰岛素分泌量和Akt蛋白表达的影响Fig.3 Effect of BWE on insulin secretion and Akt expression in HITT15 cells
2.4 BWE抑制氧化损伤而造成的胰腺细胞的凋亡
以 SIN-1 (50μmol/L)处理HIT-T15细胞后,50μg/mL BWE孵育48h,检测细胞线粒体膜电位改变程度和抗凋亡蛋白质Bcl-2表达。如图4A所示,BWE可缓解氧化损伤所致胰腺细胞凋亡时细胞线粒体膜电位的下降,维持线粒体膜的完整性,同时也可增强细胞内抗凋亡蛋白质Bcl-2的表达量(图4B)从而遏制细胞凋亡进程[13]。
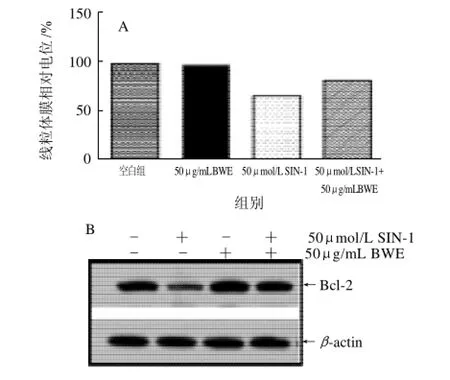
图4 BWE对HIT-T15细胞内线粒体膜电位改变和Bcl-2蛋白表达的影响Fig.4 Effect of BWE on MMP change and Bcl-2 protein expression in HIT-T15 cells
3 结 论
体外研究表明,大叶紫薇叶有很好的抗氧化活性[14-15]。近年来,随着对2型糖尿病的深入研究,自由基引发的氧化应激反应所导致的胰腺细胞凋亡被认为是糖尿病的主要病因之一。本实验结果提示:大叶紫薇叶水提取物可抑制自由基所致氧化损伤所引起的细胞凋亡,其可能的机制是上调细胞内抗凋亡蛋白质Bcl-2的表达量。而Bcl-2蛋白可通过维持细胞线粒体的跨膜电位(即维持细胞线粒体膜的完整性),进而抑制凋亡过程中线粒体途径的细胞色素C的释放过程,最终抑制细胞凋亡的发生[13]。另一方面,大叶紫薇叶水提物还可下调Akt蛋白的表达量,抑制其在胰岛素分泌信号通路中的负向调节作用,进而促进胰岛素的分泌。为大叶紫薇叶作为一种天然抗糖尿病药物提供了分子层面上的依据。
[1]纵伟, 夏文水. 大叶紫薇的化学成分和生理功能研究进展[J]. 食品与药品, 2006, 8(6): 21-23.
[2]KAKUD T, SAKANE I, TAKIHARA T, et al. Hypoglycemic effect of effects from Lagerstroemia speciosa L. leaves in genetically diabetic KK-AY mice[J]. Biosci Biotechnol Biochem, 1996, 60: 204-208.
[3]纵伟, 夏文水. 大叶紫薇总三萜对脂肪细胞葡萄糖和脂肪代谢的影响[J]. 食品科学, 2006, 27(7): 77-80.
[4]SUZUKI Y, UNNO T, USHITANI M, et al. Antiobesity activity of extracts from Lagerstroemia speciosa L. leaves of female KK-AY mice [J]. J Nutr Sci Vitaminol, 1999, 45: 791-795.
[5]纵伟, 夏文水, 崔宝良, 等. 大叶紫薇中降血糖活性成分的筛选[J].食品与生物技术学报, 2006, 25(3): 67-71.
[6]LIU Xueqing, KIM J K, LI Yunsheng, et al. Tannic acid stimulates glucose transport and inhibits adipocyte differentiation in 3T3-L1 cells [J]. J Nutr, 2005, 135(2): 165-171.
[7]LIU Fang, KIM J K, LI Yunsheng, et al. An extract of Lagerstroemia speciosa L. has insulin-like glucose uptake-stimulatory and adipocyte differentiation-inhibitory activities in 3T3-L1 cells[J]. J Nutr, 2001, 131 (9): 2242-2247.
[8]纵伟, 夏文水, 崔宝良. 薄层分离-分光光度法测定大叶紫薇叶中的总三萜含量[J]. 食品科学, 2005, 26(4): 222-225.
[9]YOSHITAKA K, HIDEAKI K. Role of oxidative stress in pancreatic β cell dysfunction[J]. Ann NY Acad Sci, 2004, 1011: 168-176.
[10]HIDEAKI K, TAKAAKI M, YOSHIHISA N, et al. Oxidative stress and the JNK pathway in diabetes[J]. Curr Diabetes Rev, 2005, 11: 65-72.
[11]刘铮, 只德贤, 王敏伟. 胰岛细胞系模型的研究进展[J]. 沈阳药科大学学报, 2007, 24(1): 61-64.
[12]CHEN Yawen, HUANG Chunfa, TSAI Kehsung, et al. The role of phosphoinositide 3-kinase/Akt signaling in low-dosemercury-induced mouse pancreatic beta-cell dysfunction in vitro and in vivo[J]. Diabetes. 2006, 55(6): 1614-1624.
[13]童彤, 詹启敏. 线粒体在细胞凋亡中的分子机制和作用[J]. 国外医学: 遗传学分册, 2004, 27(5): 263-267.
[14]吴清, 黄绢, 罗兰欣, 等. 15种中草药提取物抗氧化活性的研究[J].中国食品学报, 2006, 6(1): 284-289.
[15]陈林, 吴青, 韦薇, 等. 大叶紫薇叶提取物抗氧化性的研究[J]. 食品与发酵工业, 2006, 32(3): 47-50.
Protective Effect of Water Extract from Lagerstroemia specious L. Leaves on Oxidation-damaged HIT-T15 Pancreatic Cells
SONG Jia-le
(Department of Food Science and Nutrition, Pusan National University, Pusan 609735, South Korea)
In this study, the protective effect of water extract from Lagerstroemia specious L. (Banaba) (BWE) on insulin secretion in oxidation-damaged HIT-T15 pancreatic cells was explored. Insulin secretion was determined by ELISA assay, and the BWE-induced insulin secretion capability was evaluated by Western-blotting. The anti-apoptotic capability of BWE was analyzed by mitochondria membrane potential (MMP) change and Bcl-2 protein expression. Results indicated that BWE could enhance insulin secretion and inhibit oxidative stress-induced cell apoptosis in HIT-T15 pancreatic cells.
Lagerstroemia specious L.;oxidation-damaged;anti-apoptosis;insulin secretion
R931.71
A
1002-6630(2011)03-0238-03
2010-06-11
宋家乐(1983—),男,博士研究生,研究方向为分子营养学、植物化学。E-mail:bio.paul@hotmail.com



