李小芳,冯小强,杨 声,李阳春
(天水师范学院生命科学与化学学院,甘肃 天水 741001)
硫脲壳聚糖-Cu配合物的制备、表征及其抑菌活性
李小芳,冯小强,杨 声,李阳春
(天水师范学院生命科学与化学学院,甘肃 天水 741001)
利用IR、UV、TG-DTA和XRD手段,对合成的硫脲壳聚糖-Cu配合物进行表征,研究壳聚糖、硫脲壳聚糖及硫脲壳聚糖-Cu配合物对大肠杆菌、金黄色葡萄球菌的抑菌性能。结果表明:硫脲壳聚糖-Cu配合物的抑菌性能优于单一的壳聚糖和硫脲壳聚糖。
壳聚糖;硫脲壳聚糖-Cu配合物;抑菌性能
壳聚糖(CS)具有无毒、生物相溶、可降解、抑菌等特性,在医学、食品营养学、环境保护、轻工业等领域有着极为广泛的应用。与一般抑菌剂相比,它具有抑菌活性高、广谱、杀灭率高和无毒等优点[1-4]。对壳聚糖分子链上的氨基和羟基进行改性,来达到增强抑菌性能的目的。硫脲壳聚糖(TUCS),由于其分子链结构中含有大量带孤对电子的活性基团,可与多种金属离子配位形成金属配合物,在废水处理、负载金属催化剂等应用领域有诱人前景。金属离子也具有抗炎、杀菌、抗癌、抗凝血等药理作用和发光性质[5]。将这两种具有生物活性的物质通过共价键键联得到一种新型的目标化合物,期望该化合物能发挥两者的独特性能或协同效应。
本实验选择金属离子Cu2+与TUCS配位,采用FTIR、UV、DG-DTA和XRD分析手段,研究配合物的结构与性质,并对CS、TUCS及TUCS-Cu配合物对大肠杆菌、金黄色葡萄球菌的抑菌性能进行比较研究,旨在为CS及其衍生物的临床应用提供参考。
1 材料与方法
1.1 材料与试剂
壳聚糖(Mw为50kD,脱乙酰度90%,用体积分数1.0%HAc溶解) 浙江玉环壳聚糖有限公司;大肠杆菌(E.coli,ATCC 35218)、金黄色葡萄球菌(S.aureus,ATCC 26113)均由天水市中医医院化验科提供。
硫脲、氯化铜(分析纯) 天津化学试剂公司;乙酸、乙醇、丙酮等其他试剂均为分析纯。
1.2 仪器与设备
UV-9200型紫外可见分光光度计 北京瑞利分析仪器公司;Spectrum One 3.0傅里叶变换红外光谱仪、TGDTA分析仪(Pyris Diamond Analyzer) 美国Perkin Elmere公司。
1.3 方法
1.3.1 TUCS的制备
将3.3504g(0.1mol)的硫脲和3.0530g(0.2mol)CS及30mL的无水乙醇加入到三颈烧瓶中,温度控制在65℃,回流搅拌12h,产物冷却至室温,过滤、反复用乙醇洗涤,将过滤物溶解于100mL的体积分数1%乙酸溶液,加入10g/100mL氢氧化钠溶液进行过滤,收集沉淀,用水洗净、干燥,得到TUCS[6]。
1.3.2 TUCS-Cu配合物的制备
在装有0.5g TUCS的锥形瓶中加入40mL体积分数0.5%的乙酸溶液,在水浴振荡器中振荡1h,待TUCS充分溶解后,加入一定量的CuCl2溶液,用10%的HCl调节pH 4.5,控温反应4h后,加入200mL丙酮溶液析出产物,充分洗涤并过滤,再用无水乙醇充分洗涤、过滤,真空干燥,得到蓝绿色产物[7]。
1.3.3 TUCS-Cu配合物表征
采用KBr压片法,扫描波数范围为400~4000cm-1,测定CS、TUCS及TUCS-Cu的红外光谱;用体积分数1%乙酸溶解配制1mg/mL的硫脲、CS、TUCS和TUCS-Cu溶液, 于200~500nm波长范围内测定紫外吸收光谱;以α-Al2O3为参比,升温速率10℃/min,对CS、TUCS、TUCS-Cu进行热力学分析;采用XRD-6000 粉末衍射仪,X射线,Cu靶,扫描范围:0~40°(2θ),电压40kV,电流30mA。
1.3.4 TUCS-Cu配合物对E.coli和S.aureus抑菌活性
将受试菌种接种于固体琼脂培养基,37℃活化E.coli 24h,S.aureus 活化48h。将活化后的受试菌种用接种环挑取菌苔于生理盐水中,制成菌悬液备用。取直径6mm已灭菌的圆滤纸片浸泡在浓度均分别为10、5、2.5mg/mL的TUCS-Cu、TUCS和CS溶液中。取0.1mL菌悬液涂布在培养基平板上,然后用无菌镊子夹取浸泡过的圆滤纸片贴于培养皿中,每皿贴5片。以1.0%的HAc溶液作为空白对照。37℃恒温培养24~48h,测定抑菌圈直径。
2 结果与分析
2.1 TUCS-Cu配合物表征
2.1.1 红外光谱
CS、TUCS和TUCS-Cu的红外光谱如图1所示。CS中位于3446cm-1左右的N-H,O-H缔合峰形,改性后发生位移且峰形变窄;CS原位于1664cm-1处较强的酰胺吸收峰和1599cm-1左右的-NH2面内弯曲振动吸收峰[8],在TUCS中分别位移至1638cm-1和1616cm-1处,峰形变窄;且TUCS在1493cm-1处出现弱的新峰,表明在CS结构中的-NH2引入硫脲基团[9]。与TUCS相比,TUCS-Cu的红外光谱在848、916、950、990cm-1出现新的吸收峰,归属为S-Cu伸缩振动峰。

图1 CS、TUCS和TUCS-Cu的红外光谱Fig.1 IR spectra of chitosan, thiourea chitosan and thiourea chitosan copper
2.1.2 紫外光谱

图2 CS、硫脲、TUCS、TUCS-Cu的紫外光谱Fig.2 UV spectra of chitosan, thiourea, thiourea chitosan and thiourea chitosan Cu (II)
CS、硫脲、TUCS、TUCS-Cu的紫外光谱如图2所示。CS、硫脲分别在224.50、253nm有吸收峰,合成的TUCS在235nm有一吸收峰,与CS、硫脲相比吸收峰位置发生了变化,表明合成了TUCS。TUCS与金属铜离子发生配位后,在234nm有一强吸收峰,这是由于TUCS-Cu中氮、氧的孤对电子发生n→σ*跃迁和π→π*跃迁,导致电子光谱发生的变化所致。
2.1.3 差热-热重分析
CS、TUCS和TUCS-Cu的TG-DTA数据如表1所示。CS的降解分为两个阶段[10]:第一个阶段在80℃开始,失重率7.6%,主要是失去水分子;第二个阶段失重在250℃开始,到600℃失重达最大, 在284℃有一强的放热峰,TG曲线上表现为一个显着的失重变化。TUCS热分析表明,随着失重的进行,差热曲线出现多个放热峰,是TUCS分解、氧化、燃烧的结果。在98.2~150℃之间有明显失重并伴有2个低矮的放热峰,失重率达10.9%,当温度升至250℃左右有一强的放热峰,峰形尖而高,与之相应的热重线又有明显的失重拐点。这是由于TUCS减弱了壳聚糖分子的规整度和氢键网络,从而降低了壳聚糖的结晶程度,导致分解温度降低;对于TUCS-Cu,当温度升至270℃左右有一强的放热峰,峰形尖而高,与之相应的热重线又有明显的失重拐点。可能是由于TUCS与Cu2+配位后,其分子内的氢键结合被破坏,结晶度发生改变,热稳定性减小。这种结构稳定性变化表明,TUCS与金属离子配合后,分子中不同金属离子与含有孤对电子的活性基团-NH2、-OH的配合作用,不仅改变了聚合物的部分化学键性质及其原子之间的相互作用, 必然要改变它们的稳定的空间构象[11],进而此次级转变的转变温度略有降低,它们的不稳定性是由于缺少自由的氨基,在制备衍生物时氨基被取代,而CS因其有自由的氨基而更稳定[12]。

表1 CS、TUCS和TUCS-Cu的TG-DTA数据Table 1 TG-DTA data of CS, TUCS and TUCS-Cu
2.1.4 X射线衍射

图3 CS(a)、TUCS(b)和TUCS-Cu (c)的X射线衍射谱图Fig.3 XRD of chitosans, thiourea chitosan and thiourea chitosan Cu (II) complex
图3为CS、TUCS和TUCS-Cu的X射线衍射谱图。CS在2θ为10.4°和19.8°处出现2个特征衍射峰[13],呈现“L-2 polymorph”晶型衍射图。TUCS在这两处的衍射峰强度显着减弱,是由于TUCS减弱了CS分子的规整度和氢键网络,从而降低了CS的结晶程度。TUCS-Cu在10.4°和19.8°处的衍射峰几乎消失,在16°出现新的衍射峰,表明有规则的结晶相形成[14]。
2.2 抑菌实验
抑菌圈直径越大,说明该抑菌剂对此种供试菌的抑制效果越好,反之则抑制效果越差。不同质量浓度CS、TUCS和TUCS-Cu对E.coli和S.aureus对应的抑菌圈直径见表2、3。以1.0%HAc溶液作为空白对照,对E.coli和S.aureus的抑菌圈均为0.65cm。
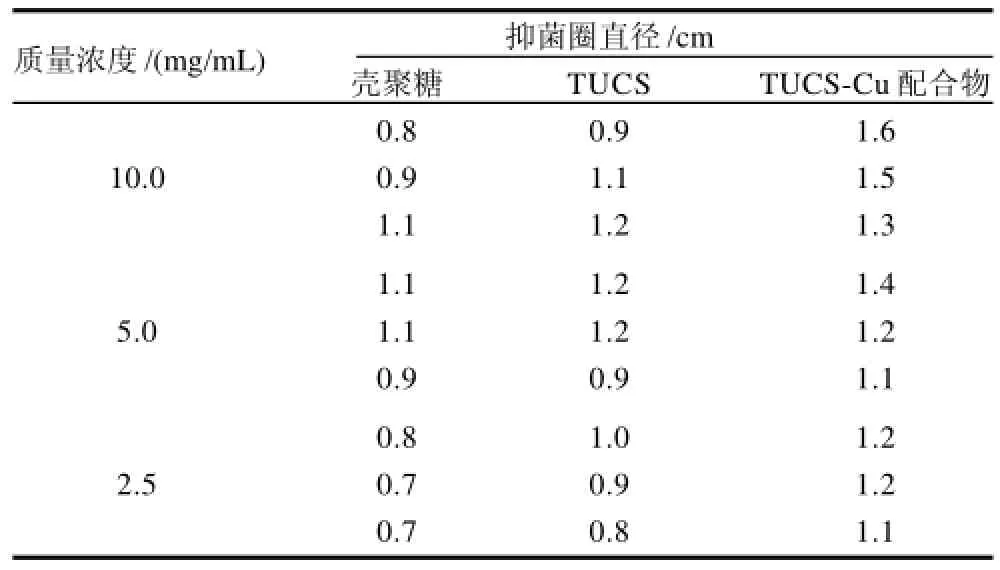
表2 CS、TUCS和TUCS-Cu对大肠杆菌的抑菌作用Table 2 Inhibition zone diameters of CS, TUCS and TUCS-Cu complex against E. coli

表3 CS、TUCS和TUCS-Cu配合物对金黄色葡萄球菌的抑菌作用Table 3 Inhibition zone diameters of CS, TUCS and TUCS-Cu complex against S. aureus
由表2、3可知,CS、TUCS和TUCS-Cu作用E.coli和S.aureus后,均具有明显的抑菌圈,且随着样品质量浓度的增加,与对照组相比抑菌圈的直径逐渐增加;TUCS-Cu的抑菌圈直径比单一的CS、TUCS显着增大,说明TUCS-Cu对E.coli和S.aureus的生长有较好的抑制作用。
金属铜离子可称为“超级酸”。TUCS和金属铜离子配位后,虽然一定程度上破坏了结构中的-NH2的阳离子化,使消毒因子-NH3+减少,但分子表面正电荷密度增加,从而增强了聚阳离子吸附到带负电荷的细菌表面的能力[15],并且Cu2+具有较多的核外电子和较小的离子半径,与TUCS结合作用很强,具有高电子密度的铜配合物更容易和细菌表面作用进而显示更强的抑菌效果。且Cu2+也具很强的抑菌性能,故TUCS-Cu配合物的抑菌性能较CS、TUCS远远增强。
3 结 论
利用IR、UV、TG-DTA和XRD手段,对合成的TUCS-Cu(II)配合物进行了表征。抑菌实验结果表明,TUCS-Cu配合物对大肠杆菌和金黄色葡萄球菌的抑菌性能优于单一的CS、TUCS。
参考文献:
由上述中考题型不难看出,中考“名着阅读”依然偏爱“重点情节”。那幺怎样组织有效复习让学生更好把握重点情节呢?笔者认为,横读局部,以人物为线,整合重点情节。
[1] CHUNG Y C, CHEN C Y. Antibacterial characteristics and activity of acid-soluble chitosan[J]. Bioresource Technol, 2008, 99: 2806-2814.
[2] JEONY J, KIM S K. Chitosan derivatives killed bacteria by disrupting the outer and innen membrane[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6629-6633.
[3] ISSAM S T, ADELE M G, ADELE C P, et al. Chitosan polyer as bioactive coating and film against Aspergillus niger contamination[J]. Journal of Food Science, 2005, 70(2): 100-104.
[4] KIM C H, KIM S Y, CHOI K S. Synthesis and antibacterial activity of water-soluble chitin derivatives[J]. Polymers of Advanced Technologies, 1997, 8: 319-325.
[5] 夏金兰, 王春, 聂珍媛, 等. 羧甲基壳聚糖银噻苯咪唑的制备及其抑菌性能[J]. 中南大学学报: 自然科学版, 2005, 36(1): 34-37.
[6] CHEN Shuiping, WU Guozhong, ZENG Hongyan. Preparation of high antimicrobial activity thiourea chitosan-Ag+complex[J]. Carbohydrate Polymers, 2005, 60: 33-38
[7] 冯小强, 李小芳, 伏国庆, 等. 壳聚糖Cu(Ⅱ)配合物的合成及抑菌性能研究[J]. 食品工业科技, 2009, 219(7): 119-121.
[8] PEARSM F G, MARCHESSAULT R H, LIANG C Y. Infrared spectra of crystalline polysaccharides.V.Chitin[J]. J Polym Sci, 1960, 43(141): 101-116.
[9] PADHYE S. Transition metal complexes of semicarbazones and thiosemicarbazones[J]. Coordination Chemical Review, 1985, 63: 127-135.
[10] QIN Caiqin, DU Yuming, XIAO Ling. Effect of hydrogen peroxide treatment on the molecular weight and structure of chitosan[J]. Polymer Degradation and Stability, 2002, 76: 211-218.
[11] 林芳, 贾新刚, 秦磊, 等. 壳聚糖-Cu(Ⅱ)吸附条件的优化[J]. 中国皮革, 2008, 37(3): 29-33.
[12] TOIDA T, CHAIDEDGUMJOM A, LINHARDT R J. Structure and bioactivity of sulfated polysaccharides[J]. Trends in Glycoscience and Glycotechnology, 2003, 15: 29-46.
[13] 蒋挺大. 壳聚糖[M]. 北京: 化学工业出版社, 2001.
[14] MUZZARELLI R A A, FERRERO A, PIZZOLI M. Light-scattering, X-ray diffraction, elemental analysis and infrared spectro- photometry characterization of chitosan, a chelating polymer[J]. Talanta, 1972, 19(10): 1222-1226.
[15] WANG Xiaohui, DU Yuming. Chitosan-metal complexes as antimicrobial agent: synthesis, characterization and structure activity study[J]. Polym Bull, 2005, 55: 105-113.
Preparation, Characterization and Antibacterial Activity of Thiourea-chitosan -copper (II) Complex
LI Xiao-fang,FENG Xiao-qiang,YANG Sheng,LI Yang-chun
(College of Life Science and Chemistry, Tianshui Normal University, Tianshui 741001, China)
Thiourea-chitosan-copper (II) complex was prepared, characterized by FT-IR, UV-visible spectroscopy, XRD and TG-DTA. The antibacterial activities of chitosan, thiourea-chitosan and thiourea-chitosan-copper (II) complex against E. coli and S. aureus were investigated. Results showed that the antibacterial activity of thiourea-chitosan-copper (II) complex was obviously enhanced when compared with chitosan.
chitosan;thiourea-chitosan-Cu (II) complex;antibacterial activity
O627.81
A
1002-6630(2011)07-0057-04
2010-06-03
甘肃天水师范学院物理无机化学重点学科基金项目(ZD0840);天水师院中青年教师科研资助项目(TSA1003)
李小芳(1983—),女,助教,硕士,主要从事天然高分子活性研究。E-mail:lix_f06@lzu.cn



