岳 岑,冯维希,黄 文,王 益,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.江苏联合职业技术学院连云港中医药分院,江苏 连云港 222006)
双水相萃取法提取条斑紫菜R-藻红蛋白工艺
岳 岑1,冯维希2,黄 文1,王 益1,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.江苏联合职业技术学院连云港中医药分院,江苏 连云港 222006)
以条斑紫菜为原料,采用双水相萃取法对R-藻红蛋白进行提取,讨论不同工艺条件聚合物分子大小及质量分数、成相盐质量分数、离子强度对藻红蛋白的提取效果,通过正交试验确定藻红蛋白的最佳提取条件。结果表明当6%聚乙二醇4000、13%硫酸钠、1.5%氯化钠时,蛋白纯度可由粗液的0.187上升至0.727,是传统硫酸铵盐析法的2.25倍,说明双水相萃取法比硫酸铵盐析法更适合提取R-藻红蛋白。
条斑紫菜;藻红蛋白;双水相萃取;优化
藻红蛋白(phycoerythrin,PE)是藻类中的天然色素蛋白,其中以R-藻红蛋白(R-phycoerythrin,RPE)最具代表性。RPE是多亚基、超大分子质量的色素蛋白化合物,据报道其蛋白分子质量为230~300kD,主要见于红藻和部分蓝藻中,由于RPE具有强烈的荧光性,同时具有其抗氧化、提高免疫力[1]、抗肿瘤及抗炎等生物活性[2],因此RPE不仅为天然的增色剂也是营养剂[3],而且广泛应用于食品、软饮料、化妆品和纺织品中[4]。
目前,对于藻红蛋白的提取常采用盐析法,但由于盐析法所获得的纯度有限,因此还需要额外的多步层析来达到纯度目标,步骤过多、操作复杂、动力能消耗高等导致产量损失及规模化生产的困难[5],这对于工业生产极为不利;双水相萃取法(aqueous tw o-phase extraction,ATPS)又称水溶液两相分配技术,是近年来出现的新型分配技术[6]。双水相萃取不仅条件温和,容易放大,可连续操作,还能使目标蛋白的纯度得到较大提升,现已被广泛用于蛋白质、核酸、氨基酸、多肽、细胞器等产品的分离和纯化[7]。专家预测ATPS是目前为止对生物活性物质纯化分离最有希望应用于大规模工业化生产的技术[8],它在工业应用上的已日渐成熟,为蛋白质尤其是藻胆蛋白这样的胞内蛋白质的提取开辟了新的途径。
目前,国内外对于ATPE提取藻胆蛋白的研究集中在于螺旋藻藻蓝蛋白[9]、紫球藻B-藻红蛋白[10]中,对RPE的双水相萃取尚未见报道,紫菜是获取藻红蛋白的理想资源[11],本研究以条斑紫菜(Porphyra yezoensis)为原料,考虑不同因素对萃取效果的影响,通过正交试验对提取条件进行优化,并将其与传统硫酸铵盐析法进行比较,从而体现双水相萃取对于纯度的提升的优势,为双水相萃取应用于RPE的提取提供参考。
1 材料与方法
1.1 材料、试剂与仪器
条斑紫菜粉末:条斑紫菜干片购于江苏连云港市,粉碎成8 0目干粉于-2 0℃避光保存;聚乙二醇(polyethylene glycol,PEG,1000~6000D)、硫酸钠、氯化钠、硫酸铵(均为分析纯)。
UV-9100紫外分光光度计 北京瑞利分析仪器有限公司;TDL-80-2B型离心机 上海安亭科学仪器厂;多功能粉碎机 永康市帅通工具有限公司。
1.2 方法
1.2.1 RPE粗液制备
采用渗透压破碎法[12],准确称取0.5g条斑紫菜粉末置于15mL离心管中,以质量分数1∶20加入蒸馏水,充分混匀后4℃浸泡5h,将悬浮液离心(10000×g)10min后收集上清液。
1.2.2 双水相萃取
双水相萃取一般常用“聚合物/聚合物”、“聚合物/盐”这两种体系所形成的双水相体系,由于“PEG/盐”体系相比双聚合物体系而言,具有因黏度较低而缩短相分离时间的优点,目前在藻胆蛋白的双水相提取中,一般采用“P E G/盐”体系。
在双水相萃取中,相分离效果的好坏一般通过分配系数K来表现,K值越大则相分离程度越好。K不是一个确定的量[13],它取决于溶质与双水相系统间的各种相互作用。影响藻红蛋白在双水相体系中的分配因素有很多,本实验选取“PEG/硫酸钠”体系进行研究,考察PEG分子质量及质量分数,成相盐硫酸钠质量分数,以及离子强度对藻红蛋白的提取效果的影响。
[10]将一定质量比的PEG、无机盐、蒸馏水加入到质量分数50%的RPE上清液中,使总体系质量为定值,25℃搅拌30min达到相分离,25℃、1500×g离心20min,直接从刻度管上评估上下两相的体积并计算体积比Vr,从体系中小心提取上相样品,用0.01mL/L磷酸钾缓冲液(pH7.0)稀释并测定两相溶液在波长280、614、561、652nm处的吸光度,计算RPE的分配系数K、纯度及提取率。
1.2.3 R PE纯度、质量浓度、提取率、分配系数及相比计算

式中:A280、A561、A614、A652分别代表波长280、561、614、562nm处的吸光度;V表示溶液体积;0、t、b分别代表粗液、双水相体系上相和下相溶液。
2 结果与分析
2.1 PEG平均分子质量对双水相体系平衡的影响
PEG分子质量对于双水相体系的平衡影响很大,由表1可知,在相同PEG质量分数下,分子质量1000D和2000D均不能成相,可见小分子质量的PEG虽可使水溶性增大,提高成相的临界质量分数,但PEG分子质量过小则无法形成双水相体系。在可成相的分子质量4000D与6000D中,由于聚合物的分子质量越小,体系黏度越低,可使相分离时间缩短,更易于工业化的分离,因此选取PEG 4 000为成相聚合物。
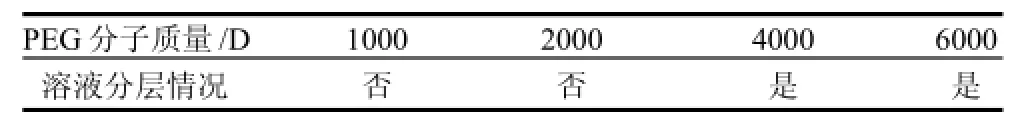
表1 PEG平均分子质量对双水相体系的影响Table 1 Effect of PEGs of different molecular weights on phase partitioning in aqueous two phase systems
2.2 PEG质量分数对RPE双水相萃取效果的影响

表2 PEG质量分数对RPE双水相萃取效果的影响Table 2 Effect of PEG 4000 concentration on R-phycoerythrin extraction and phase partitioning in aqueous two phase systems
如表2所示,当硫酸钠质量分数保持在12%、PEG质量分数从7%增加到12%时,分配系数K由14.71提高到51.77,提取率也相应增大至41.2%,可见,分配系数K的增加,有利于目标蛋白在上相的富集,这也同样表现在体积比Vr的增加上(由0.47升至0.72)。但随着K的增大,蛋白纯度降低,这意味着K增大会导致杂蛋白的引入。当PEG质量分数8%时,可得到最大纯度0.507。
2.3 硫酸钠质量分数对RPE双水相萃取效果的影响
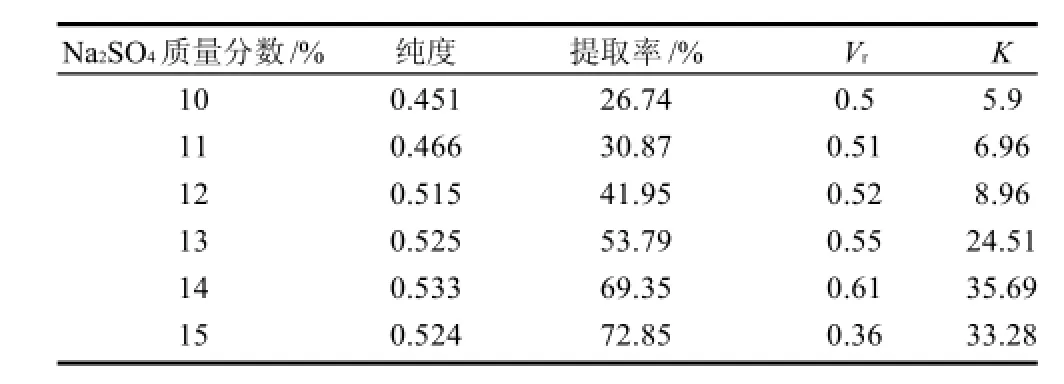
表3 硫酸钠质量分数对RPE提取效果的影响Table 3 Effect of Na2SO4concentration on R-phycoerythrin extraction and phase partitioning in aqueous two phase systems
如表3所示,PEG质量分数保持在8%时,RPE的纯度与Vr的变化规律相似,当硫酸钠质量分数为10%~14%时,RPE纯度随着体积比Vr的增大(0.5~0.61)而增大(0.451~0.533),并且Vr的增大在提高蛋白纯度的同时,也增加了RPE的提取率及分配系数K。当硫酸钠质量分数大于14%后,Vr开始下降,蛋白纯度也随之减小。可见Vr的降低(上相体积减少),使杂蛋白在上相浓缩而导致目标蛋白纯度下降,该结论[14]也通过实验得以证明。当硫酸钠质量分数为14%时,可得到最高纯度0.533。
2.4 离子强度对RPE双水相萃取效果的影响
在双水相体系中,适当增加离子强度可以加快分相速度,并可提高目的产物的选择性[7]。提高离子强度一般可加入的中性盐有氯化钠、氯化钾等[15],本实验选用氯化钠作为研究对象,影响结果如表4所示,当氯化钠质量分数增大时,RPE的提取率、纯度、体积比Vr都呈现先增大后减小的趋势,当氯化钠质量分数为1%时,出现最大分配系数K及提取率。当氯化钠质量分数为1.5%时,此时RPE纯度最高(0.691)。
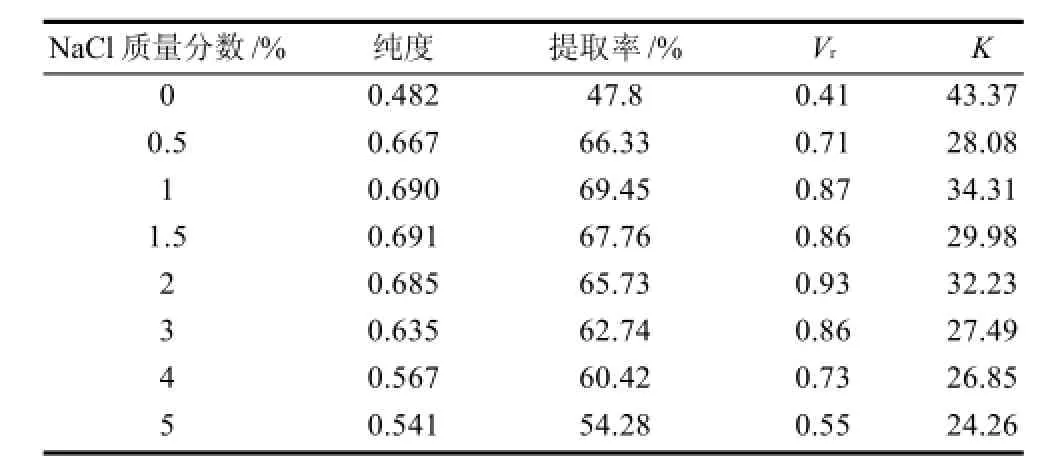
表4 离子强度对RPE提取效果的影响Table 4 Effect of ion strength on R-phycoerythrin extraction and phase partitioning in aqueous two phase systems
2.5 双水相萃取正交试验方案设计
为获得最优提取工艺条件,综合单因素试验结果,以纯度为考察指标,以PEG质量分数、硫酸钠质量分数、氯化钠质量分数为考察因素,采用L16(34)正交试验,因素与水平选择见表5,正交试验方案与方差分析结果见表6、7。
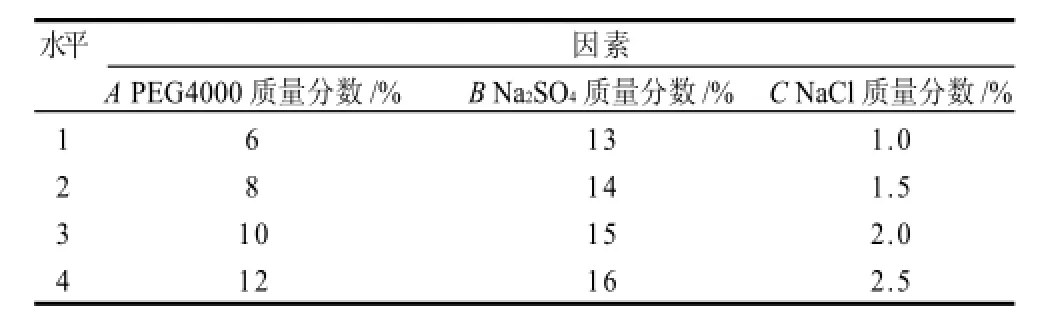
表5 双水相萃取正交试验因素水平表Table 5 Factors and their coded levels in orthogonal array design
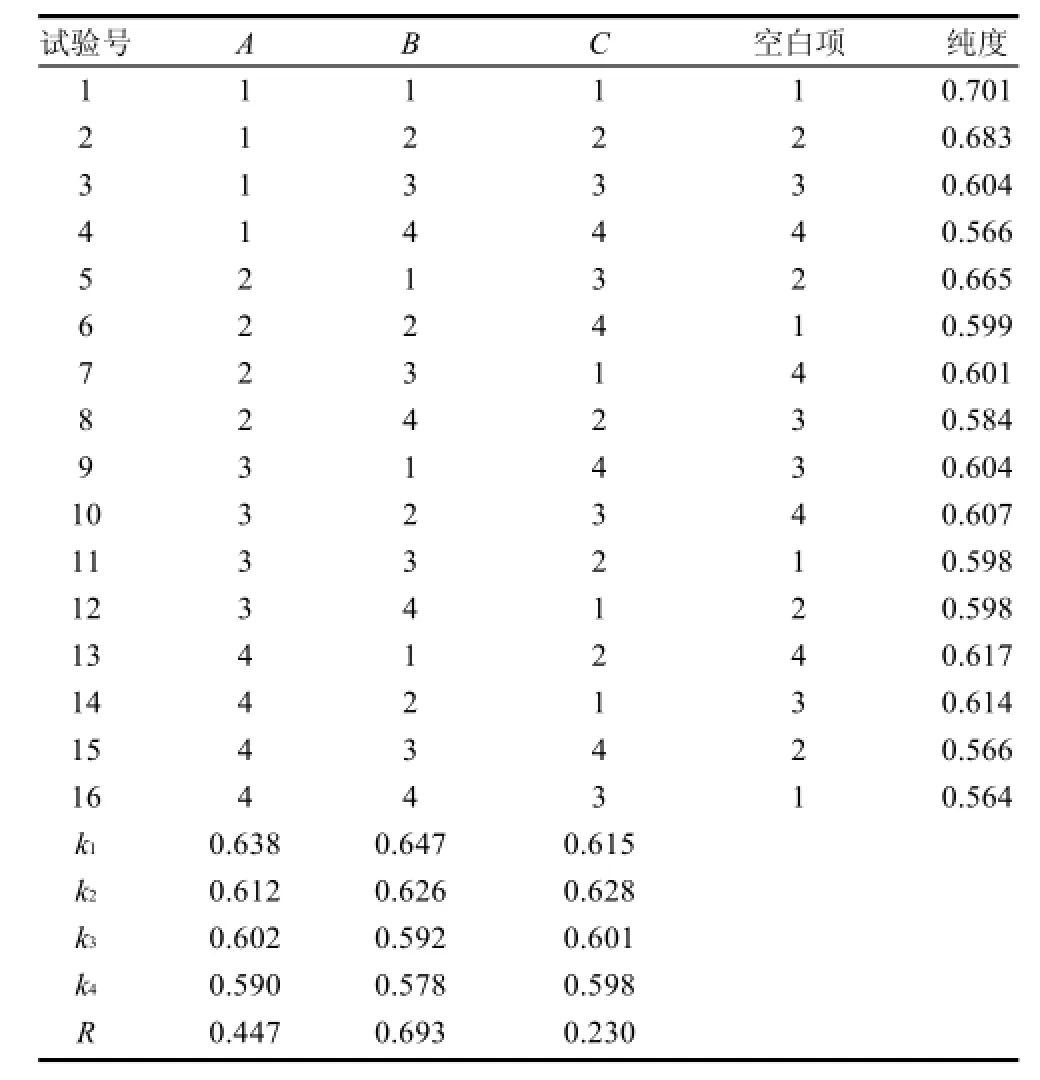
表6 双水相萃取L16(43)正交试验设计及结果Table 6 Orthogonal array design and corresponding experimental results
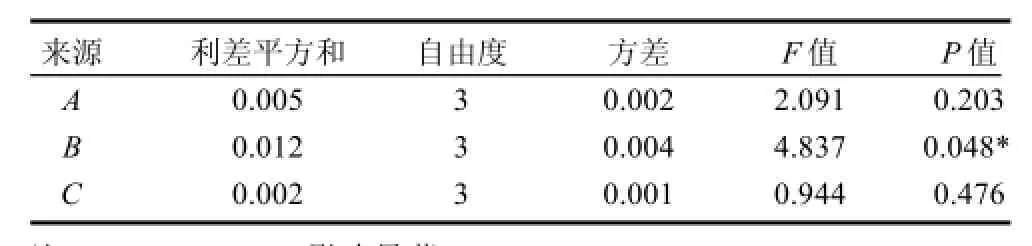
表7 正交试验结果方差分析Table 7 Variance analysis of R-phycoerythrin purity with various extraction conditions
由表6可见,PEG质量分数、硫酸钠质量分数和氯化钠质量分数对RPE纯度的影响程度依次为:B(硫酸钠质量分数)>A(PEG质量分数)>C(氯化钠质量分数),由表7可知,硫酸钠质量分数对RPE纯度有显着影响,最佳萃取条件为A1B1C2,即所得RPE纯度最高时的配比为6% PEG、13% Na2SO4、1.5% NaCl。
2.6 最佳工艺条件验证实验
称取20g RPE粗液按正交试验所得最佳提取工艺条件(A1B1C2)进行平行实验5次。计算得出,RPE的纯度为0.727,提取率为66.5%,说明此方法稳定可行。
2.7 双水相萃取与硫酸铵盐析的提取效果比较
根据文献[16]方法,向20g RPE粗液中加入饱和度为60%的硫酸铵,4℃放置过夜,10000×g离心10min,收集沉淀并用0.01mL/L磷酸钾缓冲液(pH7.0)溶解稀释至适量体积,测定RPE纯度及提取率,并与ATPE法进行比较。比较结果为ATPE法RPE纯度0.727、提取率66.5%;硫酸铵盐析法纯度0.322、提取率85.4%。
由结果可知,ATPE所得RPE提取率虽稍低于盐析法,但纯度明显得到很大提升。盐析法可将RPE的纯度由粗液的0.187上升为0.322,而通过ATPE法可达0.727,是盐析法的2.25倍。可见,通过ATPE法使纯度的提高,可减少盐析法后续为进一步纯化而进行的多次层析,从而减少了在层析过程中导致的蛋白流失,在经济适用的前提下还克服了提取率不及盐析法的弱点,由此显示了ATPE在工业生产上的优势。
另外,RPE的等电点为4.56左右,远离pH中性的双水相体系环境,利于蛋白的分配;同时RPE在40℃以下及pH7.0时最为稳定[16],ATPE的温和萃取条件也恰能最大程度的保持RPE的生物活性。
3 结 论
粗液纯度0.187的条斑紫菜R-藻红蛋白,通过双水相萃取法的最佳工艺条件为6% PEG 4000、13% Na2SO4、1.5% NaCl,可得到RPE最高纯度为0.727,是传统硫酸铵盐析法的2.25倍。相比盐析法,双水相萃取的生产工艺更加简单,条件更加温和,蛋白纯度更高,更适合于工业化生产。
参考文献:
[1]陈美珍, 余杰, 钟秋玲. 龙须菜藻胆蛋白免疫功能和抗氧化作用的研究[J]. 食品科学, 2005, 26(9)∶ 456-459.
[2]蔡心涵, 何立明, 蒋家伦, 等. 螺旋藻藻蓝蛋白对癌激光增敏作用的实验研究[J]. 中国海洋药物杂志, 1995, 14(1)∶ 15-18.
[3]BATIST A P, RAYMUNDOA A, SOUSAB I, et al. Rheological characterization of coloured oil-in-water food emulsions with lutein and phycocyanin added to the oil and aqueous phases[J]. Food Hydrocolloids, 2006, 20(1)∶ 44-52.
[4]顾宁琐, 刘宇峰. 紫球藻生物活性物质及其应用[J]. 中国海洋药物, 2001(6)∶ 43-45.
[5]BENAVIDES J, RITO-PALOMARES M. Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum[J]. Journal of Chromatography B, 2006, 844(1)∶ 39-44.
[6]郭宪厚. 双水相萃取技术研究进展[J]. 广州化工, 2008, 36(5)∶ 17-19.
[7]郑楠, 刘杰. 双水相萃取技术分离纯化蛋白质的研究[J]. 化学与生物工程, 2006, 23(10)∶ 7-9.
[8]姜彬, 冯志彪, 陈一. PEG/盐双水相体系萃取小麦酯酶的研究[J]. 食品工业科技, 2008, 29(9)∶200-202.
[9]PATIL G, RAGHAVARAO K. Aqueous two phase extraction for purification of C-phycocyanin[J]. Biochemical Engineering Journal, 2007, 34 (2)∶ 156-164.
[10]BENAVIDES J, RITO-PALOMARES M. Bioprocess intensification∶ a potential aqueous two-phase process for the primary recovery of B-phycoerythrin from Porphyridium cruentum[J]. Journal of Chromatography B, 2004, 807(1)∶ 33-38.
[11]高洪峰. 不同生长期坛紫菜中藻胆蛋白的含量变化[J]. 海洋与湖沼, 1993, 24(6)∶ 645-648.
[12]SILVEIRA S T, BURKERT J, COSTA J, et al. Optimization of phycocyanin extraction from Spirulina platensis using factorial design[J]. Bioresource Technology, 2007, 98(8)∶ 1629-1634.
[13]谭平华, 林金清, 肖春妹, 等. 双水相萃取技术研究进展及应用[J].化工生产与技术, 2006, 10(1)∶ 19-22.
[14]HUSTEDT H, KRONER K H, KULA M R. Protein recovery using two-phase systems[J]. Trends in Biotechnology, 1985, 3(6)∶ 139-144.
[15]刘杨, 王雪青, 庞广昌, 等. 双水相萃取法富集分离螺旋藻藻蓝蛋白的研究[J]. 海洋科学, 2008, 32(7)∶ 30-32.
[16]郑蔚然. 坛紫菜R-藻红蛋白的分离及其稳定性研究[D]. 杭州∶ 浙江工业大学, 2008.
Process Optimization for Aqueous Two-phase Extraction of R-Phycoerythrin from Porphyra yezoensi
YUE Cen1,FENG Wei-xi2,HUANG Wen2,WANG Yi1,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. Lianyungang Chinese Medicine Branch, Jiangsu Union Technical Institute, Lianyungang 222006, China)
On the basis of one-factor-at-a-time experiments, an L16(43) orthogonal array design was performed to optimize process conditions for aqueous two-phase extraction of R-phycoerythrin from Porphyra yezoensi. The effects of PEGs of different molecular weights, PEG 4000 dosage, the concentration of Na2SO4 as the phase-forming salt and ionic strength on the extraction of R-phycoerythrin were examined. The results indicated that the optimal aqueous two-phase extraction conditions were PEG 4000 as the phase-forming polymer at 6%, Na2SO4concentration 13%, NaCl concentration 1.5%. After the optimized aqueous two-phase extraction, the purity of R-phycoerythrin was increased to 0.727 from 0.187, showing a 2.25-fold increase. Therefore, aqueous two-phase extraction is more suitable for R-phycoerythrin extraction than ammonium sulfate precipitation.
Porphyra yezoensis;R-phycoerythrin;aqueous two-phase extraction;optimization
TS201.21
A
1002-6630(2011)16-0041-04
2011-03-11
连云港市2008年科技发展计划(综合类)项目(ZH200808)
岳岑(1985—),女,硕士,研究方向为天然产物化学。E-mail:yuecen7@yahoo.com.cn
*通信作者:王益(1967—),男,工程师,本科,研究方向为食品加工。E-mail:wywtx@mail.hzau.edu.cn



