杜 宁,许甜甜,李先富,夏志华,陈 军
(上海师范大学生命与环境科学学院,上海 200234)
废弃食用菌栽培块中纤维素酶的提纯工艺研究
杜 宁,许甜甜,李先富,夏志华,陈 军*
(上海师范大学生命与环境科学学院,上海 200234)
利用废弃食用菌栽培块通过浸提、膜浓缩、盐析和双水相萃取等方法提取加工工业级和高纯度纤维素酶制剂。结果表明:采用含体积分数0.2% Triton X-100的pH5.0、0.2mol/L乙酸-乙酸钠缓冲液作为酶浸提液,在25℃浸提3h条件下可以抽提出102.64U/mL的纤维素酶溶液,再在质量分数60%的(NH4)2SO4饱和度条件下可回收65.54%的纤维素酶总活力,制备成酶活力达到2865.47U/mL的工业级纤维素酶制剂;再经质量分数22%聚乙二醇6000(PEG6000)-20%(NH4)2SO4双水相体系在pH5.5、7mmol/L NaCl条件下常温萃取,可获得酶活力为10208.46U/mL,酶比活力106.62U/mg的高纯度纤维素酶,酶总活力得率为51.22%,纯度是浸提液的12.85倍。
废弃食用菌栽培块;纤维素酶;双水相萃取;提取纯化
我国年产食用菌约为1000万t,占世界产量的70%以上,每年产生大量食用菌栽培废料(spent mushroom compost,SMC),而目前这些废料大多是通过堆积或燃烧方式加以处理, 既浪费了资源,又对环境造成了严重的污染[1]。近年来,对SMC的利用已经开展了一些有益的探索,如Bisaria 等[2-4]利用SMC发酵制备燃料沼气;Sochtig等[5-7]利用SMC加工有机肥用于园艺和食用菌的生产;Chiu等[8-10]成功地利用SMC生物降解有害物质。此外,有关SMC中的生物活性物质分析讨论也有不少报道[11-15]。
食用菌生长过程中菌丝体会分泌大量纤维素酶来分解栽培料中的纤维素物质,以获得生长需要的碳源和能源[16]。在菌菇培养时期纤维素酶活性一般不易失活,整个栽培期间栽培料中会积累较多的纤维素酶活力。因此,在菌菇收获后的废弃栽培块中通常含有一定活力的纤维素酶,而从工艺上研究废弃栽培块中纤维素酶回收的报道并不多见[17-18]。目前商品纤维素酶的来源主要是通过发酵法来生产的,生产成本较为昂贵。本实验通过生化分离技术将积累在SMC中的纤维素酶提取加工精制成为商品酶制剂,为这一规模可观的废弃物资源的开发利用提供资料。
1 材料与方法
1.1 材料
香菇废弃栽培块来源于上海市奉贤现代农业园区工厂化食用菌生产中心。
1.2 仪器与设备
GL-20G高速冷冻离心机 上海安亭科学仪器厂;Millipore纳滤超滤反浸膜系统 上海摩速尔公司;高效液相层析系统 上海青浦沪西仪器;UV1000型紫外分光光度计 上海天美科技公司。
1.3 方法
1.3.1 SMC的预处理
收取食用菌工厂丢弃的已经收获3~6茬香菇的SMC,切除霉变及腐烂部分,挑选不同批次的SMC混合碾压粉碎备用。测定不同老熟程度的SMC水分含量、纤维素酶(CMCase)活力和蛋白质含量。
1.3.2 纤维素酶的提取实验
设置6组纤维素酶浸提液,分别为:去离子水;0.5g/100mL NaCl溶液;0.2mol/L pH5.0乙酸-乙酸钠缓冲液;0.2mol/L pH5.0乙酸-乙酸钠缓冲液+体积分数1%甘油;0.2mol/L pH5.0乙酸-乙酸钠缓冲液+体积分数0.2% Triton X-100;0.2mol/L pH5.0乙酸-乙酸钠缓冲液+体积分数1%甘油+体积分数0.2% Triton X-100。
取SMC加入不同的浸提液,搅拌维持相应时间后用2层纱布过滤至常压下液体自然滤尽,滤液经5000r/min离心10min,得到浸提酶液。测量浸提酶液的体积、纤维素酶活力和蛋白质含量。
正交试验优化浸提条件设定:因为4、10℃是生物活性物质提取经常采用的稳定温度环境,25℃是常温环境;pH值以纤维素酶的最适pH值为依据。料液比选择在料液混合液的可流动性比例范围内,所以分别以浸提温度(4、10、25℃)、浸提液pH值(4.5、5.0、5.5)、浸提时间(1、3、5h)和料液比(0.2:1、0.3:1、0.4:1)在最适浸提液中利用正交试验优化浸提条件。
1.3.3 粗酶的制备
取浸提酶液经截留分子质量为10000D的中空纤维膜过滤器浓缩至原体积的1/5后,缓缓加入固体硫酸铵粉末至不同的饱和度,分段盐析蛋白,每盐析段经10℃、10000r/min离心20min,得到固体酶泥。将固体酶泥加少量pH5.0,0.2mol/L乙酸-乙酸钠缓冲液溶解,测量酶液体积、酶活力和蛋白质含量。
1.3.4 纤维素酶的双水相萃取纯化
双水相相图的绘制参照朱建星等[19]方法,25℃时以40%的(NH4)2SO4溶液逐滴加入到10g 40%的聚乙二醇6000(PEG6000)的溶液中,直到出现混浊,记下此时的体系组成。再向混浊的体系中加入1g 0.2mol/L的pH5.0乙酸缓冲液,摇匀,待溶液变清后重复上述操作。将所记录的体系组成以PEG6000的质量分数为纵坐标,(NH4)2SO4质量分数为横坐标作图,即得双结点曲线。
用PEG6000和(NH4)2SO4建立酶的双水相萃取体系,依据上述双结线绘制的双水相形成特征,按体系总质量为10g,粗酶液(盐析沉淀透析除盐后的酶液)量为2g。称取一定量40% PEG6000溶液和40% (NH4)2SO4溶液及pH5.0、0.2mol/L的乙酸缓冲液混合配制成不同双水相体系组成,6000r/min离心5min促进分相。分别测出上下相的体积和酶活力,计算分配系数,确定最适萃取纤维素酶的双水相萃取体系组成。双水相系统中的分配系数k定义为:

式中:Ca为上相液酶活力/(U/mL);Cb为下相液酶活力 /(U/mL)。
下相酶的得率Y下相采用百分含量形式表示:
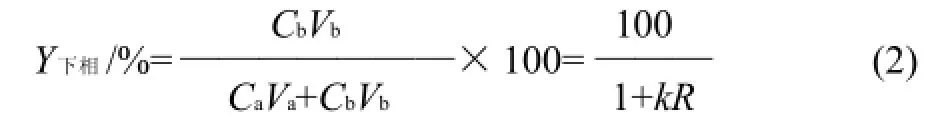
式中:Ca为上相液酶活力/(U/mL);Cb为下相液酶活力/(U/mL);Va为上相液体积/mL;Vb为下相液体积/mL;R为上下相溶液体积的比值;Y为酶回收率/%;k为分配系数。
1.3.5 提取过程指标测定
SM C含水量的测定:SM C栽培块粉碎后称取200g,置于105℃电热干燥箱中烘干约3h至质量恒定,冷至室温后称量栽培块干质量,计算栽培块基质含水量。
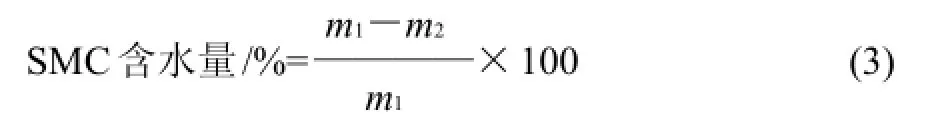
式中:m1为SMC湿质量/g;m2为SMC干质量/g。
固体物质溶出度分析:用电子天平称量30mL抽提液的质量,放入105℃的烘箱内3h,冷却后称质量,测其固体物质溶出度(%,m/m)。
纤维素酶(CMCase)活力的测定参考Han等[17]方法。在3mL 0.2mol/L乙酸-乙酸钠缓冲溶液(pH4.8)中加入1mL 0.5%的羧甲基纤维素钠(CMC-Na)溶液作底物,恒温40℃后,加酶液1mL反应,保持反应10min,加2mL 3,5-二硝基水杨酸显色剂100℃水浴显色10min后,在550nm波长处测定吸光度,并对照标准葡萄糖曲线查得葡萄糖含量,计算酶活力。
酶活力单位的定义:实验反应条件下,以1mL酶液在1min内水解生成1μg葡萄糖为1个酶活力单位(U)。
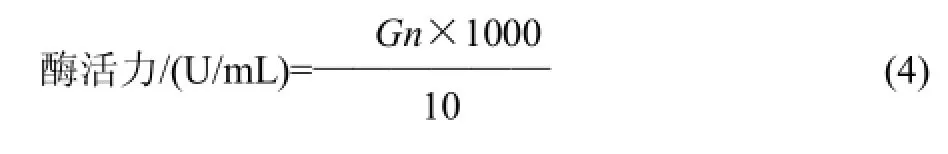
式中:G为测出显色液吸光度A550nm在葡萄糖曲线上查得的葡萄糖质量/mg;n为酶的稀释倍数;1000为mg与μg单位换算;10为反应时间/min。
蛋白质含量测定采用Bradford法[20]。用考马斯亮蓝G250与酶提取液反应显色,为避免PEG等的干扰,以相同组分但不含蛋白的溶液为空白对照,在595nm波长处比色测定吸光度,以牛血清白蛋白为标准蛋白。
2 结果与分析
2.1 不同老化度的SMC中纤维素酶活力差异比较
栽培基质中纤维素酶的累积与菌菇生理状态及基质的营养物质残留情况有密切关系,实验分别选取已收获3~6茬香菇的SMC块料,测定其中的酶含量及溶出度,结果如图1所示。

图1 不同老化度的SMC中纤维素酶活力的比较Fig.1 Comparison of cellulase activity from SMC with various ages
从图1可以看出,不同老化程度的SMC中都残留一定含量的纤维素酶,其中,收获5茬后的SMC中CMCase活力最高,达到162.56U/mL,含有的总蛋白质量相对较少,但随着栽培块的老化,在第6茬中的酶活力显着下降。又由于栽培料被利用时间的延长,固体物质在浸出液中的溶出度有所增加,这可能会增加酶分离纯化的复杂性。
2.2 浸出液组成对纤维素酶提取率的影响
根据蛋白质在提取过程中对环境因素、稳定因子及增溶性的要求,酶的浸提实验以第5茬SMC为材料,用6种不同组成的浸出液在室温下浸提1h,纤维素酶浸出结果如图2所示。
由图2 可以看出,不同浸出液对纤维素酶及蛋白质的抽提效果有一定的差异,其中NaCl溶液(b)有较小的增溶蛋白作用,适宜的缓冲液(c)更有利于酶活力的保持,由于纤维素酶活力相对较稳定,添加温度保护剂甘油(d)对提取作用不大,适量的蛋白增溶剂Triton X-100(e)对纤维素酶的浸提效果最好,酶活力达到了102.64U/mL,蛋白质的溶出度也对应有所提高,而同时添加甘油和Triton X-100(f)与e的提取差别不明显,因此,最适抽提液组成选择e。

图2 浸出液组成对纤维素酶提取率的影响Fig.2 Effect of extraction solvents on the activity of cellulase
2.3 纤维素酶提取条件优化分析
分别以浸出温度、浸出液pH值、浸出时间和料液比在浸出液(e)基础上利用正交试验优化纤维素酶的提取条件,结果如表1所示。
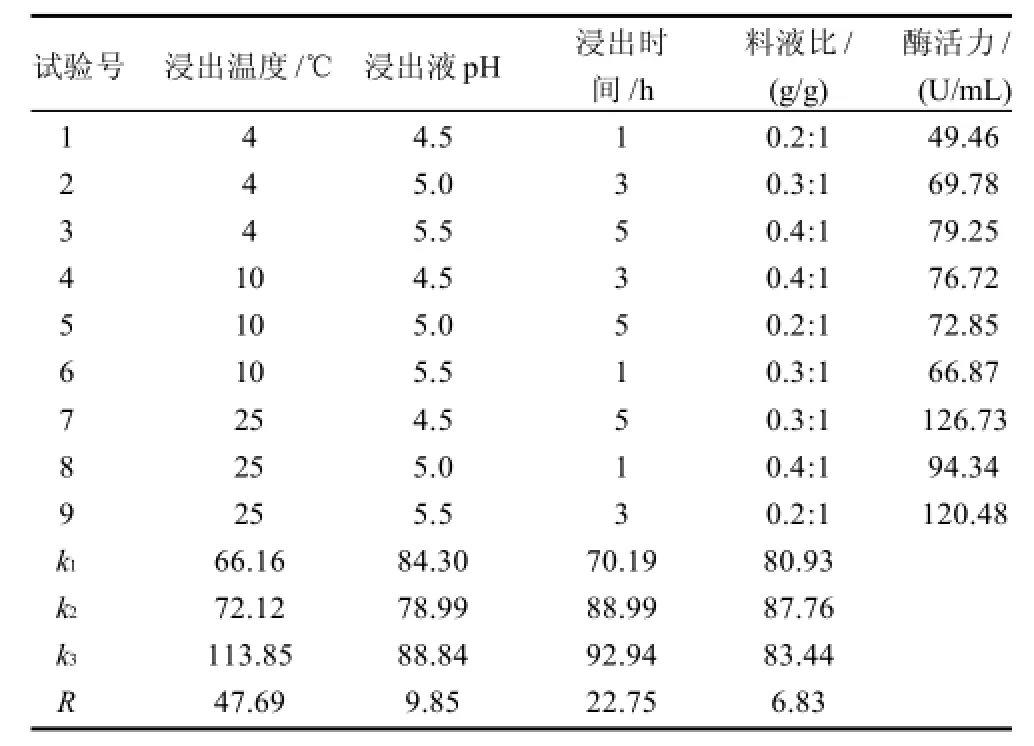
表1 纤维素酶浸出条件优化正交试验设计及结果Table1 Orthogonal array design and results for optimizing cellulase extraction from SMC
由表1可以发现,酶提取条件中影响酶溶出的主要因素是浸提温度,25℃时酶溶出效果最好。其次是浸出时间,3~5h酶的溶出情况较好;而浸出液pH值和料液比的调整对酶的浸出率影响并不显着,因此,实验最终选择以0.2mol/L pH5.5乙酸-乙酸钠缓冲液+体积分数0.2% Triton X-100为浸出液,料液比为0.3:1,25℃浸提3~5h为条件从SMC中提取纤维素酶,验证实验表明浸提液CMCase活力可以达到134.62U/mL,比优化前的102.64U/mL增加了33.11%。
2.4 纤维素酶粗酶制剂制备过程分析
SMC浸提液中酶浓度较低,杂质含量高,经膜浓缩、分段盐析(图3)后,酶的活力及纯度得到了提高,酶提纯加工过程中的各项性能指标如表2所示。
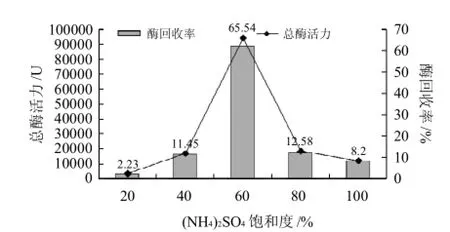
图3 (NH4)2SO4饱和度对纤维素酶提取率的影响Fig.3 Effect of (NH4)2SO4saturation degree on the extraction rate of cellulase
图3显示,从SMC中提取的纤维素酶经膜浓缩后的酶液在60%的(NH4)2SO4饱和度下盐析沉淀的组分最高,沉淀的酶泥中总酶活力为88830U,回收率达到抽提酶液中总酶活力的65.54%。
表2表明,SMC浸提液通过浓缩和盐析沉淀可以获得65.54%纤维素酶回收率,样品酶比活力达到20.95U/mg,纯度比浸出液提高了2.53倍。此纯度的酶制剂达到轻工业标准GB2583—2003《纤维素酶制剂》产品理化指标对酶活力标准的要求。
2.5 高纯度纤维素酶双水相萃取制备条件分析
2.5.1 双水相组成对纤维素酶萃取性能的影响
由于双水相萃取体系的组成性质不同,酶进入双水相体系后,由于表面性质、电荷作用和各种力(如疏水键、氢键和离子键等)的存在和环境因素的影响,使其在上、下相中的质量分数不同,实验通过分别调整体系中PEG6000和(NH4)2SO4浓度,测定其对纤维素酶在两相中的分配率的影响,结果如图4、5所示。
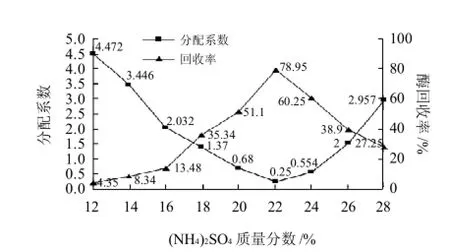
图4 双水相组成中(NH4)2SO4质量分数对纤维素酶分配系数及回收率的影响Fig.4 Effect of (NH4)2SO4concentration in aqueous two-phase system on the partition coefficient and yield of cellulase

图5 双水相组成中PEG6000质量分数对纤维素酶分配系数及回收率的影响Fig.5 Effect of PEG6000 concentration in aqueous two-phase system on the partition coefficient and yield of cellulase
由图4可知,随着(NH4)2SO4质量分数的增加,分配系数逐步下降,说明纤维素酶向下相(NH4)2SO4水相层分散,至(NH4)2SO4质量分数增加到22%时出现拐点,此时的纤维素酶最高回收率为78.95%;而图5结果分析同样发现当体系中的PEG6000质量分数为20%时,k为0.24,纤维素酶最高回收率为79.35%。因此,合适纤维素酶萃取的PEG6000-(NH4)2SO4双水相体系组成为PEG6000质量分数20%,(NH4)2SO4质量分数22%。
2.5.2 双水相萃取条件的优化
在上述最适双水相体系中添加NaCl考察在此双水相体系中NaCl浓度对纤维素酶分配率的影响,结果见图6。
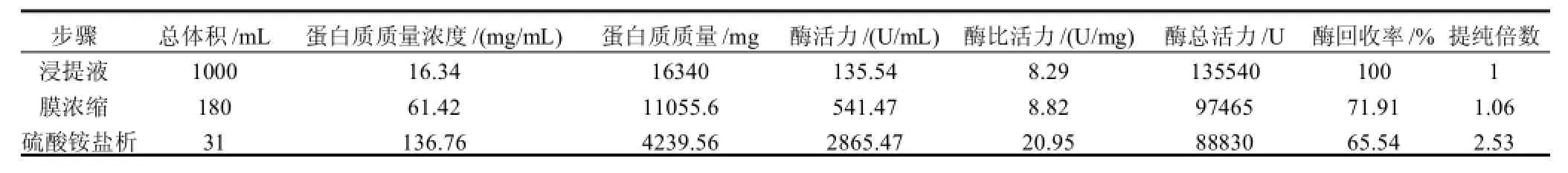
表2 SMC纤维素酶粗酶的纯化Table2 A summary of purification of industrial grade cellulase from crude enzyme solution
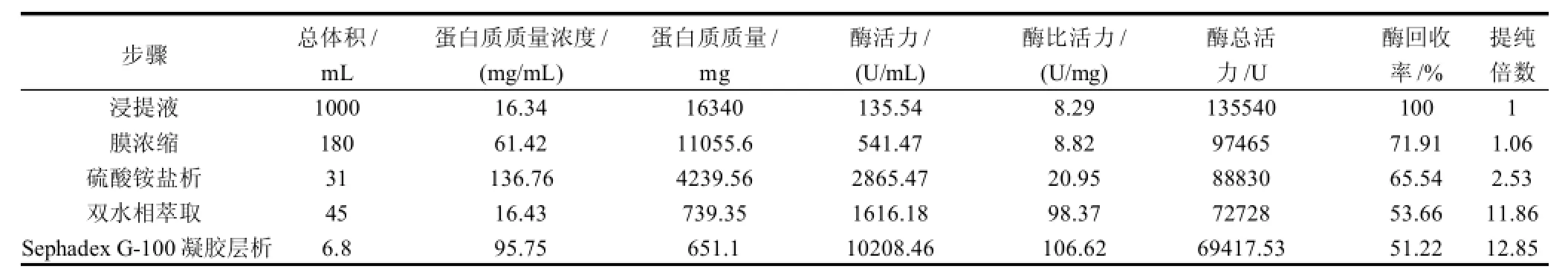
表3 高纯度提取纤维素酶的纯化结果Table3 A summary of purification of high-purity cellulase from crude enzyme solution
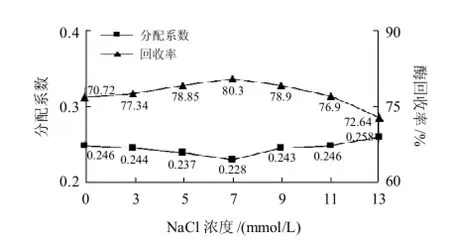
图6 外加NaCl对纤维素酶在双水相中分配系数及回收率的影响Fig.6 Effect of NaCl concentration in aqueous two-phase system on the partition coefficient and yield of cellulase
图6显示,在质量分数22% PEG6000-质量分数20% (NH4)2SO4形成的双水相系统中调整NaCl的浓度(0~13mmol/L)对纤维素酶的分配性能有一定的影响,在NaCl浓度0~7mmol/L时k值稍有下降(7mmol/L时,k为0.228,酶的回收率可达到80.3%),有利于酶在下相中分配,但随着NaCl浓度的进一步增加分配系数会明显上升,反而不利于酶在水相中的分配。这与一般认为外加中性盐会改变系统的相图和分配特性[10-11]相符合。
加7mmol/L NaCl后调整双水相体系的pH值,pH值在4~7范围内分别考察纤维素酶的分配情况,结果如图7所示。
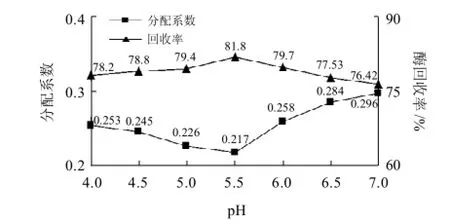
图7 pH值对纤维素酶在双水相中分配系数及酶回收率的影响Fig.7 Effect of pH of aqueous two-phase system on the partition coefficient and yield of cellulase
图7表明,PEG6000/(NH4)2SO4双水相系统中pH值在4~7区间内纤维素酶分配系数有小幅度波动,pH5.5时分配系数最低(0.217),酶回收率最高(81.8%)。产生这种现象可解释为系统pH值变化使酶所带的表面净电荷发生了改变, 一般真菌产纤维素酶的等电点为4.5~5.5[15],当系统的pH值高于5.5时酶表面负电荷增加,分配在下相(NH4)2SO4溶液中的酶量会相应减少。
2.6 纤维素酶的凝胶层析
PEG6000-(NH4)2SO4双水相提取的纤维素酶再经过Sephadex G-100凝胶层析,纯化效果如图8及表3所示。
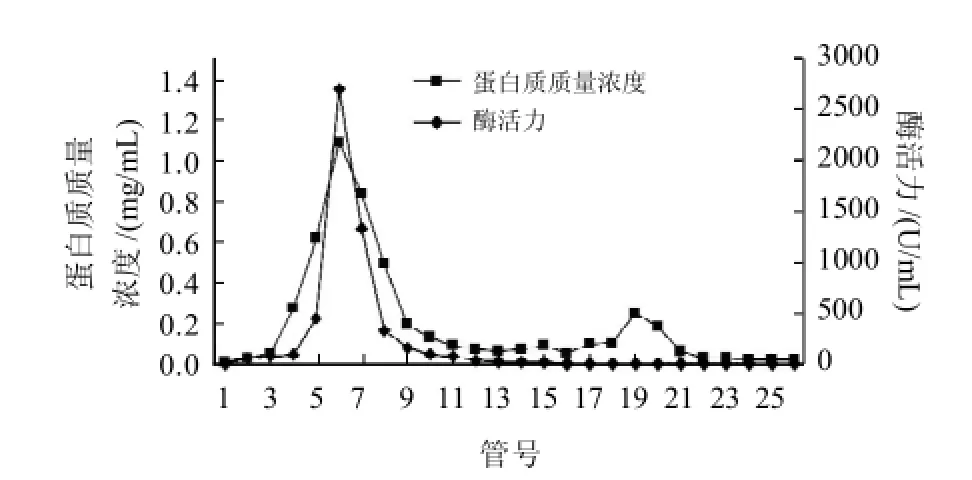
图8 纤维素酶复溶提纯液Sephadex G-100层析洗脱曲线Fig.8 Elution curve of redissolved cellulose on Sephadex G-100 column
由图8可见,高组分蛋白质与高酶活力组分峰值明显,两峰的重叠性较好,整个洗脱过程中杂蛋白峰很少,说明上样组分中纤维素酶蛋白质纯度较高,也证明共沉复溶双水相法提纯高纯度纤维素酶具有高效性和可行性。
表3表明, PEG6000-(NH4)2SO4双水相提纯纤维素酶可以获得53.66%酶回收率,样品酶比活力达到98.37U/mg,纯度比浸提液提高了11.86倍,而经过Sephadex G-100凝胶层析之后的纤维素酶纯化指标比活力为106.62U/mg,纯度虽然比双水相萃取法稍有提高,但纤维素酶总活力损失也因此增加了2.44%。实验数据再次肯定了双水相萃取法在提纯纤维素酶蛋白具有较好的应用效果。
3 结 论
本实验利用生化分离手段从食用菌废弃栽培块中提取商品价值较高的纤维素酶,该方法较一般的发酵纤维素酶生产具有较大的成本优势,科学合理地利用了食用菌生产中的废弃资源,提高了农业生产的附加值,所提取的产品安全性能可靠,应用领域比较广泛。本研究在实验条件下制备了酶活力2865.47U/mL的工业级纤维素酶制剂,酶总活力回收率达到65.54%;而运用双水相萃取和凝胶层板技术得到了酶活力为10208.46U/mL、酶比活力为106.62U/mg的高纯度酶样品,酶回收率为51.22%,纯度是浸提液的12.85倍,比常规盐析-层析法提纯周期明显缩短,成本消耗也较低廉,过程容易放大,纯化后的酶安全性良好。
[1]时连辉, 张志国, 刘登民, 等. 菇渣和泥炭基质理化特性比较及其调节[J]. 农业工程学报, 2008, 24(4): 199-203.
[2]BISARIA R, VASUDEVAN P, BISARIA V S. Utilization of spent agroresidues from mushroom cultivation for biogas production[J]. Appl Microbiol Biotechnol, 1990, 33: 607-609.
[3]KUMARAN S, SASTRY C A, VIKINESWARY S, et al. Cellulase and xylanase activities during the growth of Pleurotus sajorcaju on sago hampas[J]. World J Microbiol Biotechnol, 1997, 13: 43-49.
[4]WILLIAMS B C, MCMULLAN J T, MCCAHEY S. An initial assessment of spent mushroom compost as a potential energy feedstock [J]. Biores Technol, 2001, 79: 227-230.
[5]SOCHTIG H. GRABBE K. The production and utilization of organicmineral fertilizer from spent mushroom compost[M]// ELLIOTT T J. Science and Cultivation of Edible Fungi: Vol 2. Rotterdam (The Netherlands): Balkema Publishers, 1995: 907-915.
[6]STEWART D P C, CAMERON K C, CORMFORTH I S, et al. Release of sulphate, potassium, calcium and magnesium from spent mushroom compost under laboratory conditions[J]. Biol Fertil Soils, 1998, 26: 146-151.
[7]SHERRY, HSIAO L W, VIRGINIA I, et al. Growth response of selected vegetable crops to spent mushroom compost application in a controlled environment[J]. Plant and Soil, 1984, 82: 31-40.
[8]CHIU S W, CHING M L, FONG K L, et al. Spent mushroom substrate performs better than many mycelia in removing the biocide pentachlorophenol[J]. Mycol Res, 1998, 102: 1553-1562.
[9]CHIU S W, GAO T, CHAN C S S, et al. Removal of spilled petroleum in industrial soils by spent compost of mushroom Pleurotus pulmonarius [J]. Chemosphere, 2009, 75(6): 837-840.
[10]CHEN Guiqiu, ZENG Guangming, TU Xiang, et al. A novel biosorbent: characterization of the spent mushroom compost and its application for removal of heavy metals[J]. Journal of Environmental Scences, 2005, 17 (5): 756-760.
[11]顾雅君, 王瑛, 刘建荣, 等. 与食用菌相关主要酶的研究和应用[J].中国食用菌, 2006, 25(1): 40-42.
[12]YOUNG W C, BIDUS K D, ARUP R, et al. Performance of a SAPS-based chemo-bioreactor treating acid mine drainage using low-DOC spent mushroom compost and limestone as substrate[J]. Mine Water Environ, 2010, 29: 217-224.
[13]BALL J. The recovery of lignocellulose degrading enzymes from spent mushroom compost[J]. Biores Technol, 1995, 54: 311-314.
[14]ZERVAKIS G, PHILIPPOUSSIS A, IOANNIDOU S, et al. Mycelium growth kinetics and optimal temperature conditions for the cultivation of edible mushroom species on lignocellulosic substrates[J]. Folia Microbiol, 2001, 46: 231-234.
[15]TOMSOVSKY M, HOMOLKA L. Laccase and other ligninolytic enzyme activities of selected strains of Trametes spp. from different localities and substrates[J]. Folia Microbiol, 2003, 48: 413-416.
[16]LOYD R S, WILLIAM R W, FREDERICK M W. Restoring the capacity of spent mushroom compost to treat coal mine drainage by reducing the inflow rate: a microcosm experiment[J]. Water Air and Soil Pollution, 1994, 75: 405-420.
[17]HAN G K, SANG H P, SEONG H K, et al. Detection and recovery of hydrolytic enzymes from spent compost of four mushroom species[J]. Folia Microbiol, 2005, 50(2): 103-106.
[18]李顾鹏, 沈标, 樊庆笙. 从食用菌菇渣中提取粗纤维素酶的研究[J].南京农业大学学报, 1991, 14(3): 120-121.
[19]朱建星, 王红艳, 张万忠. 应用响应面法优化AS1.398中性蛋白酶的双水相萃取条件[J]. 沈阳化工学院学报, 2007, 21(4): 252-256.
[20]BRADFORD M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding[J]. Anal Biochem, 1972, 72: 248-252.
Extraction and Purification of Cellulase from Spent Mushroom Compost
DU Ning,XU Tian-tian,LI Xian-fu,XIA Zhi-hua,CHEN Jun*
(College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China)
Spent mushroom compost (SMC) was used to prepare industrial grade cellulase by solvent extraction, membrane filtration and salting out and high-purity cellulase by further aqueous two-phase extraction. The results showed that crude cellulase solution with an enzymatic activity of 102.64 U/mL was obtained after 3 h of extraction at 25 ℃ with an extraction solvent composed of 0.2 mol/L acetic-acetate sodium buffer at pH 5.0 and 0.2% Triton X-100. Subsequent salting out at 60% (NH4)2SO4 saturation could recover 65.54% of the total cellulase activity, and industrial grade cellulase with an enzymatic activity of 2865.47 U/mL was obtained. After further aqueous two-phase extraction with a system made up of 22% polyethylene glycol 6000 (PEG6000) and 20% (NH4)2SO4 under the conditions of 7 mmol/L NaCl, pH 5.5 and normal temperature, the cellulase activity and specific activity were 10208.46 U/mL and 106.62 U/mg, respectively and a total activity yield of 51.22% was achieve, revealing a 12.85-fold increase when compared with that of crude enzyme solution. As a result, high-purity cellulase was obtained.
spent mushroom compost(SMC);cellulose;aqueous two-phase extraction;extraction and purification
TS209
A
1002-6630(2012)01-0125-06
2011-02-14
国家自然科学基金项目(50678102;0000005472);上海市教委青年基金项目(03DQ25);上海师范大学科技基金项目(SK201228);上海市大学生科研创新活动计划项目(CX016)
杜宁(1986—),女,硕士研究生,研究方向为微生物分子生物学。E-mail:Duing@shnu.edu.cn
*通信作者:陈军(1966—),男,副教授,博士,研究方向为微生物酶学。E-mail:cj7206@shnu.edu.cn



