王晶钰,董 睿,王利勤,芮 弦,陈 婷,李成山,张三东,张彦明,郭抗抗
(西北农林科技大学动物医学院,陕西 杨凌 712100)
市售鲜鸡蛋中沙门氏菌的分离鉴定及毒力岛基因检测
王晶钰,董 睿,王利勤,芮 弦,陈 婷,李成山,张三东,张彦明,郭抗抗
(西北农林科技大学动物医学院,陕西 杨凌 712100)
目的:监测市售鲜鸡蛋中沙门氏菌的污染情况,检测分离菌株的致病性及其毒力岛基因携带情况,了解沙门氏菌分离株毒力岛基因的携带与其致病力的相关性。方法:从陕西省不同地市的超市中随机购买鲜鸡蛋,无菌取其蛋壳膜分离沙门氏菌,聚合酶链式反应方法扩增沙门氏菌菌属特异性invA基因鉴定分离株;对分离菌株进行无特定病原体(SPF)雏鸡的致病性试验,依据GenBank发表的基因序列,设计引物聚合酶链式反应检测沙门氏菌毒力岛(SPI)核心蛋白基因。结果:从陕西省55家超市1100枚鲜蛋中分离鉴定出30株沙门氏菌,分离率达2.73%;动物致病性实验表明,30株沙门氏菌中13株有致病力,其中强致病力菌株有7株,占23.3%;分离菌株的毒力岛基因携带率分别为:SPI-1 60%、SPI-2 73.3%、SPI-3 100%、SPI-4 90%、SPI-5 76.7%,毒力岛基因SPI-1+SPI-2的携带与细菌致病性有关。结论:市售鲜鸡蛋中沙门氏菌携带率为2.73%,分离菌株对动物具有一定的致病力,毒力岛基因SPI-1+SPI-2的携带与沙门氏菌的致病性呈正相关。
沙门氏菌;invA基因;致病性;毒力岛基因;鸡蛋;蛋壳膜
沙门氏菌属是一类寄生于人和动物肠道内的无芽孢革兰氏阴性直杆菌,被沙门氏菌污染的禽肉、禽蛋可导致人发生食物中毒和败血症等,人一旦摄入了含有大量沙门氏菌的动物性食品,可导致食源性中毒[1-2]。在美国,每年有将近130万人感染食源性沙门氏菌,导致500多人死亡[3],2010年美国有2000多人因食用被肠炎沙门氏菌污染的鸡蛋而出现腹泻等症状[4]。目前已经明确蛋与蛋制品是引发人类沙门氏菌病发生的主要食物媒介。在我国,沙门氏菌引起的食物中毒也是居细菌性食物中毒的首位[5-6],进出口食品安全检测监控项目中,沙门氏菌属于不得检出的微生物种类。因此畜禽产品中,尤其是禽肉和禽蛋中沙门氏菌的存在对食品安全、兽医公共卫生等具有重要的意义。本研究从陕西省4个不同地市的55个超市中随机购买鲜蛋,从蛋壳膜中分离鉴定沙门氏菌,对分离菌进行动物致病性实验,用聚合酶链式反应(polymerase chain reaction,PCR)方法检测沙门氏菌属毒力岛核心蛋白基因,了解市售鲜鸡蛋中有无沙门氏菌的污染,分离菌的致病力及其毒力基因的携带情况,毒力岛基因的携带与沙门氏菌的致病性的相关性,为食品安全提供科学资料。
1 材料与方法
1.1 材料、试剂与仪器
鲜蛋采集:2010年9月至2011年8月,从陕西省的西安、咸阳、宝鸡、铜川等市的55个超市随机购买鲜蛋,每个超市选购20枚,共收集1100枚鸡蛋。增菌液及培养基:缓冲蛋白胨水(BPW)、亚硒酸盐胱氨酸(SC)增菌液、XLD培养基、亚硫酸铋(BS)琼脂、营养琼脂、MH肉汤 北京路桥技术有限公司。实验动物:1日龄SPF雏鸡93只,由杨凌绿方生物工程有限公司提供(SPF受精蛋购自北京梅里亚维通实验动物技术有限公司),隔离器中饲养观察5d,确认健康后进行实验。
Taq酶试剂盒、PCR Master Mix(TaqDNA聚合酶、dNTP)、DNA Marker DL2000 宝生物工程(大连)有限公司;NaCl 四川西陇化工有限公司;酵母提取物和胰蛋白酶 英国Oxoid公司;溴化乙锭(100mg) 广州宝泰克生物科技有限公司;琼脂糖 西班牙Biowest公司;胶回收试剂盒 天跟生化科技有限公司。
DYY-8C型电泳仪 北京市六一仪器厂;凝胶紫外成像系统 美国Syngene公司;PCR扩增仪、台式高速离心机和微量移液器 德国Eppendorf 公司;ZHWY-100B塑壳经典型小容量恒温培养振荡器 上海智城分析仪器制造有限公司;超净工作台 苏州净化设备有限公司。
1.2 方法
1.2.1 蛋壳膜的采集及前增菌
参照2010年发布的GB 4789.4—2010《食品微生物学检验》中的沙门氏菌的检验方法,将所采集到的鸡蛋分别以碘酊和75%的酒精消毒,小心地去除蛋壳,将蛋壳膜用消毒镊子取下装入含BPW液的灭菌试管中,37℃培养增菌8h后将BPW液培养物接种到沙门氏菌的选择性增菌液SC中,37℃进行选择性增菌18~24h[7-9]。
1.2.2 沙门氏菌选择性培养
将SC增菌液中沙门氏菌阳性样本接种于选择性培养基XLD培养基和BS琼脂,37℃分别培养18~24h和40~48h。挑选疑似沙门氏菌的单个菌落划线接种于营养琼脂斜面37℃培养18~24h后4℃保存。使用时接种于MH肉汤培养18h。
1.2.3 沙门氏菌PCR鉴定
1.2.3.1 引物合成
根据GenBank中已发表的沙门氏菌菌属特异性invA基因的核苷酸序列[5],利用Primer 5.0软件,设计一对特异性引物,引物由南京金斯瑞生物科技有限公司合成,详见表1。
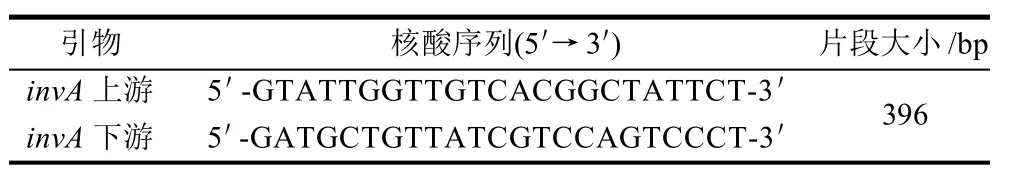
表1 沙门氏菌invA基因PCR引物序列Table 1 Primer sequences used in the PCR amplification for invA gene from Salmonella
1.2.3.2 PCR 反应体系与反应参数
PCR反应体系:2×PCR Master Mix(含有2×TaqDNA聚合酶、2×PCR Buffer和2×dNTP)10μ L,10pmol/μL上下游引物各0.5μL,ddH2O 10μL,模板为4μL MH肉汤培养的菌液,总体积为25μL。
PCR反应参数:为95℃预变性5min,94℃变性30s,Tm退火30s,72℃延伸45s,共进行30个循环;最后72℃延伸10min,4℃保存。反应结束后取5μL 用于检测,用1%琼脂糖凝胶电泳,在电压120V,电泳40min左右,以DNA Marker DL2000为参照用凝胶成像仪成像观察。
1.2.4 沙门氏菌毒力基因PCR检测
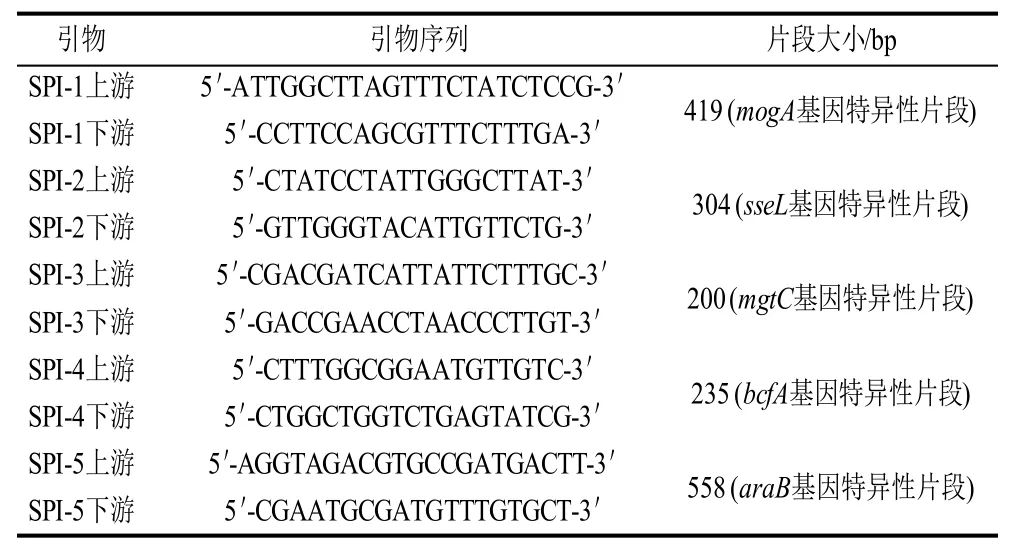
表2 沙门氏菌毒力岛核心蛋白基因PCR引物设计Table 2 Primer sequences used in the PCR amplification for Salmonella SPI genes
根据G e n B a n k中已发表的沙门氏菌毒力岛(Samonellapathogenicity island genes,SPI)核心蛋白基因[6],利用Primer 5.0软件,共设计5对特异性引物,分别检测沙门氏菌毒力岛核心蛋白基因SPI-1、SPI-2、SPI-3、SPI-4和SPI-5,反应体系与反应参数同1.2.3.2节,引物由南京金斯瑞生物科技有限公司合成,详见表2。
1.2.5 PCR产物的纯化及测序
将PCR扩增的invA基因阳性产物按照胶回收试剂盒说明书进行回收,并将回收产物送到南京金斯瑞生物科技有限公司测序。将测序结果与从 GenBank 获得的相应基因片段用DNAStar软件进行核苷酸序列对比分析。
1.2.6 动物致病性实验
将93只1日龄SPF健康雏鸡随机分成31组,每组3只,在隔离器中饲养,观察5d确定健康后用于实验。1~30组为试验组,每组分别接种一株菌液,每只皮下接种沙门氏菌肉汤培养物0.2mL(含菌量约2.0×107CFU);第31组为对照组,每只皮下接种灭菌生理盐水0.2mL。感染后每日观察4次,连续观察10d,记录发病及死亡情况。
2 结果与分析
2.1 沙门氏菌的分离及invA基因鉴定
通过对蛋壳膜的前增菌及选择性培养,从1100枚鲜鸡蛋样本中分离出疑似沙门氏菌45株。经PCR检测,在45株疑似沙门氏菌中有30株扩增出396bp大小的沙门氏菌invA基因特异性条带,与设计相吻合,测序结果表明,30株沙门氏菌分离株invA基因序列与GenBank获得的相应基因核苷酸序列的同源性在98.2%~99.8%之间。结果见图1。
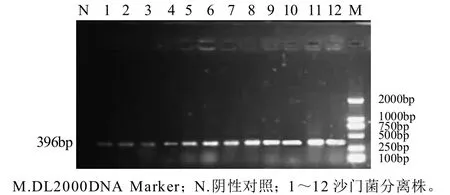
图1 invA基因的PCR检测结果Fig.1 PCR detection results of invA gene
2.2 沙门氏菌毒力岛核心蛋白基因PCR检测
对30个沙门氏菌分离株进行了5种毒力岛核心蛋白基因检测,结果检出SPI-3阳性菌株30株,检出率为100%;SPI-1阳性菌株18株,检出率为60%;SPI-2阳性菌株22株,检出率为73.3%;SPI-4阳性菌株27株,检出率为90%;SPI-5阳性菌株23株,检出率76.7%。结果见图2。
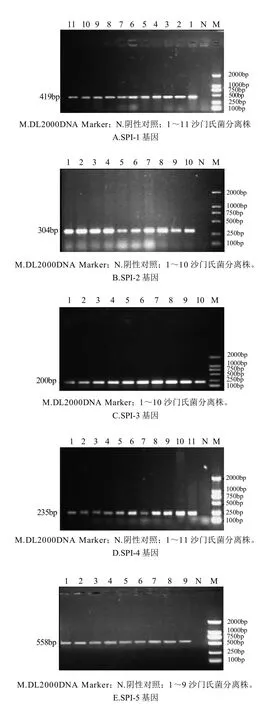
图2 各基因的PCR检测结果Fig.2 PCR detection results of 5 SPI genes
2.3 动物致病性实验
雏鸡致病性实验结果显示,30个沙门氏菌分离株中有7株为强致病性菌株,72h内能导致3只实验雏鸡全部死亡,剖检有沙门氏菌病的主要病理变化;6株为中等致病性菌株,72h内能导致1~2只实验雏鸡死亡,并有沙门氏菌病的主要病理变化;17株无致病性,72h内不能导致雏鸡死亡。沙门氏菌分离株的致病性与毒力岛基因携带情况的关系见表3。
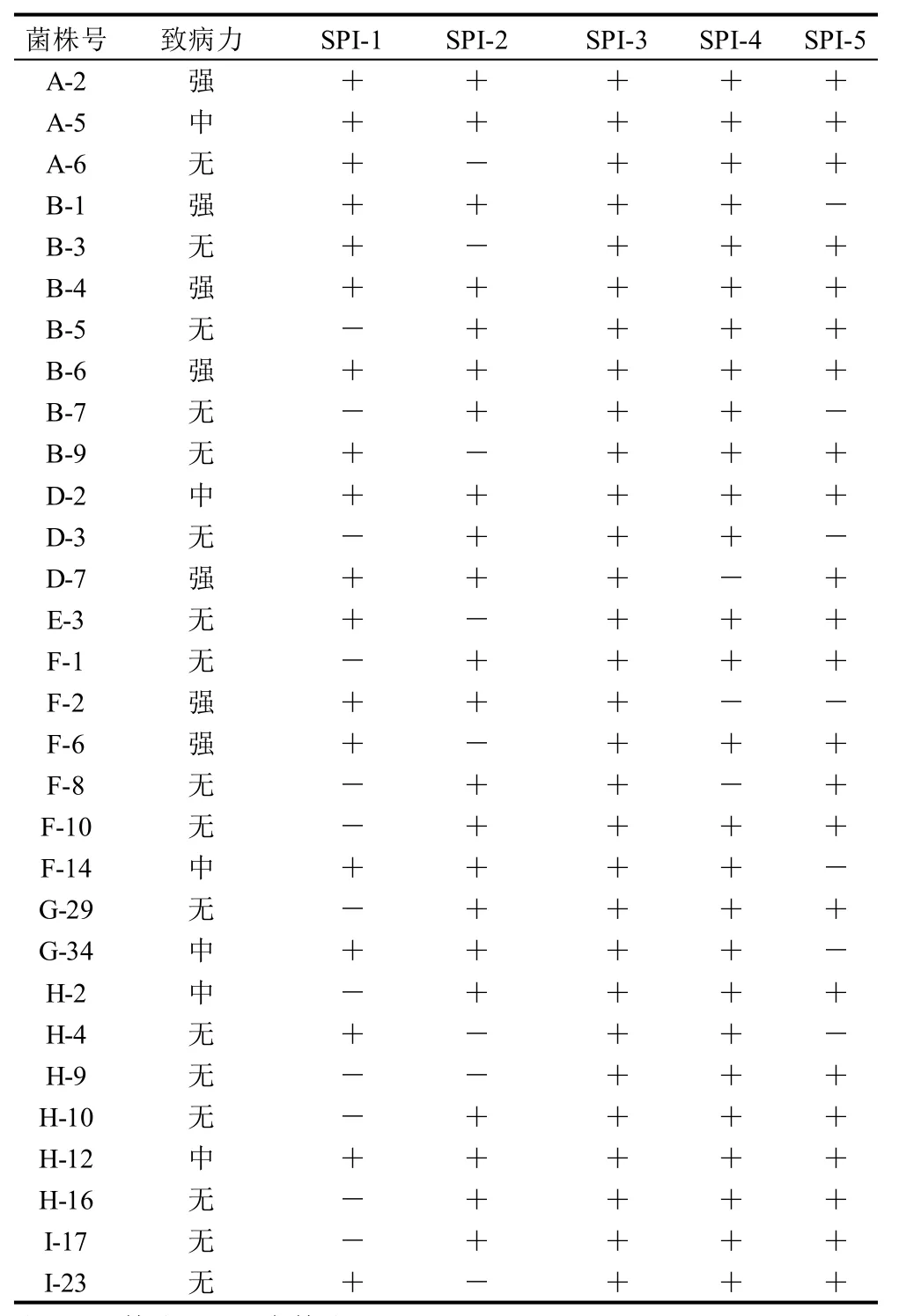
表3 30个沙门氏菌分离株的致病性与5个毒力岛核心蛋白基因的相关性Table 3 Correlation between 5 SPI genes and pathogenesis of 30 Salmonella strain isolates
2.4 沙门氏菌毒力岛基因的携带与致病性相关性分析
表3显示,30个沙门氏菌分离株中,SPI-1+SPI-2+SPI-3+SPI-4+SPI-5毒力基因组合检出的有6株,均有一定的致病力,其中强致病性3株,中等致病性3株;SPI-1+SPI-2毒力基因组合检出有11株,均有一定的致病力,其中强致病性6株,中等致病性5株;携带SPI-1及SPI-2毒力基因中的一种的有18株,其中16株无致病性,1株为强致病性,1株为中等致病性;毒力基因SPI-4+SPI-5组合检出的有21株,其中强致病性4株,中等致病性4株,13株无致病性;携带SPI-4及SPI-5毒力基因中的一种的有8株,其中2株无致病性,2株为强致病性,4株为中等致病性;毒力基因SPI-4+SPI-1组合检出的有16株,其中强致病性5株,中等致病性5株,6株无致病性;毒力基因SPI-1及SPI-5组合检测出的有13株,其中5株无致病性,5株为强致病性,3株为中等致病性;毒力基因SPI-2及SPI-4组合检测出的有19株,其中9株无致病性,4株为强致病性,6株为中等致病性;毒力基因SPI-2及SPI-5组合检测出的有15株,其中7株无致病性,4株为强致病性,4株为中等致病性。结果表明,毒力基因SPI-1+SPI-2组合和SPI-1+SPI-2+SPI-3+SPI-4+SPI-5毒力基因组合与沙门氏菌致病力有显着的相关性,而且携带SPI-1菌株的致病性略高于携带SPI-2的菌株,但SPI-1与SPI-2的中的哪一种的携带对菌株致病性的影响较大,还有待进一步的研究,而SPI-4、SPI-5毒力岛基因的携带与菌株的致病性并无显着相关性。
3 讨 论
世界范围内的细菌性食物中毒事件中,沙门氏菌是一种主要的病原菌。在美国,1985—1999年中371例已知的沙门氏菌源性食品中毒事件中,有80%与鸡蛋有关[10],2010年,美国2000多人因食用被沙门氏菌污染的鸡蛋发生食物中毒后回收超过5.5亿枚鸡蛋,损失惨重[4],欧盟发布的2008年人畜共患疾病和食源性疾病报告中食源性沙门氏菌感染的病例为131468例,在我国,细菌性食物中毒中有70%~80%是由沙门氏菌引起的,而引起沙门氏菌中毒的食品主要是蛋及蛋制品,约占90%[11], 2011年卫生部办公厅关于第2季度全国食物中毒事件情况的通报中,微生物引起的食物中毒达1744例,其中最主要的致病性微生物即为沙门氏菌等[12]。本实验从1100枚市售鲜鸡蛋的蛋壳膜中分离鉴定出沙门氏菌30株,分离率达2.73%。这与王硕[13]、Askari[14]等的研究结果相近,比Chao[9]、韩磊[15]等的检出率低。检测结果表明我国商品鸡蛋中存在一定程度的沙门氏菌污染,生食鸡蛋有感染沙门氏菌的风险。
沙门氏菌对宿主的致病性与细菌的毒力岛基因有关,目前已经发现的沙门氏菌毒力岛基因有10余个,其中SPI-1 编码与侵袭力有关的Ⅲ型分泌系统,SPI-2编码与系统感染有关的Ⅲ型分泌系统,SPI-3与沙门氏菌在巨噬细胞内存活有关;SPI-4编码开放阅读框架,与Ⅱ型分泌系统和沙门氏菌巨噬细胞内存活有关;SPI-5编码pipA、pipB、pipC、pipD等基因[16-17],本研究对30个沙门氏菌分离株中的上述5个主要毒力岛核心蛋白基因进行检测的结果与田质高[6]的研究结果有差异,其中SPI-3的检出率相同,而SPI-1、SPI-2和SPI-5检出率略低,SPI-4基因检出率略高,这可能与采集的样品及当地流行沙门氏菌血清型的不同有关。
在沙门氏菌鉴定方法中,PCR技术比起传统生化鉴定具有简便快速、敏感性高、特异性强等优点[5,18],依据沙门氏菌种属特异性的invA基因设计引物,本研究从45株疑似沙门氏菌中PCR检测鉴定出30株沙门氏菌,证明了PCR方法检测的高效和实用性,该方法可用于动物性食品中沙门氏菌的卫生监督和检测检验。
我国商品鸡蛋虽然存在一定程度的沙门氏菌污染,但沙门氏菌对热较敏感,65℃加热15min或100℃加热数分钟即可被杀死。我国传统的鲜蛋及蛋制品烹饪方式大多为煎煮,该过程中持续的高温可杀死沙门氏菌,确保蛋及蛋制品的食用安全。
[1] 陈飞, 成大荣, 田志高, 等. 鸡蛋中沙门氏菌的快速检测[J]. 江苏农业科学, 2009(5): 284-285.
[2] AHIER C. Genetic and environmental control ofSalmonellainvasion[J]. Micmbiol, 2005, 43: 85-92.
[3] FOLEY S L, LYNNE A M. Food annimal-associatedSalmonellachallenges[J]. J Anim Sci, 2008, 86(Suppl14): 173-187.
[4] SHANE S. The US egg industry and theSalmonellarecall[J]. Poultry International, 2011(2): 22-24.
[5] 吕世明, 陈杖榴, 陈建新, 等. 应用PCR快速检测食品中沙门氏杆菌方法的研究[J]. 食品科学, 2006, 27(12): 607-610.
[6] 田质高. 蛋源沙门氏菌毒力岛的检测及标志基因的研究[D]. 扬州: 扬州大学, 2009: 28-30.
[7] COX N A, BERRANG M E, CASON J A.Salmonellapenetration of egg shells and proliferation in broiler hatching eggs: a review[J]. Poult Sci, 2000, 79(11):1571-1574.
[8] WIGLEY P, Jr. BERCHIERI A PAGE K L, et al.Salmonella entericaserovarPullorumpersist in splenic macrophages and in the reproductive tract during persistent, disease free carriage in chickens[J]. Infect Immun,2001, 69(12): 7873-7879.
[9] CHAO M R, HSIEN C H, YEH C M, et al. Assessing the prevalence ofSalmonella entericain poultry hatcheriesby using hatched eggshell membranes[J]. Poult Sci, 2007, 86(8): 1651-1655.
[10] PATRICK M E, ADCOCK P M, GOMEZ T M, et al.Salmonella enteritidisinfections, United States, 1985-1999[J]. Emerg Infect Dis,2004, 10(1): 1-7.
[11] 吴斌, 秦成, 石智, 等. 畜产品中沙门氏菌的风险评估[J]. 大连轻工业学院学报, 2004, 23(3): 226-228.
[12] 卫生部. 卫生部办公厅关于2011年第二季度全国食物中毒事件情况的通报[EB/OL]. (2011-07-18) [2011-09-07]. http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsyjbgs/s3586/201107/52406.htm.
[13] 王硕, 赵金龙, 刘昕煜, 等. 肉蛋类食品沙门氏菌分离与菌膜检测[J].食品研究与开发, 2010,12(1): 136-139.
[14] ASKARI B M, MOHAMMADIAN G B, MADADGAR O. Study onSalmonellacontamination of traditionally produced edible poultry eggs[J]. Com Clin Pathol, 2011, DOI: 10.1007/s00580-011-1238-z.
[15] 韩磊, 赵从凯, 王洪波, 等. 自由市场鲜鸡蛋黄中沙门氏菌的检测[J].畜禽检疫, 2010(10): 50-51.
[16] GERLACH R G, CLFIUDIO N, ROHDE M, et a1.Cooperation ofSalmonellapathogenicity islands l and 4 is required to breach epithelial barriers[J]. Cell Microbiol, 2008, 10(11): 2364-2376.
[17] 王效义. 沙门氏菌毒力岛及其Ⅲ型分泌系统[J]. 生物技术通讯, 2004,15(2): 160-162.
[18] QASEM J, AL-MOUQATI S, RAJKUMAR G. Comparison of DNA probe, PCR amplification, ELISA and culture methods for the rapid detection ofSalmonellain poultry[M]//HARINDER P S M, GERRIT J V. Applications of gene-based technologies for improving animal production and health in developing countries. Berlin, Germany: Springer Verlag, 2005: 529-541.
Isolation, Identification and Pathogenicity Island Gene Detection ofSalmonellain Commercial Eggs
WANG Jing-yu,DONG Rui,WANG Li-qin,RUI Xian,CHEN Ting,LI Cheng-shan,ZHANG San-dong,ZHANG Yan-ming,GUO Kang-kang
(College of Veterinary Medicine, Northwest A & F University, Yangling 712100, China)
Objective: To monitor theSalmonellacontamination status of commercial eggs, detect the pathogenesis and pathogenicity island (SPI) gene ofSalmonellaisolates and their correlation. Methods: Commercial eggs were collected from supermarkets in different cities in Shaanxi province. The eggshell membranes were harvested for isolating and culturingSalmonellain eggs. The strain isolates were identified through the PCR amplification of the special gene invA fromSalmonella. The isolated strains were used for testing the pathogenesis for chicken. According to the sequence of SPI genes published in GenBank, PCR primers were designed to amplify and identify the SPI genes of core proteins. Results: A total of 30Salmonellastrains were isolated from 1100 commercial eggs that were purchased from 55 supermarkets. According to animal pathogenesis tests, 13 strains were pathogenic and 7 strains were strongly pathogenic among theseSalmonellastrains. The carrying rate of SPI gene was 60% for SPI-1, 73.3% for SPI-2, 100% for SPI-3, 90% for SPI-4 and 76.7% for SPI-5. Meanwhile, SPI-1 and SPI-2 revealed an obvious correlation with pathogenesis. Conclusion: The isolation rate ofSalmonellafrom commercial eggs observed in this study is 2.73%.SPI-1 and SPI-2 have a positive correlation with pathogenesis.
Salmonella;invAgene;pathogenesis;SPI;egg;eggshell membrane
S851.347
A
1002-6630(2012)16-0154-05
2011-07-26
国家公益性行业(农业)科研专项(200903055)
王晶钰(1964—),男,副教授,博士,主要从事兽医公共卫生学研究。E-mail:wjingyu2004@126.com



