廖芙蓉,阚建全*
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716)
籽粒苋(Amaranthus sp.)是一种苋科(Amaranthceae)、苋属(Amaranthus)草本植物,属一年生,原产于中美洲和东南亚的热带与亚热带地区。籽粒苋具有优良的特性,已在我国绝大多数地区试种成功,主要包括Amaranthus hypochondriacus, A. cruentus和A. caudatus等品种[1-2]。籽粒苋中的蛋白质,膳食纤维,不饱和脂肪酸和矿质元素的含量均不同程度的高于其他谷物,氨基酸组成较为理想,含量最丰富的淀粉也具有优良的品质[3-7]。此外,研究者还发现籽粒苋具有抗氧化、降血糖、降血脂等生理功能[8-13]。值得注意的是,籽粒苋还是一种天然色素的良好来源。目前,对籽粒苋色素的研究还局限于提取方面[14-15],且仍旧不足,关于籽粒苋花穗色素稳定性的研究尚未见报道。本实验对籽粒苋花穗色素的稳定性进行研究,以期为籽粒苋色素的开发和利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
籽粒苋花穗,采自重庆北碚区静观镇,籽粒苋品种为K112(Amaranthus cruentus L.)。将采摘下的籽粒苋花穗与籽实分离,除去茎叶及昆虫等杂质,然后将花穗放入鼓风干燥箱中在40~50℃条件下干燥并粉碎,将处理好的样品置于阴凉通风处备用。
乙醇、过氧化氢、亚硫酸钠等均为分析纯。
1.2 仪器与设备
DHG-9240型电热鼓风干燥箱 上海一恒科学仪器有限公司;JA2003型分析天平 上海精科天平厂; KQ3200DB数控超声波清洗器 昆山市超声仪器有限公司;UV-2450紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 籽粒苋花穗色素原液的制备
称取一定质量的籽粒苋花穗样品,以10%的乙醇为提取溶剂,在料液比1:50、提取温度40℃、超声波功率150W、提取时间60min的条件下对样品进行色素提取并过滤;滤渣按照与样品相同的方法重复一次色素提取;将两次提取得到的滤液合并即得籽粒苋花穗色素原液,将样品倒入棕色玻璃瓶中冷藏备用。
1.3.2 籽粒苋花穗色素的光谱特征取一定量色素原液,以10%的乙醇溶液进行适当稀释,以蒸馏水为空白对照,用紫外-可见分光光度计在400~700nm波长范围内进行扫描,确定籽粒苋花穗色素在可见光区的最大吸收波长。
1.3.3 籽粒苋花穗色素的稳定性
以籽粒苋花穗色素在可见光区的特征吸收峰波长处的吸光度为指标,研究不同条件对籽粒苋花穗色素稳定性的影响。取一定量的籽粒苋花穗色素原液,适当稀释后测定其吸光度,将稀释后的色素液等量分装到带塞试管中备用,每组实验均重复3次。
1.3.3.1 温度对籽粒苋花穗色素稳定性的影响
将装有样品稀释液的试管分别置于不同温度的恒温水浴锅中保温,定时取样使之快速冷却至室温并测定其吸光度。
1.3.3.2 光对籽粒苋花穗色素稳定性的影响
将装有样品稀释液的试管分别放置于自然光,室温避光和冰箱等条件下保存,每24h取样测定其吸光度,连续观察1周。
1.3.3.3 pH值对籽粒苋花穗色素稳定性的影响[16]
取12支装有样品稀释液的试管,其中一支作空白对照不进行pH值的调整,用1mol/L HCl和1mol/L NaOH溶液将其余各样品调至不同的pH值,测定各pH值条件下样品在可见光区的最大吸收波长和吸光度,观察并记录相应的颜色变化。
1.3.3.4 氧化剂对籽粒苋花穗色素稳定性的影响
选取H2O2作氧化剂,在装有样品稀释液的试管中加入一定量的H2O2,使色素液中H2O2的体积分数分别为0、0.05%、0.5%、1%、2%,测定各样品的吸光度。
1.3.3.5 还原剂对籽粒苋花穗色素稳定性的影响
选取Na2SO3和VC作还原剂,在装有样品稀释液的试管中分别加入一定量的Na2SO3和VC,使色素液中Na2SO3和VC的质量分数分别为0、0.01%、0.02%、0.03%、0.04%,测定各样品的吸光度。
1.3.3.6 有机酸对籽粒苋花穗色素稳定性的影响
在装有样品稀释液的试管中分别加入一定量的柠檬酸、草酸、乙酸、乳酸和酒石酸,使色素液中各种有机酸的质量分数分别为0、0.05%、0.1%、0.5%、1%,测定各样品的吸光度。
1.3.3.7 糖类对籽粒苋花穗色素稳定性的影响
在装有样品稀释液的试管中分别加入一定量的葡萄糖、木糖和甘露糖,使色素液中甘露糖的质量分数分别为0、5%、10%、15%、18%(甘露糖的溶解度为18%),葡萄糖和木糖的质量分数分别为0、5%、10%、15%、20%,测定各样品的吸光度。
1.3.3.8 防腐剂对籽粒苋花穗色素稳定性的影响
在装有样品稀释液的试管中分别加入一定量的苯甲酸钠和山梨酸钾,使色素液中防腐剂的质量分数分别为0、0.02%、0.06%、0.1%、0.2%,测定各样品的吸光度。
1.3.3.9 金属离子对籽粒苋花穗色素稳定性的影响
在装有样品稀释液的试管中分别加入一定量的Al3+、Na+、K+、Mg2+、Ca2+、Zn2+、Fe2+、Fe3+等离子的溶液,使色素液中各种金属离子的浓度分别为0、0.005、0.01、0.05、0.1mol/L,测定各样品的吸光度并观察记录实验现象。
2 结果与分析
2.1 籽粒苋花穗色素的光谱特征

图 1 籽粒苋花穗色素10%乙醇溶液的紫外-可见吸收光谱图Fig.1 Absorption spectrum of the pigment from grain amaranth fl ower spikes
图1为籽粒苋花穗色素10%乙醇溶液的紫外-可见吸收光谱扫描图谱,可以看出,其在可见光区的最大吸收波长为534nm。
2.2 籽粒苋花穗色素的稳定性
2.2.1 温度对籽粒苋花穗色素稳定性的影响

图 2 温度对籽粒苋花穗色素稳定性的影响Fig.2 Effect of temperature on the stability of the pigment from grain amaranth fl ower spikes
由图2可知,温度对籽粒苋花穗色素的影响较大。当温度低于50℃时,吸光度下降的较为缓慢,色素溶液稳定性维持较好;随着温度的升高,色素溶液的稳定性逐渐变差,当温度为80℃时,色素溶解的吸光度在2h内从0.852下降至0.084,色素被严重破坏,呈现出浅黄色。可见,籽粒苋花穗色素对温度较敏感,在加工过程中应避免高温。
2.2.2 光对籽粒苋花穗色素稳定性的影响
由图3可知,比较室温避光和自然光两种条件的实验结果可知,一周之后两者的吸光度均从高于0.8的水平下降到了0.3以下,其中室温避光条件下的吸光度水平比自然光条件下略高,可见光能够对籽粒苋花穗色素造成一定的破坏;冰箱同时提供了黑暗和低温的环境,一周过后其吸光度仍维持在0.8以上。
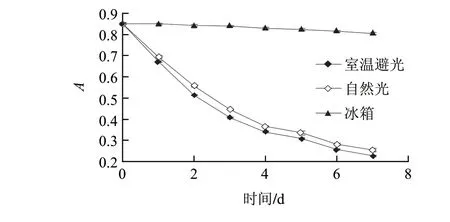
图 3 光对籽粒苋花穗色素稳定性的影响Fig.3 Effect of light on the stability of the pigment from grain amaranth fl ower spikes
2.2.3 pH值对籽粒苋花穗色素稳定性的影响
调节籽粒苋花穗色素溶液的至不同的pH值,其中空白组不进行pH值调节,测定不同pH值条件下籽粒苋花穗色素在可见光区的最大吸收波长,并观察其颜色变化,结果见表1。

表 1 pH值对籽粒苋花穗色素稳定性的影响Table 1 Effect of pH on the stability of the pigment from grain amaranth flower spikes
从表1可见,当pH1~9时,最大吸收波长在534nm左右,而当pH值大于9时,最大吸收波长产生了红移;在pH 4~9范围内,吸光度均与空白样品接近,在其余pH值条件下吸光度都较为明显的低于空白样品;pH3~8范围,色素能够维持红色,其余pH值条件会使色素变色。由此可见,籽粒苋花穗色素在pH4~8范围较为稳定。
2.2.4 氧化剂对籽粒苋花穗色素稳定性的影响

图 4 H2O2体积分数对籽粒苋花穗色素稳定性的影响Fig.4 Effect of H2O2 on the stability of the pigment from grain amaranth fl ower spikes
由图4可知,当籽粒苋花穗色素中H2O2体积分数分别为0.05%、0.5%、1%、2%时,起初吸光度与未添加H2O2的样品没有大的差距,色素基本未受影响;经过较长时间的观察发现,在一定范围内,H2O2体积分数越高,存放时间越长,吸光度呈现越明显的下降趋势,色素的受破坏程度越大。
2.2.5 还原剂对籽粒苋花穗色素稳定性的影响
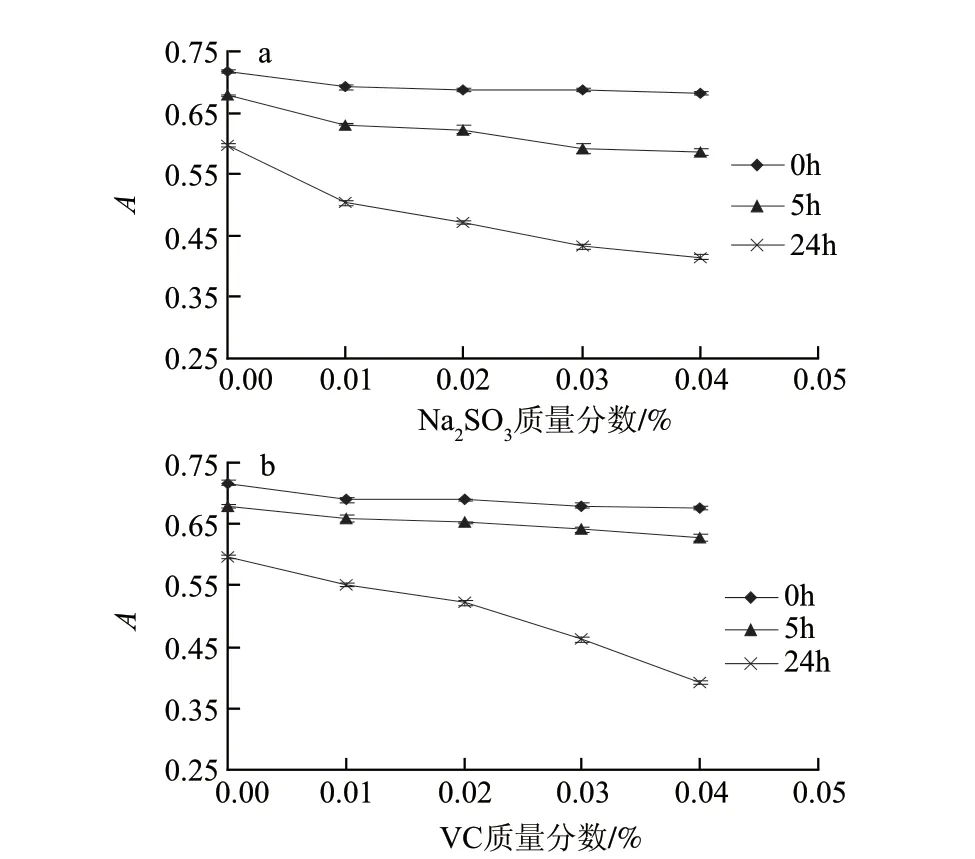
图 5 Na2SO3(a)和VC(b)对籽粒苋花穗色素稳定性的影响Fig.5 Effect of Na2SO3(a) vitamin C(b) on the stability of the pigment from grain amaranth fl ower spikes
由图5可知,加入质量分数低于0.04%的Na2SO3和VC时,起初吸光度降幅微小,可以认为对籽粒苋花穗色素几乎没有影响;随着存放时间的延长,可以发现,在一定范围内,还原剂质量分数越大,吸光度越小,色素被破坏程度越大;从24h后的吸光度曲线可以看出,当Na2SO3质量分数达到0.04%时,吸光度的下降趋势趋于平缓,VC质量分数大于0.02%时,吸光度就开始显着下降。
2.2.6 有机酸对籽粒苋花穗色素稳定性的影响
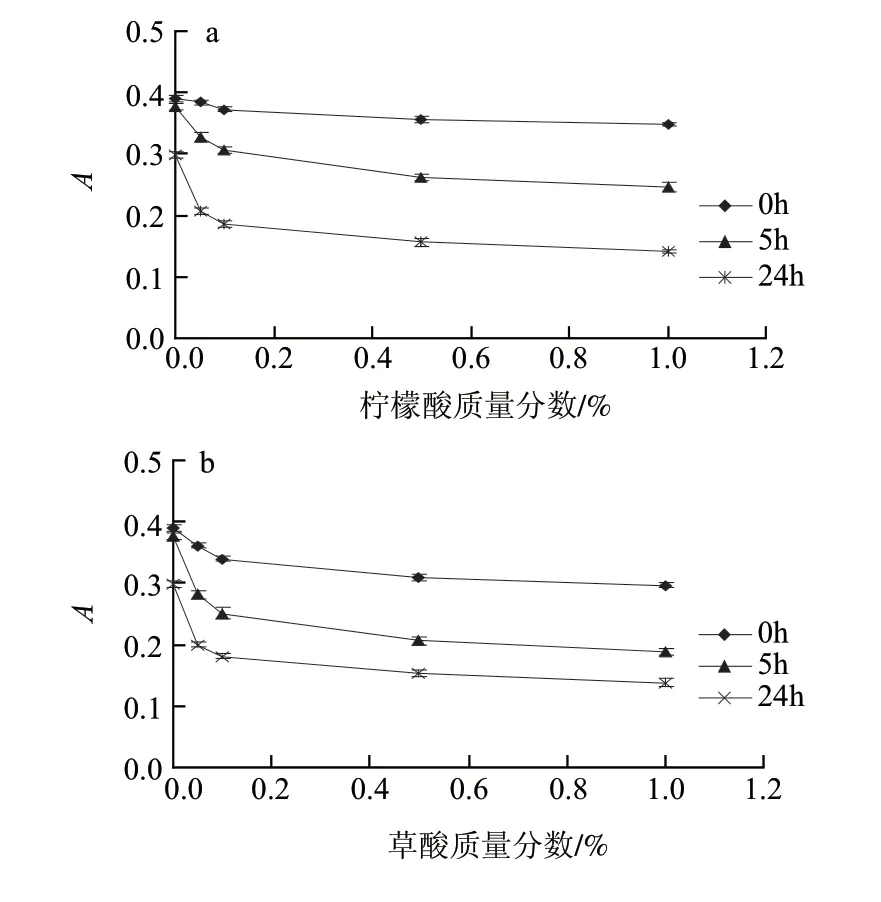
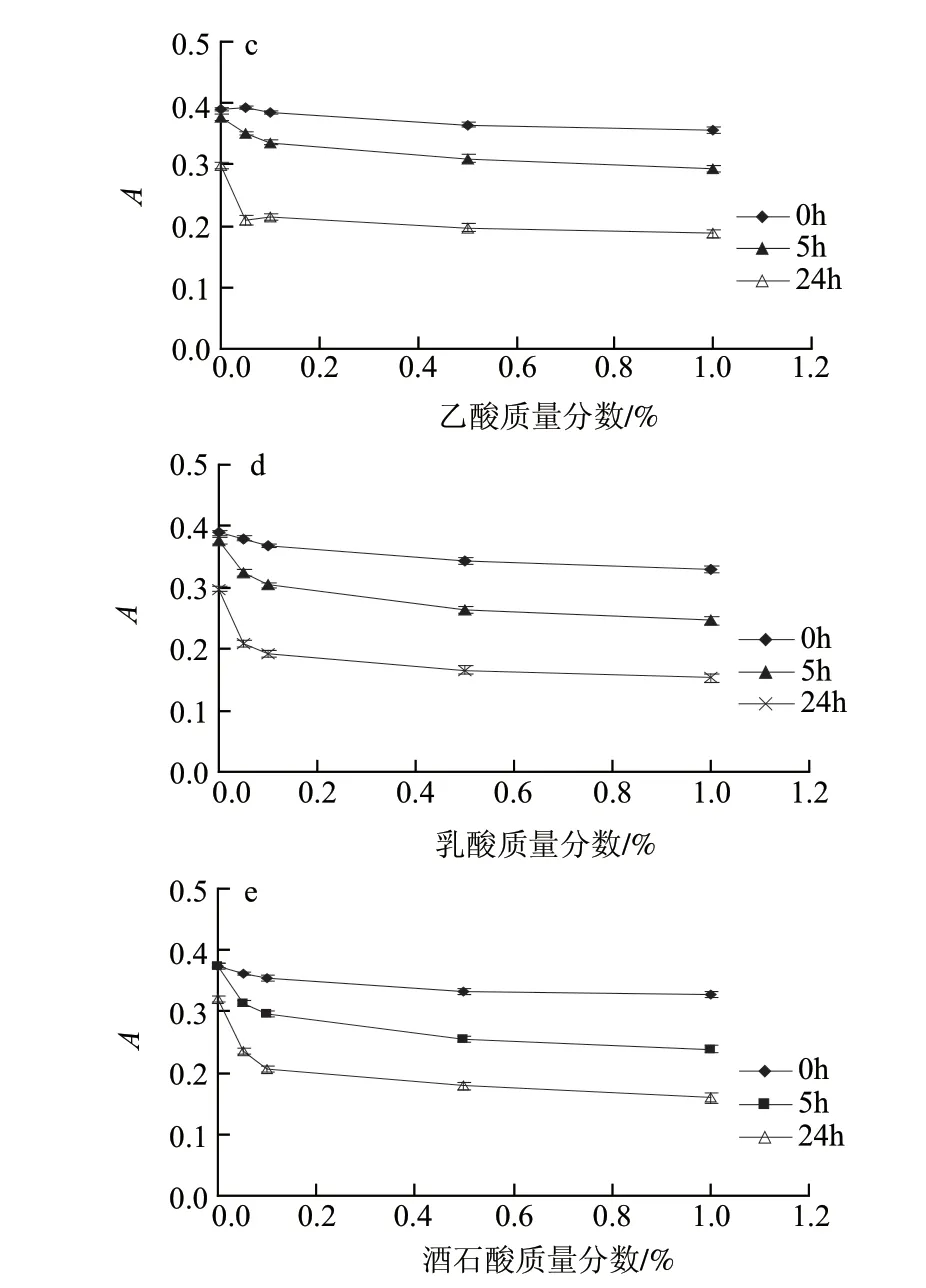
图 6 柠檬酸(a)、草酸(b)、乙酸(c)、乳酸(d)和酒石酸(e)对籽粒苋花穗色素稳定性的影响Fig.6 Effect of citric acid(a), oxalic acid(b), acetic acid(c), lactic acid(d) and tartaric acid(e) on the stability of the pigment from grain amaranth fl ower spikes
由图6可知,当加入的有机酸质量分数在0.1%以下时,吸光度多呈现较为明显的下降趋势,5h和24h后,实验组的吸光度更显着的低于空白组;当有机酸质量分数大于0.1%时,其使吸光度减小的趋势变的相对平缓,可见,有机酸对色素稳定性的影响并未随着有机酸质量分数的继续增大而增大。
2.2.7 糖类对籽粒苋花穗色素稳定性的影响
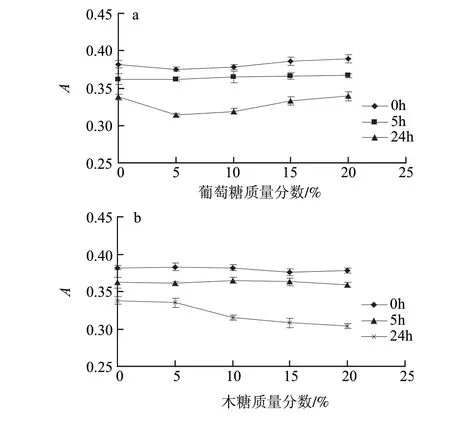

图 7 葡萄糖(a)、木糖(b)、甘露糖(c)对籽粒苋花穗色素稳定性的影响Fig.7 Effect of glucose(a), xylose(b) and mannose(c) on the stability of the pigment from grain amaranth fl ower spikes
由图7可知,当加入不同质量分数的葡萄糖、木糖和甘露糖后,吸光度有所增加,加入的葡萄糖和甘露糖质量分数大于10%时,吸光度增大较显着,而当木糖质量分数大于10%,吸光度比更低质量分数时有所下降;5h后,各种不同质量分数糖的添加仍能将吸光度值维持在与空白样品相当的水平;而24h后,各添加量木糖和甘露糖条件下的吸光度均低于空白样,葡萄糖质量分数为15%和20%时的吸光度与空白样的吸光度接近。可见,糖类能够起到一定的增色、护色的效果,其中以葡萄糖的效果较为明显,有利于维持籽粒苋花穗色素的稳定性。
2.2.8 防腐剂对籽粒苋花穗色素稳定性的影响

图 8 苯甲酸钠(a)、山梨酸钾(b)对籽粒苋花穗色素稳定性的影响Fig.8 Effect of sodium benzoate(a) and potassium sorbate(b) on the stability of the pigment from grain amaranth fl ower spikes
由图8可知,5h内,质量分数小于0.2%的防腐剂对籽粒苋花穗色素基本没有影响;24h后,质量分数大于0.06%的苯甲酸钠对色素有明显的破坏作用,山梨酸钾质量分数大于0.02%时可对色素产生较明显的破坏;看来,防腐剂质量分数越高,存放时间越长,色素被破坏程度越严重。
2.2.9 金属离子对籽粒苋花穗色素稳定性的影响
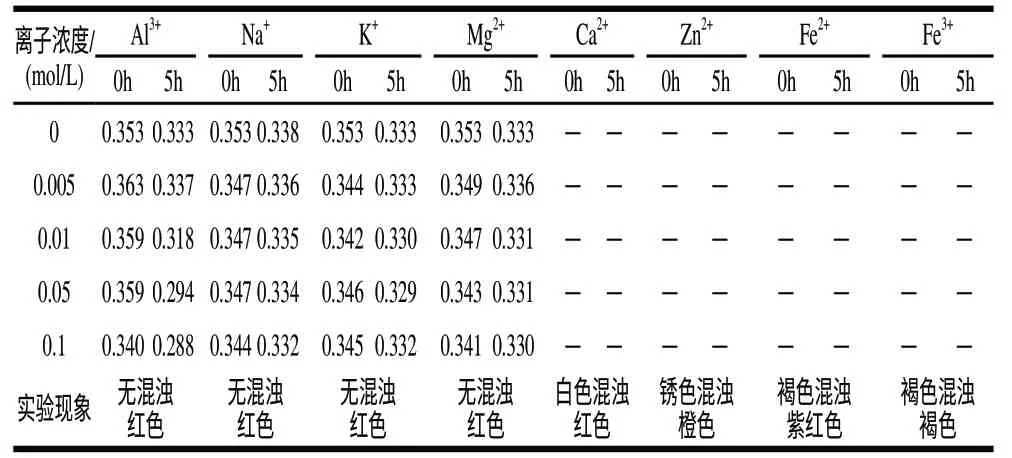
表 2 金属离子对籽粒苋花穗色素稳定性的影响Table 2 Effect of metal ions on the stability of the pigment from grain amaranth fl ower spikes
由表2可知,Ca2+、Zn2+、Fe2+、Fe3+等金属离子可严重破坏籽粒苋花穗色素,使之产生混浊甚至改变本色;Al3+、Na+、K+、Mg2+等对籽粒苋花穗色素的影响相对较小,它们的存在不会使色素产生浑浊和变色等不良变化,低浓度的Al3+和Mg2+有一定的增色作用,Na+和K+的存在使得色素的吸光度产生了小幅度的降低,随着浓度的增大,这种影响并没有表现的更为明显。
3 结 论
综合以上实验结果发现,籽粒苋花穗色素热稳定性较差,适合应用于低温食品;在pH4~8范围内稳定,在应用的过程中应避免酸碱性条件;Ca2+、Zn2+、Fe2+、Fe3+等可使色素混浊变色,在生产利用时应防止与可能存在这些金属离子的设备接触;Na+、K+和低浓度的氧化还原剂和防腐剂不会对色素的稳定性造成大的影响;某些糖类,Al3+、Mg2+在一定条件下能对籽粒苋花穗色素起到护色和增色作用。
[1] 岳绍先, 孙鸿良. 籽粒苋在中国的研究与开发[M]. 北京: 农业科技出版社, 1993.
[2] BAVEC F, MLAKAR S G. Effects of soil and climatic conditions on emergence of grain amaranths[J]. European Journal of Agronomy, 2002, 17(2): 93-103.
[3] OJO D O. Effect of weeding frequencies on grain amaranth (Amaranthus cruentus L.) growth and yield[J]. Crop Protection, 1997, 16(5): 463-466.
[4] GIMPLINGER D M, ERLEY G S, DOBOS G, et al. Optimum crop densities for potential yield and harvestable yield of grain amaranth are conflicting[J]. Europ JAgronomy, 2008, 28(2): 119-125.
[5] SILVIA V R, ARMANDO G R, CLAUDIA M V, et al. Cloning of a cDNA encoding a cystatin from grain amaranth (Amaranthus hypochondriacus) showing a tissue-specific expression that is modified by germination and abiotic stress[J]. Plant Physiology and Biochemistry, 2007, 45(10/11): 790-798.
[6] RAVINDRAN V, HOOD R L, GILL R J, et al. Nutritional evaluation of grain amaranth(Amaranthus hypochondriacus) in broiler diets[J]. Animal Feed Science Technology, 1996, 63(1/4): 323-331.
[7] XU Fangxiu, SUN Mei. Comparative analysis of phylogenetic relationships of grain Amaranths and their wild relatives (Amaranthus; Amaranthacea)using internal transcribed spacer, amplified fragment length polymorphism, and double-primer fluorescent intersimple sequence repeat markers[J]. Molecular Phylogenetics and Evolution, 2001, 21(3): 372-387.
[8] ROBERT Y N, HIROE K, YOTARO K. Antioxidant activity of various extracts and fractions of Chenopodium quinoa and Amaranthus spp. seeds[J]. Food Chemistry, 2008,106(2): 760-766.
[9] 刘世凯, 李楠, 匙丹丹. 籽粒苋籽多酚的提取及其抗氧化性的研究[J]. 中国酿造, 2010(9): 80-82.
[10] PAWEL P, HENRYK B, PAWEL Z, et al. Anthocyanins, total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J]. Food Chemistry, 2009, 115(3): 994-998.
[11] ANDREA C, GUERRA M, JOSE A G A. Glycemic and insulinemic responses in women consuming extruded amaranth (Amaranthus cruentus L.)[J]. Nutrition Research, 2005, 25(9): 815-822.
[12] 曾汉庭, 王俊, 陈明利, 等. 籽粒苋降糖保健食品生产技术研究[J]. 农产品加工: 创新版, 2009, 182(8): 30-32.
[13] 董文彦, 刘德富, 张东平, 等. 籽粒苋食品降血脂作用的实验研究[J]. 食品科学, 1996, 17(5): 40-43.
[14] 童哲, 梁伯璠. 光对尾穗苋幼苗内苋红素合成的诱导[J]. 植物生理学报, 1989, 15(1): 1-5.
[15] 梁伯. 细胞分裂素生物测试法评述[J]. 河北大学学报, 1997, 17(4): 93-96.
[16] 杨晓玲, 郭金耀, 黄玲. 五色彩叶草叶片色素的稳定性及抑菌性研究[J]. 食品科学, 2009, 30(19): 35-39.



