仇小妹,王 英,董明盛,周剑忠,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
优良降酸酵母菌的筛选及发酵性能
仇小妹1,2,王 英1,董明盛2,周剑忠1,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
以能够降解L-苹果酸的酿酒酵母FM-cs-08为出发菌株,分别进行紫外诱变和60Co诱变,旨在诱变得到降酸能力显着提高又具有良好发酵性能的酿酒酵母菌。最终筛选得到诱变菌株FM-cs-08-2U,降L-苹果酸比率达到(29.48±0.21)%,比出发菌株提高了(25.44±0.89)%。对诱变菌株FM-cs-08-2U的耐受性及发酵特性进行研究,结果表明该菌株耐受最低pH值为2.5,耐受最高SO2质量浓度为800 mg/L。用FM-cs-08-2U发酵蓝莓果酒,得到果酒残糖量(3.70±0.10)g/L,pH值为3.18±0.01,有机酸含量(8.64±0.02)g/L,酒精度(12.00±1.00)%,结果证明菌株FM-cs-08-2U适合酿造蓝莓果酒。
降酸酵母;诱变育种;发酵性能
L-苹果酸又名L-2-羟基丁二酸,主要存在于苹果、葡萄和不成熟的山楂等果实中[1]。苹果酸含量高会使葡萄酒有酸涩感,酒味粗硬,如何降解果酒中的苹果酸一直是果酒酿造中一个亟待解决的问题[2-3]。目前果酒的降酸方法主要有物理降酸法、化学降酸法和生物降酸法,但物理降酸法和化学降酸法对果酒的风味物质影响较大,使口感变差,降低果酒的营养价值,其弊端在生产上日益受到重视。要降低酒中苹果酸含量,宜采用生物降酸法[4]。
果酒生物降解苹果酸的途径主要有两个,其中苹果酸-乳酸发酵(malolactic fermentation,MLF)途径主要采用乳酸菌将葡萄酒中的苹果酸转化为乳酸,其特点是降酸时有选择性。迄今为止,国外生产的优质红葡萄酒甚至一些佐餐红葡萄酒大部分采用MLF降酸。而苹果酸-酒精发酵(malo-alcoholic fermentation,MAF)途径是通过裂殖酵母利用糖作底物生成酒精外,还能在厌氧条件下分解苹果酸,最终生成乙醇和CO2。裂殖酵母发酵能力较弱,且会产生不良气味[4-6]。
本研究以降L-苹果酸的酿酒酵母菌株FM-cs-08为出发菌,经过紫外诱变和60Co诱变得到降酸效果显着提高的诱变菌株FM-cs-08-2U,对其耐受性和发酵性能作初步探究,证明诱变菌株能降低果酒酸度的同时保持了良好的发酵能力。此研究为提高果酒品质提供参考,并丰富酿造果酒菌种资源。
1 材料与方法
1.1 材料与试剂
降酸酵母FM-cs-08 本实验室保藏[7];兔眼蓝莓(含水量(89.50±0.67)%,果实直径(1.34±0.08)cm,质量(0.98±0.03)g/个,-20 ℃冷藏) 江苏溧水蓝莓种植基地。
葡萄糖、柠檬酸、偏重亚硫酸钠、氯化钠、磷酸、磷酸二氢钾(均为分析纯) 广东汕头西陇化工股份有限公司;甲醇(色谱纯) 国药集团化学试剂有限公司;L-苹果酸(分析纯) 梯希爱(上海)化成工业发展有限公司;酚酞(分析纯)、蒽酮(分析纯) 上海浦口化学试剂有限公司。
1.2 仪器与设备
LRH-150生化培养箱 上海恒科技有限公司;THZ-C-1台式冷冻恒温震荡机 太仓市实验设备厂;SevenEasy plus pH仪 梅特勒-托利多仪器(上海)有限公司;TGL-16C 台式离心机 上海安亭科学仪器厂;超级水浴锅 常州国华电器有限公司;LC2030型高效液相色谱仪 北京安捷伦科技有限公司。
1.3 方法
1.3.1 FM-cs-08生长曲线测定
以2%接种量将活化的FM-cs-08菌株接种到20 mL PDA液体培养基中,150 r/min、28 ℃恒温培养。每隔3 h进行取样,测定OD600nm。
1.3.2 降酸酵母的诱变
将甘油保藏的菌株FM-cs-08转接到马铃薯葡萄糖琼脂(potato dextrose agar,PDA)液体培养基中,28 ℃、150 r/min摇床培养48 h。以2%接种量将菌液接种到20 mL的PDA溶液中,28 ℃、150 r/min摇床培养。每隔3 h测定菌液的OD600nm,以生理盐水做空白对照。取对数期菌液,8 000 r/min离心5~10 min获得菌体,用生理盐水洗涤两次,制成菌悬液,待诱变用。
紫外诱变:分别加入5 mL菌悬液于平板上,紫外灯打开预热30 min,然后在20 W紫外灯,距离20 cm,分别照射0、1、2、3、4、5 min;将照射后的菌液转移到空试管中,空试管需用铂纸裹住,0 ℃放置2 h;将照射0 min的对照菌液和经紫外照射的菌液稀释、涂布于固体PDA上,用黑布包起来,放置在28 ℃培养48 h,计数,计算致死率。
辐照诱变:在南京辐射中心进行辐照诱变。取适量孢子悬液,调整孢子浓度为107个/mL,辐照诱变剂量为0、200、400、600 Gy。经过60Co射线处理后的单孢子悬液稀释、涂布于固体PDA固体培养基上,以未经60Co诱变处理的菌悬液作为空白对照,于28 ℃培养箱中倒置培养48 h,计数,计算致死率。
1.3.3 降L-苹果酸菌株的筛选
样品预筛选及色谱条件选择:根据致死率挑取形态不同的菌落进行液体培养24 h,按4%接种量将孢子液接种到添加了4 g/L L-苹果酸的PDA培养基中,28 ℃、150 r/min,培养48 h后,8 000 r/min离心10 min后取上清,经0.22 μm膜过滤后进行反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)测定。
液相色谱条件[8]:色谱柱:Agilem 20RBAX.SB C18柱(4.6 mm×250 mm,5 μm);流动相:3%甲醇-97% KH2PO4缓冲溶液(0.01 mol/L);流速:0.8 mL/min;进样体积20 μL;检测波长:214 nm;柱温:常温。
L-苹果酸标准曲线绘制及L-苹果酸定性定量测定:用纯度>99%的L-苹果酸标准品分别配制1、2、3、4、5、6 mg/mL L-苹果酸标准溶液。0.22 μm膜过滤后,采用RP-HPLC分析,L-苹果酸的吸收峰在(3.016±0.008)min出现,其峰面积为样品中L-苹果酸的含量,可以用于实验结果比较。
1.3.4 菌株耐受性实验
1.3.4.1 耐酸能力实验
配制5瓶20 mL PDA液体培养基,用柠檬酸调节pH值分别为1.5、2.0、2.5、3.0,最后一瓶不做处理。将活化好的诱变菌株FM-cs-08-2U菌液,按2%的量接种于20 mL PDA液体培养基中,150 r/min、28 ℃恒温培养。每隔3 h取样,以无菌生理盐水做空白对照,测定菌液的OD600nm值。以自然pH值的PDA液体培养液中的菌株生长曲线为对照组,根据曲线判断菌株耐酸能力。
1.3.4.2 耐SO2能力实验
配制5瓶20 mL PDA液体培养基,用偏重亚硫酸钠调节SO2分别为500、600、700、800、900 mg/L。将活化好的诱变菌株FM-cs-08-2U菌液,按2%的量接种于20 mL PDA液体培养基中,150 r/min、28 ℃恒温培养。每隔3 h取样,以无菌生理盐水做空白对照,测定菌液的OD600nm值。以不添加SO2的PDA液体培养液中的菌株生长曲线为对照组,根据曲线判断菌株耐SO2能力。
1.3.5 诱变菌株发酵特性研究
按照以下工艺制备4瓶200 mL发酵液置于500 mL三角瓶中:蓝莓→打浆→酶解(0.3%果胶酶和0.3%复合果浆酶,40 ℃,4 h)→离心→过滤→添加16%白砂糖、0.01%偏重亚硫酸钠→分别接种5%干酵母活化菌液及诱变菌FM-cs-08-2U菌液→20 ℃发酵至残糖量低于4 g/L,即发酵完全。
发酵过程中取样测定发酵液的总酸、总糖及pH值,观察其变化。总糖含量测定:蒽酮-硫酸法[9];总酸:GB/T 15038—1994《葡萄酒、果酒通用试验方法》中的电位滴定法,以柠檬酸计;酒精度:GB/T15038—1994中的蒸馏比重法[10];pH值:酸度计。发酵完全后对发酵酒作感官评价。
1.3.6 致死率及降酸率的计算
1.3.6.1 致死率

式中:A1为未经处理的菌株稀释涂布的菌落数/(CFU/mL);A2为诱变处理的菌株稀释涂布的菌落数/(CFU/mL)。
1.3.6.2 降酸率
以L-苹果酸的不同质量浓度为横坐标,外标峰面积为纵坐标,绘制标准曲线,可得到回归方程y=90 867x+101 182(R2=0.999 9)。

式中:ρ0为空白对照中L-苹果酸质量浓度/(g/L);ρi为不同处理样中L-苹果酸质量浓度/(g/L)。
1.4 数据处理
2 结果与分析
2.1 FM-cs-08生长曲线及不同诱变方法对FM-cs-08致死率的影响
2.1.1 FM-cs-08生长曲线
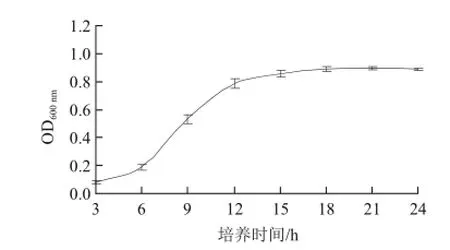
图1 酵母菌FM-cs-08生长曲线Fig.1 The growth cruve of the parent strain FM-cs-08
由图1可知,3~6 h菌体处于适应期,生长速度较慢;6~12 h,FM-cs-08生长迅速,此时菌株生长达到对数期对诱变比较敏感,因此一般选择培养了8~9 h的菌体,进行诱变处理。
2.1.2 紫外诱变对FM-cs-08致死率的影响
由靶子学说可知,紫外线在诱变作用之初,菌株数目很大,而此时的辐射剂量很少,辐射作用呈单击现象,这时紫外光照射作用的效率很高。随着照射时间延长,存活的菌株逐渐减少,变异菌株逐渐增加,突变率增大;一般紫外致死率在80%~90%,可保证菌体发生最大程度的突变[11-12]。由图2可知,0~4 min菌株的致死率直线上升,在2 min时致死率达到(80.30±1.75)%,4 min时致死率达到(95.20±1.30)%,5 min之后菌株的致死率基本达到(99.86±0.23)%。所以诱变时间在2~3 min的诱变菌株突变率较高,选择此时间段的诱变菌液进行稀释涂布,进而筛选出正突变株。

图2 紫外诱变致死率曲线Fig. 2 Fatality rate of yeast treated with UV irradiation
2.1.360Co诱变对FM-cs-08致死率的影响

图3 36060Co诱变致死率曲线Fig.3 Fatality rate of yeast treated with60Co γ-ray irradiation
FM-cs-08对于60Co的敏感性较高,随着诱变剂量的提高诱变菌的致死率不断提高。如图3所示,在诱变的3种剂量中600 Gy剂量条件下的致死率最高。在不超过90%的情况下,菌株的突变率最高,相对应的正突变的数量也最多[13]。所以本实验采用600 Gy剂量条件下诱变的菌株为筛选的对象。

表1 出发菌与诱变菌降解L-苹果酸效率Table 1 Degradation efficiencies of the parent strain and the mutant strain ffoorr L-malic aacciidd
由表1可知,空白对照中L-苹果酸质量浓度为(4.85±0.01)g/L,FM-cs-08发酵液中L-苹果酸质量浓度为(3.71±0.12)g/L,与空白对照相比,其L-苹果酸含量降低了(23.50±2.47)%。
从200株经过紫外诱变和60Co诱变的菌株中筛选出1株降酸效果最为显着的正突变株FM-cs-08-2U,L-苹果酸的质量浓度为(3.42±0.01)g/L,与空白对照组比较其L-苹果酸质量浓度降低了(29.48±0.21)%。
2.3 诱变菌株FM-cs-08-2U的耐受性实验
2.3.1 诱变菌株FM-cs-08-2U的耐酸度实验

图4 FM-cs-08-2U在不同pH值条件下生长曲线Fig.4 Growth curves of FM-cs-08-2U at different pH values
pH值能够改变营养物质的电离程度,从而影响细胞对营养物质的吸收,最终影响菌体的生长[14]。 由图4可知,与对照相比,pH 3环境中生长曲线最为接近,pH 2.5环境中生长曲线明显出现滞后现象,生长变得缓慢,而pH 2.0与pH 1.5这两条曲线基本维持水平,说明酵母在此pH值条件下无法正常生长。最终得出该酵母最大耐受酵母pH值为2.5。
2.3.2 诱变菌株FM-cs-08-2U的耐SO2实验
在果酒生产中SO2的作用为杀菌、澄清、抗氧化、增酸、改善口味等。适当添加SO2有利于保持果汁的新鲜度,防止微生物的破坏和过早褐变;而添加过多,会抑制酵母活性,影响主发酵;添加过少,则达不到抑制有害微生物生长的作用,使得酒体发酸有异味[15]。

图5 FM-cs-08-2U在不同SSOO2质量浓度条件下生长曲线Fig.5 Growth curves of FM-cs-08-2U at different concentrations of SO2
诱变菌株FM-cs-08-2U的耐SO2质量浓度实验结果如图5所示。与对照生长曲线相比,SO2添加量为500 mg/L和600 mg/L时,菌株生长趋势跟对照样基本保持一致,15 h后才进入稳定期;SO2添加量为700 mg/L与800 mg/L时,该酵母生长虽然缓慢,但仍有生长趋势;添加量为900 mg/L时,菌种生长受到抑制,难以生长,该菌株最大耐SO2质量浓度为800 mg/L。
时和珅用事,世铭忧愤,与同官论前代辅臣贤否,语饥切无所避。会迁御史,则大喜,夜起彷徨,草疏将劾之,诏仍留军机处。故事,御史留直者,仪注仍视郎官,不得专达封事。世铭自言愧负此官,阿桂慰之曰:“报称有日,何必急以言自见。”盖留直阿桂所请,隐全之,使有待。[9]5330
2.4 诱变菌株FM-cs-08-2U的发酵性能研究
2.4.1 诱变菌株FM-cs-08-2U发酵蓝莓酒过程中总糖变化

图6 FM-cs-08-2U蓝莓酒发酵过程中残糖量变化Fig.6 Variation in residual sugar content during the fermentation process of blueberry wine by FM-cs-08-2U
FM-cs-08-2U发酵蓝莓果酒,降糖速度如图6所示,第1周,残糖含量迅速下降;从第2周开始降糖速度下降,趋势较为平缓;经过3周将残糖含量降至(3.70±0.10)g/L,发酵成干酒。
2.4.2 诱变菌株FM-cs-08-2U发酵蓝莓酒过程中总酸变化

图7 FM-cs-08-2U蓝莓酒发酵过程中总酸含量变化Fig.7 Variation in total acid content during the fermentation process of blueberry wine by FM-cs-08-2U
蓝莓汁中主要的有机酸为柠檬酸、苹果酸,发酵过程中酵母的代谢活动改变了发酵液中有机酸组分的组成和含量[16],总酸变化趋势如图7所示。发酵过程中总酸含量呈先上升后下降的趋势,在发酵前期,酵母代谢产生有机酸,总酸含量增加;发酵后期,酵母菌的酒精发酵作用将有机酸降解为酒精等小分子物质,使得总酸含量下降[17]。FM-cs-08-2U在发酵前期,代谢旺盛,总酸含量上升较快,从发酵第5天,发酵液中总酸含量开始迅速下降。降酸酵母表现出一定的降酸能力。
2.4.3 诱变菌株FM-cs-08-2U发酵蓝莓酒过程中pH值变化
由于发酵液中有机酸组成发生变化,pH值也会发生一定的变化,由图8可知,发酵过程中pH值变化不稳定,但整体呈上升趋势。发酵结束时酵母FM-cs-08-2U酿造的蓝莓干酒pH值为3.18±0.01。

图8 8FM-cs-08-2U蓝莓酒发酵过程中ppHH值变化Fig.8 Variation in pH during the fermentation process of blueberry wine by FM-cs-08-2U
2.5 诱变菌株FM-cs-08-2U酿造蓝莓酒的理化指标及感官品评
用FM-cs-08-2U发酵蓝莓果酒得到的果酒测定理化指标,残糖量(以葡萄糖计)为(3.70±0.10)g/L,pH值为3.18±0.01,有机酸(以柠檬酸计)含量为(8.64±0.02)g/L,酒精度为(12.00±1.00)%;感官指标:外观深红,澄清透亮,无悬浮物和沉淀物;具有果香、甜香及典型的酒香;口味协调,酸甜适口,后味较长。
3 结 论
与葡萄酒酿造相关的酵母菌共有18个属,70多个种,其中部分酵母菌株具有降解苹果酸的能力。最为典型的是,粟酒裂殖酵母(Schizosaccharomyces pombe)通过苹果酸-酒精发酵MLF能将苹果酸分解为酒精和CO2,从而达到降酸的目的[18]。
本实验通过对降酸酿酒酵母FM-cs-08进行60Co诱变,获得1株诱变菌株FM-cs-08-2U,降L-苹果酸比率达到(29.48±0.21)%,比出发菌株提高了(25.44±0.89)%;耐受最低pH值为2.5,耐受最高SO2质量浓度为800 mg/L,同时具有良好的发酵性能。用FM-cs-08-2U发酵蓝莓果酒,得到的果酒残糖量为(3.70±0.10)g/L,pH值为3.18±0.01,有机酸含量为(8.64±0.02)g/L,酒精度为(12.00±1.00)%,外观深红,澄清透明,具有典型的酒香,口味协调,酸感降低,无苦涩和异味,稳定性好,证明FM-cs-08-2U适合酿造蓝莓果酒。与Dharmadhikari等[19]用粟酒裂殖酵母中的G13-3株系发酵葡萄酒相比,FM-cs-08-2U降低了果酒pH值,可使含苹果酸高的葡萄酒的酸度降低,同样发酵的果酒没有明显的异味产生。在新西兰,目前已广泛采用酵母菌株Lalvin-D432和Lalvin-71B进行葡萄酒降酸[20]。本实验在已有的研究基础上,对降酸酵母进行诱变育种,并对诱变菌株耐受性及发酵性能进行了探讨,丰富了酿酒酵母菌种资源。
[1] SWEETMAN C, DELUC L G, CRAMER G R, et al. Regulation of malate metabolism in grape berry and other developing fruits[J]. Phytochemistry, 2009, 70(11/12): 1329-1344.
[2] 张春晖. 微生物降酸技术在葡萄酒酿造中的应用[J]. 酿酒科技, 2002(2): 22-70.
[3] BOLTON R B, SIGLETON V L, BISSON L F, et al. Principles and practices of winemaking[M]. New York: Chaman & Hall, 1995.
[4] 甄会英, 王颉, 李长文, 等. 苹果酸-乳酸发酵在葡萄糖酿造中的应用[J].酿酒科技, 2005(3): 75-78.
[5] VOLSCHENK H, VILJOEN-BLOOM M, SUBDEN R E, et al. Malo-ethanolic fermentation in grape must by recombinant strains of Saccharomyces cerevisiae[J]. Yeast, 2001, 18(10): 963-970.
[6] 康孟利, 凌建刚, 林旭东. 果酒降酸方法的应用研究进展[J]. 现代农业科技, 2008(24): 25-26.
[7] 朱佳娜, 王英, 李思睿, 等. 自然发酵黑莓果酒中降酸酵母的筛选与鉴定[J]. 中国食品学报, 2012, 12(10): 182-187.
[8] 刘加兰, 王玮玮. HPLC法测定柠檬酸发酵液中的有机酸[J]. 现代测量与实验管理, 2009, 12(6): 9-12.
[9] 国家质量技术监督局. GB/T15038—1994葡萄酒、果酒通用试验方法[S]. 北京: 中国质检出版社, 1994.
[10] 刘晓涵, 陈永刚, 林励, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[11] 孙晓君, 朱婷婷, 秦智, 等. 紫外诱变获得耐高浓度丙烯腈菌株的研究[J]. 哈尔滨工业大学学报, 2005, 37(10): 1376-1393.
[12] 诸葛健. 工业微生物实验技术手册[M]. 北京: 中国轻工业出版社, 1994.
[13] 陈豪锋, 朱丹华, 薛临生, 等. 利用Co60γ-射线选育优良红曲霉菌株的研究[J]. 科技创新导报, 2010(6): 7-8.
[14] MARINA K N, NILS A. The effect of citric acid and pH on growth and metabolism of anaerobic Saccharomyces cerevisiae and Zygosaccharomyces bailii cultures[J]. Food Microbiology, 2007, 24: 101-105.
[15] TERESA G C, ROBERT M F, MARGALUZ A G, et al. Influence of SO2on the consumption of nitrogen compounds through alcoholic fermentation of must sterilized by pulsed electric fields[J]. Food Chemistry, 2007, 103(3): 771-777.
[16] 王秀菊. 蓝莓干酒及蓝莓酒渣花色苷提取工艺研究[D]. 泰安: 山东农业大学, 2010.
[17] 刘小翠, 赵思明, 王莲. 籼米甜酒的发酵动力学及工艺优化[J]. 食品科学, 2007, 28(7): 263-267.
[18] SOUSA M J, TEUXEURA J A, MOTA M. Must deacidification with an induced flocculant yeast stain of Schizosaccharomyces pombe[J]. Applied Microbiology and Biotechnology, 1993, 39(2): 189-193.
[19] DHARMADHIKARI M R, WILKER K L. Deacidification of high malate must with Saccharomyces pombe[J]. American Journal of Enology and Viticulture, 1998, 49(4): 408-412.
[20] PILONE G J, RYAN F A. A New Zealand experience in yeast inoculation for acid reduction[J]. New Zealand Wine Industry Journal, 1996, l1(4): 83-86.
Strain Improvement of Saccharomyces cerevisiae for Acid Degradation and Fermentation Performance of the Screened Strain
QIU Xiao-mei1,2, WANG Ying1, DONG Ming-sheng2, ZHOU Jian-zhong1,*
(1. The Research Institute of Agricultural Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Sac charomyces cerevisiae FM-cs-08, a strain with the ability to degrade L-malic acid, was treated with UV or60Co γ ray irradiation with the aim to obtain a mutant strain having improved acid-degrading ability and fermentation performance. The mutant strain was named FM-cs-08-2U, by which the degradation efficiency of L-malic acid was (29.48±0.21)%, showing a (25.44±0.89)% increase compared with the starting strain. The tolerance and fermentation performance of the mutant strain were assessed and the results showed that its lowest tolerable pH was 2.5 and its highest tolerable SO2concentration was 800 mg/L. The residual sugar content of blueberry wine fermented with FM-cs-08-2U was (3.70 ± 0.10) g/L, pH 3.18±0.01, organic acid content (8.64±0.02) g/L, and alcohol content (12.00±1.00)%. These results indicate that the selected mutant strain is suitable for brewing blueberry wine.
acid-degrading yeast; mutation breeding; fermentation performance
Q815
A
1002-6630(2014)05-0160-05
10.7506/spkx1002-6630-201405032
2013-04-02
江苏省农业科技自主创新项目(cx(11)2066)
仇小妹(1989—),女,硕士研究生,研究方向为食品微生物。E-mail:qiuxiaomei.789@163.com
*通信作者:周剑忠(1965—),男,研究员,博士,研究方向为食品生物技术。E-mail:zjzluck@yahoo.com



