刘 林,谢 和*
(贵州大学生命科学学院,贵州 贵阳 550025)
解淀粉芽孢杆菌产纤溶酶的19 L发酵罐实验及其酶学性质
刘 林,谢 和*
(贵州大学生命科学学院,贵州 贵阳 550025)
在摇瓶实验的基础上,对解淀粉芽孢杆菌(Bacillus amyloliquefaciens)GZJSI-12-7产纤溶酶最佳条件进行19 L发酵罐实验,结果表明:GZJSI-12-7在发酵罐中培养6 h时开始产纤溶酶,78 h后纤溶酶产量基本稳定,达到4 178.39 IU/mL,产酶高峰比摇瓶发酵提前12 h左右。将发酵液经离心除菌、硫酸铵分级盐析、透析除盐、Sephadex G-75凝胶过滤,得到纤溶酶的纯化倍数为9.84倍,酶活力回收率为42.52%,比活力为48 073.193 IU/mg。对纤溶酶的酶学性质研究表明,该酶的分子质量约为30.2 kD,最适温度和pH值分别为40 ℃、7.5;在40 ℃以下酶的稳定性良好,超过50 ℃后酶活力迅速降低,耐热性较差;金属离子Mg2+、Ca2+、Mn2+对纤溶酶活性均有较强的激活作用,而Cu2+和Fe3+对酶活性具有明显的抑制作用。
解淀粉芽孢杆菌;纤溶酶;发酵;分离纯化;酶学性质
近年来,随着人口老龄化趋势的加剧和生活水平的逐步提高,我国心脑血管栓塞性疾病的发病率不断上升,给人们的健康造成了严重的威胁[1-2]。溶栓疗法是治疗血栓类疾病最有效的手段之一,作为溶栓药物的重要来源,微生物由于具有种类多、繁殖快并能产生大量胞外蛋白酶的优点,引起了人们的广泛关注[3-4]。然而,目前国内微生物源纤溶酶的研究尚处于实验室阶段,几乎还没有微生物纤溶酶产品上市,主要是由于纤溶酶发酵产量较低的缘故,用野生型微生物进行液体发酵时的纤溶酶活力一般可达200~1 500 U/mL,诱变优化后可达600~3 000 U/mL,最高可达18 228 U/mL[5]。
本实验室前期对分离自酱香型白酒酒曲中的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)GZJSI-12通过紫外线和亚硝基胍的复合处理,获得了1株高产纤溶酶的突变株GZJSI-12-7,摇瓶优化后产酶活力高达4 789.08 IU/mL[6]。进一步对解淀粉芽孢杆菌GZJSI-12-7的摇瓶最佳发酵条件进行19 L发酵罐实验,并对发酵液中的纤溶酶进行分离纯化和酶学性质初步研究,为溶栓药物的研究开发和纤溶酶的工业化生产提供理论依据和技术参数。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)GZJSI-12-7由分离自酱香型白酒酒曲中的GZJSI-12诱变所得[6],仍具有较好的产酱香能力,保存于贵州大学生命科学学院微生物学实验室。
1.1.2 培养基
固体斜面培养基:牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L,琼脂20 g/L、pH 7.2~7.4,121 ℃灭菌30 min。
种子培养基:葡萄糖10 g/L、蛋白胨10 g/L、Na2HPO42 g/L、NaH2PO41 g/L、CaCl20.2 g/L、MgSO40.5 g/L,pH 7.0,121 ℃灭菌20 min。
发酵培养基[6]:葡萄糖30 g/L、蛋白胨10 g/L、吐温-80 5 g/L、CaCl20.4 g/L、MgSO40.847 g/L、Na2HPO42 g/L、NaH2PO46.988 g/L,pH 9.0,121 ℃灭菌20 min。
1.1.3 试剂
纤维蛋白原、凝血酶 美国Sigma公司;葡聚糖凝胶G-75 北京博奥拓达科技有限公司;即用型蛋白质分子质量标准(低) 日本TaKaRa公司;其他试剂均为国产分析纯或进口分装。
1.1.4 仪器与设备
L1523小型发酵罐(19 L) 瑞士比欧生物工程公司;2-16K高速冷冻离心机 美国Sigma公司;DYY-4C稳流稳压定时电泳仪 北京市六一仪器厂;Gel Doc XR+凝胶成像仪 美国Bio-Rad公司;THZ-160D气浴恒温振荡器 上海博迅实业有限公司;SW-CJ-1FD标准型净化工作台 苏州净化设备有限公司。
1.2 方法
1.2.1 纤溶酶酶活力测定
采用琼脂糖-纤维蛋白平板法[7]测定纤溶酶酶活力,并以尿激酶(标准品)作纤溶酶酶活力标准曲线。
1.2.2 蛋白质标准曲线制作
以考马斯亮蓝G-250法测定发酵液的蛋白质含量,蛋白质标准曲线的制作参照文献[8]。
1.2.3 19 L发酵罐实验
对摇瓶优化出的最佳培养基成分和发酵条件[6](装液量和摇床转速除外)进行19 L发酵罐实验。发酵罐参数为:装液量13 L,转速设定为350 r/min、通气量6 L/min、发酵96 h,每隔6 h取样测纤溶酶活性。
1.2.4 纤溶酶的分离纯化
1.2.4.1 分段盐析提取纤溶酶
将GZJSI-12-7发酵液于4 ℃、8 000 r/min离心20 min,弃沉淀后加入硫酸铵至10%饱和度,4 ℃静置过夜,冷冻离心(4 ℃、12 000 r/min、10 min),留取上清液备用。将上清液分为等量15份,分别加入不同量的硫酸铵使饱和度达到20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%,4 ℃条件下静置过夜,冷冻离心,分别收集沉淀和上清液。将沉淀溶于巴比妥钠-HCl缓冲液中,以纤维蛋白平板法分别测定沉淀和上清液的纤溶酶活性。
1.2.4.2 透析与浓缩
将盐析后收集的沉淀溶于pH 7.5的20 mmol/L Tris-HCl缓冲液中,4 ℃、8 000 r/min离心20 min后,将上清液装入透析袋内,在蒸馏水中于4 ℃充分透析至透析液经BaCl2检验无沉淀为止。后将其置于聚乙二醇20 000中浓缩。
1.2.4.3 葡聚糖凝胶层析
将经过透析除盐浓缩后的粗酶液用葡聚糖凝胶G-75进行层析分离,以磷酸盐缓冲液(pH 7.8)为洗脱液,每管接洗脱液10滴,检测收集到的各管中蛋白质和纤溶酶分布情况。
1.2.4.4 纤溶酶的分子质量测定
参照文献[9]的方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,选择5%浓缩胶、12%分离胶。
1.2.5 纤溶酶的酶学性质研究
1.2.5.1 温度对纤溶酶活性的影响
将纯酶液作适当稀释后,取10 μL点样于纤维蛋白平板上,将其置于不同温度下(25、30、35、37、40、45、50、55、60 ℃)恒温放置18 h,测量水解圈垂直直径,比较纤溶酶在不同温度下的活性。
1.2.5.2 纤溶酶的温度稳定性
将纯酶液作适当稀释后,分别置于30、40、50、60 ℃水浴锅中保温1 h,期间每隔15 min取样,测定酶的剩余酶活力,确定纤溶酶对温度的耐受性。
1.2.5.3 pH值对纤溶酶活性的影响
用pH值为3.0、4.0、5.0、6.0、7.0、7.5、8.0、9.0、10.0、11.0的广泛缓冲液分别与纯酶液按体积比1∶1的比例混合,4 ℃放置1 h后,用纤维蛋白平板法测定纤溶酶酶活力,研究pH值对纤溶酶活性的影响。
1.2.5.4 金属离子对纤溶酶活性的影响
配制含不同金属离子的盐溶液:NaCl、KCl、MgCl2、CaCl2、FeCl3、CuCl2、MnCl2。将盐溶液分别加入纯酶液中,使金属离子的终浓度分别为5、10 mmol/L,并以不加金属离子的酶液为对照,4 ℃放置1 h后测纤溶酶酶活力,比较金属离子对纤溶酶活性的影响。
2 结果与分析
2.1 19 L发酵罐实验
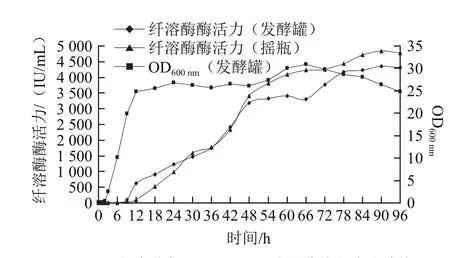
图1 发酵罐中GZJSI-12-7的生长曲线和产酶曲线Fig.1 Growth and fibrinolytic activity curves of GZJS1-12-7 in 19 L fermenter
对摇瓶最优条件进行19 L发酵罐实验,每6 h取样,测其OD600nm光密度和纤溶酶酶活力,结果如图1所示。菌株在发酵罐中培养时,1~2 h内为延滞期,2 h后进入对数生长期,并在12 h后进入稳定生长期,66 h后则进入衰亡期。由发酵罐中的产酶曲线可以看出,培养6 h后菌株开始产生纤溶酶,并在48 h时达到一个高峰,此后的18 h内纤溶酶产量稳定,可能是由于发酵液中的纤溶酶浓度较高,对菌株产酶产生了反馈抑制所致;66 h后纤溶酶产量又逐渐增加,可能是进入衰亡期后菌体细胞破裂,细胞内的纤溶酶得以释放,抑或是酶的二次诱导所致;进入78 h后,纤溶酶的产量增加趋于平缓,考虑到经济效益,选择78 h作为发酵终点,此时纤溶酶的产量为4 178.39 IU/mL。从菌体生长与产酶的关系来看,在进入对数中后期时纤溶酶开始合成,并且在进入稳定期后继续合成,属于部分生长偶联型[10]。
由图1中摇瓶和发酵罐中产酶曲线的比较可以看出,发酵罐中的起始产酶时间比摇瓶提前6 h左右,并在9~24 h内纤溶酶产量高于摇瓶,可能是由于在发酵罐中的稳定期比摇瓶提前,生物量在这段时间内多于摇瓶的缘故;30~48 h内,摇瓶和发酵罐中产酶速率均处于较高的水平,纤溶酶产量迅速上升,可能是进入稳定期后纤溶酶的迅速积累;48 h后,摇瓶中的纤溶酶产量开始高于发酵罐,并一直处于领先水平,可能是由于发酵罐中前期原料(底物或碳源)消耗较快,后期相对于摇瓶原料(底物或碳源)匮乏的结果;60~78 h内摇瓶中的纤溶酶产量趋于平稳,之后又缓慢上升并在90 h时产酶达到高峰,为4 847.63 IU/mL,比发酵罐中的产酶高峰推迟了12 h左右。
2.2 硫酸铵分级盐析
GZJSI-12-7发酵液经不同饱和度硫酸铵盐析后上清液和沉淀中的纤溶酶酶活力如图2所示。当硫酸铵饱和度小于35%时,纤溶酶不形成沉淀,酶活力基本存在于上清液中;35%~80%饱和度范围时,纤溶酶的沉淀量随硫酸铵饱和度的增加而增加;当硫酸铵饱和度达到80%时,上清液中纤溶酶活力为零,酶基本被沉淀下来;但饱和度大于75%时,沉淀中纤溶酶活力并没有显着增加,由于高浓度样品盐析存在共沉淀的问题,因此,考虑用35%~75%饱和度的硫酸铵分段盐析,可以把发酵液中的纤溶酶盐析沉淀出来,并减少其他杂蛋白的干扰。
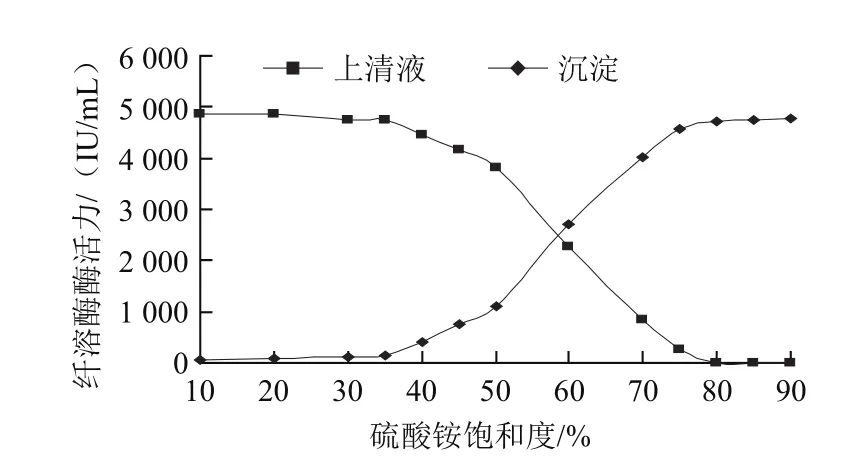
图2 硫酸铵饱和度对纤溶酶盐析效果的影响Fig.2 Effect of different saturation degrees of ammonium sulfate on salting out of fibrinolytic enzyme
2.3 葡聚糖凝胶层析结果
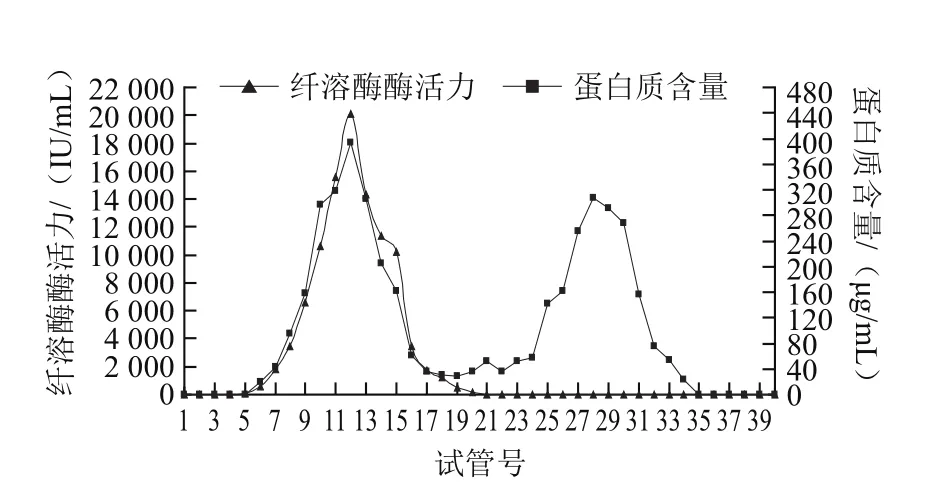
图3 葡聚糖凝胶G-75层析各管蛋白质含量和纤溶酶分布Fig.3 Distribution of protein content and plasmin activity by Sephadex G-75 chromatography
由图3可见,粗酶液经葡聚糖凝胶G-75层析分离后,蛋白质主要分布在6~34管,且在第12管和第28管出现两个活性峰,其中第12管蛋白质含量最高,达到393.62 μg/mL;纤溶酶主要分布在第6~20管,其中在第12管出现一个峰值。由洗脱曲线还可以看出,纤溶酶酶活力峰基本上与蛋白质浓度的前一个洗脱峰相重叠,纤溶酶集中在6~20管被洗脱出来,与21~34管的杂蛋白分离开。
经分析比较之后,以7~17管的收集液作为纯化分离后的酶液,经浓缩后测定蛋白质含量和纤溶酶活性,计算层析分离后酶的各项指标。
2.4 纤溶酶的分子质量
由图4可知,纯化后样品的电泳图谱检测只显示一条明显的蛋白条带,根据分子质量标准蛋白做标准曲线,确定该纤溶酶的分子质量约为30.2 kD,与Agrebi等[11]报道的从解淀粉芽孢杆菌An6发酵液中分离的纤溶酶的分子质量相近。
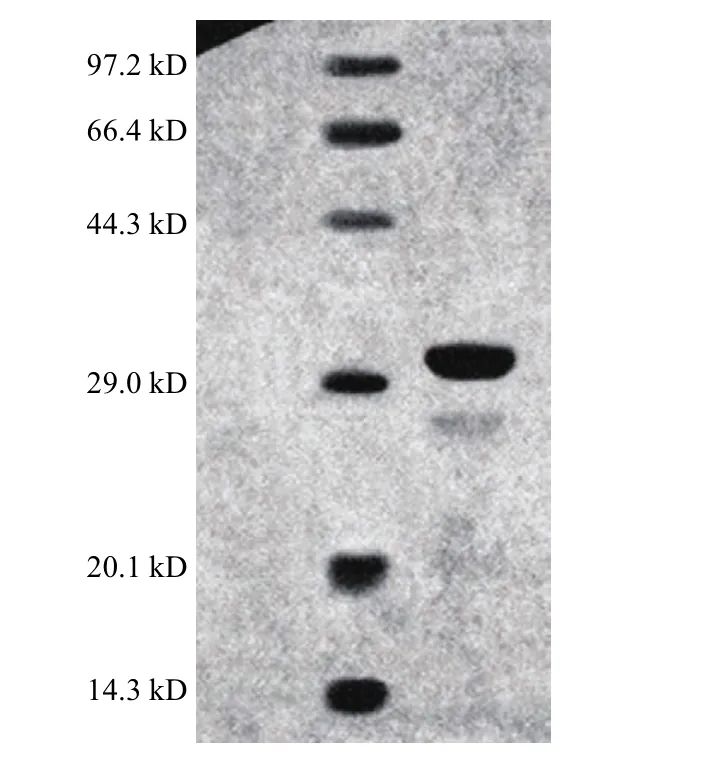
图4 纯化纤溶酶电泳图谱Fig.4 Eletrophoresis of purified fibrinolytic enzyme
2.5 纤溶酶的纯化倍数与回收率
500 mL发酵液经硫酸铵分级盐析、Sephadex G-75层析后,各步骤酶的比活力、纯化倍数及酶活力回收率如表1所示。
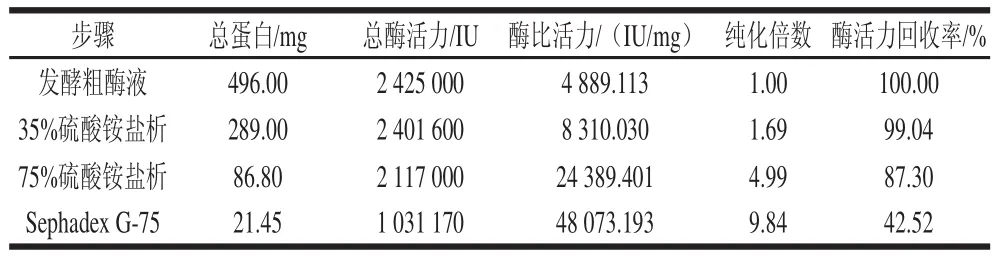
表1 纤溶酶纯化效果Table 1 Purification of fibrinolytic enzyme
由表1可知,发酵粗酶液经过一系列的分离纯化步骤后,酶的纯化倍数为9.84倍,酶活力回收率42.52%,比活力为48 073.193 IU/mg,纯化效果明显。
2.6 纤溶酶的酶学性质
2.6.1 温度对纤溶酶酶活力的影响结果
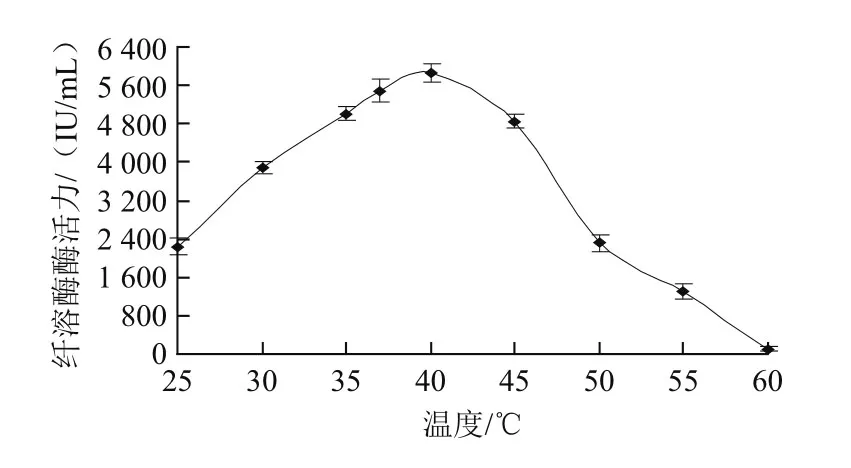
图5 温度对纤溶酶活性的影响Fig.5 Effect of temperature on the activity of fibrinolytic enzyme
由图5可知,温度低于40 ℃时,纤溶酶活力随着温度的升高而提高;35~45 ℃的范围内,纤溶酶酶活力相对较高,并且在40 ℃时活性最大;当温度高于40 ℃时,酶活力随着温度的进一步升高而降低,且当温度为60 ℃时,酶活力基本上丧失。
2.6.2 纤溶酶的温度稳定性结果
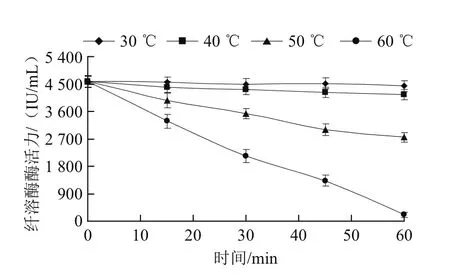
图6 纤溶酶的温度稳定性Fig.6 Effect of temperature on the stability of fibrinolytic enzyme
由图6可知,该酶在30 ℃时比较稳定,酶活力基本保持不变,40 ℃保温l h后酶活力损失不大。50 ℃时随时间延长酶活力逐渐降低,1 h后酶活力损失约40%。60 ℃时随着保存时间的延长,纤溶酶活力迅速下降,1 h后基本失活,与牛术敏等[12]报道的BS-26菌株纤溶酶热稳定性一致,说明该纤溶酶的耐热性不是很好。
2.6.3 pH值对纤溶酶活性的影响结果
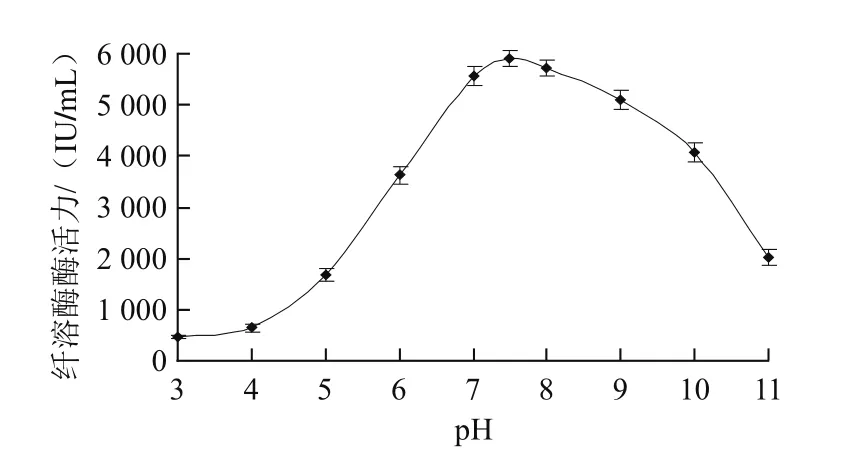
图7 pH值对纤溶酶活性的影响Fig.7 Effect of pH on the activity of fibrinolytic enzyme
由图7可知,pH 7.0~9.0时,纤溶酶酶活力相对稳定,pH 7.5左右时,酶活力达到最高。pH值低于7.5时,酶活力随着pH值的增大而提高。pH值高于7.5时,酶活力随着pH值的增大而减小,pH 10.0后随着pH值的增大酶活力迅速降低,由此推测该纤溶酶的最适pH值为7.5左右,且该纤溶酶在碱性范围内的稳定性优于在酸性环境中的稳定性。
2.6.4 金属离子对纤溶酶活性的影响结果
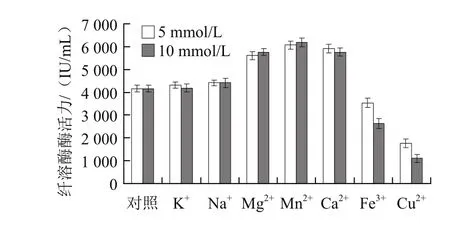
图8 金属离子对纤溶酶活性的影响Fig.8 Effects of metal ions on the activity of fibrinolytic enzyme
由图8可知,Na+、K+对纤溶酶酶活力的影响不大;Mg2+、Ca2+、Mn2+对纤溶酶酶活力均有较强的激活作用,并且以Mn2+的激活作用最为明显,但5 mmol/L和10 mmol/L的离子浓度对酶活力的影响差异均不显着(P>0.05);Cu2+和Fe3+则明显抑制纤溶酶的酶活力,且随着浓度的增大,抑制作用增强(P<0.05)。
3 结 论
目前国内外关于纤溶酶类的研究非常活跃,也取得了许多显着的成果[13-15],但是这些成果大多局限于实验室的摇瓶发酵,而摇瓶发酵的条件与发酵罐的发酵条件在一定程度上存在差异,往往存在着“放大效应”,并且由于传递因素造成的影响导致摇瓶实验难以实现精确在线检测和调控,所以采用发酵罐进行发酵实验仍是目前生物技术开发和实现产业化的必由之路[16]。本实验对突变株GZJSI-12-7的摇瓶产纤溶酶最佳条件进行19 L发酵罐实验,结果表明,78 h后纤溶酶产量基本稳定,达到4 178.39 IU/mL,与文献相比仍处于较高的产酶水平[17-18],下一步有望通过对发酵罐中培养基成分和发酵参数的优化及基因工程菌的构建来进一步提高纤溶酶的发酵效价。
经一系列的分离纯化手段后获得了纯化的纤溶酶,酶的纯化倍数为9.84倍,酶活力回收率42.52%,酶比活力为48 073.193 IU/mg,该比活力与已有文献相比处于较高的水平[19-21],可将其用于溶栓药物的研究。SDS-PAGE电泳结果表明,该酶的分子质量约为30.2 kD。最适温度和pH值分别为40 ℃、7.5,接近于人体血液的微环境,说明该酶在人体正常生理环境下酶活力稳定,开发为溶栓药物的潜力巨大。在40 ℃以下酶的稳定性良好,超过50 ℃后酶活力迅速降低,耐热性较差。金属离子Mg2+、Ca2+、Mn2+对纤溶酶活性均有较强的激活作用,其中Mn2+的激活作用最强,Cu2+和Fe3+对酶具有明显的抑制作用,这与Jeong等[22]的研究结果差异较大,而与牛术敏等[12]的研究结果相似。
[1] 王佃亮, 杜娟, 孟永钢, 等. 溶栓药物的研究现状及发展趋势[J]. 中国心血管病研究, 2009, 7(12): 936-940.
[2] 卫生部心血管病防治研究中心. 中国心血管病报告2011[M]. 北京:中国大百科全书出版社, 2012: 7-12.
[3] 关晨晨, 赵敏. 豆豉纤溶酶的分离纯化及部分酶学性质研究[J]. 中国药学杂志, 2010, 45(16): 1218-1223.
[4] WU Bin, WU Licheng, CHEN Daijie, et al. Purification and characterization of a novel fibrinolytic protease from Fusarium sp. CPCC 480097[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(3): 451-459.
[5] 袁军, 李国良, 沈榕强, 等. 豆豉溶栓酶产生菌Bacillus subtilis LD-8547的诱变选育[J]. 江西农业大学学报, 2012, 34(6): 1251-1255.
[6] 刘林, 谢和. 高产纤溶酶菌株的诱变育种及产酶条件的响应面法优化[J]. 广东农业科学, 2013, 43(7): 103-107.
[7] 林芬, 谢和. 产酱香细菌中高活性纤溶酶菌株的筛选[J]. 食品科学, 2010, 31(17): 258-262.
[8] 杨建雄. 生物化学与分子生物学实验技术教程[M]. 北京: 科学出版社, 2002: 35-36.
[9] 陆健. 蛋白质纯化技术及应用[M]. 北京: 化学工业出版社, 2005: 181-184.
[10] 陈书安, 王晓东, 袁晓凡, 等. 藏红花细胞悬浮培养动力学研究[J].生物技术通报, 2011(4): 102-105.
[11] AGREBI R, HMIDET N, HAJJI M, et al. Fibrinolytic serine protease isolation from Bacillus amyloliquefaciens An6 grown on mirabilis jalapa tuber powders[J]. Applied Biochemistry and Biotechnology, 2010, 162(1): 75-88.
[12] 牛术敏, 郭晓军, 李术娜, 等. 枯草芽孢杆菌BS-26菌株纤溶酶的性质分析及活性组分的分离纯化[J]. 微生物学报, 2008, 48(10): 1389-1392.
[13] CHOI N S, SONG J J, CHUNG D M, et al. Purification and characterization of a novel thermoacid-stable fibrinolytic enzyme from Staphylococcus sp. strain AJ isolated from Korean saltfermented Anchovy-joet[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(3): 417-426.
[14] 梁惠仪, 郭勇. 全基因组重排育种技术提高豆豉纤溶酶菌产酶量[J].中国生物工程杂志, 2007, 27(10): 39-43.
[15] MANDER P, CHO S S, SIMKHADA J R. A low molecular weight chymotrypsin-like novel fibrinolytic enzyme from Streptomyces sp. CS624[J]. Process Biochemistry, 2011, 46(7): 1449-1455.
[16] 杨新建, 段素云. 产β-甘露聚糖酶环状芽孢杆菌发酵罐放大工艺研究[J]. 中国饲料, 2011(11): 34-37.
[17] 吴思方, 向梅, 陶琳, 等. 豆豉溶栓酶产生菌发酵条件研究[J]. 中国医药工业杂志, 2004, 35(6): 332-334.
[18] ZHANG Xu, YUN Luojia, PENG Liangbin, et al. Optimization of Douch fibrinolytic enzyme production by statistical experimental methods[J]. Journal of Huazhong University of Science and Technology, 2013, 33(1): 153-158.
[19] LEE A R, KIM G M, PARK J Y, et al. Characterization of a 27 kDa fibrinolytic enzyme from Bacillus amyloliquefaciens CH86-1 isolated from Cheonggukjang[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010, 53(1): 56-61.
[20] 王成涛, 籍保平, 曹雁平, 等. 豆豉纤溶酶Subtilisin FS33的提取纯化与鉴定[J]. 中国酿造, 2009, 82(2): 29-33.
[21] 顾昌玲, 郭晓军, 李佳, 等. 一株产纤溶酶芽孢杆菌的鉴定及纤溶酶的分离纯化与性质分析[J]. 微生物学报, 2009, 49(4): 492-497.
[22] JEONG Y K, PARK J U, BAEK H, et al. Purification and biochemical characterization of a fibrinolytic enzyme from Bacillus subtilis BK-17[J]. World Journal of Microbiology and Biotechnology, 2001, 17(1): 89-92.
Production and Characterization of Fibrinolytic Enzyme from Bacillus amyloliquefaciens in 19 L Fermenter and Investigation of Its Properties
LIU Lin, XIE He*
(College of Life Sciences, Guizhou University, Guiyang 550025, China)
As an extension of our previous fermentation experiments in shake flasks, the objective of this study was to optimize the fermentation conditions for the production of fi brinolytic enzyme by Bacillus amyloliquefaciens GZJSI-12-7 in a 19 L fermenter. The results showed that plasmin activity began to appear after incubation for 6 h and remained constant after 78 h at a level of 4 178.39 IU/mL. The peak of enzyme production occurred about 12 h earlier than in shake flasks. Fibrinolytic enzyme was purified from the fermented liquid medium by bactofugation, ammonium sulfate precipitation, dialysis and Sephadex G-75 gel filtration, with a purification fold of 9.84 and an activity recovery of 42.52%. The specific activity of the purified fibrinolytic enzyme was 48 073.193 IU/mg. Enzymatic characterization showed that the molecular weight of the fibrinolytic enzyme was about 30.2 kD, and its optimum temperature and pH were 40 ℃ and 7.5, respectively. The purified fibrinolytic enzyme was stable blow 40 ℃ but sharply decreased above 50 ℃. The enzymatic activity was markedly catalyzed by Mg2+, Ca2+and Mn2+, but strongly inhibited by Cu2+and Fe3+.
Bacillus amyloliquefaciens; fibrinolytic enzyme; fermentation; purification; characterization
TQ464.8
A
1002-6630(2014)07-0176-05
10.7506/spkx1002-6630-201407035
2013-06-23
刘林(1988—),男,硕士研究生,研究方向为应用微生物学。E-mail:liulin6904@126.com
*通信作者:谢和(1963—),男,副教授,硕士,研究方向为资源微生物学和应用微生物学。E-mail:xieheh@163.com



