池爱平,李 虹,康琛喆,郭欢欢,张海猛,郭 飞,王一民
(陕西师范大学体育学院,陕西 西安 71011 9)
富硒茶多糖的提取及其对运动疲劳恢复的影响
池爱平,李 虹,康琛喆,郭欢欢,张海猛,郭 飞,王一民
(陕西师范大学体育学院,陕西 西安 71011 9)
目的:研究紫阳富硒茶多糖(selenium-rich tea polysaccharide,STP)的基本理化性质及其对小鼠游泳能力与疲劳恢复的影响。方法:采用水提醇沉法提取STP,对其基本成分含量、紫外和红外光谱进行了检测;同时建立了一个5 周的小鼠耐力运动模型,灌胃不同剂量的STP水溶液,测定了小鼠的游泳力竭时间,然后分别在小鼠在力竭运动即刻、运动后24 h恢复两 种情况下取材,测定了血糖、血尿素氮、血乳酸的浓度以及肝糖原含量、肝谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和丙二醛(malondialdehyde,MDA)含量。结果:STP是一种含蛋白的硒多糖,对小鼠游泳 力竭时间有明显的延长作用;对于小鼠的糖代谢能力具有调节作用,而且显着提高小鼠肝组织的GSH-Px活性,降 低MDA的含量。结论:STP具有抗运动性疲劳的作用,其机理与其调节机体糖代谢和改善运动造成机体组织脂质过氧化作用有关。
富硒茶多糖;力竭运动;运动疲劳
目前关于耐力运动疲劳产生的机制有众多理论支持:诸如能源物质消耗学说、自由基氧化学说、内环境稳定性失调学说、代谢产物堆积学说以及神经-内分泌-免疫网络学说等[1]。所以,通过有针对性地补充外源性营养补剂或者药物活性成分,来延缓或者缓解运动员运动疲劳的发生,是解决运动性疲劳的有效途径之一。研究表明,许多植物的多糖成分具有改善运动性疲劳的作用,其作用机制大多与提高机体糖储备以及提高机体免疫能力等方面有关,故多糖抗运动性疲劳方面的研究成为近几年运动营养学领域研究一个热点[2-4]。硒具有多种生理功能,它不仅是谷胱甘肽过氧化物酶活性中心的组成部分,还能够维持机体的正常免疫功能[5]。硒是人体特别是运动员体内易缺乏的微量元素。多糖类物质目前被证明具有增强机体免疫、改善糖代谢以及抗氧化功能。研究发现硒多糖的生物活性普遍高于多糖和硒[6],此外也有研究证明硒多糖具有明显的调节糖、脂代谢的作用[7-8]。紫阳县是我国高富硒地区之一,每年产2 200 t富硒茶,来源丰富但开发利用率低。紫阳富硒茶中的硒含量丰富,主要以有机态的形式与蛋白质或者多糖结合在一起[9],是一种理想的补硒、补多糖的途径。人们通过饮用富硒茶或者服用茶制品来达到多种保健目的,但至今未见富硒茶与运动相关的研发产品,甚至与运动相关的研究报道也极少,因此,本课题以耐力运动疲劳的特殊生理现象和富硒茶多糖的生物活性为研发的理论依据,在实验中,采用水提醇沉法,提取了紫阳富硒茶多糖(selenium-rich tea polysaccharide,STP),建立了小鼠5 周的耐力运动模型,通过服用不同剂量的STP溶液,来检测STP对小鼠耐力运动、行为学表现与疲劳恢复的影响程度,旨在为进一步开发运动补剂提供实 验支持。
1 材料与方法
1.1 实验动物、材料与试剂
实验动物为健康昆明种雄性小鼠,2 月龄,体质量22~26 g,由陕西省交大医学院实验动物饲养中心购入,同时购入基础饲料。
富硒茶由陕西省紫阳县闽秦茶叶有限公司提供。
乙醇、三氯甲烷、丙酮、乙醚 天津化学试剂有限公司;过氧化氢、浓硫酸 西安化学试剂厂;以上试剂均为AR级;硒粉 西安顺达化学试剂仪器公司;透析袋(Mw10 000) 北京鼎国生物技术有限责任公司。
1.2 仪器与设备
752B型分光光度计 上海第三分析仪器厂;U-3900/3900H紫外光谱仪 日立公司;Tensor27红外光谱仪 德国布鲁克公司;DD5低温高速离心机 湖南凯达科学仪器有限公司。
1.3 方法
1.3.1 STP的提取
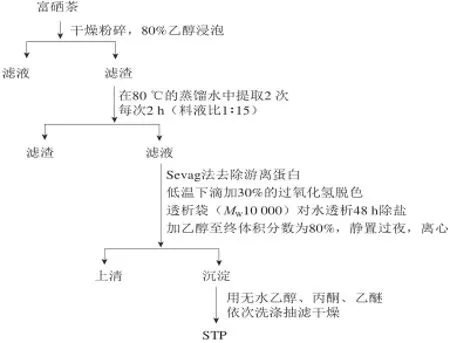
图1 STP提取流程图Fig.1 Flow chart of STP extraction
STP的提取过程参照文献[10]采用的水提醇沉法,并做改良,游离蛋白的去除采用Sevag法。流程图见图1。
1.3.2 STP主要成分测定
多糖含量的测定采用蒽酮-硫酸法[11]。硒含量测定采用紫外分光光度法[12]。蛋白质含量测定采用双缩脲法[13]。
1.3.3 STP的紫外光谱采集
称取STP 5 mg,配成0.5 mg/mL的溶液,以蒸馏水为对照,在紫外光谱仪190~600 nm波长区域内扫描。
1.3.4 STP的红外光谱采集
称取STP 3 mg,分别于400 mg干燥的KBr混匀,在玛瑙研钵中研磨5 min,压片,在红外光谱仪上测定4 000~400 cm-1的红外光谱。
1.3.5 实验动物与模型建立
动物饲养室的温度为12~18 ℃,相对湿度为43%~50%,光照随同自然光变化。将小鼠随机分为4 组:空白对照组(A组)、阳性对照组(B组)、STP低剂量组(C1组)和高剂量组(C2组),每组20 只。适应性饲养1周后进行实验。
1.3.6 运动模型的建立
各组小鼠在塑料水池(长×宽×高为:80 cm×60 cm×50 cm,水温30 ℃,水深40 cm)进行为期5周的游泳训练,每周的周一至周六每晚8点进行90 min的尾部负重(负荷为体质量的5%)游泳训练,周日休息,最后一周的周六训练改为负重力竭游泳(力竭判断的标准:以小鼠头部沉入水中5 s不能浮出水面)。每次运动结束后进行灌胃:C1和C2组小鼠分别灌胃剂量为100 mg/(kg·d)和200 mg/(kg·d)的STP水溶液;A组小鼠灌胃等体积的生理盐水;B组为阳性对照组,灌胃蔗糖水溶液,剂量参照文献[14]为6 g/(kg·d)。灌胃时间为30 d。
1.3.7 血液与肝组织部分生化指标的测定
记录小鼠力竭时间,力竭游泳结束后,立刻在每组小鼠中随机选择一半,进行采血处死取材。测定项目包括:血糖、血乳酸、血尿素氮的浓度;肝糖原、肝组织丙二醛(malondialdehyde,MDA)的含量以及肝组织谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性。每组剩余的一半小鼠恢复24 h后,进行采血处死取材,测定相同项目。测定均使用南京建成生物制剂公司生产的试剂盒,按照说明操作。
1.4 数据处理
数据用SPSS 10.0统计软件进行分析,组间比较采用t检验进行比较,用±s表示。
2 结果与分析
2.1 STP的基本理化性质
采用水提醇沉法从1 000 g富硒茶原料中提取STP 39.7 g,得率为3.97%,与原料的主要成分对比结果见表1。
从表1中STP与茶原料的成分含量对比来看,总糖含量与硒含量明显增加,蛋白质含量下降,原因主要是本实验采用Sevag法除去了原料中游离蛋白。
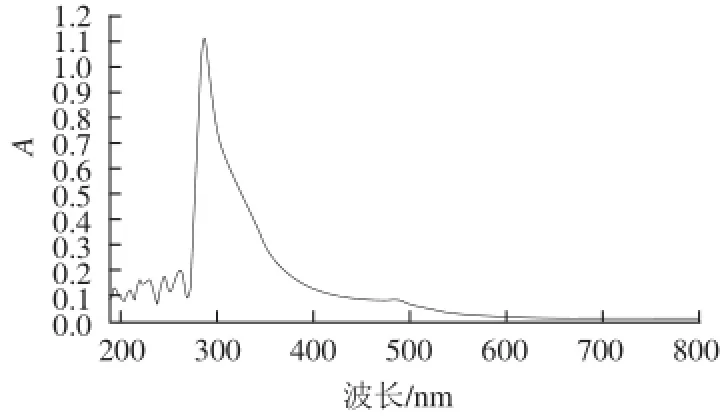
图2 STP的紫外光谱Fig.2 Ultraviolet spectrum of STP
紫外光谱图(图 2)显示STP在280 nm左右有强吸收峰,表明STP含有结合蛋白,这与表1结果相一致,属于蛋白多糖。红外光谱图(图3)显示:STP属于典型的多糖结构,在3 438.22 cm-1处的吸收峰表示O—H伸缩振动,在1 639.09 cm-1处的吸收峰表示C=O或者O—CHO伸缩振动,在1 393.81 cm-1处的吸收峰表示C—H伸缩振动,在1 111.16 cm-1处的吸收峰表示C—O伸缩振动,在850.89 cm-1处的弱吸收峰表示STP含有少量α-D-吡喃糖,在887.89 cm-1处的弱吸收峰表示STP还含有少量β-D-吡喃糖。
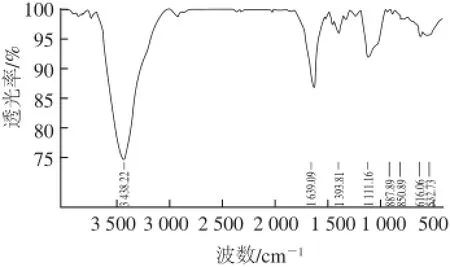
图3 STP的红外光 谱Fig.3 Infrared spectrum of STP
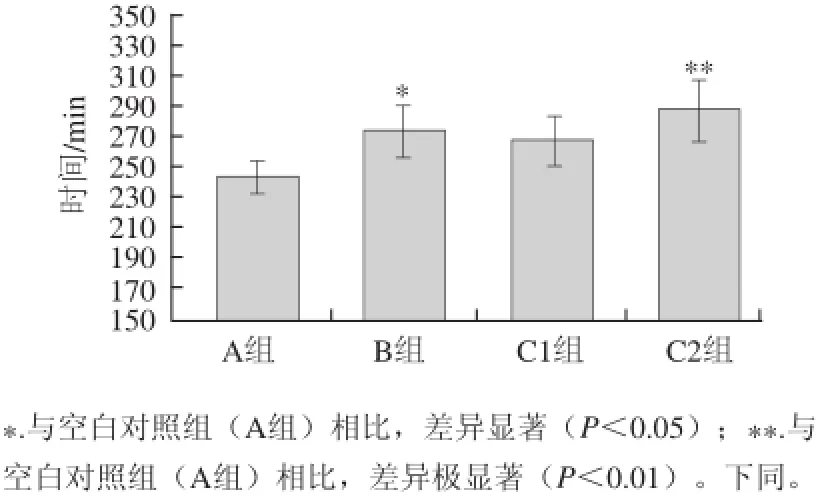
图4 小鼠力竭游泳时间对比(n=20)=20Fig.4 Comparison of swimming exhaustion time in mice (n = 20)
2.2 各组小鼠力竭游泳时间的比较由图4可知,蔗糖组小鼠的 力竭时间与空白对照组相比较显着延长(P<0.05),STP高剂量组小鼠的力竭时间与空白对照组相比较极显着延长(P<0.01),说明蔗糖和高剂量的STP对小鼠的力竭疲劳的时间具 有延缓的作用,但二者之间没有显着性差别。
2.3 各组小鼠血液部分生化指标测定结果
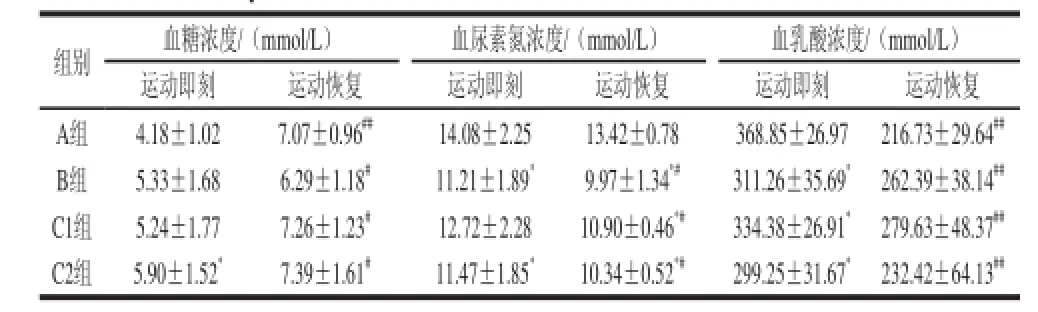
表2 小鼠血液生化指标的比较(x±s,n=10)Table 2 Comparison of blood biochemical indexes in mice (x±s , n = 10)
由表2可知,从运动后即刻各组小鼠的血糖浓度比较来看,只有STP高剂量组显着高于空白对照组(P<0.05),运动后恢复24 h,各组之间小鼠的血糖浓度比较无显着性差异,但与同组运动即刻相比较,均有显着或极显着地升高(P<0.05,P<0.01)。由于力竭运动的能量需求使小鼠的血糖浓度在运动时降低,在24 h恢复后,各组小鼠血糖恢复良好,但组间没有显着性差异,这与机体血糖动态平衡性有关系。在各组小鼠血尿素氮浓度的比较中,蔗糖组和STP高、低剂量组较空白对照组有不同程度的降低,说明这蔗糖和STP参与供能后,都能使小鼠的蛋白质分解代谢有明显的节省现象。在同组恢复前后的对比中,除了空白对照组之外,其他各组小鼠血尿素氮都有显着性的降低(P<0.05)。组间血乳酸含量的对比中,蔗糖组和STP高、低剂量组小鼠在运动后即刻,都明显比空白对照组小鼠的血乳酸含量低(P<0.05);而在同组之间的比较,运动恢复24 h比运动即刻,各组小鼠血乳酸浓度都极显着性地降低(P<0. 01)。说明血乳酸能在较短时间内恢复。
2.4 各组小鼠肝组织部分生化指标测定结果
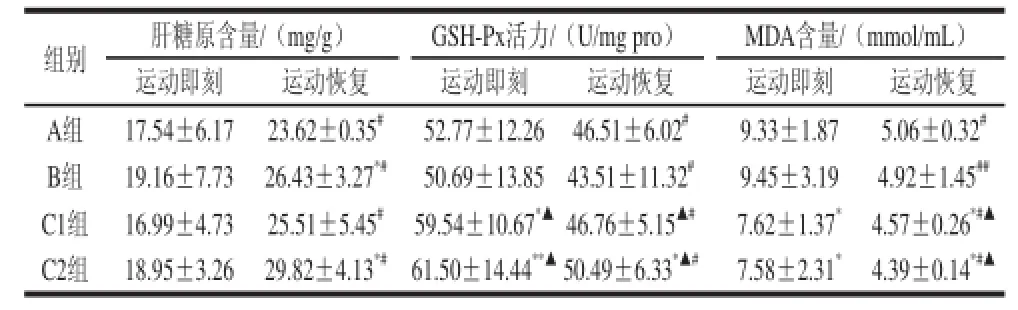
表3 小鼠肝组织部分生化指标比较(x±s,n=10)Table 3 Comparison of liver tissue biochemical indexes in mice (x ±s,n=10)
由表3可知,运动后即刻组间肝糖原含量的对比,均没有显着性差异,这与力竭运动导致各组小鼠机体肝糖原耗尽有关。但在24 h的恢复后,各组小鼠肝糖原均有显着性的恢复(P<0.05),蔗糖组与STP高剂量组的恢复情况较空白对照组更明显(P<0.05)。在肝组织GSH-Px活性的对比中,不管是运动即刻组还是运动恢复组,STP组小鼠GSH-Px活性均不同程度高于空白对照组和阳性对照组(P<0.05,P<0.01),而同组相比较,小鼠GSH-Px活性均显着性下降(P<0.05)。同组MDA含量的对比中,各组小鼠运动恢复后比运动即刻的MDA含量均有显着或极显着地降低(P<0.05,P<0.01),但组间比较时,STP组在运动即刻时和恢复24 h后,MDA含量显着低于空白对照组和蔗糖组(P<0.05),这可能与STP提高了小鼠肝组织GSH-Px活性有关。
3 讨论与结论
经过一系列的提取与纯化,本实验得到的富硒茶多糖的活性成分包括糖、结合蛋白和硒的含量都大幅度提高,结果证明富硒茶多糖是一种含硒蛋白多糖,其结构特点可能决定富硒茶多糖具有某些活性功能,这有待于进一步研究。
运动性疲劳是一个极其复杂的身体变化综合反应过程。研究证明在长时间大强度运动中,糖原耗尽、血糖浓度降低、乳酸堆积都能诱发运动性疲劳的发生[15]。单糖与双糖易被消化系统吸收,能够迅速提高机体的糖原恢复与储备,进而改善运动后疲劳的恢复。目前在运动性疲劳与补糖的研究中,蔗糖是主要的补糖种类之一[16-17],故本实验选用补充蔗糖作为阳性对照组。运动疲劳的产生还与氧化损伤、内环境改变、免疫机能下降以及机体保护性抑制等多重因素有关[1],故在运动补剂的研究方面应予以多重因素考虑。多糖由于分子质量大,不易被消化系统吸收,但众多研究证明,多糖可以改善肠道黏膜免疫系统,间接提高机体的免疫系统功能[18-20]。另外,也有研究证明一些多糖能够改善机体运动造成的氧化损伤[21-22]。这说明,补充多糖对运动疲劳的作用机理,可能与其改善了机体的免疫功能和抗氧化能力有关。本实验结果证实,高剂量的STP对小鼠的力竭疲劳的时间具有延缓的作用,与阳性对照组作用效果相似。但二者的作用途径与机理可能不同。
本实验选用3 个血液生化指标:血糖、血尿素氮、血乳酸,都能够间接反映运动疲劳程度的血液生化指标[17]。实验结果显示血糖的变化不明显,可能与血糖的动态平衡性有关。而血尿素氮是反映机体蛋白质代谢的一个指标,一般在长时间大强度运动时,糖原储备不足的情况下,蛋白质参与代谢的程度增大,本实验证明,补充蔗糖和STP后,对机体蛋白质代谢具有一定的节省作用。乳酸含量在另外一方面反映了糖进行无氧酵解的程度,也是反映机体有氧代谢能力的一个指标[23]。实验结果表明,补充蔗糖和STP后,机体乳酸含量较对照组降低,说明蔗糖和STP促进了机体糖的有氧代谢能力。肝糖原储备水平是反映机体的有氧代谢能力和疲劳程度的重要指标[24]。实验结果表明,补充蔗糖和高剂量的STP后,对于肝糖原的恢复具有显着的增强作用。
力竭运动会使机体自由基产生增多,抗氧化酶因受到自由基的伤害导致活性下降,使机体脂质过氧化的程度增加,其产物MDA可以反映组织的脂质过氧化的程度。GSH-Px是一种含硒蛋白,能够清除脂类氢氧化物和有机氢过氧化物,减轻机体损伤,在氧化防御反应中起着关键作用,在一定程度上阻止机体脂质过氧化的程度[25-26]。实验结果表明,服用STP后,不管在运动即刻还是在运动恢复后,小鼠肝组织中GSH-Px活性均显着升高,而MDA含量显着下降,这与STP中的硒有关,硒为机体合成GSH-Px提供了必要的材料,最终对于机体由于过度运动造成的脂质过氧化具有保护作用。虽然蔗糖和STP同样具有延缓小鼠运动疲劳的作用,但STP在提高抗氧化酶的层面上,对机体组织的氧化损伤保护中,具有积极地意义。这也正是积极开发富硒茶多糖的目的所在。关于STP在免疫学层面上是否对运动性疲劳产生影响,有待于进一步证实。
[1] 邓树勋, 王健, 乔德才. 运动生理学[M]. 北京: 高等教育出版社, 2013: 233-235.
[2] CHI Aiping, TANG Liang, ZHANG Jing, et al. Chemical composition of three polysaccharides from Gynostemma pentaphyllum and their antioxidant activity in skeletal muscle of exercised mice[J]. International Journal of Sport Nutrition and Exercise Metabolism, 2012, 22(6): 479-485.
[3] CHI Aiping, CHEN Jingping, WANG Zhezhi, et al. Morphological and structural characterization of a polysaccharide from Gynostemma pentaphyllum Makino and its anti-exercise fatigue activity[J]. Carbohydrate Polymers, 2008, 74(4): 868-874.
[4] JUNG K, KIM I H, HAN D. Effect of medicinal plant extracts on forced swimming capacity in mice[J]. Journal of Ethnopharmacology, 2004, 93(1): 75-81.
[5] 张钧, 张蕴琨. 运动营养学[M]. 北京: 高等教育出版社, 2012: 23-30.
[6] 焦子明. 紫阳富硒茶中硒的赋存形态研究及茶渣的开发利用[D]. 西安: 陕西师范大学, 2012: 9-10.
[7] 刘振锋, 东方, 季宇彬, 等. 硒多糖药理活性研究进展[J]. 北京联合大学学报: 自然科学版, 2011, 25(4): 36-40.
[8] 方敏. 甲壳低聚糖硒的合成及其干预性糖尿病鼠模型形成的研究[D].衡阳: 南华大学, 2005: 17-36.
[9] 焦自明, 杨建雄, 张小飞, 等. 紫阳富硒茶中茶多糖、碱溶性茶蛋白结构形貌及硒赋存形态[J]. 陕西师范大学学报: 自然科学版, 2012, 40(1): 73-76.
[10] 何念武. 紫阳富硒绿茶茶多糖与茶多酚抗肿瘤药理作用研究[D]. 西安: 陕西师范大学, 2012: 21-25.
[11] 刘晓涵, 陈永刚, 林励, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[12] 周跃花, 杨菊香, 张娜. 紫外分光光度法测定紫阳富硒茶中的硒[J].西北农业学报, 2009, 18(4): 229-232.
[13] 王卫国, 吴强, 胡宝坤, 等. 几种测定灰树花多糖中蛋白质含量方法的比较研究[J]. 中国食用菌, 2002, 22(1): 27-30.
[14] 唐海军, 周亮. 补糖和刺五加调节大鼠运动后糖代谢的研究[J]. 北京体育大学学报, 2009, 32(6): 51-53.
[15] 李良鸣, 杨则宜, 魏源, 等. 运动后前糖原和大糖原的恢复规律及其机制研究[J]. 体育科学, 2005, 25(7): 25-30.
[16] AOI W, NAITO Y, HANG L P, et al. Regular exercise prevents high-sucrose diet-induced fatty liver via improvement of hepatic lipid metabolism[J]. Biochemical and Biophysical Research Communications, 2011, 413(2): 330-335.
[17] JENTJENS R L, SHAW C, BIRTLES T, et al. Oxidation of combined ingestion of glucose and sucrose during exercise[J]. Metabolism, 2005, 54(5): 610-618.
[18] 姜帆. 五味子多糖的提取纯化及其对肠道免疫功能的影响[D]. 哈尔滨: 东北农业大学, 2013: 33-47.
[19] 张立. 香菇多糖对小鼠肠道粘膜免疫系统T细胞亚群的影响[D]. 广州: 广州中医药大学, 2012: 14-53.
[20] CHE Yi, ZHANG Hui, WANG Yuanxing, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry, 2014, 156: 279-288.
[21] ZHAO Zhonghui, ZHENG Xiaowei, FANG Fang. Ganoderma lucidum polysaccharides supplementation attenuates exercise -induced oxidative stress in skeletal muscle of mice[J]. Saudi Journal of Biological Sciences, 2014, 21(2): 119-123.
[22] JIANG Juan, GUO Yingjie, NIU Aijun. Extraction, characterization of Angelica sinensis polysaccharide and modulatory effect of the polysaccharide and Tai Chi exerciseon oxidative injury in middle-aged women subjects[J]. Carbohydrate Polymers, 2009, 77(2): 384-388.
[23] XU Chao, LÜ Junli, LO Y M, et al. Effects of oat β-glucan on endurance exercise and its anti-fatigue properties in trained rats[J]. Carbohydrate Polymers, 2013, 92(2): 1159-1165.
[24] 于滢, 秦华奇, 衣雪洁. 四君子汤和糖对过度训练大鼠胃肠功能和糖贮备的影响[J]. 沈阳体育学院学报, 2012, 31(2): 79-85.
[25] 于扬, 魏景艳. 谷胱甘肽过氧化物酶及其合成机制[J]. 生物物理学报, 2013, 29(10): 724-737.
[26] YUAN Chengfu, WANG Changdong, BU Youquan, et al. Antioxidative and immunoprotective effects of Pyracantha fortuneana (Maxim.) Li polysaccharides in mice[J]. Immunology Letters, 2010, 133(1): 14-18.
Extraction of Polysaccharides from Selenium-Rich Tea and Their Influence on Fatigue and Recovery after Exercise
CHI Ai-ping, LI Hong, KANG Chen-zhe, GUO Huan-huan, ZHANG Hai-meng, GUO Fei, WANG Yi-min
(School of Sports, Shaanxi Normal University, Xi’an 710119, China)
Objective: To evaluate the physical and chemical properties of polysaccharides from selenium-rich tea and the effects of these polysaccharides on swimming performance and recovery from swimming-induced fatigue in mice. Methods: The polysaccharides were extracted by using the method of water extraction and alcohol precipitation. The proximate composition and ultraviolet and infrared spectral characteristics of selenium-rich tea polysaccharides (STPs) were tested. At the same time, a 5-week endurance exercise model in mice was established, and the mice were given by oral gavage different doses of STPs. The swimming exhaustion time of mice was recorded and the concentrations of blood glucose, blood urea nitrogen (BUN), blood lactic acid (BLA) and the contents of hepatic glycogen and malonaldehyde (MDA) as well as the activity of hepatic glutathione peroxidase (GSH-Px) were measured immediately and at 24 h after exhaustive exercise. Results: STPs were Se-binding glycoproteins and could prolong the swimming exhaustion time, improve the carbohydrate metabolism, significantly increase the activity of GSH-Px and reduce the content of MDA in liver tissue of mice. Conclusion: STPs have an anti-fatigue effect in mice and the underlying mechanism is related to regulating the carbohydrate metabolism and improving tissue lipid peroxidation caused by excessive exercise.
selenium-rich tea polysaccharide (STP); exhaustive exercise; exercise-induced fatigue
G804.7
A
1002-6630(2014)13-0240-05
10.7506/spkx1002-6630-201413047
2014-04-11
中央高校基本科研业务费专项资金项目(GK201402046);陕西师范大学“211工程”项目(2010-93);陕西师范大学体育学院青年教师科研基金项目(2013140)
池爱平(1972—),男,副教授,博士,研究方向为运动营养与健康。E-mail:chimu@snnu.edu.cn



