朱晓璐*,程 浩,赵文杰,尹 曦,卢胜波
(1.河海大学 机电工程学院,江苏 常州;2.康达斯(南京)科技有限公司,江苏 南京)
铜是生物体必须的微量元素,成年人每天正常的铜摄入量约为1.5~3 mg[1]。生物体铜离子浓度需维持在一个相对稳定的水平(如,血清铜10~20 μmol/L),浓度过高或过低会造成严重生理问题,甚至危及生命[2-3]。铜对细胞代谢具有重要作用[4],铜代谢障碍会引起Menkes 氏综合征和Wilson 氏综合征。
为了实现对细胞的非破坏式的金属离子吸收度的高灵敏度且满足生物学研究需求的高精度定量检测,本文提出针对细胞培养基的特性,优化基于汞膜修饰工作电极的电化学测量设置,在对细胞完全培养基内铜离子浓度标定的基础上,通过检测细胞培养液中剩余铜离子浓度,推导出细胞在生长过程对铜离子的吸收量。最后讨论了汞膜修饰电极特点、培养基内铜离子溶出峰的特点及C2C12 细胞对铜离子的吸收机制。
1 试验材料与方法
1.1 仪器和试剂
试验仪器:恒温二氧化碳培养箱、倒置生物显微镜、实验室超纯水机、FA1004 电子分析天平、RST5060F 电化学工作站、SN-MS-1D 磁力搅拌器、电化学三电极系统,修饰的玻碳电极为工作电极(3 mm GCE),AgCl/Ag 电极为参比电极,铂片电极为对电极。
试验试剂材料与细胞培养方法:浓度120 mg/L Hg2+溶液;浓度0.1 g/L Cu2+溶液;浓度0.1 g/L Pb2+溶液;醋酸- 醋酸钠缓冲液(0.1 mol/L);Dulbecco's modified eagle medium(DMEM)培养基;完全培养基是包含10% 胎牛血清和1% 青霉素/链霉素双抗的DMEM 溶液。实验所用C2C12 细胞,于37℃,5% CO2条件下培养,约每48 h 传代一次。
1.2 玻碳电极预处理
先将裸玻碳(Glassy Carbon,GC)电极用去离子水冲洗,然后在麂皮上用2 μm、200 nm 和30 nm 的Al2O3浆连续抛光,之后用去离子水冲洗,紧接着放入硝酸(20%)、乙醇(75%)和去离子水中分别超声1 min,并在室温下干燥,得到表面清洁且呈镜面的玻碳电极。
1.3 修饰电极的制备
在工作电极上涂覆汞膜对于检测铜离子具有灵敏度提高,稳定性更好等特点[5]。取50 mL 浓度为120 mg/L 的Hg2+溶液于电解池中,加入搅拌子,置入三电极并接入电化学工作站,打开磁力搅拌器,调节转速为300 rpm,选择“恒电位电解i-t 曲线”,在-0.2 V 电压下富集240 s,得到汞膜修饰的玻碳电极,备用。图1 是裸玻碳电极和汞膜修饰电极在Cu2+和Pb2+浓度为50 ng/mL 的DMEM 培养基(不含血清)中的溶出伏安曲线对比。由图1 可知,汞膜修饰电极上电子传递效率优于裸电极。

图1 汞膜修饰的玻碳电极(Hg/GCE)与裸玻碳电极(GCE)对铜离子的检测对比曲线
1.4 电化学测量方法与步骤
完全培养基内Cu2+含量标定:完全培养基中含有Cu2+,主要因为其含有的胎牛血清中含Cu2+,所以,需要用去离子水对其中的Cu2+含量进行标定:(1)首先将去离子水对照组的用醋酸-醋酸钠缓冲液稀释5倍,最终pH 3.75, 体积为50 mL;(2)然后滴加2.5 μL 浓度10 mg/L 的CuCl2溶液,搅拌均匀后得到Cu2+浓度为0.5 ng/mL;(3)将汞膜修饰电极置入培养基中,设置参数如下:富集电位-1.2 V,富集时间480 s,起始电位-0.6 V,终止电位0 V,电位增量1mV,脉冲幅度0.1V,脉冲周期0.08 s,脉冲宽度0.01 s,采样宽度0.002 s,得0.5 ng/mL 时的差分脉冲溶出伏安曲线;(4)继续滴加CuCl2溶液,重复步骤3,最终得到0.5, 1.0, 2.0, 3.0, 4.0 ng/mL 条件下的差分脉冲溶出伏安曲线(以下简称曲线)。
1.5 样品标准浓度曲线的测定步骤
以检测10 ng/mL Cu2+为例,(1)首先将空白对照组(不含胎牛血清的DMEM, 未加铜离子)的培养基用醋酸-醋酸钠缓冲液稀释5 倍,体积为50 mL;(2)然后滴加5 μL 浓度10 mg/L 的CuCl2溶液,搅拌均匀;(3)将汞膜修饰电极置入培养基中,设置参数同上;(4)继续滴加CuCl2溶液,重复步骤(3),最终得到浓度为1,2,3,4,5,6 ng/mL 条件下曲线;(5) 将培养C2C12 细胞3 天后回收的10 mL 完全培养基按步骤(1)稀释5 倍,按照步骤(3),得到外加 10 ng/mL Cu2+的曲线;(6) 计算得到外加10 ng/mL 完全培养基中剩余Cu2+的含量。同理,对外加50 ng/mL 和500 ng/mL 铜离子的情况进行测量。
2 结果与讨论
2.1 完全培养基内所含Cu2+的浓度的测定结果
由于牛血清中的铜蓝蛋白和胺氧化酶都含有铜,所以完全培养基本身就含有一定量的铜[6],只是并非全部以离子形式存在。根据此测量,得到稀释5 倍后的完全培养基中Cu2+浓度为3.14 ng/mL,故原完全培养基中的铜离子浓度近似为3.14×5=15.7 ng/mL。
2.2 Cu2+对C2C12 生长增殖的影响
图2 表示加入梯度浓度Cu2+72 h 后对C2C12 细胞生长和增殖的影响。图2(a)表示对照组和初始添加10,50,500 ng/mL Cu2+的完全培养基实验组以初始细胞数为300 k 培养72 h 后的细胞生长形貌(10 cm培养皿),图2(b)表示细胞数量(10 cm 培养皿)。10 ng/mL Cu2+对细胞增殖具有促进作用。50 ng/mL Cu2+对细胞增殖具有促进作用且增殖率相对于10 ng/mL条件下更大。500 ng/mL Cu2+对细胞增殖具有抑制作用且作用很明显。

图2 加入不同浓度的Cu2+ 72 h 后对C2C12 细胞生长和增殖后数量的影响。第三天的细胞数量为平均值±标准差。
2.3 C2C12 成肌细胞对Cu2+吸收度的测量结果及讨论
在空白对照组培养基(DMEM)中添加预设定量的铜离子,进而测量出不同标准浓度对应的峰电流,进而确定标准曲线;接着利用峰电流与浓度之间的线性关系,确定实验组培养基中剩余Cu2+浓度。图3(a)中,用醋酸-醋酸钠缓冲液,将目标培养液稀释为原来体积的5 倍, 测得红线条峰值对应浓度约为2.1 ng/mL,故3 天后铜离子浓度接近10.5 ng/ml,即相对初始Cu2+浓度(25.7 ng/ml), 细胞约吸收了15.2 ng/ml 铜离子。同理,根据图3(b),50 ng/mL 实验组培养72 h 后,培养基中剩余Cu2+浓度为7.214 ng/mL × 5 = 36.07 ng/mL,表明细胞对Cu2+吸收量为50+15.7-36.07=29.63 ng/ml。根据图3(c),得到500 ng/mL 实验组培养72 h 后,细胞吸收Cu2+的量为129.44 ng/ml。
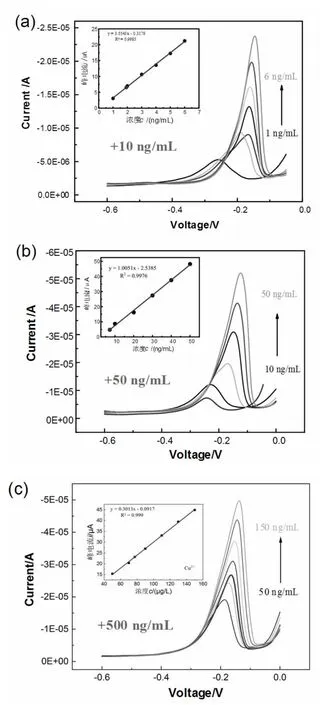
图3 加入不同浓度的Cu2+ 溶液72 h 后培养基中剩余Cu2+浓度的差分脉冲溶出伏安曲线及相应范围的浓度标定曲线
上述试验结果表明了本三电极体系及相关的参数配置能够定量检测培养基中的铜离子(最小可检测浓度变化量为0.5 ng/mL),且试验结果高度可重复。对于本体系中采用的汞膜修饰工作电极利于捕获铜离子的机制方面的解释如下:Cu2+在一定的预电解电位下富集后在汞膜上形成汞齐,静止一段时间后,再反扫到初始电位,使汞齐中已经被还原的铜单质氧化,变成铜离子后进入溶液。当测量时的溶液是醋酸盐缓冲液(不含培养基)时,Cu2+在-0.05 V 附近出现溶出峰,当介质溶液为细胞培养基时,铜溶出峰左移。其内在机制可能是培养基中的氨基酸、谷氨酰胺和多种维生素等使得铜离子在工作电极的沉积时受到干扰,铜汞之间的微观作用力相对减小,所以铜在培养基溶液中更容易溶出(溶出峰偏左)。
3 结论
本研究能够检测培养基内铜离子最低0.5 ng/mL的变化量,线性测量范围:1-150 ng/mL。当介质溶液为细胞培养基时,铜溶出峰左移。外加铜离子浓度达到50 ng/mL 时成肌细胞依然保持增殖,但外加铜离子浓度达到500 ng/mL 时成肌细胞数量下降,且细胞对铜离子的吸收度随初始添加的铜离子浓度变化而变化。



