菊轩 许崇涛*
快眼动睡眠剥夺及腺苷受体拮抗剂对抑郁模型大鼠自发活动的影响
菊轩许崇涛*
目的 研究快眼动睡眠剥夺(REMSD)抗抑郁机制中腺苷及其受体对抑郁模型大鼠自发活动的影响。方法 成年雄性SD大鼠56只,随机分为正常对照组(8只)和应激模型组(48只),应激模型组经21d慢性不可预见性应激(CUS)和单笼孤养建立抑郁模型,再随机分为抑郁模型组、睡眠剥夺组、水环境对照组、生理盐水对照组、腺苷A1受体拮抗剂组、腺苷A2A受体拮抗剂组,每组各8只;行72h REMSD观察大鼠自发活动路程的变化。结果 72h REMSD后,睡眠剥夺组总路程、中央路程、周边路程大于水环境对照组,差异有统计学意义(P<0.05);72h REMSD后,腺苷A1受体拮抗剂组总路程和周边路程较前明显增加,差异有统计学意义(P<0.01),中央路程无明显变化,差异无统计学意义(P>0.05);72 h REMSD后,腺苷A2A受体拮抗剂组总路程和周边路程较前显着增加,差异有统计学意义(P<0.01),中央路程增加,差异有统计学意义(P<0.05)。结论 72h REMSD可使抑郁模型大鼠的自发活动增加,在72h REMSD过程中腺苷A1受体或A2A受体失活时也可使抑郁模型大鼠的自发活动增加。
睡眠剥夺 腺苷 抑郁 自发活动
文献提示,睡眠剥夺可以快速发挥抗抑郁作用,而且无明确的禁忌证和副反应[1]。部分睡眠剥夺可使约60%的患者抑郁症状得以缓解[2],整夜的睡眠剥夺可使抑郁症患者汉密尔顿抑郁量表的总分下降50%[3]。睡眠剥夺可使腺苷水平明显升高,腺苷受体也会发生一系列的改变[4]。腺苷受体有4种亚型,其中A1和A2A受体在脑中含量最多,且在睡眠调节、情绪改变中起重要作用。本实验通过对慢性不可预见性应激(CUS)模型大鼠进行72h快眼动睡眠剥夺(REMSD)并结合腺苷受体拮抗剂,观察对大鼠自发活动的影响,以探讨睡眠剥夺抗抑郁机制中腺苷及其受体可能发挥的作用。
1 材料与方法
1.1实验动物 成年雄性SD大鼠(汕头大学医学院实验动物中心提供)56只,体质量220~260g。实验前1周开始昼夜交替各喂养12 h,环境温度22℃,大鼠自由进食、进水。
1.2实验仪器与试剂 DigBehv自发活动视频分析系统,大鼠睡眠剥夺箱:32cm×30cm×36cm,腺苷A1、A2A受体拮抗剂(Tocris公司,美国)。
1.3动物分组 大鼠随机分为正常对照组(8只)和应激模型组(48 只),并对其进行第1次行为学测试。应激模型组进行21d CUS,并进行第2次行为学测试。随后再将应激模型组分为抑郁模型组、睡眠剥夺组、水环境对照组、生理盐水对照组、腺苷A1受体拮抗剂(DPCPX)组、腺苷A2A受体拮抗剂(ZM241385)组,每组各8只。第2次行为学测试完成后对睡眠剥夺组、水环境对照组、生理盐水对照组、腺苷A1受体拮抗剂组、腺苷A2A受体拮抗剂组分别进行72h REMSD,并在72h REMSD过程中分别对生理盐水对照组,腺苷A1、A2A受体拮抗剂组注射生理盐水(1ml/kg)、腺苷A1受体拮抗剂(DPCPX 2mg/kg)、腺苷A2A受体拮抗剂(ZM241385 1mg/kg)[1]。72h REMSD后对上述5组进行第3次行为学测试。
1.4实验方法 (1)抑郁模型的建立:本实验选用21d CUS和单笼孤养两种模式建立抑郁模型[1],将行为束缚2h,4℃冰水游泳5min,禁食24h,禁水24h,明暗颠倒24h,夹尾1min,点击足底10min(10次/ min,1s/次),鼠笼倾斜45°24h,潮湿垫料10h,空瓶放置5h和45℃高温5min,11种刺激随机安排在21d 内,1种/d。在整个过程中刺激平均出现2~3次/种,同种刺激不能连续出现,使动物不能预料刺激的发生。(2)REMSD模型的建立[5]:本实验采用改良小平台睡眠剥夺法建立72h REMSD大鼠模型。在睡眠剥夺箱中央放置1个直径6.3 cm的平台,平台高8.0 cm,底部固定于水箱中央,在平台周边注满水,水温保持在22℃左右,水面距平台面约1.0 cm,大鼠站在平台上可自行饮食、饮水。当大鼠进入REM睡眠时,由于全身肌张力降低,节律性地垂头触水或落入水中而觉醒,从而使动物始终不能进入REM睡眠期。睡眠剥夺期间灯光持续照射,水箱中的水每天更换。水环境对照组采用与睡眠剥夺组尺寸相同的水箱,但在其底部则放置直径为18 cm的大平台,使大鼠可以在台上睡眠,其他条件均与睡眠剥夺组相同。各组处理时间均持续72h。(3)行为学测试:应用DigBehv动物自发活动视频跟踪分析系统检测大鼠的总路程、中央区路程、周边路程。在应激前、应激后及72 h REMSD后分别测定大鼠的自发活动。
1.5统计学方法 采用SPSS16.0统计软件。计量资料以(x±s)表示。多组比较采用单因素方差分析,自身前后比较采用配对样本t检验,两样本均数比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1REMSD对抑郁模型大鼠自发活动的影响 见表1。
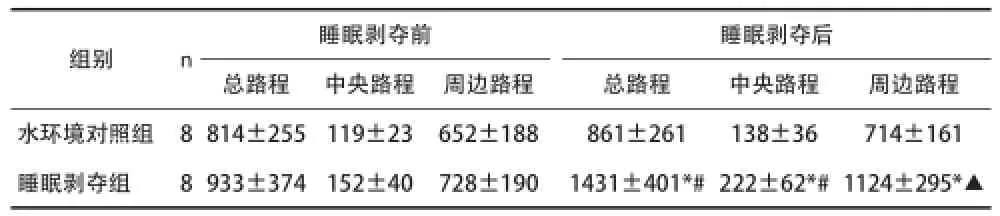
表1 REMSD对抑郁模型大鼠自发活动的影响[cm,(x±s)]
2.2腺苷A1、A2A受体拮抗剂对睡眠剥夺改善大鼠抑郁样行为的影响 见表2。
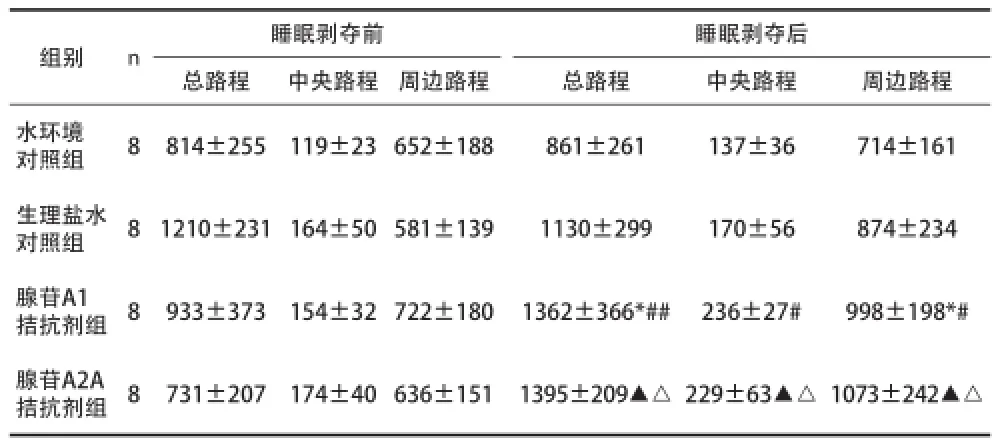
表2 各种处理方式对抑郁模型大鼠自发活动的影响[cm,(x±s)]
3 讨论
抑郁症的药物治疗需要长时间才能起效,而睡眠剥夺则可快速发挥抗抑郁作用,此特点明显优于抗抑郁药物[1]。本实验对抑郁模型大鼠进行72h REMSD,发现睡眠剥夺后抑郁组大鼠的活动路程明显增加。为排除水环境在方法上的干扰,本实验设置水环境对照组;结果发现睡眠剥夺组大鼠的活动路程相比水环境组有明显增加。所以72h REMSD可以逆转抑郁模型大鼠的抑郁样行为。睡眠剥夺后大鼠脑内能量代谢增加,ATP消耗增多,胞内腺苷含量随之增加,通过非浓度依赖型腺苷转运体将腺苷从胞内转移到胞外,进而作用于腺苷受体。通过特异性受体拮抗剂,可证明腺苷的抗抑郁作用是通过A1R和A2AR的激活来实现的[6]。电休克、睡眠剥夺和抗抑郁药物等多种抗抑郁治疗均可引起A1R上调[3],24h睡眠剥夺可以模拟SSRIs类药物的作用降低强迫游泳实验中大鼠的不动时间[7]。故作者推测睡眠剥夺的抗抑郁机制与腺苷及其受体有着密切的关系。
在持续觉醒状态下,细胞外腺苷水平会明显升高,腺苷本身对于记忆、认知、睡眠周期、焦虑和攻击行为都发挥重要的作用[8]。本项目在72h REMSD过程中对抑郁模型大鼠分别腹腔注射腺苷A1及 A2A受体拮抗剂。结果发现腺苷A1受体拮抗剂组前后比较总路程、周边路程明显增加,提示A1受体被选择性拮抗、A2A受体发挥主导作用时睡眠剥夺可以使抑郁模型大鼠的自发活动增加,发挥抗抑郁作用;腺苷A2A受体拮抗剂组前后比较,总路程、中央路程和周边路程显着增加,提示A2A受体被选择性拮抗、A1受体发挥主导作用时睡眠剥夺也可使抑郁模型大鼠的自发活动增加,发挥抗抑郁作用。本实验设立生理盐水对照组以排除腹腔注射的干扰,结果提示试验中单纯腺苷受体拮抗剂发挥作用。本实验发现72h REMSD过程中,腺苷A1和A2A受体分别失活时均可以发挥抗抑郁的效果。
腺苷作为神经调质在突触水平上影响其它神经递质的功能,当腺苷A1受体发挥主要作用时,抑郁模型大鼠经72h REMSD表现出抗抑郁作用。A1受体对于睡眠剥夺的抗抑郁作用是必须的,而且该受体的激活可持续维持抗抑郁作用[9]。腺苷A1受体可通过抑制兴奋性神经元的释放、降低细胞的兴奋性来保护细胞。腺苷与A1受体结合抑制5-HT的释放,而5-HT系统与抑郁症密切相关;有实验发现正常大鼠72h睡眠剥夺后,由于负反馈调节机制,海马及中脑腺苷A1受体mRNA表达明显降低[10],故可以推测72h睡眠剥夺抑制A1受体的表达,进而使腺苷抑制5-HT释放的作用减弱,使细胞间5-HT的含量增加发挥抗抑郁作用。也有实验证明睡眠剥夺改变星形胶质细胞介导的信号通路产生抗抑郁作用[9],而星形胶质细胞的作用通过A1受体的介导[11];A1受体可刺激星形胶质细胞释放神经保护因子,而且可通过PI3/ERK1/2/MAPK通路减少胶质细胞凋亡[12],所以可推测A1受体通过影响星形胶质细胞从而产生的抗抑郁效应。
当腺苷A2A受体发挥主要的作用时,抑郁模型大鼠经72h REMSD仍表现出抗抑郁作用。脑室内注射A2A受体激动剂可以促进视前核及腹外侧视前区GABA神经元的激活[13],同时A2A受体可影响纹状体GABA的释放[14];而GABA浓度的上升可产生明确的抗抑郁作用。腺苷A2A受体激动剂还可增强海马、纹状体单胺类神经递质的释放从而发挥抗抑郁作用[14]。内源性腺苷所介导的A2A受体激活,促进神经元的可塑性从而发挥抗抑郁作用[15]。故可推测睡眠剥夺可通过激活A2A受体产生抗抑郁作用。不过有实验提示睡眠剥夺可使嗅球、苍白核、尾状核3个实验脑区的腺苷A2A受体密度降低,与本实验的推测并不一致[16],其原因可能是由A2A受体与多巴胺受体形成的二聚体相互作用造成的[17]。
1Baghai TC,Moller HJ,Rupprecht R,et al.Recent Progress in pharmacological and non-pharmacological treatment options of major depression .Current Pharmaceutical Design,2006,12(4):503~515.
2Ellen T,Kahn-Greene,Desiree B,et al.The effects of sleep deprivation on symptoms of psychopathology in healthy adults.Sleep Medicine, 2007,8(8):215~221.
3Francesco Benedetti,Cristina Colombo.Sleep Deprivation in Mood Disorders. Neuropsychobiology,2011,64(3):141~151.
4Chapman D P,Perry G S,Strine T W.The vital link between chronic disease and depressive disorders .Prev Chronic Dis,2005,2(1): A14.
5Allard J S,Tiazbi Y,Shaffery J P,et al.Effects of rapid eye movement deep deprivation on hypocretin neurons in the hypothalamus of a rat model of depression.Neuropeptides,2007,41(5):329~337.
6Kaster MP,Rosa A,Rosso MM,et al.Adenosine administration produces an antidepressant like effect in mice: evidence for the involvement of A1 and A2A receptors.Neurosci Lett,2004,355(1~2):21~24.
7Hua-Cheng YAN, Xiong CAO, Manas Das, et al. Behavioral animal models of depression . Neurosci Bull,2010,26(4): 327~337.
8J.A. Ribeiro,A.M. Sebastia,A. de Mendonc,et al. Adenosine receptors in the nervous system: pathophysiological implications .Prog Neurobiol,2003,26(8):377~392.
9DJ Hines,LI Schmitt,RM Hines,et al.Antidepressant effects of sleep deprivation require astrocyte-dependent adenosine mediated signaling. Transl Psychiatry,2013,3:e212.
10张金玲,张印南,唐建军,等.睡眠剥夺对大鼠自发活动及各脑区腺苷A1受体表达的影响.汕头大学医学院学报,2012,25(4):202~205.
11L.Ian Schmitt,Robert E. Sims,Nicholas Dale,et al.Wakefulness Affects Synaptic and Network Activity by Increasing Extracellular Astrocyte-Derived Adenosine. The Journal of Neuroscience,2012, 32(13):4417~4425.
12Dalimontel,Ballerinip,Nargie,et al.Staurosporine-induced apoptosis in astrocytes is prevented by A1 adenosine receptor activation .Neuroscilett, 2007,418(1):66~71.
13Sunil Kumar,Seema Rai,Kung-Chiao Hsieh,et al.Adenosine A2A receptors regulate the activity of sleep regulatory GABAergic neurons in the preoptic hypothalamus. Am J Physiol Regul Integr Comp Physiol,2013,305:31~41.
14Sebastião AM, Assaife-Lopes N,Diógenes MJ,et al. Modulation of brain-derived neurotrophic factor (BDNF) actions in the nervous system by adenosine A(2A) receptors and the role of lipid rafts.Biochim Biophys Acta,2011, 1808(5):1340~1349.
15Emily Urry,Hans Peter Landolt. Adenosine,Caffeine,and Performance From Cognitive Neuroscience of Sleep to Sleep Pharmacogenetic.Curr Top Behav Neurosci,2015,25:331~366.
16Youngsoo KimDavid,Elmenhorst Angela,Weisshaupt,et al. Chronic sleep restriction induces long-lasting changes in adenosine and noradrenaline receptor density in the rat brain. Journal of Sleep Research,2015,4. Epub ahead of print.
17Lazarus M,Chen J F,Urade Y et al.Role of the basal ganglia in the control of sleep and wakefulness.Curr Opin eurobiol,2013,23(5):780~785.
Objective To investigate the effects of adenosine and its receptors for spontaneous activities of depression-model rats in antidepressive mechanism of Rapid-Eye-Movement sleep deprivation (REMSD). Methods 56 adult males Sprague-Dawley rats were randomly divided into two groups: normal control group (n=8) and stress-model group (n=48). The stress-model group used chronic unpredicted stress(CUS) and Single cage solitary raise way to establish depression model. The stress-model group were divided into six groups in randomized method:the depression-model group (n=8),sleep deprivation group(n=8),water control group(n=8),adenosine A1 receptor antagonist group(n=8),adenosine A2A receptor antagonist group(n=8),saline group(n=8). The function of the 72h REMSD was to observe the changes of rats spontaneous activities of the distance. Results After 72 hours sleep deprivation,the total distance the central distance and the around distance in sleep deprivation group was longer than that in water control group(P<0.05); After 72h REMSD,the total distance and the around distance in A1 receptor antagonist group increased significantly compared with that before perform(P<0.01),the central distance had no significant difference(P>0.05). After 72 h REMSD,the total distance and the around distance in A2A receptor antagonist group increased significantly compared with that before perform(P<0.01),the central distance increased compared with that before perform(P<0.05).Conclusion The spontaneous activities of depression-model rats can be increased by 72h REMSD. In the process of 72h REMSD,the spontaneous activities of depression-model rats can be also increased when the A1 receptor antagonist or A2A receptor antagonist were inactivated.
Sleep deprivation Adenosine Depression Spontaneous activity
国家自然科学基金资助项目(30670756)
310013杭州市第七人民医院(菊轩)515065汕头大学精神卫生中心(许崇涛)



