李国术,何平平,王 波,周寿红,欧阳新平△
(1.衡阳市中心医院急诊科,湖南衡阳 421001;2.南华大学心血管疾病研究所/生理学教研室,湖南衡阳 421001;3.南华大学附属第一医院麻醉科,湖南衡阳 421001)
泡沫细胞的形成是动脉粥样硬化(artherosclerosis,AS)重要的病理学基础,单核巨噬细胞吞噬修饰的低密度脂蛋白,特别是氧化修饰低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)而形成泡沫细胞[1]。肝外组织细胞中的胆固醇通过血液运输到肝脏,合成胆汁排出体外,称为逆向胆固醇转运(reverse cholesterol transport,RCT)。RCT能力的减弱是泡沫细胞形成的重要原因。三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)被称作RCT的“看门人”,发挥抗 AS作用[2]。硫化氢(hydrogen sulfide,H2S)被称为第3种气体信号分子,广泛分布于各系统中[3-4]。H2S能延缓AS的进程,缩小AS斑块,具有抗AS作用[5]。本研究旨在观察H2S对泡沫细胞胆固醇流出和ABCA1表达的影响,探讨H2S抗AS的机制。
1 材料与方法
1.1 细胞培养与分组 RAW264.7细胞购自中科院上海细胞库。细胞培养于含10%胎牛血清的RPMI1640培养液中。细胞融合60%~70%时,ox-LDL(50μg/mL)孵育48h,转变成泡沫细胞。实验分为泡沫细胞组、硫氢化钠(sodium hydrosulfide,NaHS)(10-5、10-4和10-3mol/L)处理0、12、24和48h组。
1.2 方法
1.2.1 试剂及仪器 NaHS购自Sigma公司。[3H]标记的胆固醇(原子能院同位素所)。ABCA1兔抗鼠一抗以及辣根过氧化物酶标记羊抗兔二抗购自Santa Cruz公司。MMLV第一链cDNA合成试剂盒、总RNA提取试剂盒和Hot Star Taq Master Mix试剂盒购自Invitrogen公司。
1.2.2 胆固醇流出检测 对数生长的细胞,浓度为3.0×106个/mL,接种6孔板,含10%胎牛血清、0.2μCi/L[3H]标记的胆固醇和ox-LDL(50μg/mL)的培养液共敷育48h。H2S组用 NaHS(10-5、10-4和10-3mol/L)继续敷育12、24和48h。更换培养液,细胞在无血清含50μg/mL载脂蛋白AI的新鲜培养液中敷育12h,液闪仪检测培养液和细胞中的[3H]胆固醇浓度。胆固醇流出率用培养液中[3H]/总值[3H](培养液+细胞)×100%表示。

表1 H2S对泡沫细胞内FC及CE浓度的影响(n=5)
表2 H2S对泡沫细胞内胆固醇流出的影响(,n=5)

表2 H2S对泡沫细胞内胆固醇流出的影响(,n=5)
a:P<0.05,与泡沫细胞组比较;b:P<0.05,与 NaHS(10-5 mol/L)组比较。c:P<0.05,与 NaHS(10-4 mol/L)组比较;d:P<0.05,与 NaHS处理0h比较。e:P<0.05,与NaHS处理12h比较;f:P<0.05,与 NaHS处理24h比较。
胆固醇流出率(%)组别0h 12h 24h 48h泡沫细胞组 13.46±1.76 14.39±2.06 15.15±1.94 17.82±2.25 NaHS(10-5 mol/L)组 13.79±1.54 14.26±1.84 17.69±2.17 20.43±3.14 NaHS(10-4 mol/L)组 14.21±1.13 15.51±1.64 28.91±3.65abde 36.80±1.13abdef NaHS(10-3 mol/L)组 14.68±1.79 16.37±2.12 42.77±4.21abcde 54.17±5.71abcdef
1.2.3 高效液相色谱检测 超声破碎细胞,BCA法蛋白定量。细胞裂解产物分成两份,一份测定游离胆固醇(free cholesterol,FC),加入等体积8.9mmol/L的KOH醇。另一份测定总胆固醇(total cholesterol,TC),加入等体积的15%KOH醇。两份样本加入6%三氯乙酸及等体积正己烷和异丙醇的混合溶液,1500r/min离心5min,收集上层有机相。加入100μL异丙醇、正庚烷和乙晴的混合溶液溶解样品。1500r/min离心5min,收集上清液进行高效液相色谱分析。采用C18柱,以异丙醇∶正庚烷∶乙晴为流动相进行非梯度洗脱,流速为1mL/min,216nm波长下检测,以峰面积定量胆固醇。胆固醇酯(cholesterol ester,CE)经胆固醇酯酶水解为胆固醇,测定TC量,TC量减去FC量为CE量,以mg/mg细胞蛋白为胆固醇和CE单位。
1.2.4 实时定量PCR检测 收集细胞,Trizol提取细胞的总RNA。提取的总RNA为模板进行逆转录反应,合成cDNA第一链。取cDNA样品梯度稀释,进行实时定量PCR反应,反应总体系为30μL,包含cDNA 4μL,上下游引物各1μL,dNTP Mix(2×)8μL。ABCA1引物:上游:5′-AGG AAA CCC AAT CCC AGA TAC CC-3′,下游:5′-GCT CGG AGG AAG TGC TTG AGA AT-3′。β-actin引物:上游:5′-CCA TCA TCT TGC AGG AGC G-3′,下游:5′-CTG GCA GTG AGC TAT ACT CG-3′。采用2-△△CT法处理数据。
1.2.5 Western blotting检测 提取细胞总蛋白,BAC法蛋白定量。100μL样本加入到2×SDS凝胶加样缓冲液中煮沸。凝胶电泳1h分离蛋白质,分离的蛋白转膜至聚偏氟乙稀膜上。10%脱脂牛奶封闭2h,加入兔抗鼠ABCA1和β-actin一抗,4℃下过夜。加入羊抗兔二抗,孵育6h。显影后进行半定量分析。
1.3 统计学处理 采用SPSS16.0统计软件进行统计分析,计量资料用表示,单因素方差分析后,组间差异比较用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 H2S对泡沫细胞内FC及CE浓度的影响 与泡沫细胞组相比,NaHS(10-4、10-3mol/L)处理24h或 NaHS(10-4mol/L)处理48h均显着降低了泡沫细胞中TC、FC和CE及CE/TC水平(P<0.05)。NaHS(10-5mol/L)处理24h和NaHS(10-4mol/L)处理12h细胞中TC、FC和CE及CE/TC水平与泡沫细胞组相比差异无统计学意义(P>0.05),见表1。
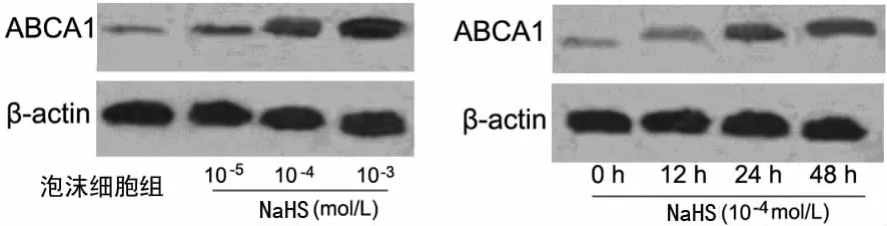
图1 H2S对泡沫细胞ABCA1蛋白表达的影响
表3 H2S对泡沫细胞ABCA1表达的影响(,n=5)
表3 H2S对泡沫细胞ABCA1表达的影响(,n=5)
a:P<0.05,与泡沫细胞组比较;b:P<0.05,与 NaHS(10-5 mol/L)24h组比较。c:P<0.05,与NaHS(10-5 mol/L)24h组比较;d:P<0.05,与 NaHS(10-4 mol/L)12h组比较;e:P<0.05,与 NaHS(10-4 mol/L)24h组比较。
组别 ABCA1mRNA相对表达水平(%)ABCA1蛋白100.00±0.00 0.15±0.02 NaHS(10-5 mol/L)24h组 103.27±3.65 0.17±0.03 NaHS(-4 mol/L)24h组 125.76±5.14abd 0.48±0.05abd NaHS(-3 mol/L)24h组 148.63±8.36abc 0.98±0.12abc NaHS(-4 mol/L)12h组 105.38±2.47 0.16±0.02 NaHS(-4 mol/L)48h组 156.79±5.96ade 0.96±0.13相对表达水平泡沫细胞组ade
2.2 H2S对泡沫细胞内胆固醇流出的影响 与泡沫细胞组相比,NaHS(10-4、10-3mol/L)处理24和48h时间和浓度依赖的方式增加泡沫细胞胆固醇流出(P<0.05)。NaHS(10-5mol/L)处理12、24和48h及 NaHS(10-5、10-4、10-3mol/L)处理12h没有影响泡沫细胞胆固醇流出(P>0.05),见表2。
2.3 H2S对泡沫细胞ABCA1mRNA和蛋白表达的影响 与泡沫细胞组相比,NaHS(10-4和10-3mol/L)处理 24h或NaHS(10-4mol/L)处理48h均显着上调细胞中 ABCA1mRNA和蛋白表达(P<0.05),呈时间和浓度依赖性。NaHS(10-5mol/L)处理24h及 NaHS(10-4mol/L)处理12h细胞中ABCA1的表达与泡沫细胞组相比差异无统计学意义(P>0.05)。见图1和表3。
3 讨 论
AS发病机制十分复杂,至今尚未阐明。H2S具有改善血管内皮功能、调节平滑肌细胞凋亡和增殖、抑制血管重构、舒张血管和抗氧化等心血管保护作用[6]。研究表明H2S具有抗AS的作用,但机制没有完全阐明[7]。研究发现H2S可以延缓对ApoE基因敲除小鼠AS的进程,减小AS斑块[8]。本研究结果表明H2S降低了泡沫细胞内胆固醇和胆固醇酯的浓度,增加胆固醇的流出率。
在致病因素的作用下,单核巨噬细胞在血管内膜下吞噬过多的胆固醇和磷脂,特别是ox-LDL,以脂滴的形式聚集在细胞内形成泡沫细胞[9-10]。巨噬细胞摄取过多脂质并沉积于血管内膜下,本身是一种自我保护机制,关键是这些细胞摄取脂质后能否将其代谢并转运出去。细胞脂质摄取与流出的失衡是泡沫细胞形成的关键。ABCA1在巨噬细胞胆固醇流出和RCT的过程中发挥十分重要的作用[11]。研究发现H2S能下调巨噬细胞CD36mRNA和蛋白表达,减少ox-LDL摄取,抑制泡沫细胞形成[12]。那么H2S能否影响细胞RCT,而发挥抗AS的作用?本研究结果表明H2S以剂量和浓度依赖方式上调了巨噬细胞性泡沫细胞中ABCA1mRNA和蛋白的表达,并增加泡沫细胞中胆固醇流出。因此H2S抗AS的作用可能与通过上调泡沫细胞中ABCA1表达并促进胆固醇流出有关。
[1]Karper JC,Ewing MM,Habets KL,et al.Blocking tolllike receptors 7and 9reduces postinterventional remodeling via reduced macrophage activation,foam cell formation,and migration[J].Arterioscler Thromb Vasc Biol,2012,32(8):e72-e80.
[2]饶春燕,乐湘华.硫化氢在炎症反应中的作用研究进展[J].重庆医学,2012,41(6):609-611.
[3]Martelli A,Testai L,Breschi MC,et al.Hydrogen sulphide:novel opportunity for drug discovery[J].Med Res Rev,2012,32(6):1093-1130.
[4]Chen Y,Zhao J,Du J,et al.Hydrogen sulfide regulates cardiac sarcoplasmic reticulum Ca2+uptake via K(ATP)Channel and PI3K/Akt pathway[J].Life Sci,2012,91(7/8):271-278.
[5]Zhang H,Guo C,Wu D,et al.Hydrogen sulfide inhibits the development of atherosclerosis with suppressing CX3CR1and CX3CL1expression[J].PLoS One,2012;7(7):e41147.
[6]Qiao W,Chaoshu T,Hongfang J,et al.Endogenous Hydrogen sulfide is involved in the pathogenesis of atherosclerosis[J].Biochem Biophys Res Commun,2010,396(2):182-186.
[7]Mani S,Li H,Untereiner A.Decreased endogenous production of hydrogen sulfide accelerates atherosclerosis[J].Circulation.2013,127(25):2523-2534.
[8]Wang Y,Zhao X,Jin H,et al.Role of Hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice[J].Arterioscler Thromb Vasc Biol,2009,29(2):173-179.
[9]Huang Z,Dong F,Li S,et al.Berberine-induced inhibition of adipocyte enhancer-binding protein 1attenuates oxidized low-density lipoprotein accumulation and foam cell formation in phorbol 12-myristate 13-acetate-induced macrophages[J].Eur J Pharmacol,2012,690(1/2/3):164-169.
[10]李华波.普伐他汀与罗格列酮联合作用对巨噬细胞ABCAl表达的影响[J].重庆医学,2010,39(7):777-779.
[11]Ma L,Dong F,Zaid M,et al.ABCA1protein enhances Toll-like receptor 4 (TLR4)-stimulated interleukin-10(IL-10)secretion through protein kinase A (PKA)activation[J].J Biol Chem,2012,287(48):40502-40512.
[12]Zhao ZZ,Wang Z,Li GH,et al.Hydrogen sulfide inhibits macrophage-derived foam cell formation[J].Exp Biol Med(Maywood),2011,236(2):169-176.



