佘瑞芳,伏 兵,刘建华,钱明月,田亚平,陈皆春△
(1.蚌埠医学院附属连云港医院神经内科,江苏连云港 222000;2.中国人民解放军总医院生化科,北京 100853)
脑卒中位列全球人口全因病死率第4位,尤其在低、中等收入国家,其发病率仍在不断升高[1]。有研究提出,非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)可能是一个新的心脑血管疾病危险因子,并可预示心脑血管疾病的患病风险和病死率[2]。Worthmann等[3]提出,血浆 ADMA水平可独立推测脑卒中预后。然而,血浆ADMA水平与脑梗死病灶大小及病情严重程度有无相关性,及相互作用的病理生理机制如何,目前相关文献较少。本研究从临床实践中探索血浆ADMA水平与急性脑梗死病灶大小及病情严重程度的相关性,以期为临床提供一种急性脑梗死病情判断的指标,并为缺血性脑卒中探寻新的治疗靶点。
1 资料与方法
1.1 一般资料 选取2012年12月至2013年6月蚌埠医学院附属连云港医院,符合标准神经内科住院的急性脑梗死患者及体检中心同期健康体检者共186例。其中急性脑梗死组126例,男73例,女53例,平均年龄(63.44±9.92)岁;健康体检者60例为对照组,其中男34例,女26例,平均年龄(63.85±8.57)岁。急性脑梗死组纳入标准:首次发病;年龄40~80岁;病程72h内;梗死位于前循环供血区;符合全国第4届脑血管病会议修订的关于脑梗死的诊断标准[4],并经头颅CT/磁共振成像/磁共振扩散加权成像等影像学证实;知情同意,依从性好。排除标准:有严重感染或自身免疫性疾病者;有脑肿瘤、脑出血、出血性脑梗死的患者;近3个月有心肌梗死病史者;心房颤动、甲状腺疾病,严重心、肝、肾功能不全者。对照组纳入标准:年龄、性别与急性脑梗死组相匹配,经询问病史既往无脑血管病病史。
1.2 方法 急性脑梗死组依据梗死灶面积大小分为4组[5]:腔隙性梗死组(梗死最大径线1.5cm以下);小梗死组(梗死最大径线为1.6~3.0cm);中梗死组(梗死小于一个脑叶,最大径线为3.1~5.0cm);大梗死组(超过一个脑叶,或最大径线5 cm以上)。神经功能缺损程度分型:按美国国立卫生研究所卒中量表(NIHSS)评分进行神经功能缺损程度评估,分为轻型梗死组(<4分)、中型梗死组(4~15分)、重型梗死组(>15分)[6]。标本采集:所有患者于入院后第2天清晨空腹时,用肝素锂抗凝管收集新鲜静脉血3mL,离心(3000r/min,10 min),吸取上清血浆置于-80℃冰箱中保存。为减小批间误差和测量误差,完成全部标本采集后一次性成批检测。血浆ADMA采用酶联免疫吸附法(ELISA)进行检测,试剂盒及质控品购自北京九强生物技术股份有限公司,操作完全按照说明书进行。三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)的测定用RxL Max HM全自动生化分析仪。
1.3 统计学处理 采用SPSS13.0软件进行数据处理。对所有计量资料进行正态性或方差齐性检验,符合正态分布的资料采用表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析。计数资料采用频数、百分比表示,组间比较采用χ2检验。相关性分析采用Spearman相关分析法。所有检验均采用双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 急性脑梗死组与对照组基本资料比较 两组研究对象的性别、年龄,差异无统计学意义(P>0.05)。吸烟史、高血压病史、糖尿病病史、TG、LDL、HDL比较,差异均有统计学意义(P<0.05)。见表1。
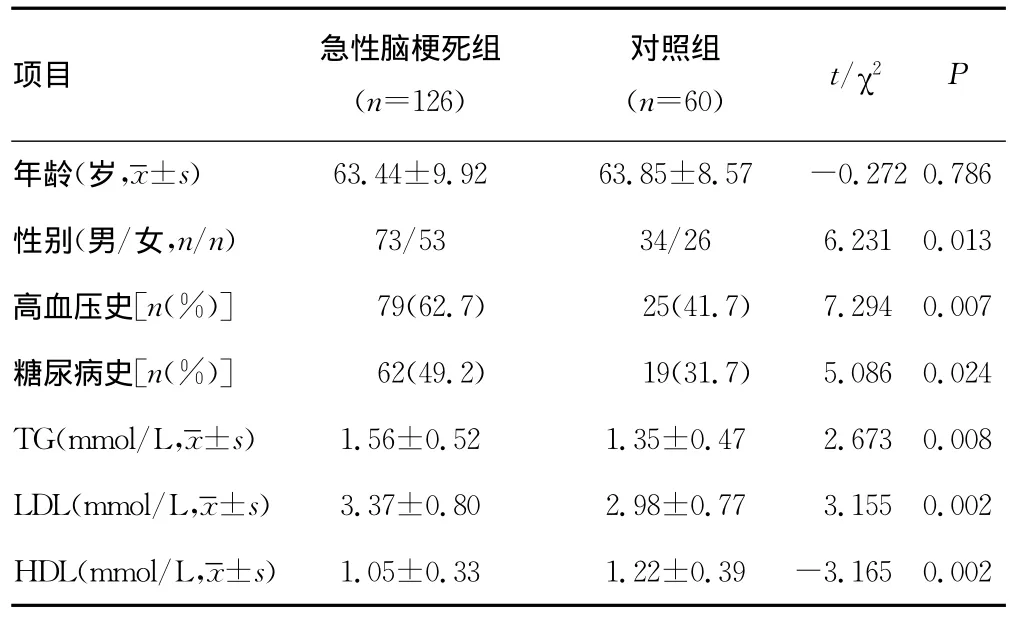
表1 急性脑梗死组与对照组一般资料比较
2.2 血浆ADMA浓度与脑梗死病灶面积的关系 腔隙性梗死组、小梗死组、中梗死组、大梗死组的血浆ADMA水平均高于对照组,差异均有统计学意义(P<0.01)。不同梗死面积组间多重比较,腔隙性梗死组与小梗死组、中梗死组、大梗死组比较,差异均有统计学意义(P=0.010、P=0.000、P=0.000);小梗死组与中梗死组、大梗死组比较,差异均有统计学意义(P=0.035、P=0.000);中梗死组与大梗死组比较,差异有统计学意义(P=0.028)。见表2。Spearman相关分析发现血浆ADMA水平与病灶面积大小呈正相关(r=0.633,P=0.000)。
2.3 血浆ADMA浓度与神经功能缺损程度的关系 轻型梗死组、中型梗死组、重型梗死组的血浆ADMA水平均高于对照组,差异均有统计学意义(P<0.01)。不同神经损伤程度组间多重比较,轻型梗死组与中型梗死组、重型梗死组比较,差异均有统计学意义(P=0.017、P=0.000);中型梗死组与重型梗死组比较,差异有统计学意义(P=0.010),见表3。Spearman相关分析发现血浆ADMA与神经功能缺损程度呈正相关(r=0.392,P=0.000)。

表2 不同梗死面积组与对照组血浆ADMA比较
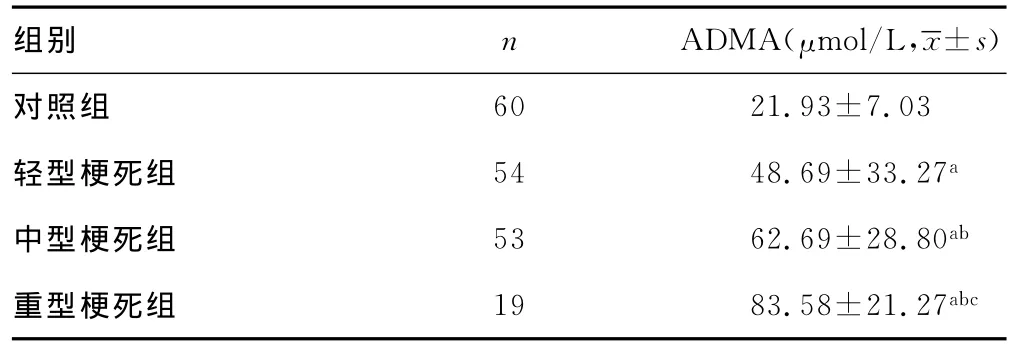
表3 不同神经功能缺损程度与对照组血浆ADMA比较
3 讨 论
ADMA是一种内源性一氧化氮合酶抑制剂,主要由蛋白精氨酸甲基转移酶-1(protein arginine methyltransferase,PRMT-1)催化含甲基化精氨酸残基的蛋白水解产生[7],大部分在二甲基精氨酸二甲胺水解酶-1(dimethylarginine dimethylaminohydrolase DDAH-1)的作用下代谢为L-胍氨酸和二甲胺[8],从而形成一条 PRMT1-ADMA-DDAH1代谢轴。若该代谢轴两端的表达或功能异常,就可致ADMA堆积。具体概述为:(1)PRMT-1基因表达或酶活性增强:氧化应激增强[9]、氧化修饰型LDL增多等[10]。(2)甲基化蛋白水解速率增加:见于机体代谢增加的情况下,如发烧、甲状腺功能亢进等。(3)肾功能不全使滤过功能下降导致排泄减少。(4)DDAH-1基因表达或酶活性下降:氧化应激、高血糖、高同型半胱氨酸、高血压、氧化修饰型LDL、炎性反应等[11]。(5)其他因素:如碱性氨基酸转运蛋白-1表达下降使从循环中摄取ADMA到细胞内的量减少,从而导致血浆中ADMA水平升高[12]。
脑梗死急性期脑组织缺血缺氧氧化应激释放活性氧族物质,梗死病灶越大其释放越多,再加上酸中毒、炎性反应等影响,使PRMT-1基因表达上调及酶活性增强,DDAH-1基因表达下调、酶活性受抑制,从而导致ADMA积聚。先前研究提出,脑梗死急性期ADMA在血浆[13]和脑脊液[14]中的浓度均有增加。本研究将急性脑梗死患者依据病灶面积大小分为腔隙性、小、中、大梗死4个亚组,检测血浆ADMA水平,比较组间差异,分析其与病灶大小的相关性。结果发现急性脑梗死组血浆ADMA水平高于对照组,并且血浆ADMA水平与病灶大小呈正相关(r=0.633,P=0.000)。研究表明ADMA参与了急性脑梗死的病理生理过程,通过测定血浆ADMA水平能反映中枢神经细胞的损伤和死亡程度,这与Leong等[15]研究结果基本一致。本研究还发现血浆ADMA水平与入院时NIHSS评分呈正相关(r=0.392,P=0.000),提示血浆 AD-MA水平可反映急性脑梗死患者病情的严重程度,与金艳等[16]研究结果相符。
综上所述,急性脑梗死患者血浆ADMA水平升高,且随病灶增大和神经功能缺损程度加重而升高,提示ADMA参与了急性脑梗死的病理生理过程。测定血浆ADMA水平对评估急性脑梗死患者病灶大小、病情严重程度,进而判断其预后具有重要意义。
[1]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235causes of death for 20age groups in 1990and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095-2128.
[2]Sibal L,Agarwal SC,Home PD,et al.The role of asymmetric dimethylarginine(ADMA)in endothelial dysfunction and cardiovascular disease[J].Curr Cardiol Rev,2010,6(2):82-90.
[3]Worthmann H,Chen S,Martens-Lobenhoffer J,et al.High plasma dimethylarginine levels are associated with adverse clinical outcome after stroke[J].J Atheroscler Thromb,2011,18(9):753-761.
[4]中华神经科学会中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[5]黄如训.神经病学[M].4版.北京:高等教育出版社,2010:332.
[6]饶明俐.中国脑血管病防治指南[M].北京:人民卫生出版社,2007:140-141.
[7]Leiper J,Nandi M.The therapeutic potential of targeting endogenous inhibitors of nitric oxide synthesis[J].Nat Rev Drug Discov,2011,10(4):277-291.
[8]Blackwell S.The biochemistry,measurement and current clinical significance of asymmetric dimethylarginine.[J].Ann Clin Biochem,2010,47(Pt 1):17-28.
[9]Himmelfarb J.Uremic toxicity,oxidative stress,and hemodialysis as renal replacement therapy[J].Semin Dial,2009,22(6):636-643.
[10]Ueda S,Yamagishi S,Okuda S.New pathways to renal damage:role of ADMA in retarding renal disease progression[J].J Nephrol,2010,23(4):377-386.
[11]卜云涛,边波,万征.非对称性二甲基精氨酸和冠状动脉性心脏病及其危险因素的关系[J].中国循证心血管医学杂志,2011,3(1):63-66.
[12]Teerlink T.ADMA metabolism and clearance[J].Vasc Med,2005,10(1):73-81.
[13]Wanby P,Teerlink T,Brudin L,et al.Asymmetric dimethylarginine(ADMA)as a risk marker for stroke and TIA in a Swedish population[J].Atherosclerosis,2006,185(2):271-277.
[14]Brouns R,Marescau B,Possemiers I,et al.Dimethylarginine levels in cerebrospinal fluid of hyperacute ischemic stroke patients are associated with stroke severity[J].Neurochem Res,2009,34(9):1642-1649.
[15]Leong T,Zylberstein D,Graham I,et al.Asymmetric dimethylarginine independently predicts fatal and nonfatal myocardial infarction and stroke in women:24-year follow-up of the population study of women in Gothenburg[J].Arterioscler Thromb Vasc Biol,2008,28(5):961-967.
[16]金艳,张春和,王艳玲.脂蛋白相关磷脂酶A2和非对称二甲基精氨酸与急性缺血性脑卒中的相关性研究[J].中国医药,2012,7(11):1366-1368.



