朱 鸿,李想韵,王 松,付伟丽,唐靓婷,诰赵伟,唐云明*
鸭肝谷氨酸脱氢酶的纯化与酶学性质研究
朱 鸿,李想韵,王 松,付伟丽,唐靓婷,诰赵伟,唐云明*
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆市甘薯工程研究中心,重庆 400715)
目的:获得鸭肝谷氨酸脱氢酶纯品并对其酶学性质进行研究。方法:采用丙酮脱脂、重金属离子沉淀、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析和Sephacryl S-200凝胶层析方法,分离纯化鸭肝谷氨酸脱氢酶,用SDS-聚丙烯酰胺凝胶电泳法进行纯度鉴定和酶相对分子质量测定。结果:从鸭肝中分离纯化获得电泳纯的谷氨酸脱氢酶,纯化倍数为60.93倍,酶活力回收率为11.02%,比活力达24.37U/mg。酶相对分子质量为371.41,亚基相对分子质量为61.60。推测该酶由6个相同亚基构成。该酶对NADH的Km为53.19μmol/L,最适pH值为10.0,最适反应温度为35℃。该酶在pH8.0左右较稳定;在40℃以下酶活力保持稳定。Zn2+、Li+和Cu2+对该酶具有显着的抑制作用。结论:分离纯化获得谷氨酸脱氢酶,该酶具有较高应用价值。
鸭肝;谷氨酸脱氢酶;分离纯化;性质
谷氨酸脱氢酶(glutamate dehydrogenase,GDH)可逆催化谷氨酸脱氨生成α-酮戊二酸和氨,是一种依赖NAD(P)的脱氢酶[1]。也是是生物体内谷氨酸生物合成的一种重要酶[2]。自20世纪60年代以来已经有不同来源的GDH得到分离纯化和研究[2-5]。Britton等[6]证明GDH主要以六聚体和四聚体形式存在,并且具有相同的亚基。该酶在化学分析,医药卫生等领域具有重要的应用[7]。
GDH广泛存在于动物、植物和微生物中[8]。但目前还存在依赖进口,酶源窄,成本高,价格昂贵等不足,因此寻找一种廉价的酶源是市场降低成本的需要。本实验以来源广泛的鸭肝为原料对GDH进行分离纯化和酶学性质研究,为谷氨酸脱氢酶的进一步研究和应用提供参考,也为该酶的获得开辟一条有效途径。
1 材料与方法
1.1 材料与试剂
家鸭(Anas platyrhynchos)肝脏取自健康活鸭,杀死后立即取肝脏于-20℃冰箱中冰冻保存备用。
牛血清白蛋白、NADH、ADP 美国Sigma公司;DEAE-Sepharose、Sephacryl S-200、分子质量标准品GE公司;三羟甲基氨基甲烷 Farco公司;蛋白质SDSPAGE标准品、Marker(MM0900) Genscript公司;考马斯亮蓝R-250、丙烯酰胺、甲叉-双丙烯酰胺 Fluka公司;其余试剂均为国产分析纯。
1.2 仪器与设备
3704型高速冷冻离心机 日本玖保田公司;UV-2102 PC型分光光度计 上海尤尼柯仪器有限公司;N355制冰机 意大利Icematic公司;Bio-spemini型蛋白核酸分析仪 日本岛津公司;DYY-Ⅱ型电泳仪 北京六一公司、PHS-32W微电路pH计 上海理达公司;F-20S冷冻干燥仪 日本Nihon公司;BSZ-2型自动双蒸馏水仪上海博通公司;Mill-Q plus超纯水仪 美国Millipore公司;Powerlook 2100XL凝胶扫描仪 台湾Umax公司;AKTA prime plus蛋白质纯化系统 GE公司。
1.3 方法
1.3.1 丙酮干粉的制备
称取新鲜鸭肝50g,用自来水洗净,再用双蒸水清洗数次。剪碎,然后以1:10(m/V)的比例加入经-20℃预冷的丙酮,匀浆后抽滤脱脂得滤饼。两次丙酮脱脂后将滤饼冷冻干燥至质量恒定。研磨成干粉备用。
1.3.2 粗提液的制备
将丙酮干粉以1:20(m/V)的比例加入已经预冷的0.05mol/L、pH8.0的Tris-HCl缓冲液。匀浆后,4℃冰箱静置抽提2h,6000×g离心1h,收集上清液即得粗提液。
1.3.3 重金属离子沉淀
粗提液加入MnCl2溶液使Mn2+终浓度为7mmol/L,4℃冰箱静置2h后,6000×g离心30min,收集上清液后4℃透析除去Mn2+得粗酶液。
1.3.4 硫酸铵分级沉淀
粗酶液加入固体硫酸铵至10%饱和度,4℃冰箱静置2h后,6000×g离心30min,收集上清液。再加入硫酸铵至30%饱和度,4℃冰箱静置2h,6000×g离心30min,沉淀用0.05mol/L、pH8.0的Tris-HCl缓冲液溶解,4℃蒸馏水透析过夜即得到粗酶液。
1.3.5 DEAE-Sepharose离子交换层析
DEAE-Sepharose离子交换柱按产品说明书要求处理。装柱后,用0.05mol/L、pH8.0 Tris-HCl缓冲液平衡4个柱体积,粗酶液样品上DEAE-Sephrose柱(2.6cm× 14cm),每次上样为10mL,用0~1.0mol/L线性梯度的NaCl溶液(内含0.05mol/L、pH8.0的Tris-HCl缓冲液)进行梯度洗脱,流速30mL/h,每管收集5mL,紫外检测波长为280nm。测定各管谷氨酸脱氢酶活性和蛋白质含量,收集活性较高的各管酶液,4℃透析过夜,冷冻浓缩后进行Sephacryl S-200凝胶层析。
1.3.6 Sephacryl S-200凝胶过滤柱层析
Sephacryl S-200凝胶柱按产品说明书进行装柱(16mm× 835mm)处理后,每次上样3mL。用Tris-HCl缓冲液(0.05mol/L、pH8.0)进行洗脱,流速18mL/h,每管收集3mL。测定每管谷氨酸脱氢酶活性和蛋白质含量;收集活性较高的各管酶液,4℃透析,冷冻干燥,得到酶纯品。
1.3.7 谷氨酸脱氢酶活性测定
参照文献[8],略有改动。利用分光光度法进行测定。分别加入2.465mL 0.08mol/L、pH8.5 Tris-HCl缓冲液,200μL 0.135mol/L α-酮戊二酸,20μL 18mmol/L ADP溶液,200μL 2.85mol/L NH4Cl溶液,100μL酶液,最后加入15μL 30mmol/L NADH溶液,混匀后,在37℃进行酶促反应,测定反应开始1min时在340nm波长处的吸光度减少量。在该反应条件下,每分钟催化1μmol NADH氧化所需的酶量定义为一个酶活力单位。
1.3.8 蛋白质含量测定
采用Lowery法[9]和分光光度法[10],以牛血清白蛋白为标准样品。
1.3.9 谷氨酸脱氢酶的纯度鉴定
采用SDS-聚丙烯酰胺凝胶电泳进行纯度鉴定[11]。Marker为重组蛋白复合物,12%分离胶,5%浓缩,加样量为10μL。100V电泳10min,180V电泳40min。电泳结束后取出分离胶用0.1%考马斯亮蓝R-250染色2h后用脱色液脱色,至蛋白条带清楚,最后照相分析。
1.3.10 谷氨酸脱氢酶的相对分子质量测定
采用凝胶过滤法[12-13]。鸭肝谷氨酸脱氢酶亚基相对分子质量的确定采用SDS-聚丙烯酰胺凝胶电泳法测定[14]。
1.3.11 谷氨酸脱氢酶的动力学参数测定
用pH10.0、0.05mol/L Tris-HCl缓冲液配制不同浓度(0.01~0.1mmol/L)的底物溶液,按酶活力测定方法测定相应的酶活力,根据Lineweaver-Burk双倒数作图法[15]求出Km值。
2 结果与分析
2.1 鸭肝谷氨酸脱氢酶的分离纯化
鸭肝谷氨酸脱氢酶粗酶液经DEAE-Sepharose柱层析(每管收集5mL)的洗脱图谱如图1所示,谷氨酸脱氢酶的活性峰集中在30~34管之间,其中31~33管酶活性最高;分别收集透析冷冻浓缩后再经Sephacryl S-200凝胶分子筛柱层析(每管收集3mL),洗脱图谱见图2,谷氨酸脱氢酶活性峰集中在23~29管之间,其中25~27管酶活性最高,分别收集透析冷冻浓缩后备用。整个纯化结果见表1。最终可得到纯化60.93倍,比活力为24.37U/mg,总回收率为11.02%的酶制剂。所得谷氨酸脱氢酶经SDS-PAGE鉴定为单一蛋白成分,见图3,说明该酶制剂已达到电泳纯。以该纯品为对象进行鸭肝谷氨酸脱氢酶性质研究。
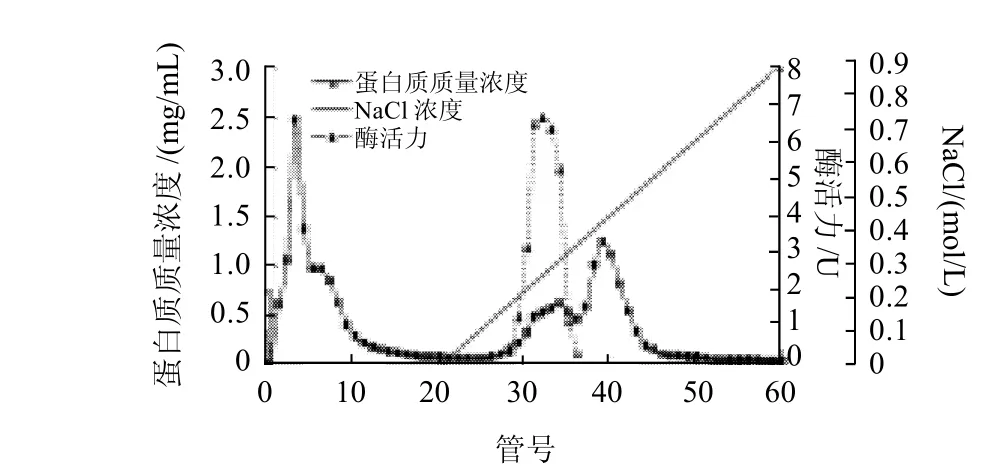
图1 DEAE-Sepharose离子交换层析图谱Fig.1 DEAE-Sepharose ion-exchange chromatographic fractionation of crude GDH
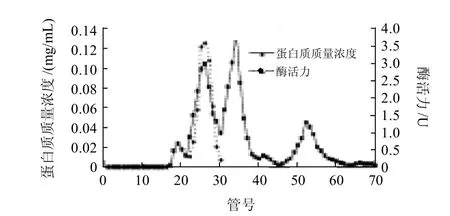
图2 Sephacryl S-200凝胶层析图谱Fig.2 Sephacryl S-200 gel permeation chromatographic fractionation of preliminarily purified GDH
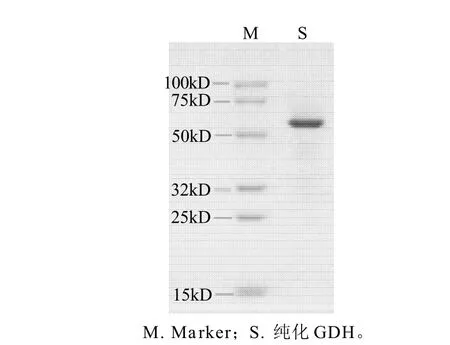
图3 SDS-PAGE电泳图Fig.3 SDS-PAGE of purified GDH from duck liver
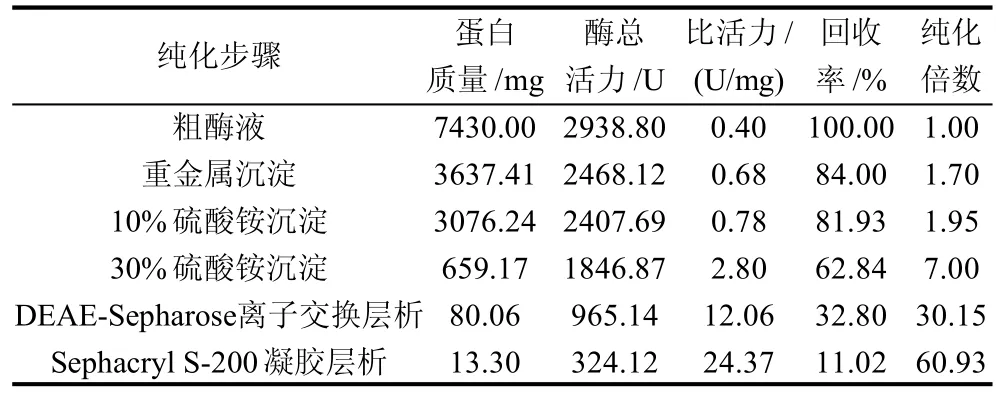
表1 鸭肝谷氨酸脱氢酶的纯化Table 1 Separation and purification procedures of GDH from duck liver and corresponding experimental data
2.2 鸭肝谷氨酸脱氢酶的性质
2.2.1 鸭肝谷氨酸脱氢酶相对分子质量和亚基相对分子质量
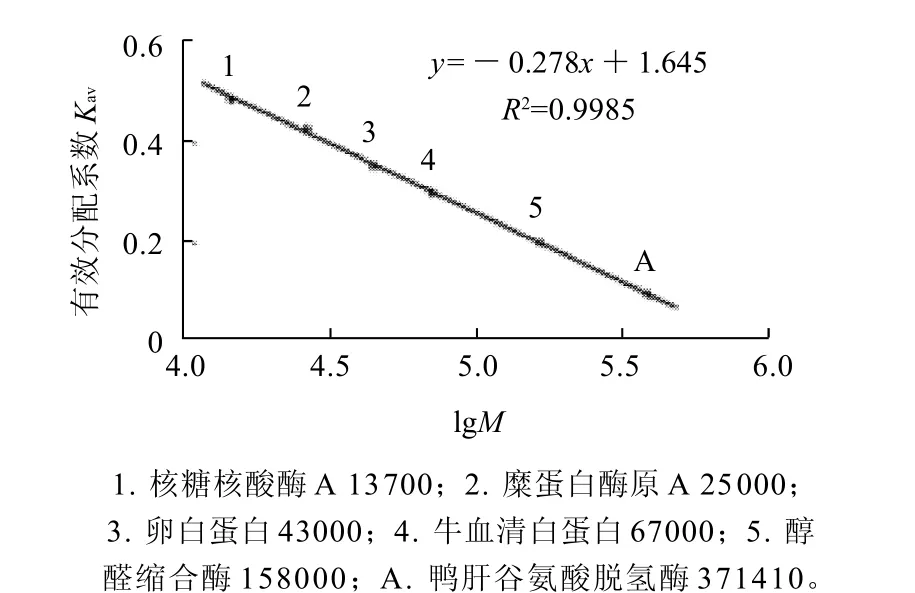
图4 Sephacryl S-200凝胶过滤测定鸭肝谷氨酸脱氢酶相对分子质量Fig.4 Standard curve for determining relative molecular mass of GDH by Sephacryl S-200 gel permeation chromatography
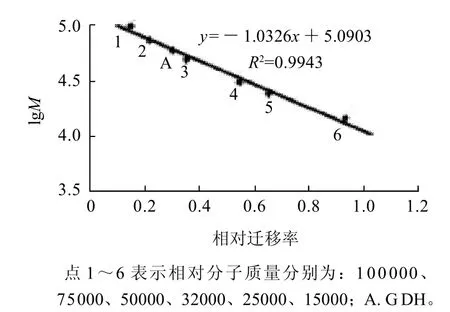
图5 SDS-PAGE测定鸭肝谷氨酸脱氢酶亚基相对分子质量Fig.5 Standard curve for determining subunit relative molecular mass of GDH by SDS-PAGE
经Sephacryl S-200凝胶柱层析法测定鸭肝谷氨酸脱氢酶的全酶相对分子质量为371.41,结果如图4所示。经SDS-PAGE测定其亚基相对分子质量为61.60,结果如图5所示。说明鸭肝谷氨酸脱氢酶由6个相同的亚基组成。
2.2.2 鸭肝谷氨酸脱氢酶的最适反应pH值
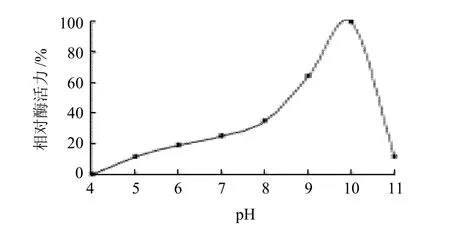
图6 pH值对鸭肝谷氨酸脱氢酶活力的影响Fig.6 Optimal reaction pH of GDH
在pH4.0~11.0的缓冲液中测定谷氨酸脱氢酶的酶活力。考察谷氨酸脱氢酶催化反应的最适pH值范围。以酶活力最高值为100%,对不同pH值作图,结果见图6。酶的最适pH值为10.0,pH值在9.0~10.0的范围内谷氨酸脱氢酶的酶活均可达到最高酶活力的50%以上,超出该范围酶活急剧下降。
2.2.3 鸭肝谷氨酸脱氢酶在不同pH值下的稳定性
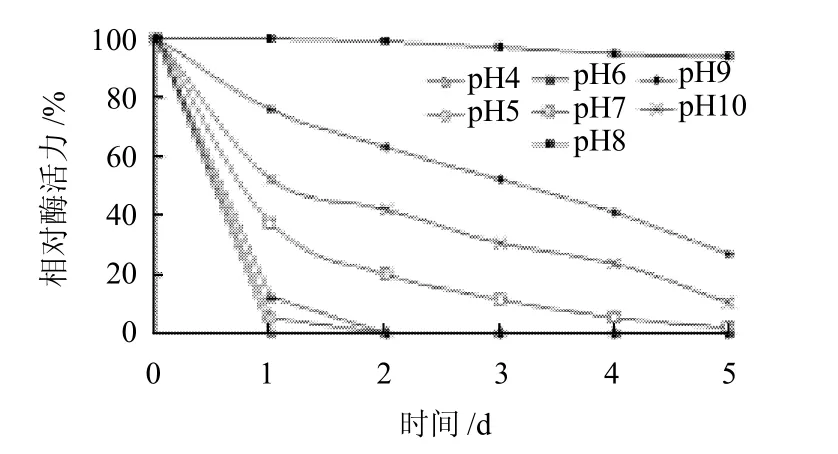
图7 不同pH值下鸭肝谷氨酸脱氢酶的储存稳定性Fig.7 pH stability of GDH
将纯化的酶液与pH4.0~10.0的缓冲体系相混合,4℃放置1、2、3、4、5d后,取适量酶液在最佳反应条件pH10.0时测定酶活力。以酶活力最高值为100%,在不同反应pH值环境下分别测定酶活力并作图,结果见图7。该酶在所测pH8.0时能较好地保持其酶活,5d孵育后,酶活基本保持不变;pH4.0~6.0酶活性迅速下降,2d内完全失活,pH9.0~10.0时,酶活均不稳定。表明该酶的酸碱耐受性很弱。
2.2.4 鸭肝谷氨酸脱氢酶的最适反应温度

图8 温度对鸭肝谷氨酸脱氢酶活力的影响Fig.8 Optimal reaction temperature of GDH
分别测定谷氨酸脱氢酶在20~60℃条件下的酶活力,其他条件不变。以酶活力最高值为100%,在不同反应温度下分别测定酶活,结果见图8,表明该酶的最适温度在35℃左右。
2.2.5 鸭肝谷氨酸脱氢酶的热稳定性和储存稳定性
酶液在4~60℃温度下分别孵育10、30、60、90、120min后测定酶活力。4℃的酶活力为100%,不同孵育条件下的相对酶活力见图9。4、20℃和30℃条件下,酶活力较稳定,保温120min活性保留原有活性的70%以上;但40℃保温60min酶活力损失50%以上,随着温度的升高,酶活力迅速降低,温度至60℃时,酶完全失活。表明该酶只在40℃以下具有一定的热稳定性。
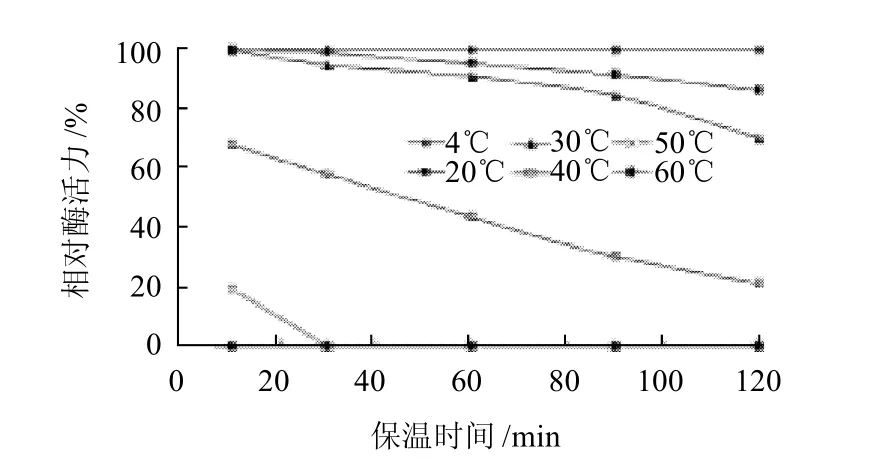
图9 鸭肝谷氨酸脱氢酶的热稳定性Fig.9 Thermal stability of GDH
在-20℃冷冻保存数月的鸭肝,所提取的谷氨酸脱氢酶活性无显着变化,但纯酶在-20℃下保存时迅速失活。实验还表明,纯酶在0.05mol/L、pH8.0的Tris-HCl缓冲液中于4℃可储存半年,活力无明显损失。
2.2.6 鸭肝谷氨酸脱氢酶反应动力学性质
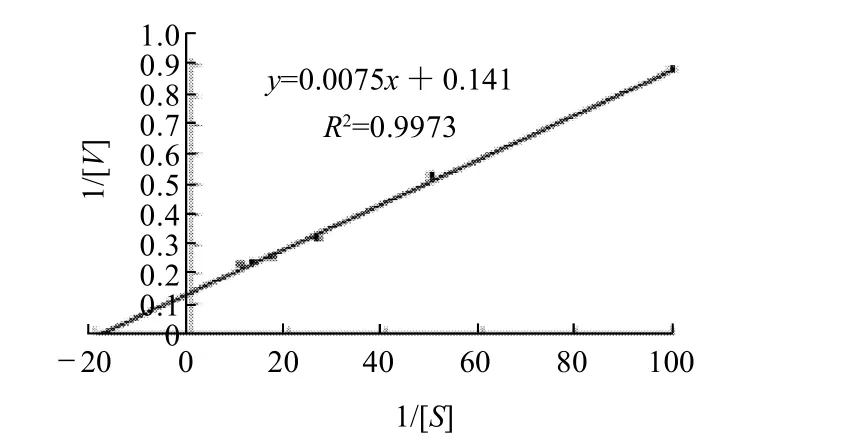
图10 谷氨酸脱氢酶的 Lineweaver-Burk双倒数图Fig.10 Lineweaver-Burk plot of GDH
用0.01~0.1mmol/L的NADH在pH10.0,35℃条件下,测定该酶表观Km,用Lineweaver-Burk双倒数[15]作图法见图10,求得该酶的表观Km和Vm分别为53.19μmol/L和7.09mmol/(L·min)。
2.2.7 金属离子对鸭肝谷氨酸脱氢酶活力的影响
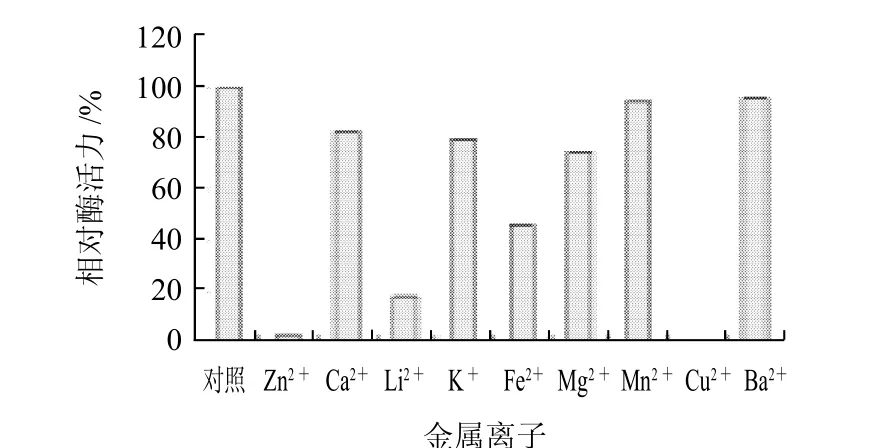
图11 不同盐离子对谷氨酸脱氢酶活力的影响Fig.11 Effects of various metal ions on GDH activity
向纯化后的鸭肝谷氨酸脱氢酶酶液中,分别加入不同的金属离子,使其终浓度为10mmol/L。同时以不加金属离子的酶液作为对照,测定谷氨酸脱氢酶的活力,结果如图11所示。10mmol/L Zn2+、Cu2+可显着抑制该酶活性,Li+、Fe2+、Mg2+对鸭肝谷氨酸脱氢酶有不同的抑制作用。其他离子对酶活力影响不明显。
3 结 论
本实验经过丙酮脱脂、重金属沉淀、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析和Sephacryl S-200凝胶层析方法,从鸭肝中获得了总回收率为11.02%,纯化倍数为60.93倍,比活力达24.37U/mg的谷氨酸脱氢酶制剂,经SDS-PAGE鉴定该酶达到电泳纯。
谷氨酸脱氢酶在国内应用广泛,但主要依赖进口。目前我国不能工业生产谷氨酸脱氢酶,主要受限于材料成本问题。而我国家禽养殖广泛,规模大,鸭肝材料丰富,价格低廉,是提取谷氨酸脱氢酶的可靠来源,可有效缓解成本压力。并且该酶比活高于现市售且价格昂贵的同类产品,具有较好的热稳定性和储存稳定性以及较高的科研和临床价值。因此,研究并开发其应用价值具有重要的现实意义。
[1]丁诗华, 刘世贵. 类产碱假单胞菌谷氨酸脱氢酶的纯化和性质[J]. 微生物学报, 1999(5): 475-477.
[2]王燕, 宋香, 杨平平, 等. 谷氨酸生产菌S9114中依赖于NADPH谷氨酸脱氢酶的纯化及性质[J]. 食品与发酵工业, 2003, 11(29): 5-9.
[3]CHO S W, LEE J, CHOI S Y. Two soluble forms of glutamate dehydrogenase isoproteins from bovine brain[J]. Eur J Biochem, 1995, 233(1): 340-346.
[4]TURANO F J, DASHNER R, UPADHYAYA A, et al. Purification of mitochondrial glutamate dehydrogenase from darkgrown soybean seedlings [J]. Plant Physiol, 1996, 112(3): 1357-1364.
[5]BELLION E, TAN F. NADP-dependent glutamate dehydrogenase from a facultative methylotroph[J]. J Bacteriol, 1984, 57(2): 435-439.
[6]BRITTON K I, BAKER P J, RICE D W, et al. Structural relationships between the hexameric and terameric family of glutamate dehydrogenase [J]. Eur J Biochem, 1992, 209: 851-859.
[7]孙立伟, 王今堆. 脲酶和谷氨酸脱氢酶的制备及有关性质的研究[J].北华大学学报: 社会科学版, 1998(5): 67-71.
[8]丁诗华, 杨志荣, 唐亚雄, 等. 类产碱假单胞菌谷氨酸脱氢酶的提纯、鉴定及某些特性的初步研究[J]. 中国生物化学与分子生物学报, 1999, 15(6): 968-973.
[9]LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem, 1951, 193(1): 265-275.
[10]LAYNE E. Spectrophotometric and turbidimetric methods for measuring proteins[J]. Methods in Enzymology, 1957, 3: 447-454.
[11]朱广廉, 杨中汉. SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量[J]. 植物生理学通讯, 1982(2): 43-47.
[12]杨安钢. 生物化学与分子生物学实验技术[M]. 北京: 高等教育出版社, 2001: 248-252.
[13]陈石根, 周润琦. 酶学[M]. 上海: 复旦大学出版社, 2001: 174-175.
[14]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[15]陈钧辉, 陶力, 朱婉华, 等. 生物化学实验[M]. 北京: 科学出版社, 2004.
Separation, Purification and Characterization of Glutamate Dehydrogenase from Duck Liver
ZHU Hong,LI Xiang-yun,WANG Song,FU Wei-li,TANG Liang-ting,GAO Zhao-wei,TANG Yun-ming*
(School of Life Science, Southwest University, Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweetpotato Engineering Research Center, Chongqing 400715, China)
Objective: To obtain high-purity glutamate dehydrogenase (GDH) from duck liver and characterize this enzyme. Methods: Crude GDH solution was obtained from duck liver after acetone defatting, addition of MnCl2for impurity precipitation, ammonium sulfate salting-out and DEAE-Sepharose ion exchange and Sephacryl S-200 gel permeation chromatographic fractionation. Purity identification and relative molecular mass determination were conducted using sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE). Results: A GDH enzyme of electrophoretic homogeneity was obtained, with a purification fold of 60.93, an activity recovery of 11.02% and a specific activity of 24.37 U/mg. This enzyme had a relative molecular mass of 371.41 and a subunit relative molecular mass of 61.60. It was deduced that this enzyme was composed of the same six subunits. Its apparent Kmtowards NADH was 53.19μmol/L, and the optimal reaction pH and temperature 10.0 and 35 ℃, respectively. This enzyme had excellent stability at around pH 8.0 and at a temperature below 40 ℃. Zn2+, Li+and Cu2+had significant inhibition on this enzyme. Conclusion: A high-purity GDH enzyme has been successfully prepared. This enzyme greatly deserves to be developed and utilized.
duck liver;glutamate dehydrogenase (GDH);purification;characterization
Q554.9
A
1002-6630(2010)19-0231-05
2010-01-20
重庆市科委科技攻关项目(CSCT,2004AC1012)
朱鸿(1985—),男,硕士研究生,主要从事酶与酶工程研究。E-mail:wild-hong@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事酶与酶工程研究。E-mail:tbright@swu.edu.cn



