郭 洪,陈庆森*,闫亚丽
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
基于超滤法从牛初乳中分离胰岛素样生长因子-Ⅰ的工艺条件
郭 洪,陈庆森*,闫亚丽
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
利用超滤技术从牛初乳中分离IGF-Ⅰ,并对脱脂和超滤条件进行优化。IGF-Ⅰ的质量浓度检测采用放射免疫法测定,总蛋白质量浓度采用考马斯亮蓝法测定。结果表明:牛初乳中分离IGF-Ⅰ过程中制备脱脂乳最适工艺条件为36℃、4000r/min离心15min;经截留分子质量为10~20kD的中空纤维膜超滤除杂蛋白和6kD的中空纤维膜超滤去除乳糖等小分子物质,所得的IGF-Ⅰ的纯度浓度较初乳中提高了约3660倍。本方法确立了从牛初乳中分离纯化较高纯度IGF-Ⅰ的技术路线。
牛初乳;胰岛素样生长因子-Ⅰ(IGF-Ⅰ);脱脂;超滤法;工艺条件
胰岛素样生长因子(insulin-like growth factor-Ⅰ,简称IGF-Ⅰ)与胰岛素有相似的结构,且与胰岛素享有70%的同源性,是一类具有细胞分化和增殖功能,并具有胰岛素样作用的多肽[1-2],因此,被命名为胰岛素样生长因子。其分子质量为7649D,等电点是8.4[3]。IGF-Ⅰ在细胞分化、动物生长发育、繁殖、代谢等方面发挥着广泛的作用,特别是通过刺激肠道上皮的生长繁殖,维护由肠道黏膜上皮层及附着于表面的黏液层构成的肠道机械屏障功能,从而对胃肠道黏膜自身稳态和伤口愈合起重要作用[4]。它除了在组织细胞存在外,在牛的初乳中大量存在[5-9]。牛初乳来源广泛,从牛初乳中提取IGF-Ⅰ可实现资源利用和提高附加值的目的。牛初乳是指奶牛分娩后7d内特别是3d内所分泌的乳汁。国内外许多研究表明因采集牛初乳的时间等条件存在着较大差异,报道的IGF-Ⅰ的质量浓度多在50~200μg/L之间,而常乳IGF-Ⅰ的质量浓度不足10μg/L[10-12]。
目前国内外分离牛初乳中IGF-Ⅰ的主要方法是凝胶过滤层析法和离子交换层析法,存在耗时长、成本较为昂贵的缺点。进入20世纪90年代,超滤技术被引入到IGF-Ⅰ的研究中,该法节省人力、物力和时间[13-14]。
本研究主要对初乳脱脂以及利用中空纤维膜超滤技术纯化IGF-Ⅰ的条件进行研究,拟建立并确立中试规模生产IGF-Ⅰ的技术路线及相关参数,为牛初乳的进一步开发利用提供有益探索。
1 材料与方法
1.1 材料、试剂与仪器
牛初乳 天津海河乳业有限公司奶源基地;木瓜凝乳酶 广西南宁庞博生物有限公司;IGF-Ⅰ放射免疫试剂盒 天津九鼎生物有限公司;考马斯亮兰试剂 Sigma公司。
中空纤维膜组件(截留分子质量60~80kD,截留分子质量10~20kD,截留分子质量6kD 天津膜天膜生物技术有限公司);FD-1型冷冻干燥机 郑州长城科工贸有限公司;RE52-05旋转蒸发器 上海亚荣生化仪器厂;79.3型磁力恒温搅拌器 常州国华电器有限公司;电热恒温水浴锅 上海益恒实验仪器有限公司。
1.2 方法
1.2.1 初乳脱脂工艺方法[6]
将初乳经多层纱布真空抽滤,除掉肉眼可见的杂质,制得预处理的初乳。制备脱脂初乳分别考察离心转速、时间、温度等不同参数,并进行条件优化,通过测定初乳及脱脂乳中的脂肪含量,计算脱脂率。同时测定每步中IGF-Ⅰ的质量浓度及总蛋白浓度,筛选出最适制备脱脂初乳的工艺条件。
1.2.2 制备IGF-Ⅰ粗提物的参数条件[15]
1.2.2.1 乳清制备
新鲜配制10%(m/V)的木瓜凝乳酶溶液,预热至36℃,按酶液:脱脂初乳为1:50(V/V)的量缓缓加入脱脂初乳液(36℃,HCl溶液调pH6.0)中,充分混合均匀,静置40min使之凝结。搅拌使凝乳破碎释放乳清,离心(3000r/min,15min)去凝结蛋白,得初乳乳清。
1.2.2.2 去除IGF-Ⅰ结合蛋白
将制得的初乳乳清低温冷却后与同样低温冷却的酸醇溶液(2mol/L HCl溶液:无水乙醇为1:7)混合,略加搅拌,4℃条件下静置30min,去除IGF-Ⅰ结合蛋白。其中初乳乳清:酸醇溶液为1:4(V/V)。
1.2.2.3 减压浓缩
在44℃条件下进行旋转蒸发至原溶液的1/3~1/4,将浓缩液调pH6.5,以除掉乙醇和HCl。离心(3000r/min,15min)取得上清液,作为超滤的前处理物。
1.2.2.460 ~80kD中空纤维超滤膜超滤
使用60~80kD超滤膜的参数条件设定为24℃、pH6.5、操作压力0.06MPa,目的是除掉大分子质量杂蛋白。
经过以上步骤后可制得IGF-Ⅰ粗提物。
1.2.3 初乳IGF-Ⅰ精制备的参数条件确定[15]
对IGF-Ⅰ的两步纯化均使用中空纤维超滤膜,截留分子质量分别为10~20kD和6kD的超滤膜,两步操作均设计了压力、温度、pH值的3个参数条件的优化。
1.2.3.1 10~20kD膜超滤
参数分别为温度(4、20、36℃)、压力(0.04、0.06、0.08MPa)、pH值(4.5、5.5、6.5),为使提取损失减少,采用1000mL粗提液与2200mL纯水混合,取得3000mL滤出液的比例进行。
1.2.3.2 6kD膜超滤
参数分别为温度(4、20、36℃)、压力(0.04、0.06、0.08MPa)、pH值(6.0、7.0、8.0),为尽可能除去乳糖和矿物质等杂质,采用1000mL一步纯化产物和2200mL纯水混合,取得400mL浓缩液的比例进行。
1.2.4 IGF-Ⅰ质量浓度及总蛋白浓度测定[15]
IGF-Ⅰ质量浓度测定:采用放射免疫法,利用放射免疫试剂盒通过γ-计数器进行检测[7];各步中的总蛋白质量浓度采用考马斯亮兰法测定。在条件优化过程中,溶液体积以及蛋白含量均发生变化,故引入“相对浓度”来考察,即:
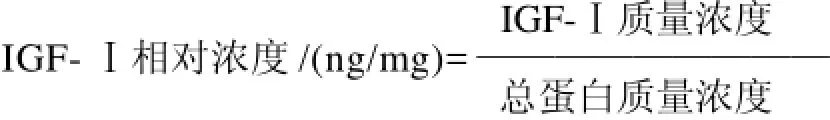
1.2.5 脂肪含量测定
参照GB/T 5409—85《牛乳检验方法》的方法即哥特里-罗兹法进行[16]。
2 结果与分析
2.1 牛初乳脱脂工艺的确定
只能这样了,何良诸绕到车那面,蹲在踏板上,小勺没有发现。就是看见了,车门外挂大肉,也不是司机买的。卡车起动,加速,寒风呼啸,出街口后,道路孬,车没命地颠簸,何良诸抠车门的手,冻得粘住了,挺起脖子,看见赵集直勾勾前视,嘴角挂着暖和的笑。何良诸愤怒了,这家伙,怎幺会笑!车没有停下的意思,叫车豁子涮了!何良诸又急又恨,心里明白,却不敢乱动,举了几次,终于把冻僵的手像棍子似竖起来,梆梆梆敲玻璃。赵集吓了一跳,才想起门外挂块肉,急煞车。赵集扭身推车门,何良诸蹲在踏板上。赵集贴住车窗,叫嚷:“下去。”
从牛初乳中提取IGF-Ⅰ,首先是通过离心方法脱脂,因脂肪的存在直接影响IGF-Ⅰ的含量及稳定性。此外,脱脂还可以防止脂肪氧化产生不良风味,提高初乳流动性。在离心脱脂过程中,会有总蛋白及IGF-Ⅰ的损失,所以在离心转速、时间及温度等操作参数影响初乳中脂肪的脱除,本研究将初乳乳脂的脱除率和IGF-Ⅰ的损失率综合考虑,以保证乳脂肪尽量脱除的前提下,最大限度保留IGF-Ⅰ。因此考察离心转速、时间及温度对IGF-Ⅰ和总蛋白质量浓度及含脂率的影响。
2.1.1 离心转速对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响
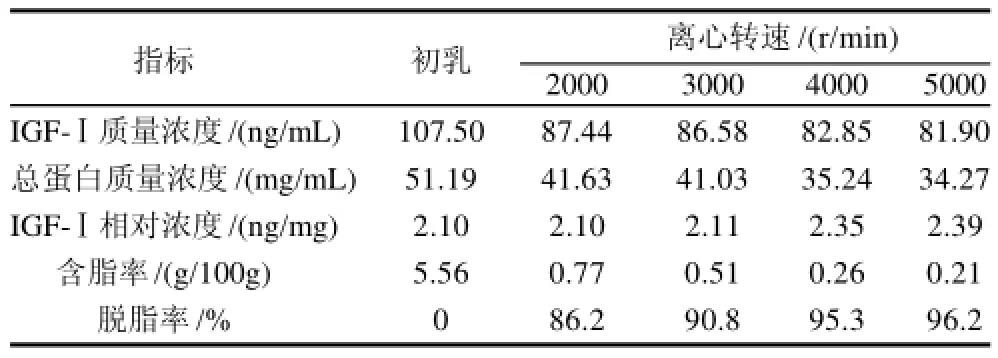
表1 离心转速对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响Table1 Effect of centrifugation speed on the content of IGF-I, total protein and degreasing rate
由表1看出,随着离心转速的增加,IGF-Ⅰ和总蛋白的质量浓度均略有减少,脱脂率显着增高,而IGF-Ⅰ的相对浓度有所增加,为达到脱脂率较高,而IGF-Ⅰ损失相对较小的目标,故选定4000r/min为最适离心转速。
2.1.2 离心时间对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响
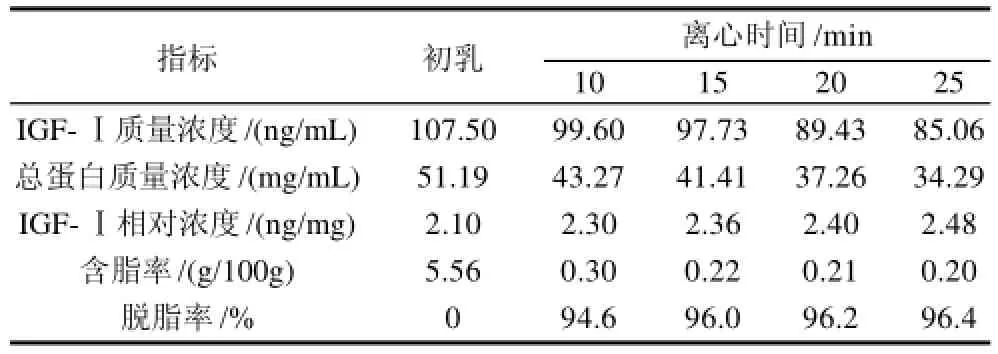
表2 离心时间对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响Table2 Effect of centrifugation time on the content of IGF-Ⅰ, total protein and degreasing rate
由表2可见,随着离心时间的增加,蛋白发生沉淀,IGF-Ⅰ和总蛋白质量浓度减少,IG-Ⅰ相对浓度增加。在保证脱脂率的前提下,而减少IGF-Ⅰ的损失,故采用离心15min 为最适离心时间。
2.1.3 离心温度对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响
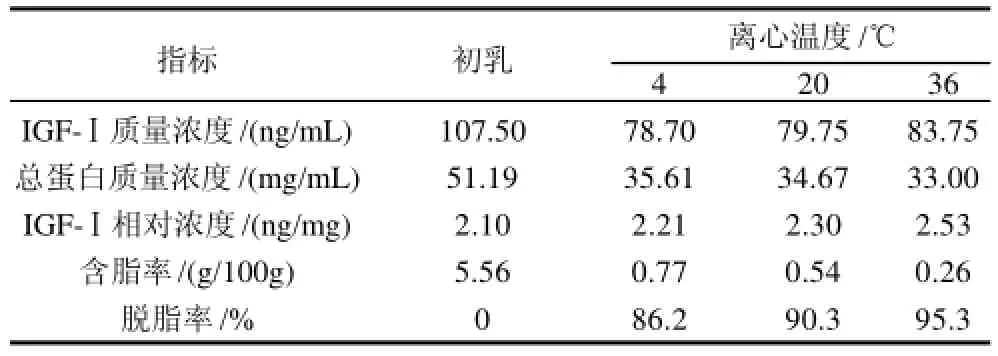
表3 离心温度对IGF-Ⅰ和总蛋白质量浓度及脱脂率的影响Table3 Effect of centrifugation temperature on the content of IGF-Ⅰand total protein and degreasing rate
从表3可以看出,随着离心温度的升高,初乳的黏度下降,流动性增加,IGF-Ⅰ的质量浓度和相对浓度均有所增加,含脂率大幅降低,因此选定36℃为最适离心温度。
2.2 IGF-Ⅰ前处理过程中IGF-Ⅰ和总蛋白质量浓度的变化
依据1.2.2节所确立的方法及参数条件,试验所得各项结果见表4。
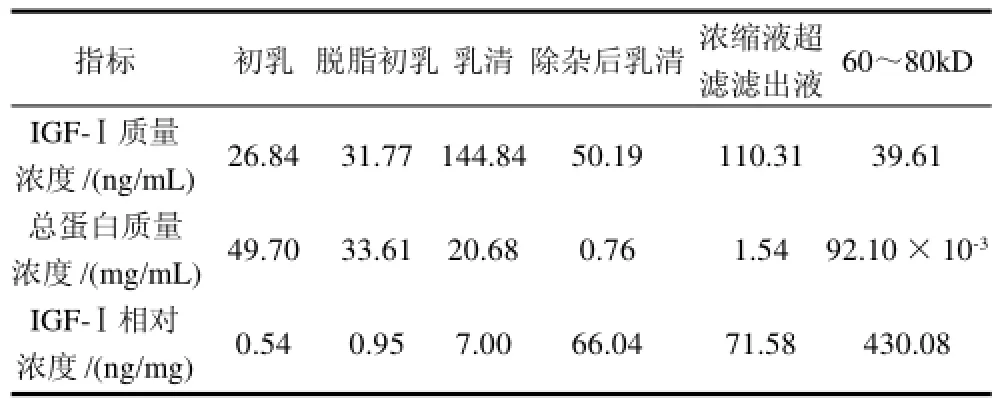
表4 前处理操作对IGF-Ⅰ和总蛋白质量浓度的影响Table4 Effect of pretreatment methods on the content of IGF-Ⅰand total protein
由表4可得,由于对牛初乳所进行的前处理过程中酸醇去结合蛋白,旋蒸浓缩及超滤操作造成的溶液体积及料液浓度变化,IGF-Ⅰ及总蛋白质量浓度有所波动,但IGF-Ⅰ的相对浓度则急剧增加,比初乳中IGF-Ⅰ的质量浓度增加796倍,说明这些前处理操作对获取高品质的IGF-Ⅰ是有效的,这将为后续的IGF-Ⅰ纯化提供了基础。
2.3 超滤条件对制备高纯度IGF-Ⅰ的影响
2.3.110 ~20kD超滤纯化IGF-Ⅰ的研究结果
经过1.2.2节的方法得到的IGF-Ⅰ粗提物已除掉了大部分的杂蛋白,使IGF-Ⅰ的相对浓度显着提高。根据IGF-Ⅰ的分子质量研究选择10~20kD的超滤膜,进一步除杂蛋白,对该超滤分离条件进行了研究。结果见表5~7。

表5 超滤pH值对IGF-Ⅰ和总蛋白质量浓度的影响Table5 Effect of pH during ultra-filtration with 10-12 kD membrane on the content of IGF-Ⅰand total protein

表6 超滤温度对IGF-Ⅰ和总蛋白质量浓度的影响Table6 Effect of temperature during ultra-filtration with 10-12 kD membrane on the content of IGF-Ⅰand total protein
从表5可知,在超滤pH5.5时处于β-乳球蛋白(分子质量在30kD左右)等电点范围内使其凝聚力增加,增
强了超滤膜对其的截流作用,此时IGF-Ⅰ的质量浓度及相对浓度均较高,因此选择超滤pH5.5作为超滤分离IGF-Ⅰ的最适pH值。
由表6可看出,在36℃时IGF-Ⅰ的质量浓度及相对浓度均较高,原因可能为在温度较高的条件下,液体黏度降低,流动性增加,有助于IGF-Ⅰ透过超滤膜,但是更高的温度会使蛋白失活,造成IGF-Ⅰ的损失,不能作为可选的温度参数来考察。因此选择超滤温度36℃作为超滤的最适温度。

表7 超滤压力对IGF-Ⅰ和总蛋白质量浓度的影响Table7 Effect of pressure during ultra-filtration with 10-12 kD membrane on the content of IGF-Ⅰand total protein
由表7可见,随压力的增大,IGF-Ⅰ的质量浓度及总蛋白质量浓度均升高,而相对质量浓度在0.06MPa时为最高,原因可能为压力升高使大于截留分子质量的杂蛋白IGF-Ⅰ透过中空纤维,使得IGF-Ⅰ相对浓度降低,因此选择0.06MPa作为超滤的最适压力。
2.3.26 kD超滤膜超滤去除乳糖等小分子物质的相关条件
为了获得更高纯度的IGF-Ⅰ,研究用截留分子质量为6kD超滤膜是为了除掉乳糖和矿物质等小分子杂质,并对终产物进行浓缩。结果见表8~10。

表8 超滤pH值对 IGF-Ⅰ和总蛋白质量浓度的影响Table8 Effect of pH during ultra-filtration with 6 kD membrane on the content of IGF-Ⅰand total protein
由表8看出,在pH8.0时IGF-Ⅰ的质量浓度及相对浓度均较高,原因可能为IGF-Ⅰ的等电点在8.0左右,调节溶液的pH值为8.0时,IGF-Ⅰ的凝聚力增强,减少了对超滤膜的透过率,通过时增加了对其他杂蛋白的通透性。因此IGF-Ⅰ得到了进一步的纯化。
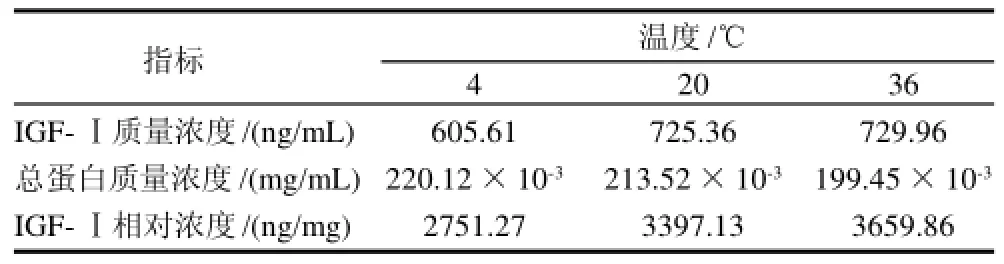
表9 超滤温度对IGF-Ⅰ和总蛋白质量浓度的影响Table9 Effect of temperature during ultra-filtration with 6 kD membrane on the content of IGF-Ⅰand total protein
由表9可见,在36℃时IGF-Ⅰ的质量浓度及相对浓度均较高,原因可能为升高温度液体粘度降低,有助于乳糖等小分子黏性物质的通过,从而提高溶液中IGF-Ⅰ的质量浓度及相对浓度。

表10 超滤压力对IGF-Ⅰ和总蛋白质量浓度的影响Table10 Effect of pressure during ultra-filtration with 6 kD membrane on the content of IGF-Ⅰand total protein
由表10看出,随超滤压力的增大,浓缩液中IGF-Ⅰ的质量浓度及总蛋白质量浓度均降低,原因可能为随压力增大,IGF-Ⅰ和大于截留分子质量的杂蛋白均透过中空纤维膜。IGF-Ⅰ的相对浓度在0.06MPa时为最高,其相对浓度较初乳中提高约3660倍,因此选择0.06MPa作为超滤的最适压力。
3 结 论
本研究最终确定从牛初乳中分离IGF-Ⅰ的脱脂工艺最适条件为采用4000r/min、15min、36℃离心条件下制备脱脂乳;经木瓜凝乳酶制备乳清后用酸醇溶液去除结合蛋白,然后采用10~20kD中空纤维超滤除杂蛋白,确定的最佳参数条件为温度36℃、pH5.5、操作压力0.06MPa;采用6kD中空纤维超滤去除乳糖等小分子物质,确定的最佳参数条件为温度36℃、pH8.0、操作压力0.06MPa;经过两步超滤纯化后,IGF-Ⅰ的相对浓度比初乳中增加3660倍。本研究获得了高纯度的IGF-Ⅰ产品,为采用规模化方法生产IGF-Ⅰ产品提供一定的参考价值。
[1]HOULE V M, SCHROEDER E A, ODLE J, et al. Small intestinal disaccharidase activity and ileal villus height are increased in piglets consuming formula containing recombinant human insulin like growth factor-Ⅰ[J]. Pediatr Res, 1997, 42(1): 78-86.
[2]王世文, 王映珍, 郑宁, 等. 外源性胰岛素样生长因子-1对重症胰腺炎大鼠肠粘膜屏障损害的保护作用[J]. 中国急救复苏与灾害医学杂志, 2008, 3(1): 15-18.
[3]张兰威, 郭明若. 牛初乳成分、性质以及产品研制[J]. 食品工业: 乳制品工业特辑, 1998(1): 20-22.
[4]游利, 俞茂华, 叶红英, 等. 牛初乳短链胰岛素样生长因子-1对糖尿病大鼠肾脏的维持作用及其机制研究[J]. 中华肾脏病杂志, 2000, 16 (4): 251-255.
[5]VACHER P Y, BLUM J W. Age dependency of insulin like growth factor 1, insulin protein and immunoglobulin concentrations and gamma glutamyl transferase activity in first colostrum of dairy cows[J].
Milchwissenschaft, 1993, 48: 423-435.
[6]ELFSTRAND L, LINDMARK-MANSSON H, PAULSSON M, et al. Immunoglobulins, growth factors and growth hormone in bovine colostrum and the effects of processing[J]. Int Dairy Journal, 2002, 12: 879-887.
[7]LUND P K, ZIMMERMANN E M. Insulin-like growth factors and inflammatory bowel disease[J]. Baillieres Clin Gastroenterol, 1996, 10: 83-96.
[8]BANG P, ERIKSSON U, SARA V. Comparison of acid ethanol extraction and acid gel filtration prior to IGF-Ⅰ and radio-immunoassays: improvement of determination acid ethanol extractions by use of truncated IGF-Ⅰ as radio-ligand[J]. Acta Endocrinology, 2002, 124: 620-629.
[9]周杰. 口服rhIGF-Ⅰ粗制品对仔鼠胃和小肠生长及部分免疫指标的影响[J]. 南京农业大学学报, 2002, 25(3): 65-69.
[10]ELFSTRAND L. Immunoglobulin, growth factors and growth hormone in bovine colostrums and the effects of processing[J]. International Dairy Journal, 2002, 12: 879-887.
[11]BAYNE P, AHLSEN M, BERG U, et al. Free insulin-like growth factor-Ⅰ: a rew hormres[J]. Molecular and Cellular Neuroscience, 2001, 55 (12): 84-93.
[12]MACH J P, PAHUD J J. Secretory IgA, a major immunoglobulin in most bovine external secretions[J]. Immunoassay, 1971, 106: 552-563.
[13]PARK Y K, MONACO M H, DOROVAN S M. Enteral insulin growth factor-Ⅰ augments intestinal disaccaridase activity in piglets receiving total par-enteral nutrition[J]. Pediatr Gastroenteral Nutr, 1999, 29(2): 198-206.
[14]ELMLIN G, GINJALA V, PAKKANEN R. Insulin growth factor-Ⅰin bovine colostrum samples[J]. Immunoassay, 1998, 19: 195-202.
[15]云振宇, 张和平. 牛初乳中类胰岛素生长因子-Ⅰ的分离制备[J]. 中国乳品工业, 2005, 33(1): l1-13.
[16]农业部. 乳品检验员[M]. 北京: 中国农业出版社, 2004: 264-265.
Use of Ultra-filtration for Separation of Insulin-like Growth Factor-Ⅰfrom Bovine Colostrums
GUO Hong,CHEN Qing-sen*,YAN Ya-li
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Insulin-like growth factors play important roles in the cell differentiation, animal growth, development, reproduction and metabolism, and are largely present in the bovine colostrums. In present study, insulin-like growth factor-Ⅰ(IGF-Ⅰ) was separated from bovine colostrums by using ultra-filtration, and the degreasing and ultra-filtration conditions were optimized. The IGF-Ⅰand total protein concentrations were detected by radio-immunoassay(RIA) and coomassie blue staining, respectively. The results showed that the optimum degreasing conditions were as follows: centrifugation temperature 36 ℃, centrifugation speed 4000 r/min and centrifugation time 15 min. Macromolecular impurities protein and lactose could be removed after ultra-filtration with molecular weight cut-off 10-20 kD and 6 kD membrane, respectively. The relative concentration of IGF-Ⅰwas 3660 times higher than that in colostrums after ultra-filtration.
colostrums;insulin-like growth factor-Ⅰ(IGF-Ⅰ);lipid extraction;ultra-filtration;technological conditions
TS252.1
A
1002-6630(2010)22-0086-05
2010-07-19
天津市科技支撑计划重点项目(09ZCKFNC00700)
郭洪(1983—),男,硕士研究生,研究方向为发酵生物技术、乳品质量与安全。E-mail:gh20020700@sina.com
*通信作者:陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、乳品质量与安全。E-mail:chqsen@tjcu.edu.cn



