宋宏新,潘 洁,柏红梅,薛海燕
(陕西科技大学生命科学与工程学院,陕西 西安 710021)
竞争ELISA法对牛乳β-酪蛋白的检测
宋宏新,潘 洁,柏红梅,薛海燕
(陕西科技大学生命科学与工程学院,陕西 西安 710021)
通过确定包被抗体最佳稀释度(anti-β-CN IgY 1:160)、封闭液及封闭时间(含1%明胶的PBST,封闭1h)、酶标抗原(1:20)和待测脱脂牛乳样品稀释液(1:80)抗体作用时间(60min)、底物最佳反应时间(20min)、温度(37℃)等对竞争ELISA效果有重要影响的因素,建立检测牛乳β-酪蛋白的竞争ELISA法。经敏感性实验和重复性实验证明本实验建立的竞争ELISA法最低检出量为5.1μg/mL,变异系数(CV)小于5%,可以开发应用于牛乳及其制品的蛋白质品质快速检测。
竞争ELISA;β-酪蛋白;鸡卵黄抗体(IgY)
有效的检测技术是保证乳品质量安全的重要方面,目前的乳品掺假检测技术主要针对掺假物一对一检测[1-4],主要有近红外光谱法、高效液相色谱法、电泳法和免疫学方法等。光谱法、液相色谱法及电泳法具有准确快速、重复性好、适用于定量检测等优点,但由于其设备造价高,操作繁琐的原因,难以满足基层及现场快速筛查的要求。本实验以牛乳β-酪蛋白为目标蛋白,建立的竞争ELISA检测方法对牛乳固有酪蛋白进行检测,免疫检测法具有特异性强,操作简单易行,尤其针对乳品中掺入其他杂蛋白的鉴别和原料奶酪蛋白质量的快速检测,在乳及乳制品质量安全监控方面有重要意义。
1 材料与方法
1.1 材料、试剂与仪器
鸡卵黄抗体(anti-β-CN IgY,效价为1:2048)和酶标牛乳β-酪蛋白抗原(β-CN-HRP,效价为1:320)分别参考文献[5-7]制得;大豆蛋白粉(S)和明胶(G) 北京鼎国生物技术有限责任公司;牛乳β-酪蛋白(β-CN)、牛乳β-乳球蛋白(β-Lg)、酶标兔抗鸡抗体IgG-HRP 美国Sigma公司。
ELISA采用辣根过氧化物显色系统:1)包被缓冲液(CB):0.05mol/L pH 9.6碳酸盐缓冲液;2)洗涤液与稀释液(PBST):0.01mol/L pH7.4 PBS+0.5% Tween-20;3)封闭液(G):含1%明胶的PBST;4)终止液:2mol/L H2SO4;5)底物溶液:2mL底物缓冲液(pH5.0磷酸柠檬酸缓冲液)+0.1mL TMB+6.4μL H2O2。
MK3型Thermo酶标仪 美国Thermo公司;酶标板(96孔聚苯乙烯板) 北京原平皓生物技术有限公司。
1.2 方法
1.2.1 抗体的封闭
将抗体和牛乳β-乳球蛋白和大豆蛋白粉混合培养,封闭其中会和牛乳β-酪蛋白产生交叉反应的抗体成分。
1.2.2 竞争ELISA步骤
以合适质量浓度的blocked anti-β-CN IgY包被酶标板(每孔100μL,4℃过夜),以封闭液(每孔300μL,4℃封闭过夜)封闭;同时加入等量酶标抗原和抗原(系列浓度标准抗原或待测乳样各50μL),于水平轨迹摇床上室温孵育2h,进行竞争反应。其中的洗板、显色、测定操作同一般ELISA[8]。
2 结果与分析
2.1 抗体 IgY的交叉反应检测与抗体修饰技术
鸡卵黄抗体(anti-β-CN IgY)为多克隆抗体,是以标准牛乳β-酪蛋白作抗原免疫获得鸡卵黄,经分离纯化后得到的多克隆抗体。该多抗必须通过交叉反应对抗体的特异性进行评价。通过抗体修饰技术[9-10],将抗体和牛乳β-乳球蛋白和大豆蛋白粉混合,于37℃培养2h,封闭其中会和牛乳β-酪蛋白产生交叉反应的抗体成分,可减少各批多克隆抗体间的变异程度,从而提高抗体的免疫反应特异性。步骤如下:1)用PBST将抗体质量浓度稀释至1mg/mL;2)牛乳β-乳球蛋白(5mg/mL)和大豆蛋白粉(4mg/mL)等体积混合后,再与步骤1)所得液体等体积混合,37℃孵育2h后,4℃隔夜放置得到修饰的抗体(blocked anti-β-CN IgY),质量浓度为2.75mg/mL。

图1 两种抗体与4种蛋白抗原的交叉反应Fig.1 Cross-actions of anti-β-CN IgY and blocked anti-β-CN IgY with four kinds of antigens
anti-β-CN IgY 和blocked anti-β-CN IgY 的交叉反应[11-14]通过间接ELISA检测,分别将4种蛋白质抗原:β-酪蛋白(β-CN)、β-乳球蛋白(β-Lg)、明胶(G)和大豆蛋白粉(S)以2n倍比稀释后包被酶标板,两种抗体(质量浓度调整至100μg/mL)与包被的蛋白质抗原反应,洗涤后加入酶标兔抗鸡抗体IgG-HRP(1:2000),孵育后加入底物溶液显色,检测A450nm值,结果见图1。
由图1a可知,anti-β-CN IgY与β-酪蛋白、β-乳球蛋白、大豆蛋白粉、明胶(蛋白质质量浓度在12.5~1.6μg/mL范围内,除明胶外其他3种蛋白A450nm均大于0.2)免疫反应后,A450nm值由大到小的顺序为β-酪蛋白>β-乳球蛋白>大豆蛋白粉>明胶。anti-β-CN IgY对β-乳球蛋白的亲和力与对其相应蛋白质抗原β-酪蛋白的亲和力较为相近,对大豆蛋白粉的亲和力稍弱,A450nm显示存在一定交叉反应,而与明胶(A450nm<0.2)基本没有交叉反应。
由图1b可知,通过所建立的竞争ELISA体系用blocked anti-CN IgY多克隆抗体分别与β-酪蛋白(β-CN)、β-乳球蛋白(β-Lg)、明胶(G)、大豆蛋白粉(S) (12.5μg/mL)进行交叉反应。结果表明blocked anti-β-CN IgY对β-酪蛋白的特异性明显提高,对其他3种蛋白基本没有交叉反应。本实验建立的ELISA体系特异性良好,可以应用于进一步实验。
2.2 竞争ELISA检测体系的建立[15-16]
2.2.1 竞争ELISA程序
通过方阵法,设定A450nm≈1.0,确定blocked antiβ-CN IgY(稀释起始质量浓度为1mg/mL)的包被最佳浓度为1:160;酶标抗原最佳工作浓度β-CN-HRP为1:20。
2.2.2 竞争ELISA法的标准曲线
以最适抗体质量浓度包被,加入酶标抗原(最适工作浓度的2倍)和系列浓度标准抗原(β-酪蛋白起始质量浓度为400μg/mL,按2n稀释)各50μL,摇床上室温孵育2h,洗板4次后显色测定绘制标准曲线,结果表明,当标准β-酪蛋白质量浓度分别在6.25~400μg/mL时,IC50为348μg/mL,A450nm与β-酪蛋白的浓度呈良好的线性关系,可以用于β-酪蛋白在此质量浓度区间的快速测定。
2.2.3 竞争ELISA方法的指标评价
2.2.3.1 敏感性实验
根据已建立的竞争ELISA检测方法,向脱脂牛乳中掺入不同梯度的明胶,应用实验的最佳反应条件确定最低检出量。所得数据结果见表1。
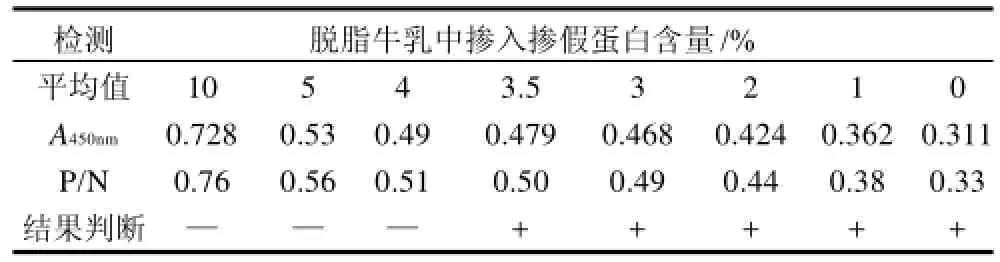
表1 竞争ELISA法测定脱脂乳品敏感性实验平均值Table1 Sensibility assay of indirect-ELISA for skim milk
结果以P/N≤0.5判断为阳性。经3组平行重复实验检测混合样品中牛乳成分的最低检出量为3.5%即5.1μg/mL,接近国外采用哺乳动物抗血清免疫方法检出量[17-18],有关其他掺假蛋白的研究还有待深入。
2.2.3.2 稳定性实验
配制5种不同质量浓度的β-酪蛋白标准溶液,每一质量浓度平行测定5次,用竞争ELISA法测定吸光值,去除最大最小值,剩下3个值取平均,比较验检结果的重复性,测量结果见表2。
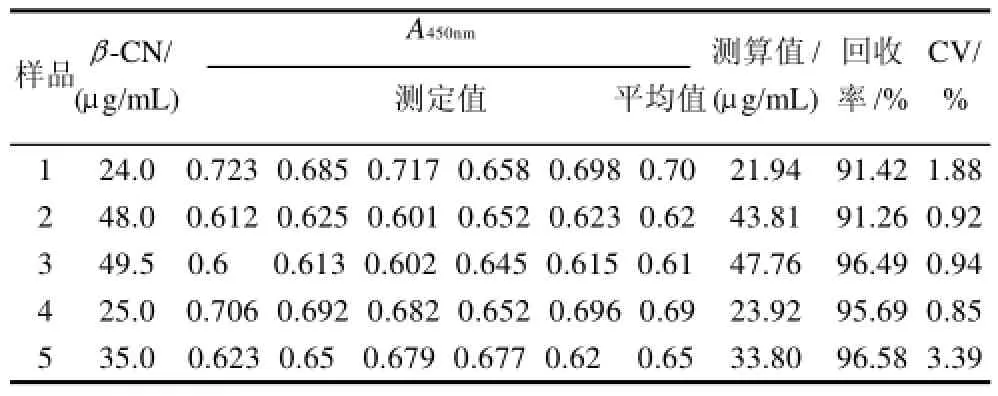
表2 竞争ELISA实验的重复性Table2 Reproducibility assay of competitive-ELISA
从表2可以看出,板内检测阳性抗原的A450nm值的变异系数(CV)小于5%,回收率91%~97%,说明所建立的竞争ELISA检测β-CN抗原具有良好的重复性。
2.3 牛乳样品的检测
2.3.1 牛乳样品制备及稀释度的确定
将鲜牛乳和脱脂牛乳(3000r/min离心20min)分别以2n倍比稀释(稀释度1:10)后与最佳工作浓度下的酶标抗原(β-CN-HRP)等体积混合,按100μL /孔加入已包被的酶标孔进行竞争反应,实验发现鲜牛乳中的脂肪的存在对竞争ELISA影响较大,当牛乳的稀释度从1:1增加到1:320时,A450nm值呈现无规则变化,阴性对照值一直低于1,因此无法取值。而鲜牛乳经过脱脂后进行竞争ELISA检测,A450nm随脱脂牛乳稀释度的增加而增加,当脱脂牛乳的稀释度在1:80时阴性A450nm≈1.0,阳性A450nm值小于0.4,且P/N值相对较小。因此选择脱脂牛乳的竞争稀释度为1:80,或者可以不作稀释。
2.3.2 牛乳样品的测定

表3 乳品蛋白含量检测结果Table3 Detection results of protein content in dairy products
由表3可知,以β-酪蛋白为检测蛋白建立的竞争ELISA法测得样品中β-酪蛋白质量浓度,并通过一般牛乳成分中总蛋白/β-酪蛋白的比例系数2.8572,计算得到理论总蛋白的质量浓度,然后与通过考马斯亮蓝法测定的实际总蛋白质量浓度相比较,相对误差在-0.84%~0.1%范围内,CV小于5%。该结果反映了本实验所建立的ELISA体系测定牛乳蛋白质量浓度的准确度和精密度都较高,可以实现ELISA检测体系对牛乳质量的定性定量监测。钱博[19]研究发现采用考马斯亮蓝法与传统的凯式定氮法测定乳中的真蛋白的结果没有显着性差异,因此本实验选用考马斯亮蓝法以酪蛋白绘制标准曲线来测定乳样品的实际蛋白质量浓度。
3 结 论
本实验确定抗体最佳包被质量浓度,酶标抗原最佳工作质量浓度,封闭液及封闭时间,抗体稀释液及酶标抗原作用时间,底物最佳反应时间等对竞争ELISA检测有影响的因素,利用blocked anti-β-CN IgY抗体,初步建立了牛乳及其乳制品中固有蛋白成分的竞争ELISA检测方法。以脱脂牛乳的检测程序为例,操作程序简单,整个检测过程仅需4h(不计包被时间),可同时处理多个不同牛乳样品及重复实验,竞争ELISA体系的最大特点是实验操作作简单快速,能够实现牛乳及其乳制品的快速定量检测,很有开发应用潜力。
[1]王晶, 王加启,卜登攀, 等. 近红外光谱技术在牛奶及其制品品质检测中的应用[J]. 光谱学与光谱分析, 2009(5): 873-878; 1281-1285.
[2]张岩春, 郑喆, 尤娟, 等. 驴乳中α-乳白蛋白和β-乳球蛋白的测定[J]. 农产食品科技, 2008, 2(4): 13-14.
[3]刘婷, 姜金斗, 刘宁. 毛细管电泳检测奶粉中添加的大豆分离蛋白[J]. 分析科学学报, 2008, 24(1): 37-41.
[4]HURLEY I P, IRELAND H E, COLEMAN R C, et al. Application of immunological methods for the detection of species adulteration in dairy products[J]. International Journal of Food Science and Technology, 2004, 39: 833-878.
[5]RUAN Guangping, MA Li, HE Xiaowei. Efficient production, purification and application of egg yolk antibodies against human HLA-A*0201 heavy chain and light chain (b2m)[J]. Protein Expression and Purification, 2005, 44(1): 45-50.
[6]王廷华, 李官成. 抗体理论与技术[M]. 北京: 科学出版社, 2005: 256-260.
[7]宋宏新, 柏红梅, 薛海燕, 等. 酪蛋白和乳球蛋白的抗体及酶标物制备研究[J]. 食品科学, 2008, 29(12): 486-489.
[8]焦奎, 张书圣. 酶联免疫分析技术及应用[M]. 北京: 化学工业出版社, 2004: 85-86.
[9]王成东. 大熊猫初乳和血清中免疫球蛋白的分离提纯及其抗血清的制备[J]. 兽类学报, 2001, 21(1): 73-77.
[10]RODRIGUEZ E, MARTIN R, GARCIA T, et al. Detection of cows milk in ewes milk and cheese by an indirect enzyme linked immunosorbent assay (ELISA)[J]. Journal of Dairy Research, 1990, 57: 197-205.
[11]RODRIGUEZ E, MARTIN R T. Indirect ELISA for detection of goats milk in ewes milk and cheese[J]. Journal of Dairy Science, 1991, 26: 457-465.
[12]DOBERSTEIN K H, GREUEL E. The preparationof specific antisera for the identification of meat of African antilope species in an agargel precipitation test[J]. Fleischwirtschaft, 1982, 62: 1011-1019.
[13]JONES S J, PATTERSON R L S. A modified indirect ELISA procedure for raw meat speciation using crude anti-species antisera andstabilised immunoreagents[J]. Journal of the Science of Food and Agriculture, 1986, 37: 767-775.
[14]杨贵贞. 医学免疫学[M]. 北京: 高等教育出版社, 2003.
[15]冯挺财, 邵谱, 胡珩, 等. 牛乳铁蛋白直接竞争ELISA检测法的建立[J]. 安徽农业科学, 2008, 36(18): 7650-7652.
[16]董雪, 钟青萍, 黄安诚, 等. 河豚毒素直接竞争ELISA检测方法的研究[J]. 现代食品科技, 2009, 25(8): 977-980.
[17]HURLEY I P, IRELAND H E, COLEMAN R C, et al. Application of immunological methods for the detection of species adulteration in dairy products[J]. International Journal of Food Science and Technology, 2004, 39: 873-878.
[18]MOATSOU G, ANIFANTAKIS E. Recent developments in antibodybased analytical methods for the differentiation of milk from different species [J]. International Journal of Dairy Technology, 2003, 56(3): 133-138.
[19]钱博. 乳粉蛋白质快速检测方法的研究[D]. 杭州: 浙江大学, 2006.
Detection of Bovine β-Casein by Competitive ELISA
SONG Hong-xin,PAN Jie,BAI Hong-mei,XUE Hai-yan
(Institute of Life Science and Engineering, Shaanxi University of Science and Technology, Xi’an 710021, China)
In order to establish a competitive ELISA method for detecting β-casein of bovine milk, the factors to affect competitive-ELISA were investigated. The optimal conditions for competitive ELISA method were coated anti-β-CN IgY concentration of 1:160, 1% gelatin-PBST as the blocking solution and blocking time of 1 h. The working titers betweenβ-CNHRP and detection samples were 1:20 and 1:80, respectively. The reaction time of antibody and antigen was 1 h and the optimum enzymatic reaction time was 20 min. Detection results indicated that the detected limit was 3.5% with a variation coefficient (CV) of less than 5%. This method can be used for rapid and accurate detection ofβ-casein in bovine milk and dairy products.
competitive ELISA;β-casein;egg-yolk antibody
Q512
A
1002-6630(2010)22-0450-03
2010-07-20
陕西省科学技术厅农业攻关项目(2009K02-09);陕西省教育厅产业化培育项目(09JC19)
宋宏新(1959—),男,教授,硕士,主要从事生物化学与分子生物学、食品科学和免疫检测研究。E-mail:hongxinsong@163.com



