乙小娟,朱加叶,丁 萍,夏拥军
(张家港出入境检验检疫局,江苏 张家港 215600)
高效液相色谱法快速测定大米中的4种烟碱农药残留量
乙小娟,朱加叶,丁 萍,夏拥军
(张家港出入境检验检疫局,江苏 张家港 215600)
建立使用高通量(RRHT)色谱柱的高效液相色谱法同时测定大米中呋虫胺、噻虫胺、吡虫啉、吡虫清四种烟碱农药残留量的方法。样品用乙腈提取,采用ENVI-Florisil和Carb复合固相萃取柱萃取净化,液相色谱高通量RRHT色谱柱,258nm紫外测定,外标法定量。检测过程快速准确,2.5min时4种农药可完全分离。样品中加标回收率为75.5%~96.0%,相对标准偏差为0.49%~4.36%,最低检出限达到0.004mg/kg。峰面积与标准溶液质量浓度在0.1~1.0mg/L范围内呈良好的线性关系,线性回归系数大于0.9996。
呋虫胺;噻虫胺;吡虫啉;吡虫清;液相色谱;高通量色谱柱;固相萃取;大米
烟碱类杀虫剂的作用机制主要是通过选择性控制昆虫神经系统烟碱型乙酰胆碱酯酶受体,阻断昆虫中枢神经系统的正常传导,从而导致害虫出现麻痹进而死亡[1]。可有效防治同翅目、鞘翅目、双翅目和鳞翅目等害虫,对用传统杀虫剂防治产生抗药性的害虫也有良好的活性。
从20世纪80年代中期由德国拜耳公司成功开发出第一个烟碱类杀虫剂一吡虫啉问世到目前为止,已有十几个产品商品化或即将商品化[1]。如呋虫胺(dinotefuran)、噻虫胺(clothianidin)、吡虫啉(imidacloprid)、啶虫脒(acetamiprid,又名吡虫清)等[2-4],日本已规定大米中这4种烟碱类农药最高残留限量(MRL)为0.01~2mg/kg[5],澳大利亚对谷物中吡虫啉的最高残留限量是0.05mg/kg[6]。
目前有文献报道用HPLC-MS/MS检测食品中的呋虫胺[7]。文献[8-10]报道用高效液相色谱法测定(HPLC)测定茶叶、蔬菜、水果中吡虫啉的残留。文献[11-15]检测蔬菜、茶叶和水果中吡虫啉或啶虫脒,文献[16]报道了茶叶中6种烟碱农药的HPLC-MS/MS检测。目前尚未见使用高通量色谱柱的液相色谱方法同时检测大米中4种烟碱类杀虫剂残留的报道。本实验对大米中呋虫胺、噻虫胺、吡虫啉、吡虫清的高效液相色谱测定方法进行研究,考察不同质量浓度的呋虫胺、噻虫胺、吡虫啉、吡虫清在Florisil-Carb复合固相萃取柱上的保留行为。本方法采用乙腈提取,复合固相萃取柱净化,HPLC-DAD分离检测,外标法定量,旨在建立采用快速分离高通量色谱柱(rapid resolution high throughput,RRHT)同时测定大米样品中呋虫胺、噻虫胺、吡虫啉、吡虫清残留量的液相色谱方法。
1 材料与方法
1.1 材料、试剂与仪器
稻谷经清理、碾米、成品整理后的成品大米。
呋虫胺、噻虫胺、吡虫啉、吡虫清标准品(纯度≥97%);乙腈(色谱纯);正己烷(农残级);丙酮(紫外光谱纯);氯化钠(分析纯),140℃烘烤4h,置于干燥器内备用。
HP1200高效液相色谱仪(附DAD检测器) 美国安捷伦公司;R200旋转蒸发器 瑞士公司;KQ-500D超声波清洗器 昆山超声仪器有限公司;SPE小柱处理系统 美国Supelco公司;Superclean ENVI-Florisil(500mg/3mL)和Superclean ENVI-Carb(500mg/3mL)固相萃取柱;T25匀浆机 德国IKA公司。
1.2 方法
1.2.1 样品中呋虫胺、噻虫胺、吡虫啉、吡虫清的提取
称取25g粉碎试样,置于250mL具塞锥形瓶中,加30mL水浸泡15min,准确加入乙腈50mL,振荡提取30min后过滤,滤液收集到装有5~7g氯化钠的100mL具塞量筒中,收集滤液60~80mL,盖上塞子,剧烈振荡,静置,使乙腈相和水相分层,从100mL具塞量筒中吸取25.00mL乙腈溶液,放入125mL心型瓶中,旋转蒸发仪50℃以下浓缩至近干。用1mL丙酮溶解残渣,待残渣完全溶解后,加入9 m L正己烷,混匀,待净化。
1.2.2 固相萃取净化样品
将Florisil和Carb固相萃取柱用连接头上下串联起来(Carb固相萃取柱在上),5mL正己烷预淋洗,将1.2.1节制备的溶液移入Florisil和Carb的复合柱中,弃去流出液。然后用10mL丙酮-正己烷(50:50)淋洗柱子,收集15mL淋洗液,旋转蒸发仪50℃以下浓缩至近干,用乙腈-水(30:70)定容至1mL,经0.22μm滤器滤至样品瓶内,待测。
1.2.3 标准溶液配制及标准曲线
准确称取适量的呋虫胺、噻虫胺、吡虫啉、吡虫清标准品,用乙腈配制成100mg/L标准储备液,用乙腈-水(30:70)将储备液稀释成0.10、0.20、0.40、0.60、0.80、1.0mg/L混合标准溶液系列。按选定色谱条件进样,以混合标准溶液中呋虫胺、噻虫胺、吡虫啉、吡虫清的质量浓度(X)和组分色谱峰面积(Y)作标准曲线,4种化合物在0.1~1.0mg/L范围内线性关系良好,其线性方程和相关系数见表1。
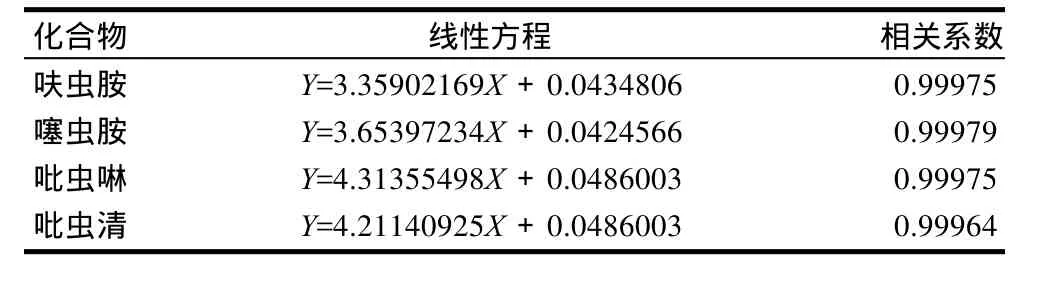
表1 呋虫胺、噻虫胺、吡虫啉、吡虫清的线性方程和相关系数Table 1 Linear equations and correlation coefficients of four neonicotinoid residues
1.3 色谱条件
色谱柱:XDB C18(4.6mm×50mm,1.8μm) RRHT;色谱柱温度:25℃;流动相:A为体积分数0.2%的甲酸溶液,B为乙腈。
梯度洗脱:流动相:0.2%甲酸溶液(A)和乙腈(B);梯度洗脱程序:0min时,5% B;0~1.5min,线性增加至35% B,保持到3.5min,再升至75%,4.5min结束,之后进行系统平衡,平衡时间2min;流速2mL/min;进样量2μL;检测波长258nm,采集时间0.01min。
2 结果与分析
2.1 样品提取剂的选择
烟碱类农药属于极性物质,易溶于甲醇、乙腈等[16],本实验以乙腈为提取剂对大米中的烟碱类农药进行提取。结果表明,用乙腈提取样品,不仅可以减少大米中油脂的提取量,而且烟碱类农药的回收率也能满足要求。为了更好地保证乙腈渗入大米体内,在大米中先加入适量的水浸润大米样品,使其细胞完全涨开,再加入乙腈振荡,可提高提取效率。
2.2 固相萃取柱的选择
Florisil属于一种正相固相萃取柱,对极性较强的化合物吸附力较强,是从有机基体中去除或分离极性物质的理想之选,它可以有效地吸附样品中的脂肪酸和叶黄素[17]。选用Florisil柱净化,用体积比1:9的丙酮-正己烷溶解提取液残渣,采用体积比1:1的正己烷-丙酮洗脱,洗脱液中仍有黄色色素存在;然后通过使用Florisil和Carb混合净化柱净化,色素被活性炭吸附,减少了色素的干扰。当收集洗脱液15mL时,通过实验发现,洗脱液中呋虫胺、噻虫胺、吡虫啉、吡虫清4种烟碱农药的回收率可达95%以上。但是直接用10mL体积比为1:9的丙酮-正己烷溶解提取液残渣,再用弗罗里硅土和活性炭混合净化柱净化,四种农药的回收率低,均小于60%;改用1mL丙酮溶解提取液残渣,再加入9mL正己烷混匀净化,回收率符合实验要求。这可能是由于烟碱农药的极性大,体积比为1:9的丙酮-正己烷不能完全溶解样品提取液残渣中呋虫胺、噻虫胺、吡虫啉、吡虫清的缘故。
2.3 液相色谱柱的选择
快速分离高通量(RRHT)色谱柱是指柱内填料粒径为1.8μm、长度只有50mm的液相色谱柱,这种色谱柱在保证分离度的情况下,可以大大提高分析时间,缩短检测周期[18]。采用XDB C18(4.6mm×50mm,1.8 μ m) RRHT柱在2.5min时就达到了4种烟碱农药的完全分离(图1),比使用常规(4.6mm×150mm,5μm)色谱柱加快了十几分钟,大大提高了工作效率。

图1 呋虫胺、噻虫胺、吡虫啉、吡虫清标准溶液色谱图Fig.1 HPLC chromatograms of four neonicotinoid standards
2.4 检测波长的选择
对于紫外-可见检测器,检测时一般选择对样品有最大吸收的波长进行,以获得最大的灵敏度和抗干扰能力,对4种标准样品进行了光谱扫描,呋虫胺在270nm处有最大吸收,噻虫胺在260nm处有最大的吸收,吡虫啉在270nm处有最大的吸收,吡虫清在250nm处有最大的吸收,综合考虑4种农药同时检测的灵敏度,实验结果表明,当检测波长设定为258nm时,相同质量浓度的呋虫胺、噻虫胺、吡虫啉、吡虫清标准溶液能够获得相似的灵敏度,最终选择258nm作为检测波长。
2.5 流动相的优化
在等度反相分离时,通过对标准溶液的实验表明,当乙腈-水体积比为35:65左右时,检测的灵敏度达到最佳,但呋虫胺峰型不是很好。当使用0.2%甲酸为流动相A,起始梯度为95% A+5% B时,峰型改善,1.5min后梯度上升至35% B,在所使用的梯度条件下,可将所有色谱峰在2.5min左右达到基线分离。整个分析4.5min结束。
2.6 溶剂效应
使用纯乙腈作定容溶剂时,由于样品溶剂强度大于乙腈-水流动相,呋虫胺的峰形有所拖尾(伸舌),会引起谱峰展宽和变形而导致定量不准,而后面的3个峰不受影响,溶解样品有机相比例远远大于起始流动相中有机相比例时,色谱峰(尤其是较早洗脱的色谱峰)会有展宽现象。本实验在乙腈中加入一定量的水调节溶剂强度,峰形窄而对称,峰形得到明显改善。将乙腈-水(30:70)作为样品溶剂进样,进样量大时呋虫胺的峰明显拖尾,通过实验将样品量定为2μL。
2.7 回收率及精密度实验
按RSN=10计算,本方法呋虫胺、噻虫胺、吡虫啉和吡虫清的最低检出限均为0.004mg/kg。
采用添加回收的方法,在空白大米样品中,分别称取3份不含呋虫胺、噻虫胺、吡虫啉、吡虫清的大米样品,分别添加10μg/mL混合标准溶液0.025、0.05、0.10mL,每份样品按样品检测方法重复检测6次,测得呋虫胺回收率在87.5%~94.0%之间,相对标准偏差在0.57%~2.48%之间;噻虫胺回收率在79.0%~90.0%之间,相对标准偏差在0.49~3.80%之间;吡虫啉回收率在75.5%~96.0%之间,相对标准偏差在2.82%~3.91%之间;吡虫清回收率在91.8%~94.5%之间,相对标准偏差在1.01%~4.36%之间。结果见表2。0.01mg/kg加标色谱图见图2。

表2 呋虫胺、噻虫胺、吡虫啉、吡虫清的回收率和精密度Table 2 Results of precision and recovery rate experiments

图2 大米加标图谱Fig.2 HPLC chromatogram of spiked rice sample
3 结 论
运用液相色谱高通量柱同时测定了大米中4种烟碱农药。所建立的方法简便快速,2.5min内在色谱上即可达到4种农药完全分离;准确度和精密度高,加标回收率在75.5%~96.0%,相对标准偏差在0.49%~4.36%;方法灵敏度高,最低检出限达到0.004mg/kg。完全可满足进出口大米中4种烟碱农药的检测要求。
[1] 张国生, 侯广新. 烟碱类杀虫剂的应用、开发现状及展望[J]. 农药科学与管理, 2004, 25(3): 22-26.
[2] 朱丽华. 新型烟碱农药呋虫胺的开发沿革[J]. 世界农药, 2004, 26(2):16-19.
[3] 孙越. 新烟碱类化合物的合成极其杀虫活性研究[J]. 农药译丛, 1996,18(6): 19-21.
[4] 慕长炜, 覃兆海. 吡啶类农药的研究进展[J]. 现代农药, 2003, 2(3):4-8.
[5] 《食品中农业化学品残留限量》编委会. 食品中农业化学品残留限量: 药品卷日本肯定列表制度[S]. 北京: 中国标准出版社, 2006.
[6] 主要贸易国家和地区食品中农兽药残留限量标准委员会. 主要贸易国家和地区食品中农兽药残留限量标准[S]. 北京: 中国标准出版社,2006.
[7] 李立, 付建, 初玉圣, 等. 食品中呋虫胺残留量的HPLC-MS/MS检测方法研究[J]. 食品科学, 2008, 29(11): 538-540.
[8] 汤富彬, 刘光明, 罗逢健, 等. 茶叶中吡虫啉残留量的HPLC测定方法[J]. 农药, 2004, 43(12): 561-562.
[9] 刘承兰, 刘丰茂, 李莉, 等. 高效液相色谱法测定芦笋中多菌灵和吡虫啉残留[J]. 农药学学报, 2004, 6(4): 93-96.
[10] 陈黎, 王金芳, 杜鹏, 等. 韭菜中吡虫啉和啶虫脒残留的微波处理-逆固相分散法净化及液相色谱检测[J]. 分析化学, 2008, 36(10): 1364-1368.
[11] 谢文, 丁慧瑛, 蒋晓英. 液相色谱-串联质谱检测蔬菜和茶叶中吡虫啉的残留量[J]. 色谱, 2006, 24(6): 633-635.
[12] 何强, 赵洁, 孔祥红, 等. HPLC法同时测定苹果及浓缩苹果汁中吡虫清等4种农药的残留量[J]. 分析实验室, 2008, 27(6): 64-66.
[13] POUS X, RUIZ M J, PICO Y, et al. Determination of imidacloprid,metalaxyl, myclobutanil, propham, and thiabendazole in fruits and vegetables by liquid chromatpography-atmospheric pressure chemical ionization-mass spectrometry[J]. Anal Chem, 2001, 371(2): 182-189.
[14] SANNINO A, BOLZONI L, BANDINI M J. Application of liquid chromatography with electrospray tandem mass spectrometry to the determination of a new generation of pesticides in processed fruits and vegetables[J]. Journal of Chromatography A, 2004, 1036(2): 161-169.
[15] 谢文, 丁慧瑛, 蒋晓英, 等. 液相色谱-串联质谱检测蔬菜和茶叶中吡虫啉的残留量[J]. 色谱, 2006, 24(6): 633-635.
[16] 谢文, 钱艳, 丁慧瑛, 等. 液相色谱电喷雾电离三级四极杆质谱法测定茶叶中6种烟碱类农药残留[J]. 分析化学, 2009, 37(4): 495-499.
[17] 林谷园, 张金虎, 赵建晖, 等. 固相萃取-气相色谱-质谱联用法检测进出口蔬菜产品中百菌清残留[J]. 福建分析测试, 2009, 18(4): 13-16.
[18] 吴献花, 林红, 李海涛, 等. 用快速分离柱高效液相色谱法测定食品中重金属元素的研究[J]. 食品科学, 2005, 26(6): 218-220.
Determination of Neonicotinoid Residues in Rice by HPLC
YI Xiao-juan,ZHU Jia-ye,DING Ping,XIA Yong-jun
(Zhangjiagang Entry-exit Inspection and Quarantine Bureau, Zhangjiagang 215600, China)
A reverse phase high performance liquid chromatography (RP-HPLC) method has been developed for determining dinotefuran, clothianidin, imidacloprid and acetamiprid residues in rice. Neonicotinoid residues were extracted from the sample by acetonitrile, and then cleaned up with ENVI-Florisil and carb SPE tube. The HPLC detection was performed using a DAD detector in the external standard mode. Results indicated that average recovery rates in spiked samples were in the range of 75.5%-96.0%, the relative standard deviations varied between 0.49% and 4.36% and the detection limit was 0.004 mg/kg. A good linear correlation between peak areas and the concentrations of four neonicotinoid residues was observed in the range of 0.1-1000μg/mL with a calibration coefficient of 0.9996.
dinotefuran;clothianidin;imidacloprid;acetamiprid;high performance liquid chromatography;solid phase extraction;rice
O657.7
A
1002-6630(2011)06-0169-04
2010-05-04
江苏省出入境检验检疫局科研项目(2006KJ14)
乙小娟(1967—),女,副主任技师,本科,主要从事进出口食品检测研究。E-mail:yxj671001@yahoo.com.cn



