李彩霞,焦 扬*,高海宁,张芬琴,袁海琴
(河西学院生物科学与工程系,甘肃 张掖 734000)
一株细菌红色素的结构及理化性质
李彩霞,焦 扬*,高海宁,张芬琴,袁海琴
(河西学院生物科学与工程系,甘肃 张掖 734000)
研究一株细菌红色素的结构和理化性质。采用95%乙醇溶液提取菌体色素,考察光照、温度、pH值、氧化剂、防腐剂、酸味剂、糖类、VC和金属离子对该色素稳定性的影响,将粗色素纯化后进行波谱结构研究。结果表明:色素最大吸收波长在533nm附近,结构鉴定为灵菌红素,其易溶于有机溶剂,在pH≤5时稳定性较好;色素对辐射及高质量浓度蔗糖的耐受力较强,对自然光、高温的耐受力较差;低质量浓度的苯甲酸钠、抗坏血酸和低体积分数的过氧化氢对色素稳定性影响不大;酸味剂和部分金属离子(Na+、K+、Mg2+、Ca2+、Al3+、Mn2+)对色素有增色作用,Fe3+对色素有明显的影响,Zn2+离子对色素基本无影响。
细菌;红色素;结构;理化性质
色素作为添加剂广泛用于食品工业、医药和化妆品行业。食用色素目前主要分为合成色素和天然色素两大类。合成色素因为大部分有毒,被世界各国相继制定法规而淘汰[1],天然色素以其安全、绿色、多功能而备受青睐。天然色素主要来源于植物、动物和微生物[2]。目前在我国的天然色素中,红色素占主导地位,但这些红色素主要是从植物中提取,存在生长周期长、提取工艺比较复杂等问题[3]。同时,植物材料受季节、气候、产地等因素的影响,其色素的应用具有一定的局限性,而微生物色素克服了植物材料生产色素的诸多弊端,生产周期短,同时不受资源、时间和空间等因素的限制,并且易于工业化生产,因此,利用微生物生产天然色素前景广泛[3-5]。
国内很多学者对微生物生产色素做了大量研究工作,廖振林等[6]对一株海洋放线菌产黄色素的提取与稳定性进行了研究,龙正海等[7]从竹黄中分离出一株产蒽醌菌株并对该菌株的鉴定及其培养特性进行研究,刘军等[8]对从近海海水和海泥中筛选出的高产红色素细菌进行鉴定并对其稳定性进行研究,袁保红等[9]从海洋中分离出一株产灵菌红素的细菌。目前,研究产色素的微生物大多来源于海洋和内生菌,菌株未涉及到独特土壤环境微生物领域。因此,研究不同地域、不同生态环境微生物所产色素很有必要。
本研究从河西走廊张掖境内采集的芦苇根系土壤中分离出一株高产红色素细菌,对其色素的结构及理化性质进行研究,以期为该色素的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
菌种为本实验室从土壤(张掖地区,芦苇根系周围的土壤)中分离的红色素高产菌株。
柠檬酸、蔗糖、苹果酸、琥珀酸、乙酸、乳酸、VC、NaCl、KCl、CaCl2、95%乙醇、盐酸等均为国产分析纯;蛋白胨、牛肉膏均为国产生化试剂;X-5型大孔吸附树脂 天津南开大学化工厂;柱层析所用硅胶(200目) 青岛海洋化工厂。
1.2 仪器与设备
AE200电子分析天平 Mettler Toledo公司;760CRT双光束紫外-可见分光光度计 上海精密科学仪器有限公司;SHZ-2000型双配套循环水式多用真空泵 河南省巩义市英峪予华仪器厂;CRG21Ⅱ高速冷冻离心机 日本日立公司;VA1-2真空干燥箱 美国Shellab公司;HZP-250型全温振荡培养箱 上海精宏实验设备有限公司;MODEL-3旋转蒸发仪 上海医疗器械专机厂;XT-5006-BF26超级恒温水槽 杭州雪中炭恒温技术有限公司; 层析柱(15cm×30cm) 上海亚荣生化仪器厂;AVANCE 400MHz核磁共振波谱仪 瑞士Brucker Biospin公司;Esquire6000离子阱液质联用仪 Bruker Daltonics公司。
1.3 培养基
斜面培养基[10]:蛋白胨10g/L、牛肉膏3g/L、氯化钠5g/L、琼脂15~20g/L,pH7.2~7.5。种子扩大培养基:同斜面培养基,其他成分相同,不加琼脂。液体发酵培养基:蛋白胨15g/L、蔗糖10g/L、CaCl20.025mol/L,加适量的硫酸锰溶液,pH6.0~7.0。
1.4 色素的提取与制备
1.4.1 色素的生产和提取工艺
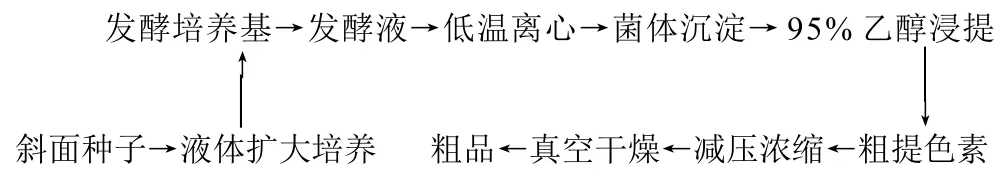
1.4.2 菌体培养
从斜面培养基上挑取单菌落接种于种子培养液中,32℃、180r/min振荡培养12~16h,以2%的接种量接入发酵培养基中,振荡培养4 8 h;合并发酵液,在12000r/min离心10min,收集紫红色菌体。
1.4.3 色素的提取
在紫红色菌体中加入95%乙醇提取色素直至菌体无色,过滤除去菌体,合并色素溶液,减压浓缩(压力0.080MPa,温度30~40℃),真空干燥成黑紫色粉末,置于棕色瓶中备用。
1.5 色素结构的鉴定方法
1.5.1 色素的分离与纯化
将色素粗品用少量的甲醇溶解,加水定容一定体积,上预处理好的X-5大孔吸附树脂,甲醇洗脱,收集高浓度的洗脱峰,浓缩后的色素用甲醇溶解,上硅胶柱,用甲醇洗脱收集红色流出液,收集到的洗脱液进行薄层色谱分析,碘蒸气显色,合并没有杂质的洗脱液,浓缩,真空干燥用于质谱和氢谱分析。
1.5.2 色素的紫外-可见光谱特性
准确吸取色素母液1mL分别用95%乙醇、酸性乙醇、酸性甲醇定容10mL,用紫外-可见分光光度计在200~600nm范围内扫描,考察不同溶剂对色素吸收峰的影响。
1.5.3 色素质谱分析
正离子扫描(ESI+,m/z 50~3000,雾化器(N2)压力17Pa,干燥器(N2)流速9.00L/min,ESI+离子源温度250℃),毛细管电压及锥孔电压采用Smart模式,导入离子源4μL/min。
1.5.4 色素的氢谱分析
1H-NMR由AVANCE核磁共振波谱仪400MHz测得,试剂为CDCl3,内标为TMS。
1.6 色素的理化性质测定方法
1.6.1 色素液的制备
称取40mg色素粉末,用95%乙醇溶解并定容到100mL棕色容量瓶中作为色素母液冷藏备用。
1.6.2 色素的溶解性
1.6.2.1 色素在不同溶剂中的溶解度
分别称取20mg干燥色素液依次用蒸馏水、95%乙醇、丙酮、乙酸乙酯、甲醇、0.1%HCl-乙醇、0.1% HCl-甲醇、氯仿各10mL,混合、振荡,观察色素的溶解性和颜色变化,并稀释15倍后(蒸馏水未稀释)在200~600nm扫描,考察色素在不同溶剂中的最大吸收峰。
1.6.2.2 不同体积分数的乙醇溶液对色素的影响
准确吸取色素母液1mL分别置于10mL容量瓶中,用体积分数为95%、80%、70%、60%、50%、40%的乙醇定容至10mL,观察色素的溶解性和颜色的变化以及色素在不同体积分数的乙醇溶液中的最大吸收峰。
1.6.3 不同环境条件对色素稳定性的影响
1.6.3.1 pH值对色素稳定性的影响
准确吸取色素母液1mL分别置于10mL容量瓶中,在室温条件下,用0.1mol/L盐酸和0.1mol/L的氢氧化钠将色素液调配成pH值为2、3、4、5、6、7、8、9,用80%的乙醇定容至10mL,静置1h,在波长为200~600nm范围内扫描测其吸光度,并观察颜色的变化,分析不同pH值对色素稳定性的影响。
1.6.3.2 温度对色素稳定性的影响
将配制好的80%乙醇(pH3)的色素溶液分别置于5组具塞试管中,然后分别置于30、40、50、60、70℃的恒温水浴锅中保温30、60、90min后立即冷却,在λmax处测定不同温度下色素液的吸光度,并观察色素液的颜色变化。
1.6.3.3 光对色素稳定性的影响
1)紫外光对色素稳定性的影响
准确吸取色素母液1mL,用80%乙醇(pH3)定容至10mL,置于紫外灯(20W,365nm)下,照射距离15cm,照射时间分别为0、15、30、45、60、75min,然后在λmax波长处测其吸光度,并观察色素液的颜色变化。
2)可见光对色素稳定性的影响
分别配制80%乙醇(pH3)的色素溶液4份,3份装于无色试剂瓶中,分别置于自然光、室温避光及低温避光条件下,1份装于棕色试剂瓶中置于自然光下,每隔一天在λmax波长处测定色素液的吸光度,并观察颜色变化,考察光和贮藏容器对色素稳定性的影响。
1.6.3.4 酸味剂对色素稳定性的影响
取1mL色素母液,分别加入1.0mL体积分数为0.2%乙酸、柠檬酸、苹果酸、乳酸、琥珀酸溶液,用80%乙醇(pH3)定容10mL,以不加酸味剂的色素乙醇溶液(pH3)为对照,静置0.5h,然后在λmax处测定色素液的吸光度,并观察颜色的变化,分析酸味剂对色素稳定性的影响。
1.6.3.5 食品添加剂对色素稳定性的影响
取1mL色素母液,分别加入0、0.2、0.4、0.6、0.8、1.0mL体积分数10%的H2O2及质量浓度10g/100mL的VC、蔗糖和苯甲酸钠,用80%乙醇(pH3)定容至10mL,使H2O2终体积分数为0、0.2%、0.4%、0.6%、0.8%、1.0%,VC、蔗糖和苯甲酸钠的终质量浓度为0、0.2、0.4、0.6、0.8、1.0g/100mL,分别放置不同时间后,并在λmax波长处测定色素液的吸光度,并观察色素溶液的颜色变化。
1.6.3.6 金属离子对色素稳定性的影响
吸取1mL的色素母液分别加入1mL 6.0mg/mL的Mn2+、Fe3+、Ca2+、Mg2+、Na+、K+、Al3+、Zn2+离子溶液,用80%乙醇(pH3)定容10mL,以不加金属离子的色素乙醇溶液(pH3)为对照,然后在λmax波长处测定色素液的吸光度,并观察色素液的颜色变化。
以上结果均重复3次,图中数据均为3次数据的平均值。
2 结果与分析
2.1 色素的结构鉴定
2.1.1 色素的紫外-可见光谱特性
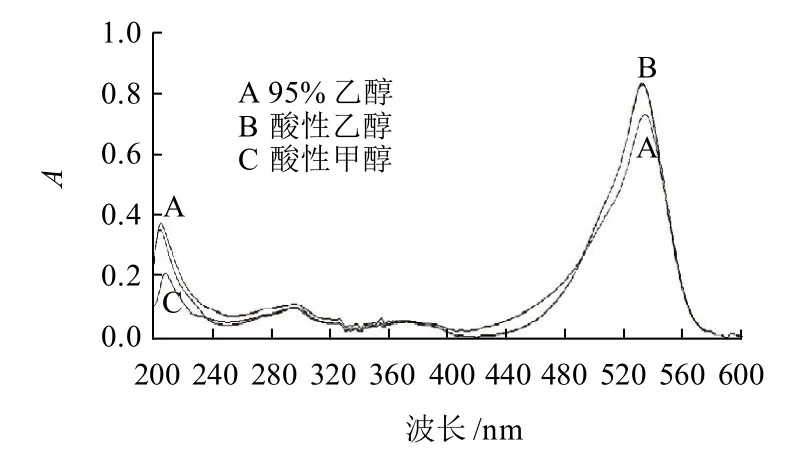
图1 色素的紫外可见光谱Fig.1 UV-visible spectra of the red pigment in different solvents
3种溶剂的色素液在200~600nm范围内的图谱如图1所示,酸性乙醇和酸性甲醇的图谱基本重合,95%乙醇的色素液的图谱吸收峰低于其他两种溶剂的吸收峰,但是3种溶剂色素液的图谱变化趋势基本一致,在533nm附近有一个最大吸收峰,该色素的紫外-可见光图谱与文献报道的灵菌红素的紫外-可见光图谱一致[11-14]。
2.1.2 色素质谱分析
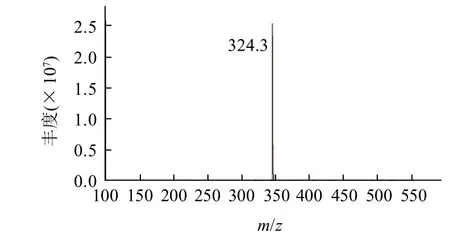
图2 红色素质谱图Fig.2 Mass spectrum of the red pigment
色素溶液用ESI-MS质谱分析,结果如图2所示,该化合物的m/z为324.3[M+H],以此可以判断该色素的相对分子质量为323.3,由此相对分子质量可以计算得到其分子式为C20H25N3O,与报道的灵菌红素的相对分子质量和分子式相一致[13,15]。
2.1.3 色素的氢谱分析
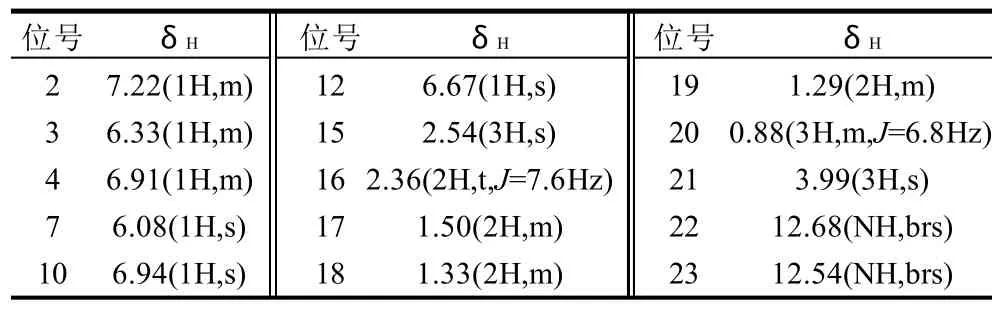
表1 红色素的氢谱数据Table 1 1H-NMR data of the red pigment
红色素由1H-NMR核磁共振波谱仪(400MHz CDCl3,TMS)分析,其氢谱的化学位移δH见表1。
由表1可知,红色素的1H-NMR数据与文献报道的灵菌红素的数据相一致[16-17],综合UV-vis、ESI-MS、1H-NMR结果均与灵菌红素的结构相一致。因此,确定该细菌所产色素为灵菌红素。
2.2 红色素的溶解性
2.2.1 色素在不同溶剂中的溶解性

表2 色素的溶解性Table 2 Solubility of the red pigment
如表2所示,红色素微溶于水,易溶于氯仿、乙酸乙酯、甲醇和乙醇等有机溶剂;在极性强的酸性甲醇和酸性乙醇溶液中溶解性也很好,但在不同的溶剂中最大吸收峰有差异,其中色素在酸性甲醇、酸性乙醇、氯仿和乙醇溶液中的最大吸收峰在波长533nm附近。以上结果表明,该色素属于脂溶性色素,在甲醇溶液里溶解度最好,考虑到甲醇的毒性较大,所以最终选择乙醇作为实验的溶剂。
2.2.2 不同体积分数的乙醇溶液对色素的影响
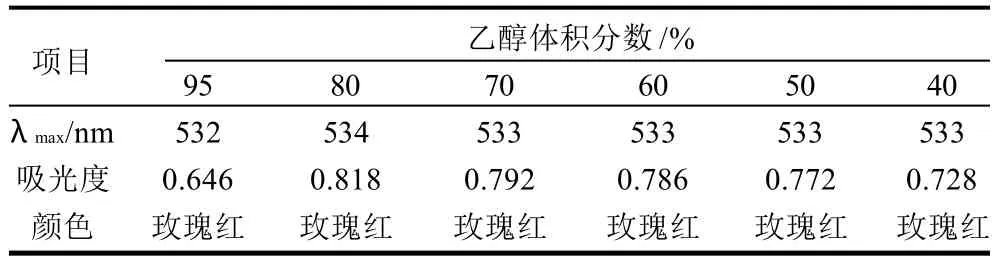
表3 不同体积分数的乙醇溶液对色素的影响Table 3 Effect of different concentrations of aqueous ethanol solutions on red pigment stability
从表3可知,不同体积分数的乙醇溶液对色素稳定性有一定的影响,随着乙醇体积分数的增高,吸光度呈先增后降的趋势,色素在不同的乙醇溶液中最大吸收峰在波长533nm附近,其中红色素在80%乙醇溶剂中吸光度最高,即80%乙醇可作为实验的最佳溶剂。
2.3 不同环境条件对色素稳定性的影响
2.3.1 pH值对色素稳定性的影响
pH值对色素稳定性的影响如图3所示,当pH≤5时,色素在可见光区域的最大吸收峰在533nm,色素液的颜色呈红色;pH值在6~7之间出现了双峰,最大吸收峰在533nm和470nm附近,色素液的颜色由红色向橘红色过度;随pH值的升高,色素液的颜色逐渐变为黄色,最大吸收峰也在470nm附近。以上结果表明红色素在pH≤5时稳定性较好,在酸性条件下为红色,最高吸收峰在波长533nm,碱性环境下为黄色,最高吸收峰在470nm附近。因此,根据以上特征说明该红色素属于灵菌红素类色素[18]。结合表3和图3选择80%乙醇(pH3)溶液进行稳定性实验。
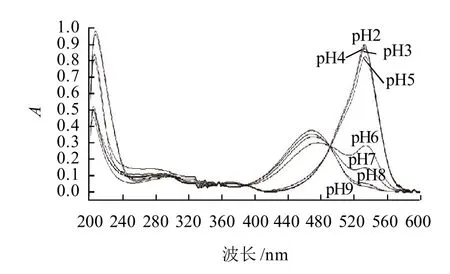
图3 pH值对色素稳定性的影响Fig.3 Effect of pH on red pigment stability
2.3.2 温度对色素稳定性的影响
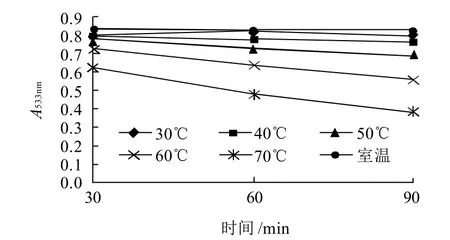
图4 温度对红色素稳定性的影响Fig.4 Effect of temperature on red pigment stability
如图4所示,随着温度的升高和加热时间的延长色素液的吸光度呈下降趋势,温度在60、70℃时色素液的吸光度下降趋势较大,当加热90min时其色素残存率分别为67.99%、46.26%;温度在30~50℃范围内色素对热的敏感度不高,当加热90min时色素残存率分别为95.53%、92.63%和84.06%。以上数据表明,该色素在储藏和使用时应低于50℃,避免高温对色素的破坏,以延长色素的货架期。
2.3.3 紫外线对色素稳定性的影响
由图5可知,随着紫外线照射时间延长,色素液的吸光度变化不大,当照射75min时色素的残存率为98.46%,说明该紫外线对色素影响不大,色素具有较强的抗辐射能力。

图5 紫外线对色素稳定的影响Fig.5 Effect of ultraviolet light on red pigment stability
2.3.4 光照对色素稳定性的影响
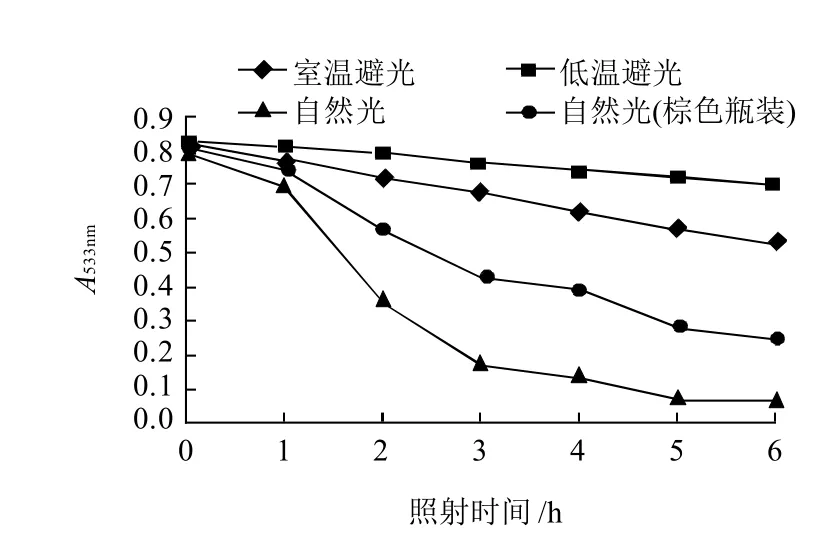
图6 光对红色素稳定性的影响Fig.6 Effect of sunlight on red pigment stability
如图6所示,光对色素的影响很大,在自然光照下随着光照时间的延长,无色试剂瓶装色素液的吸光度持续下降,颜色变淡,到第6天色素残存率为9.67%;低温避光保藏和室温避光保存组色素残存率为85.58%和63.49%,以上数据说明日光照射对色素具有强烈的降解作用。贮藏容器对色素的稳定性影响较大,棕色容器贮藏的色素液在自然光照6d时,色素的残存率是无色瓶装的3.27倍。因此该色素应贮存于棕色容器中,在低温避光处保存,色素的稳定性较好。
2.3.5 酸味剂对色素稳定性的影响
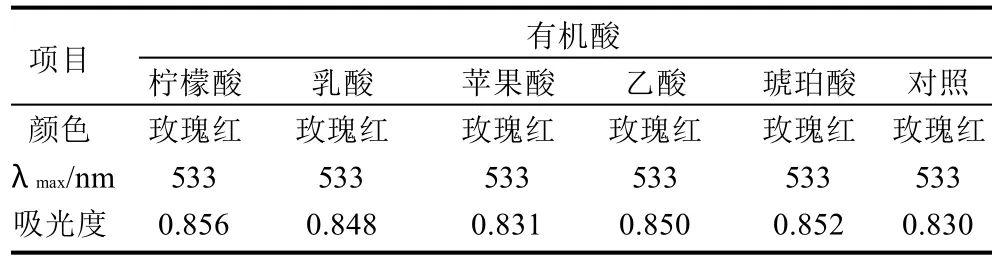
表4 不同种类的酸味剂对色素稳定性的影响Table 4 Effect of different acidity agents on red pigment stability
由表4可知,5种有机酸对色素都有一定的护色作用,其中柠檬酸、琥珀酸、乙酸和乳酸的护色效果尤为明显。
2.3.6 氧化剂对色素稳定性的影响

图7 H2O2对红色素稳定性的影响Fig.7 Effect of H2O2 on red pigment stability
由图7所示,随着H2O2体积分数的增大和放置时间的延长,色素液的吸光度呈下降趋势,但H2O2体积分数低于0.8%时随时间延长色素液的吸光度变化不大,因此该色素可与低体积分数的H2O2使用,添加量应低于0.8%时色素的稳定性较好。
2.3.7 抗氧化剂对色素稳定性的影响
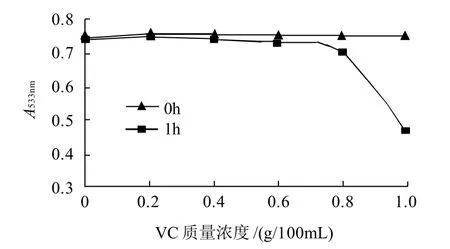
图8 VC对红色素稳定性的影响Fig.8 Effect of vitamin C on red pigment stability
从图8可以看出,随着VC质量浓度的升高,色素液的吸光度有所下降,但当VC质量浓度高于0.6g/100mL时,随时间的延长吸光度下降较快,但颜色仍呈红色。因此认为该色素可与VC一起使用,但添加量在0.2~0.4g/100mL之间较适宜。
2.3.8 甜味剂对色素稳定性的影响
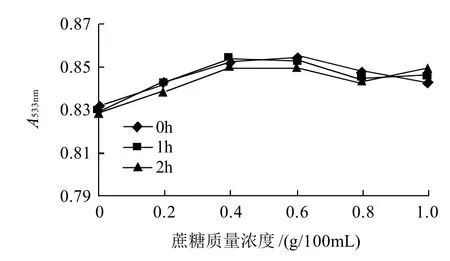
图9 蔗糖对红色素稳定性的影响Fig.9 Effect of sucrose on red pigment stability
从图9可以看出,蔗糖对色素具有增色作用,随着蔗糖质量浓度的增大色素液的吸光度有下降趋势,但变化幅度不大,说明该色素的耐糖性较好。
2.3.9 防腐剂对色素稳定性的影响
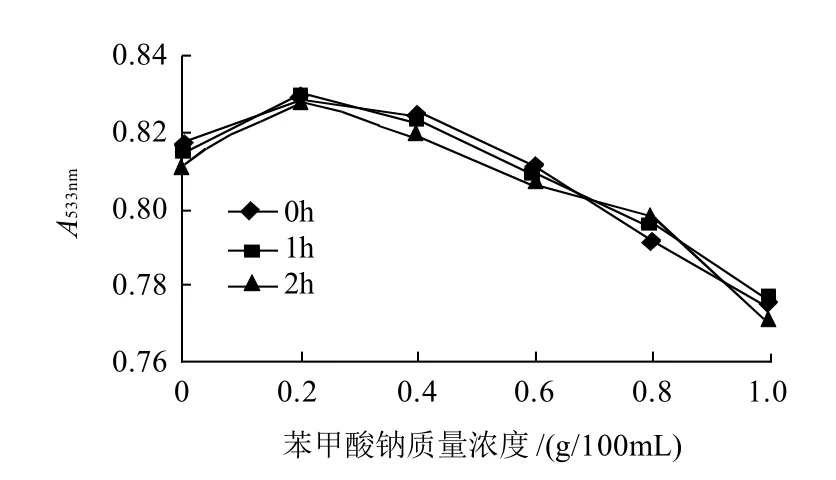
图10 苯甲酸钠对红色素稳定性的影响Fig.10 Effect of sodium benzoate on red pigment stability
从图10可以看出,苯甲酸钠对色素的影响较明显,随着苯甲酸钠质量浓度的增大,色素液的颜色由紫红色逐渐变为粉红色,色素液的吸光度减小,当苯甲酸钠质量浓度高于0.4g/100mL时下降趋势较大,其原因可能是由于苯甲酸钠的pH值引起的,苯甲酸钠水溶液的pH值为8[19],当色素溶液中苯甲酸钠质量浓度增大时,导致色素溶液pH值升高,引起色素溶液颜色和吸光度的变化。因此,防腐剂的使用量不能太大,在0.2~0.4g/100mL之间较适宜。
2.3.10 金属离子对色素稳定性的影响
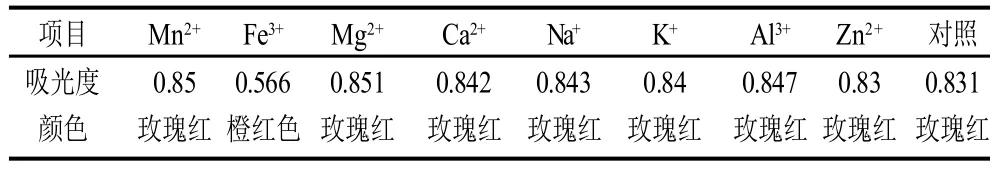
表5 金属离子对色素稳定性的影响Table 5 Effect of metal ions on red pigment stability
由表5可以看出,Na+、Al3+、Mn2+、K+、Mg2+、Ca2+的存在对色素有增色作用,其中Mg2+和Mn2+的增色作用尤为显着,Zn2+对色素基本无影响,Fe3+则对色素有较大的影响,随着Fe3+质量浓度的升高色素液颜色由红色逐渐变为橙色,色素液的吸光度变小,其机理是Fe3+和色素供电子的基团吡咯环上的—NH通过配位键结合,影响了色素分子电子云排布[20],导致色素的色泽发生了变化。因此,该色素在使用和保存时应避免与铁制容器接触。
3 结 论
3.1 根据色素的光谱特性、溶解性、不同pH值色素溶液的色泽变化以及ESI-MS和1H-NMR数据确定该色素为灵菌红素。
3.2 该细菌色素属于脂溶性色素,易溶于有机溶剂,微溶于水;色素不耐光、高温,耐辐射性强,在pH≤5的环境中较为稳定。
3.3 在80%的酸性乙醇中添加不同介质对色素的稳定性有不同影响。色素的耐糖性较好,低添加量的苯甲酸钠、VC和H2O2对色素的色泽影响不大,而酸味剂和部分金属离子Na+、K+、Al3+、Mn2+、Mg2+、Ca2+对色素有增色作用,Zn2+对色素稳定性影响不大,Fe3+则对色素有明显的影响。因此,色素的保存和使用应低温避光,避免与铁制器接触。
本实验对一株细菌所产红色素的结构和理化性质进行了研究,为该色素的开发利用提供了理论依据。实验结果表明,该色素为灵菌红素,有研究报道[9]灵菌红素在平均IC50为21μmol/L时对57种不同人的癌细胞有抗性作用,对正常细胞无任何毒害作用,因此,该细菌所产色素是一种安全性高、且具有抗癌作用的天然色素,具有广阔的开发利用前景。同时该色素在低温、避光、酸性环境中应用稳定性较好,有望应用于食品、药物、化妆品、生物制品等领域。
[1]杨晓玲, 郭金辉, 黄玲. 五色彩叶草叶片色素的稳定性及抑菌性研究[J]. 食品科学, 2009, 30(19): 35-39.
[2]ALIHOSSEINI F, JU Kousan, LANGO J, et al. Antibacterial colorants: characterization of prodiginines and their applications on textile materials [J]. Biotechnol Prog, 2008, 24(3): 742-747.
[3]苏龙, 詹萍, 陈旭健, 等. 微生物产天然红色素提取技术研究进展[J].玉林师范学院学报: 自然科学版, 2008, 29(3): 84-86.
[4]王君, 张宝善. 微生物生产天然红色素的研究进展[J]. 微生物学报, 2007, 34(3): 580-583.
[5]苏龙, 刘洪海, 吴弦华, 等. 一株高产红色素菌的筛选及其色素的提取和理化性质研究[J]. 食品科技, 2007(12): 43-45.
[6]廖振林, 徐丽华, 蔡淑娇, 等. 一株新的海洋放线菌黄色素的提取与稳定性研究[J]. 食品科技, 2008(10): 170-172; 177.
[7]龙正海, 严小军, 张煜烔, 等. 一株分离自竹黄产蒽醌类色素菌株的鉴定及其培养特性[J]. 中南林业科技大学学报, 2009, 29(6): 88-92.
[8]刘军, 张帅帅, 杨娜. 一株高产红色素海洋菌的初步鉴定及色素性质研究[J]. 江苏农业科学, 2010(3): 318-320.
[9]袁保红, 杜青平, 蔡创华. 海洋细菌Pseudomonas sp.色素的提取及稳定性的研究[J]. 海洋通报, 2005, 24(6): 92-96.
[10]沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2006: 241.
[11]LEWIS S M, CORPE W A. Prodigiosin-producing bacteria from marine sources[J]. Applied Microbiology, 1964, 12(1): 13-17.
[12]阿依努尔·阿不都热合曼, 于苹苹, 布热比亚·艾山, 等. 块根芍药产红色素内生菌XJU-PA-6的分离鉴定[J]. 生物技术, 2008, 18(5): 33-36.
[13]张梁, 郝名慧, 楼志华, 等. 一株产红色素菌株及对其红色素结构的鉴定[J]. 生物加工过程, 2008, 6(2): 28-32.
[14]袁保红. 灵菌红素产生条件和生物活性研究[D]. 广州: 中山大学, 2004.
[15]刘晓侠, 沈振忠, 胡星夏, 等. 一株红色素高产菌的鉴定、发酵及结构表征[J]. 药物生物技术, 2010, 17(3): 212-216.
[16]SONG M J, BAE J D, LEE D S, et al. Purification and characterization of prodigiosin produced by integrated bioreactor from Serratia sp. KH-95[J]. Journal of Bioscience and Bioengeering, 2006, 101(2): 157-161.
[17]牛燕, 郑立, 田黎牛燕, 等. 海洋细菌S-9801代谢产灵菌红素最佳培养条件研究[J]. 中国海洋药物杂志, 2009, 28(3): 17-22.
[18]ALLEN E G. Conditions of the colour change of prodigiosin[J]. Tetters of Nature, 1967, 216: 929-931.
[19]刘雅春. 最新食品添加剂品种优化选择与性能分析检测标准及应用工艺实用手册[M]. 长春: 吉林出版发行集团, 2004: 42.
[20]钟绵国, 赵涛. 灵菌红素的染色性能研究[J]. 染料与染色, 2009, 46 (6): 15-18; 45.
Structural and Physico-chemical Characterization of a Red Pigment of Microbial Origin
LI Cai-xia,JIAO Yang*,GAO Hai-ning,ZHANG Fen-qin,YUAN Hai-qin
(Department of Life Science and Engineering, Hexi University, Zhangye 734000, China)
The structure and physico-chemical properties of red pigment prepared from cultured cells of a high-yield microbial strain conserved in our laboratory by extraction into 95% ethanol and sequential purification on macroporous resin column and silica gel column were investigated. The stability of the pigment to sunlight, temperature, pH value, hydrogen peroxide (H2O2) as an oxidant, sodium benzoate as a preservative, acidity agents, sucrose, vitamin C and metal ions was evaluated. Results showed that the red pigment was identified as prodigiosin by the methods of UV/vis, ESI-MS and1H-NMR, with a maximum absorption peak at a wavelength of around 533 nm under acidic conditions. It was very easy to dissolve in organic solvents and had excellent stability at pH ≤ 5. In addition, the pigment exhibited strong tolerance to radiation and high sucrose concentration, but poor resistance to light and high temperature. Moreover, no significant effect of sodium benzoate, VC and H2O2 on the pigment was found at low concentrations. Acidity agents and the metal ions Na+, Al3+, Mn2+, K+, Mg2+and Ca2+exhibited hyperchromic effects on the pigments, while Fe3+had severe undesirable effect, and Zn2+had little effect.
bacteria;red pigment;structure;physicochemical properties
Q936
A
1002-6630(2011)07-0156-06
2010-08-10
河西学院校长基金项目
李彩霞(1967—),女,高级实验师,学士,研究方向为天然产物开发利用。E-mail:lipeng@hxu.edu.cn
*通信作者:焦扬(1973—),女,讲师,硕士,研究方向为生化化工。E-mail:yangjiao2808@163.com



