刘 佳,焦士蓉*,唐远谋,唐鹏程,冯 慧
(西华大学生物工程学院,四川 成都 610039)
苦丁茶多酚的提取及抗氧化活性
刘 佳,焦士蓉*,唐远谋,唐鹏程,冯 慧
(西华大学生物工程学院,四川 成都 610039)
对苦丁茶中多酚的提取及抗氧化活性进行研究。通过单因素和响应面试验可知,在乙醇体积分数52%、料液比1:24(g/mL)、提取时间62s、微波功率291W条件下可获得最高的提取量115.40mg/g。苦丁茶多酚提取液对DPPH自由基、羟自由基、超氧阴离子自由基的半清除质量浓度以及对脂质过氧化的半抑制质量浓度分别为29.24、34.14、872.3、11.48mg/L。表明苦丁茶多酚具有较强的抗氧化作用。
苦丁茶;多酚;提取;响应面分析法;抗氧化
“苦丁茶”是我国一大类代茶植物或代茶产品的统称。冬青属苦丁茶主要产于我国南部及西南部地区,是民间传统的药用植物。据文献报道,苦丁茶有防治心脑血管系统疾病、降低血压、降脂、抗氧化等药理保健作用[1],其粗提物均有不同程度的抑菌作用[2]。由苦丁茶冬青叶片制成的苦丁茶是民间常用中草药,是传统中成药“甘和茶”的主要原料之一[3],含有丰富的黄酮、多酚、三萜类皂甙及金属元素[4-5],所含的各种成分的药理作用及保健功能日益引起人们的关注[6],具有广阔的开发应用前景[7]。
本实验采用响应面法,以苦丁茶冬青树(I l e x KudinchaC.J.Tseng)叶片中的多酚含量作为响应值,对苦丁茶多酚的提取工艺进行探讨,旨在得到最优工艺条件,并通过几个方面研究苦丁茶多酚的抗氧化性能,为苦丁茶保健成分的开发利用提供一定参考。
1 材料与方法
1.1 材料、试剂与仪器
苦丁茶(市售)粉碎过80目筛;福林-酚试剂 北京奥博星生物技术有限责任公司;DPPH自由基 美国Sigma公司;2-硫代巴比妥酸 上海科丰化学试剂有限公司;其他常见试剂(分析纯) 成都科龙化工试剂厂。
TB-214型电子天平 美国丹佛仪器设备厂;HH-S型数显恒温水浴锅 金坛市金城国胜实验仪器厂;UV-2600型紫外可见分光光度计(配有玻璃比色皿) 上海尤尼柯仪器有限公司;MP17C-KE家用微波炉 美的集团。
1.2 方法
1.2.1 多酚提取方法
称取苦丁茶粉样品2g,采用不同的提取溶剂,分别探究提取时间、料液比、微波功率因素对多酚得率的影响。
1.2.2 多酚提取量测定
采用福林-酚比色法[7-8],以没食子酸为标准品,标准曲线y=0.0081x+0.0286,R2=0.9999,计算公式为:
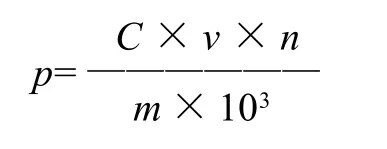
式中:p为总多酚类物质提取量/(mg/g);c为从回归方程计算得到样品中多酚类物质质量浓度/(μg/mL);v为苦丁茶溶液的体积/mL;n为稀释倍数;m为茶粉质量/g。
1.2.3 抗氧化活性的测定
1.2.3.1 对DPPH自由基的清除
按照文献[9]的方法并做适当修正:称取2,2-二苯代苦味酰基(2,2-diphenyl-2-picrylhydrazyl,DPPH)标准品20mg,无水乙醇定容至500mL,得质量浓度0.04mg/mL溶液。取此溶液3mL,加入不同质量浓度样品液1mL,室温反应30min,于517nm波长处测定吸光度,空白组以1mL无水乙醇代替样品液,并按下式计算清除率:

1.2.3.2 对羟自由基的清除
按照金鸣等[10]的比色法,0.75mmoL/L的邻二氮菲溶液1mL,加入pH7.4的磷酸缓冲溶液(PBS)2mL和蒸馏水1mL,充分混匀后,加入0.75mmol/L硫酸亚铁溶液1mL,然后再加入0.01%过氧化氢1mL,于37℃保持60min,在波长536nm处测吸光度Ap;用1mL乙醇代替1mL过氧化氢,测得吸光度Ab,1mL不同质量浓度的样液代替蒸馏水,测得吸光度As。以下式计算苦丁茶多酚对OH自由基的清除率(H/%):



1.2.3.4 对脂质过氧化的抑制
[12]的方法并做适当改进,小鼠处死后取肝洗净,剪碎,用生理盐水制成3%的匀浆。取匀浆0.6mL,加入不同浓度样液0.34mL,0.0024%过氧化氢0.2mL,0.03mmol/L硫酸亚铁溶液0.2mL,于37℃水浴保温60min后,加入2mL 20%三氯乙酸及2mL 0.67% TBA溶液,90℃保温15min,用水冷却至室温,4000r/min离心20min,取上清液,在532nm波长处测得吸光度,以水代替TBA的平行试验管调零,以蒸馏水代替料液的反应管为空白管,抑制率(I/%)计算公式为:

2 结果与分析
2.1 提取溶剂的筛选

图1 溶剂对苦丁茶多酚提取的影响Fig.1 Effect of solvents on extraction rate of polyphenols from Kuding tea
按照1.2.1节方法,在提取时间80s、料液比1:20、微波功率291W条件下进行试验,结果见图1。由图1可知,提取溶剂为丙酮时,苦丁茶多酚提取量最高,乙醇次之;由于丙酮的毒性以及溶剂价格较高的因素,选取乙醇作为提取溶剂。
2.2 单因素试验
2.2.1 乙醇体积分数对苦丁茶多酚提取的影响
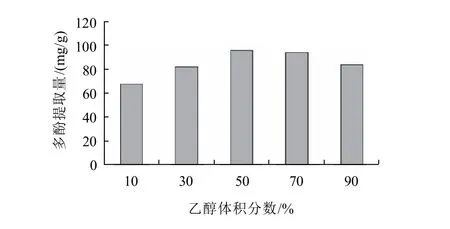
图2 乙醇体积分数对苦丁茶多酚提取的影响Fig.2 Effect of ethanol concentration on extraction rate of polyphenols from Kuding tea
按照2.1节方法,改变乙醇体积分数进行试验,结果见图2。由图2可知,当乙醇体积分数为50%时,苦丁茶多酚的提取量最高,故乙醇体积分数选取50%。
2.2.2 料液比对苦丁茶多酚提取的影响
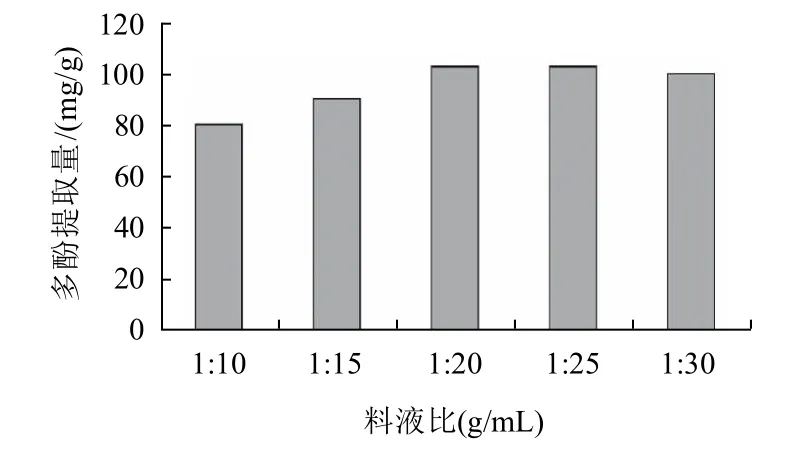
图3 料液比对苦丁茶多酚提取的影响Fig.3 Effect of material/liquid ratio on extraction rate of polyphenols from Kuding tea
乙醇体积分数为50%,其他条件同2.2.1节,改变料液比进行试验,结果如图3。由图3可知,当料液比1:20 (g/mL)时苦丁茶多酚提取量最高,故选取料液比1:20(g/mL)。
2.2.3 提取时间对苦丁茶多酚提取的影响

图4 提取时间对苦丁茶多酚提取的影响Fig.4 Effect of extraction time on extraction rate of polyphenols from Kuding tea
料液比1:20,其他条件同2.2.2节,改变提取时间进行试验,结果见图4。由图4可知,当提取时间为60s时,苦丁茶多酚提取量最大,时间过长多酚提取量反而降低,可能是因为时间过长导致部分多酚类物质被氧化或分解,故提取时间选取60s。
2.2.4 微波功率对苦丁茶多酚提取的影响

图5 微波功率对苦丁茶多酚提取的影响Fig.5 Effect of microwave power on extraction rate of polyphenols from Kuding tea
选取提取时间60s,其他条件同2.2.3节,改变微波功率,结果见图5。由图5可知,微波功率为291W时,苦丁茶多酚提取最高,但随着微波功率的增大多酚提取量迅速降低,可能是因为功率过大加速了多酚类物质的氧化分解或使溶剂大量挥发,故选取提取功率为291W。
2.3 响应曲面法结果与分析
响应曲面由法常用于优化最佳测试条件[13-14]。由单因素试验结果可知,乙醇体积分数、料液比、提取时间3个因素对苦丁茶多酚提取率的影响较大,故选取这3个因素做Box-Behnken设计,并且以苦丁茶多酚提取量作为响应值,设计及结果见表1。

表1 Box-Behnken设计试验因素水平及编码Table 1 Factors and levels in Box-Behnken design

表2 Box-Behnken试验设计及结果Table 2 Results of Box-Behnken design tests
利用Design Expert软件对上述结果进行分析,得到多酚含量(Y)对乙醇体积分数(A)、料液比(B)、提取时间(C)的二次多项回归方程:
Y=113.22+2.50A+3.92B-2.87C+1.56AB+1.02AC+4.70BC-9.64A2-3.06B2-2.31C2
试验所选用模型P值为0.0019,极显着(P<0.05),决定系数R2=0.9741,说明响应值的变化有97.41%来源于所选变量,该方程的拟合情况好。
响应面图形是响应值对各试验因素X1、X2、X3所构成的三维空间的曲面图,从响应面分析图上形象地看出最佳参数及各参数之间的相互作用。当特征值均为正值时,响应面分析图为山谷形曲面,有极小值存在;当特征值为负值时,为山丘曲面,有极大值存在;当特征值有正有负时,为马鞍形曲面,无极值存在。

图6 各两因素交互作用对多酚提取量的响应面图Fig.6 Response surface plot for the effect of cross-interaction between ethanol conceration, material-liquid ratio and extraction time on the extraction rate of polyphenols from Kuding tea
由图6A可知,乙醇体积分数对苦丁茶多酚提取量影响比较大,表现为曲线较陡,料液比对苦丁茶多酚提取量影响不是很大,表现为曲线较为平缓。当乙醇体积分数在0水平,即50%时,多酚提取量最大,说明过高过或过低的乙醇体积分数均不适合苦丁茶多酚的提取。由图6B可知,料液比对苦丁茶多酚提取量影响比较小,而提取时间对苦丁茶多酚提取影响较大,且较短的时间更有利于提取。图6C进一步说明乙醇体积分数对苦丁茶多酚提取量影响比较大,曲线较陡。
2.4 验证实验
通过辅助软件Design Expert优化提取条件得到多酚提取量最高的超过114.80mg/g的5组数据,分析这5组数据,得到苦丁茶多酚含量超过114.80mg/g的各参数的范围为乙醇体积分数51%~53%、料液比1:23~1:25(g/mL)、提取时间60~64s。经以上分析,再综合实验的好操作性,选取乙醇体积分数52%、料液比1:24、提取时间62s,进行验证实验。根据回归方程,计算其预测值为114.4832mg/g。进行3次平行实验,得到平均结果为115.40mg/g,相对误差为0.8%,证明响应面优化苦丁茶多酚的提取工艺可行。
2.5 抗氧化活性测定
2.5.1 对DPPH自由基的清除

图7 苦丁茶多酚对DPPH自由基清除作用Fig.7 Scavenging rate of polyphenols from Kuming tea on DPPH free radicals
如图7所示,由回归方程得苦丁茶多酚对DPPH自由基的半清除质量浓度EC50=29.24mg/L。
2.5.2 对羟自由基的清除

图8 苦丁茶多酚对羟自由基的清除作用Fig.8 Scavenging rate of polyphenols from Kuming tea on hydroxyl free radicals
由图8回归方程可得,苦丁茶多酚对OH自由基的半清除质量浓度HC50=34.14mg/L。

图9 苦丁茶多酚对O2·的清除作用Fig.9 Scavenging rate of polyphenols from Kuming tea on superoxide anion ion free radicals

图10 苦丁茶多酚对脂质过氧化的抑制作用Fig.10 Inhibition rate of polyphenols from Kuming tea on lipid peroxidation
2.5.4 对脂质过氧化的抑制由图10回归方程计算可得,苦丁茶多酚对脂质过氧化的半抑制质量浓度IC50=11.48mg/L。
3 结 论
3.1 通过单因素试验,确定了苦丁茶多酚提取的最佳工艺条件为乙醇体积分数50%、料液比1:20(g/mL)、提取时间60s、微波功率291W。
3.2 通过Box-Behnken响应曲面法优化,确定苦丁茶多酚提取的最佳试验条件为乙醇体积分数52%、料液比
1:24(g/mL)、提取时间62s。以该优化条件在微波功率291W时提取苦丁茶多酚含量达到115.40mg/g。
34.14、872.3mg/L,对脂质过氧化的半抑制质量浓度为11.48mg/L。
参考文献:
[1] 刘宗岸. 冬青属苦丁茶的保健功效及利[J]. 热带农业科技,2009, 32(2): 26-28.
[2] LV Ping, HUANG Qiang. Study onin vitrobacteriostasis of the different extract fromIlexKudingcha C.J.Tseng[J]. Agricultural Science &Technlogy, 2009, 10(6): 125-127.
[3] 王新, 陆慧宁, 林少琨. 苦丁茶冬青叶化学成分及药理作用研究进展[J]. 天然产物研究与开发, 2005, 17(3): 366-370.
[4] 程春萍. 苦丁茶的化学成分[J]. 内蒙古石油化工, 2009, (2): 23-24.
[5] AN Ming, WANG Ouqing, CHEN Zili, et al. Triterpenoid glycosides fromIlexKudingcha[J]. Phytochemistry, 1996, 43(2): 443-445.
[6] 刘丽香, LAURA T, 梁兴飞, 等. Folin-Ciocalteu-比色法测定苦丁茶中多酚含量[J]. 茶叶科学, 2008, 28(2): 101-106.
[7] 张文芹, 许文清, 孙怡, 等. 苦丁茶冬青与大叶冬青苦丁茶提取物体外抗氧化活性比较研究[J]. 食品科学, 2010, 31(23): 22-26.
[8] 唐远谋, 李明元, 徐坤, 等. 啤酒花多酚的提取及对DPPH自由基的清除作用[J]. 西华大学学报: 自然科学版, 2010, 29(4): 105-109.
[9] LIU Lixiang, SUN Yi, LAURA T, et al. Determination of polyphenolic content and antioxidant activity of Kudingcha made fromIlexKudingcha C.J.Tseng[J]. Food Chemistry, 2009, 112(1): 35-41.
[10] SHARIFIFAR F, MOSHAFI M H, MANSOURI S H, et al.In vitrovaluation of antibacterial and antioxidant activities of the essential oil and ethanol extract of endemicZataria multifloraBoiss[J]. Food Control,2007, 18(7): 800-805.
[11] 金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J]. 生物化学与生物物理学进展, 1996, 23(6):553-555.
[12] 刘丽香, 梁兴飞, 孙怡, 等. 苦丁茶提取物多酚含量与抗氧化活性的测定[J]. 茶叶科学, 2008, 28(4): 289-293.
[13] 何冰, 陈小夏. 茶多酚清楚氧自由基及抑制脑脂质过氧化反应的体外试验[J]. 中国药理学通报, 1998, 14(3): 270-272.
[14] SUN Yi, WU Wenqing, ZHANG Wenqin et al. Optimizing the extraction of phenolic antiodants from Kudingcha made fromIlexKudingcha C.J.Tseng by using response surface methodology[J]. Separation and Purification Technology, 2011, 78(3):311-320.
[15] 沈汪洋, 金征宇. 微波辅助提取咖啡豆残渣中多酚[J]. 食品科学,2010, 31(20): 79-82.
Extraction and Antioxidant Activity of Polyphenols from Kuding Tea
LIU Jia,JIAO Shi-rong*,TANG Yuan-mou,TANG Peng-cheng,FENG Hui
(School of Bioengineering, Xihua University, Chengdu 610039, China)
The optimal conditions for the extraction of Kuding tea polyphenols for achieving maximum extraction yield were determined by response surface methodology to be ethanol concentration of 52%, material/liquid ratio of 1:24 (g/mL), microwave power of 291 W, and microwave treatment time of 62 s. The extraction rate of polyphenols was 114.82 mg/g under the optimal extraction conditions. The IC50 values of the obtained extract against DPPH, hydroxyl, superoxide anion ion free radicals and lipid peroxidation were 29.24, 34.14, 872.3 mg/L and 11.48 mg/L, respectively, suggesting that Kuding tea polyphenols have a remarkable antioxidant effect.
Kuding tea;polyphenols;extraction;response surface analysis;antioxidant
TS272.2;TS272.5
A
1002-6630(2011)14-0134-05
2010-09-19
四川省教育厅自然科学重点项目(09ZA158);西华大学2008校人才培养与引进科研项目(R0920501)
刘佳(1987—),女,硕士研究生,研究方向为食品营养与安全。E-mail:liujia13568864205@163.com
*通信作者:焦士蓉(1968—),女,教授,博士,研究方向为食品生物技术。E-mail:jsrong2004@163.com



