李辛雷,李纪元,范正琪
(中国林业科学研究院亚热带林业研究所,浙江 富阳 311400)
红花檵木叶片花色素提取及其性质研究
李辛雷,李纪元,范正琪
(中国林业科学研究院亚热带林业研究所,浙江 富阳 311400)
以红花檵木叶片为材料,对其花色素的提取条件及理化性质进行研究。结果表明,红花檵木叶片花色素提取的最佳条件为:99.5%的甲醇、料液比1:5(g/mL)、浸提温度60℃、浸提时间2h。红花檵木叶片花色素具光、热不稳定性;在强酸性时稳定,微酸近中性时变色。色素抗氧化、还原能力差;对螯合剂、苯甲酸钠敏感。葡萄糖、蔗糖对色素无明显影响,食盐、柠檬酸有增色作用,VC具减色作用。金属离子A13+、Ca2+、Co2+等具增色作用,Cu2+、Mg2+、Zn2+、Mn2+、K+、Sn2+等有减色作用,Fe2+、Fe3+、Pb2+影响色素稳定性。
红花檵木;叶片;花色素;提取;性质
色泽是食品感官质量的重要指标之一,直接影响着消费者对食品的认可及对食品品质的评价,而色素是食品添加剂的一个重要组成部分[1]。人工合成色素具有色泽鲜艳、性质稳定、成本低廉等特点,但多具有不同程度的毒性,有些甚至有致癌、致畸、致突变作用,越来越多的国家开始严格限制使用合成色素[2]。植物天然色素取材便利、安全性高、对人体毒害小甚至无毒害,很多天然色素含有人体必需的营养物质或者其本身就是维生素或具有维生素性质的物质;同时,部分天然色素具有药理作用,对某些疾病具有防治作用,如黄酮类对心血管疾病具有防治作用;另外天然色素接近天然物质,满足人们对环保、绿色的严格要求[3]。可以预见天然色素将逐渐取代人工合成色素,成为色素开发的主流。
红花檵木(Loropetalum chinensevar.rubrumYieh)为金缕梅科(Haamelidaceaem)檵木属檵木(L. chinense)的变种,属于常绿灌木或小乔木,是绿化美化的重要树种,在我国广泛应用[4]。红花檵木资源丰富,其叶色暗红,除含有叶绿素、类胡萝卜素外,还含有丰富的花色素[5],是开发天然色素的良好材料。目前,关于红花檵木的研究主要集中于形态结构[6]、叶色变化的生理基础[7]、品种登录[8]、遗传多样性及亲缘关系等方面[9-10]。在红花檵木色素提取及性质研究方面,唐克华等[11]对红花檵木花蕾中花色素进行了微波提取与特性分析,但目前关于红花檵木叶片花色素开发利用的研究尚未见相关报道。因此,本实验对红花檵木叶片花色素的提取条件及其性质进行研究,以期为进一步开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
红花檵木无病虫害的功能叶片,取自中国林科院亚热带林业研究所苗圃,采样时间为2010年8月,将叶片洗净擦干后保存于-20℃冰箱中备用。
浓盐酸、乙醇、甲醇、丙酮、甲酸乙酯、过氧化氢、亚硫酸钠、E D T A、苯甲酸钠、葡萄糖、蔗糖、食盐、柠檬酸、V C等均为分析纯。
1.2 仪器与设备
SP-755 PC型紫外-可见分光光度计 上海光谱仪器有限公司;冰箱 青岛海尔电冰箱股份有限公司;水浴锅 北京东方精瑞科技发展有限公司。
1.3 方法
1.3.1 红花檵木叶片花色素提取
取5份-20℃冰箱中保存的红花檵木叶片,每份1.0g,直接研磨后按一定料液比(g/mL)加含体积分数1%浓盐酸的提取剂,水浴锅内浸提一定时间,冷却后过滤,得红色澄清透明液体。各浸提液分别用提取剂稀释10倍,以相应提取剂作参比,用紫外-可见分光光度计在460~600nm波长范围内扫描[12],比较其最大吸收波长(λvismax)和最大吸收波长处的吸光度(Aλvismax)[13]。
1.3.2 红花檵木叶片花色素性质
以含体积分数1%浓盐酸的99.5%甲醇为提取剂,料液比1:5、60℃条件下浸提红花檵木叶片花色素2h,过滤后于4℃、黑暗中冷藏备用。浸提液稀释10倍后,在紫外-可见分光光度计460~600nm波长范围内扫描,其吸收峰为530nm。检测不同温度、光照下530nm波长处的吸光度,观察溶液颜色。
浸提液用纯净水稀释10倍后加入具塞试管,调节pH0.0~9.0,黑暗中静置2h,在460~600nm波长范围内扫描,检测最大吸收波长和最大吸收波长处的吸光度,观察溶液颜色。
浸提液用纯净水稀释10倍后,用紫外-可见分光光度计在460~600nm波长范围内扫描,其吸收峰为510nm。取适量浸提液于具塞试管,分别加入不同浓度的金属离子、氧化剂、还原剂、螯合剂和常用食品添加剂等溶液,混匀后在黑暗中反应2h,检测510nm波长处的吸光度,观察溶液颜色。各试验处理均设3次重复。
2 结果与分析
2.1 红花檵木叶片花色素的提取
2.1.1 提取溶剂对叶片花色素提取的影响
红花檵木叶片研磨后以料液比1:20分别加入含体积分数1%浓盐酸的纯净水、乙醇、甲醇、丙酮和甲酸乙酯等提取溶剂,50℃下浸提1h,浸提液过滤后适当稀释,扫描结果见图l。由图1可知,各浸提液最大吸收波长分别为纯净水520nm、乙醇535nm、甲醇、丙酮和甲酸乙酯530nm。比较各浸提液的最大吸光度,甲醇的提取效果最好,浸提液为深红色;其次为乙醇,浸提液为红色;纯净水浸提液呈浅红色;丙酮浸提液为橙黄色,甲酸乙酯浸提液呈墨绿色,两者460~600nm波长范围内呈现不规则曲线。因此,选择甲醇作为浸提溶剂。
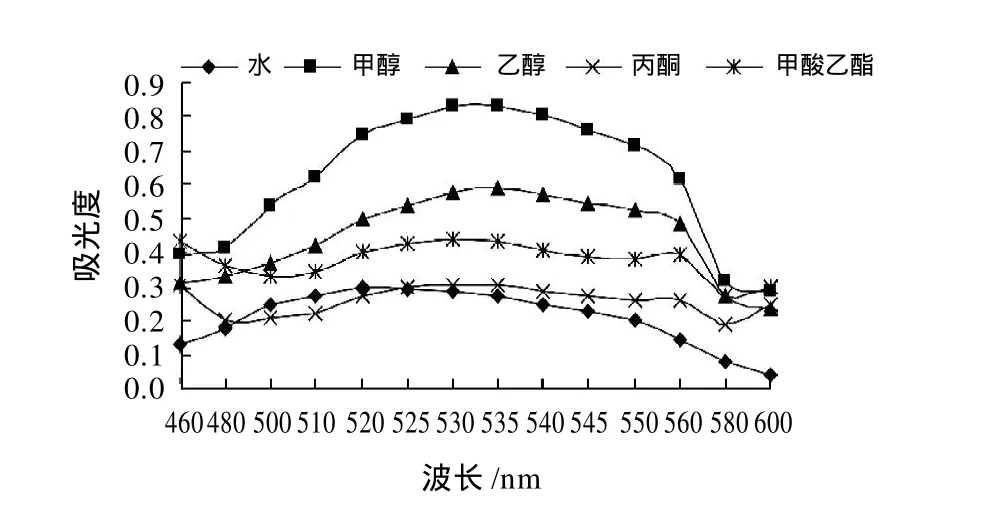
图1 浸提溶剂对色素提取的影响Fig.1 Effect of solvents on pigment extraction
2.1.2 甲醇体积分数对叶片花色素提取的影响
红花檵木叶片研磨后以料液比1:20分别加入含体积分数1%浓盐酸的20%、40%、60%、80%和99.5%的甲醇,在50℃条件下浸提1h,浸提液过滤稀释后扫描,不同体积分数的浸提液最大吸光度的波长均约为530nm,因此以530nm为检测波长,比较不同体积分数浸提液的最大吸光度,结果见图2。由图2可知,99.5%甲醇的浸提液最大吸光度最高,浸提效果最好,其次分别为40%、20%和80%甲醇,60%甲醇的提取效果较差。
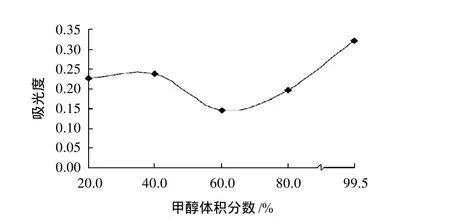
图2 甲醇体积分数对色素提取的影响Fig.2 Effect of methanol concentration on pigment extraction
2.1.3 时间对叶片花色素提取的影响
红花檵木叶片研磨后以料液比1:20加入含体积分数1%浓盐酸的99.5%甲醇,在50℃时分别浸提0.25、0.5、1、2、4h,浸提液过滤稀释后,以530nm为检测波长,比较各浸提液的最大吸光度,结果见图3。由图3可知,浸提效果2h>1h>4h>0.5h>0.25h。
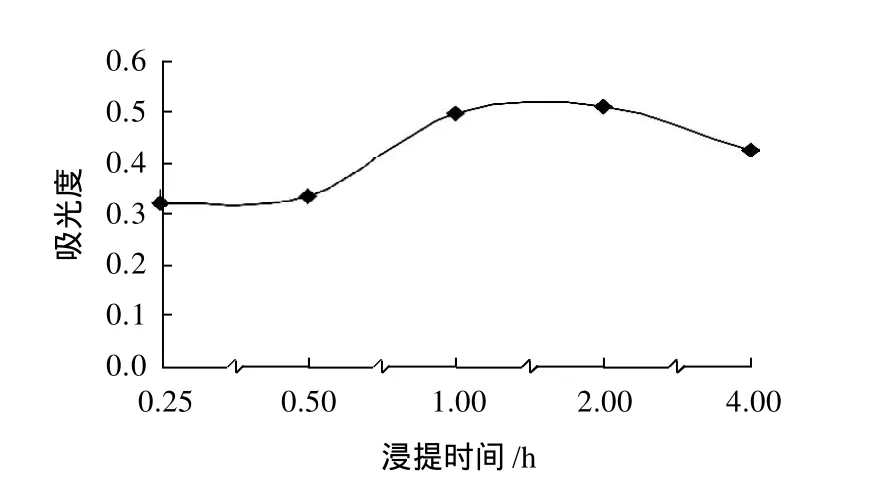
图3 浸提时间对色素提取的影响Fig.3 Effect of extraction time on pigment extraction
2.1.4 温度对叶片花色素提取的影响
红花檵木叶片研磨后以料液比1:20加入含体积分数1%浓盐酸的99.5%甲醇,30、40、50、60、80℃时分别浸提2h,浸提液过滤稀释后,以530nm为检测波长,比较各浸提液的最大吸光度,结果见图4。由图4可知,浸提效果以60℃为宜。
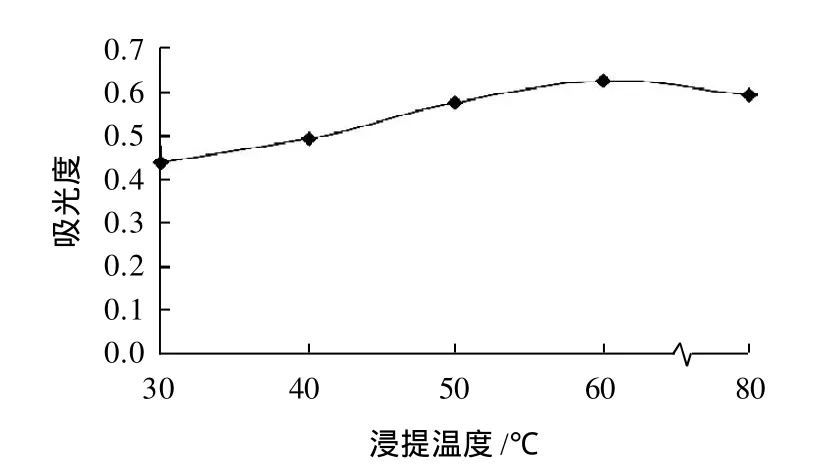
图4 温度对色素提取的影响Fig.4 Effect of temperature on pigment extraction
2.1.5 料液比对叶片花色素提取的影响
红花檵木叶片研磨后分别以料液比1:5、1:10、1:20、1:30、1:40(g/mL)加入含体积分数1%浓盐酸的99.5%的甲醇,60℃时浸提2h,浸提液过滤稀释后,以530nm为检测波长,比较各浸提液的最大吸光度,结果见图5。由图5可知,随料液比增大,各浸提液的最大吸光度逐渐降低,料液比1:5效果最好。
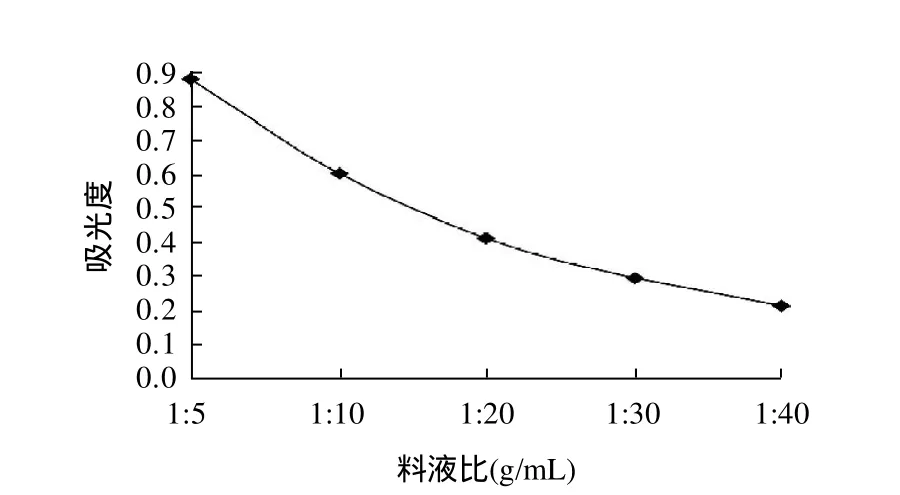
图5 料液比对色素提取的影响Fig.5 Effect of solid-to-liquid ratio on pigment extraction
2.1.6 pH值对叶片花色素提取的影响
红花檵木叶片研磨后以1:5的料液比加入含体积分数1%浓盐酸的99.5%甲醇,pH值分别调节为0.0、1.0、3.0、5.0、7.0,60℃浸提2h,浸提液过滤稀释后扫描结果见图6。由图6可知,pH0.0、1.0、3.0时,浸提液最大吸光度的波长均为530nm;pH值为5.0和7.0时,浸提液吸光度随波长增加而降低,吸收峰消失。可见,红花檵木叶片色素在强酸性范围内浸提效果较好,而碱性及弱酸性范围内浸提效果较差。
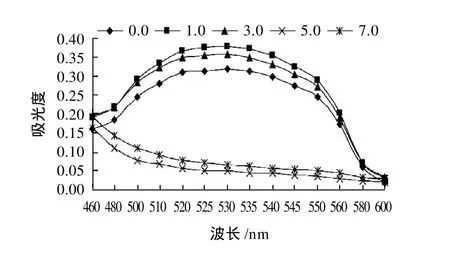
图6 pH值对色素提取的影响Fig.6 Effect of pH on pigment extraction.
2.1.7 红花檵木叶片花色素提取条件的优化
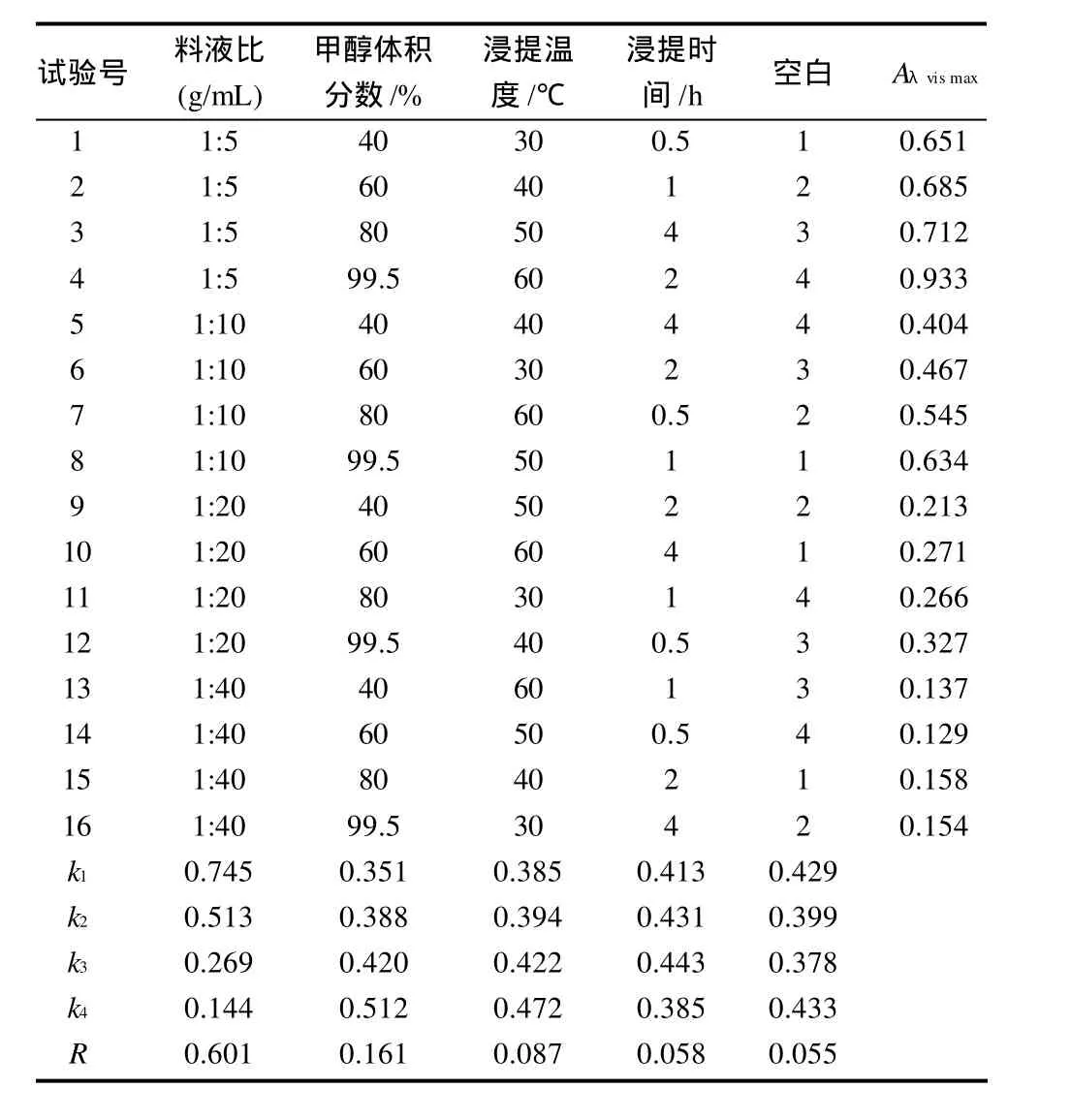
表1 红花檵木叶片花色素提取条件优化正交试验设计及结果Table 1 Orthogonal array design and corresponding experimental results for optimization of pigment extraction
通过单因素试验,初步确定了影响红花檵木叶片色素提取的相关因素。为优化提取条件,本实验以甲醇为提取剂,用料液比(1:5、1:10、1:20、1:40)、甲醇体积分数(40%、60%、80%、99.5%)、浸提温度(30、40、50、60℃)和浸提时间(0.5、1、2、4h)进行5因素(包括1个空白列)4水平正交试验。正交设计试验结果见表1,由极差(R)值可知,这4个因素的影响大小依次为:料液比>甲醇体积分数>温度>时间;最佳组合为正交设计中的第4个组合,即以99.5%的甲醇为提取溶剂,料液比1:5,60℃浸提2h的提取效果较好,正交设计与单因素试验结果相符。
2.2 红花檵木叶片花色素的性质
2.2.1 温度对色素的影响
不同温度下,随时间延长叶片色素最大吸光度的变化见图7。随处理时间延长,A530nm持续降低,叶片色素红色逐渐变淡,且温度越高,作用越明显。说明红花檵木叶片色素耐热性较差,高温导致叶片色素部分降解。
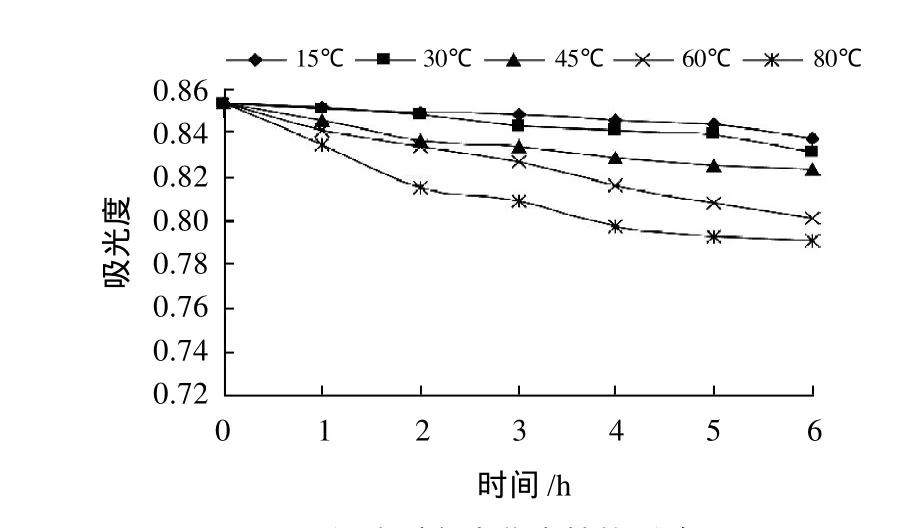
图7 温度对色素稳定性的影响Fig.7 Effect of temperature on the stability of the pigments
2.2.2 光照对色素的影响
不同光照下叶片色素最大吸光度的变化见图8,随处理时间延长,日光、紫外光、日光灯光和室内自然光下叶片色素红色变淡、A530nm持续降低。其中,日光的作用最强烈,表现较为明显,其次分别为为紫外光、日光灯光、室内自然光。各种光下红花檵木叶片色素均出现不同程度的降解,说明其具有光稳定性差的特点。
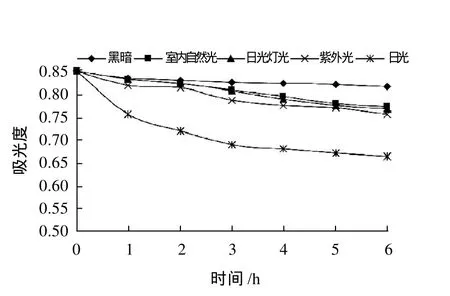
图8 光照对色素稳定性的影响Fig.8 Effect of light on the stability of the pigments
2.2.3 pH值对色素的影响
不同pH值对叶片色素最大吸光度及颜色的影响见表2,pH0.0~3.0时,最大吸收波长为510.0nm,随pH值升高,A510nm逐渐降低;pH>4.0时吸收峰消失。pH0.0~3.0时色素呈红色,且随pH值升高红色变淡;pH4.0~6.0时,色素呈黄色且随pH升高颜色加深;pH大于6.0时,色素逐渐显黑色。可见,红花檵木叶片色素在强酸性时较稳定,微酸近中性时变色。

表2 pH值对色素稳定性的影响Table 2 Effect of pH on the stability of the pigments
2.2.4 氧化剂、还原剂对色素的影响
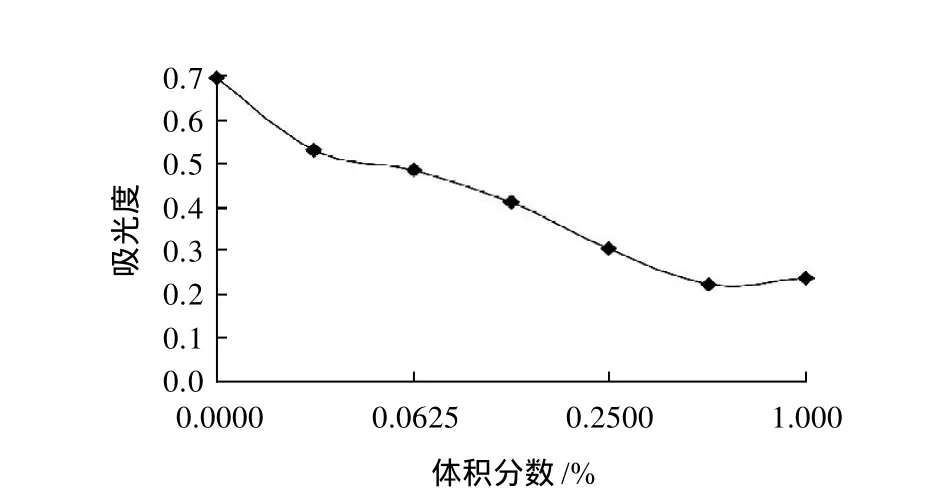
图9 H2O2 对色素稳定性的影响Fig.9 Effect of H2O2 on the stability of the pigments
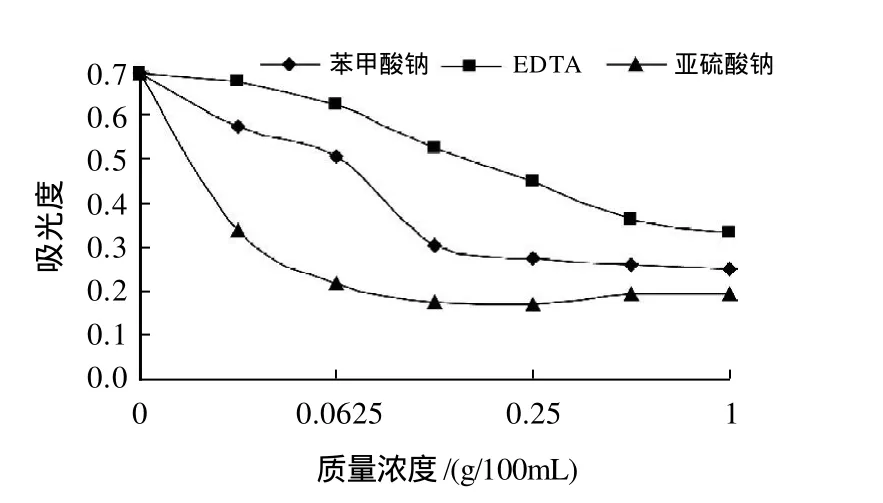
图10 还原剂、苯甲酸钠、EDTA对色素稳定性的影响Fig.10 Effect of Na2SO3, sodium beneoate and EDTA on the stability of the pigments
氧化剂过氧化氢对叶片色素最大吸光度的影响见图9,随过氧化氢体积分数增大,叶片色素红色逐渐变淡,A510nm逐渐降低,体积分数大于0.5%时,A510nm逐渐升高,色素呈现橙黄色。还原剂亚硫酸钠对叶片色素最大吸光度的影响见图10,亚硫酸钠质量浓度增大时,色素A510nm迅速降低,红色逐渐变淡,质量浓度大于0.25%时,色素变为橙黄色,A510nm逐渐升高。可见,红花檵木叶片色素抗氧化、还原能力较差。
2.2.5 苯甲酸钠、螯合剂对色素的影响
苯甲酸钠、螯合剂EDTA对叶片色素最大吸光度的影响见图10,苯甲酸钠质量浓度增大时,A510nm逐渐降低,叶片色素红色逐渐变淡,质量浓度为0.125g/100mL时,色素由淡红色变为橙黄色,大于0.25%,颜色无明显变化,A510nm降低幅度变小。随螯合剂EDTA质量浓度增大,A510nm逐渐降低,叶片色素红色逐渐变淡。可见,红花檵木叶片色素对螯合剂、苯甲酸钠敏感。
2.2.6 糖、食盐对色素的影响
2.2.8 金属离子对色素的影响
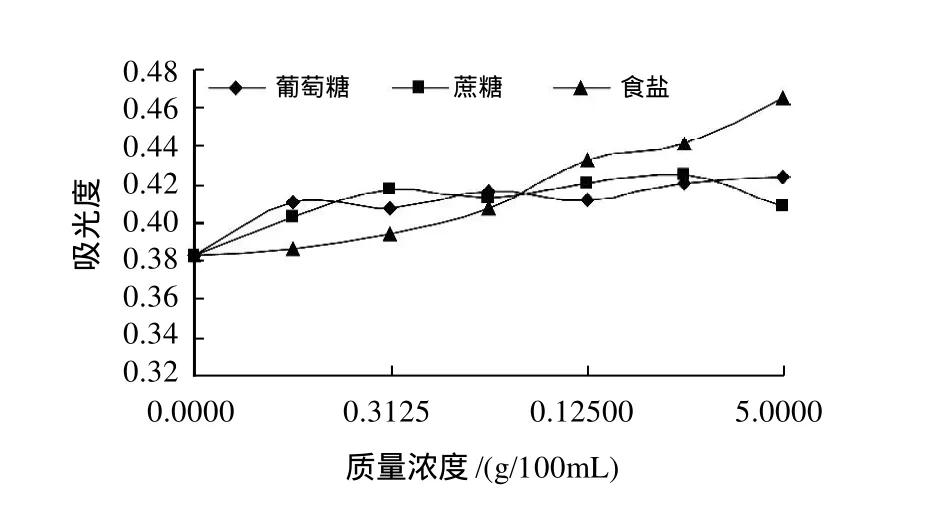
图11 葡萄糖、蔗糖及食盐对色素稳定性的影响Fig.11 Effect of glucose, sucrose and NaCl on the stability of the pigments
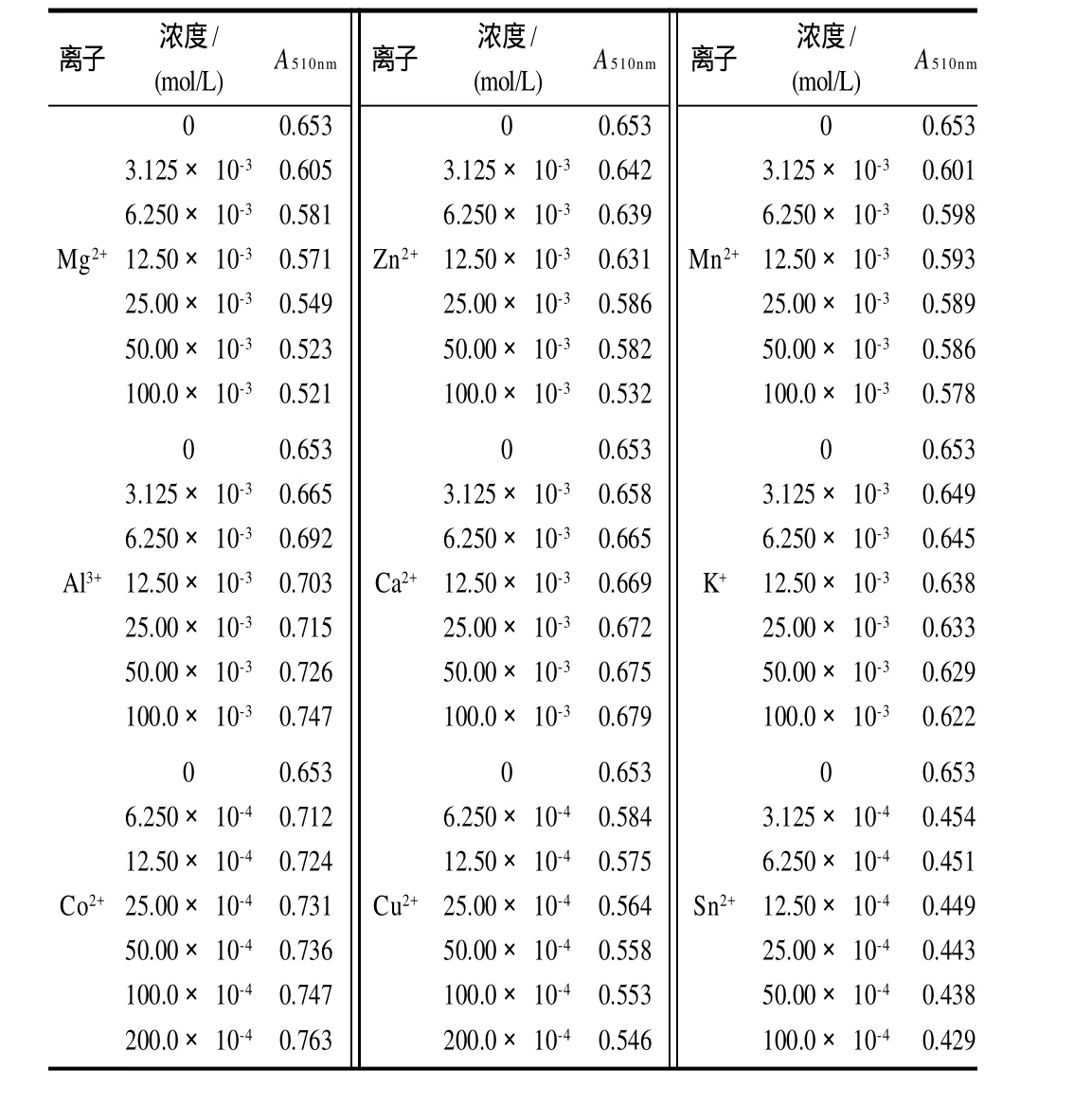
表3 金属离子对色素稳定性的影响Table 3 Effect of metal ions on the stability of the pigments
葡萄糖、蔗糖及食盐对红花檵木叶片色素最大吸光度的影响见图11,葡萄糖、蔗糖溶液中叶片色素均呈红色,溶液质量浓度增大时,色素颜色无明显变化,A510nm总体呈升高趋势,但变化幅度不大。食盐质量浓度升高导致叶片色素A510nm逐渐增大,红色加深。可见,葡萄糖、蔗糖对叶片色素影响不大,而食盐引起其色泽加深。
2.2.7 柠檬酸、VC对色素影响
食品中常用添加物柠檬酸、VC对红花檵木叶片色素最大吸光度的影响见图12,随柠檬酸质量浓度增大,色素红色加深,A510nm逐渐增大。VC质量浓度增大时,叶片色素红色逐渐变淡,A510nm逐渐降低。
从表3可知,A13+、Ca2+、Co2+等均可使红花檵木叶片色素呈现红色,且离子浓度越高,红色越深,A510nm越大;Mg2+、Zn2+、Mn2+、K+、Cu2+、Sn2+等亦均可使红花檵木叶片色素呈现红色,但离子浓度越高,红色越浅,A510nm越小;低浓度Fe2+、Fe3+(3.125× 10-4mol/L)即使色素产生褐色沉淀;Pb2+在低浓度时色素呈红色,浓度达3.125×10-4mol/L时色素呈褐色,6.250× 10-4mol/L时色素呈现暗绿色,并出现混浊。可见,红花檵木叶片色素随金属离子及其浓度的不同而变化,Fe2+、Fe3+、Pb2+影响红花檵木叶片色素的稳定性。
3 结 论

图12 柠檬酸、VC对色素稳定性的影响Fig.12 Effect of citric acid and VC on the stability of the pigments
红花檵木叶片色素呈现红色,易溶于酸性醇溶液或酸性水溶液等极性溶剂中,酸性和近中性条件下的最大吸收波长介于510~540nm之间,属于花色素特征峰变动范围。红花檵木叶片花色素提取的最佳条件为:99.5%的甲醇、料液比1:5(g/mL)、浸提温度60℃、浸提时间2h。
4 讨 论
本实验中红花檵木的叶片花色素易溶于水等极性较强物质,与唐克华等[14]对红檵木花蕾花色素的研究一致。红花檵木叶片花色素在不同提取剂中最大吸收波长不同,可能由于其吸收峰在不同的介质中发生位移,其偏移范围与花色素的光谱特征相符[12]。浸提温度、时间对红花檵木叶片色素最大吸收波长无影响,但低温或短时间时色素吸光度较小,可能由于色素浸提不完全;而高温或长时间时,色素吸光度降低,可能主要在于高温或长时间浸提使部分色素分解[15]。红花檵木叶片花色素提取在低pH值时较稳定,在pH值为微酸近中性时浸提液吸光度随波长增加而降低,吸收峰消失,可能由于花色素及其苷结构被破坏[15]。本研究提取红花檵木叶片花色素时,在已有单因素试验的基础上,进行正交设计试验,正交设计试验结果与单因素试验相符,各因素间是否存在互作有待于进一步研究。
植物色素的性质受温度、光照、氧化剂及还原剂等影响,本实验中红花檵木叶片花色素具光、热不稳定性及抗氧化能力差的特点,这与唐克华等[11]对红花檵木花蕾花色素理化性质的研究不完全一致,可能主要由于植物中不同种类的花色素具有不同性质[16],具体原因有待于进一步研究。红花檵木叶片色素在强酸性时稳定,微酸近中性时变色,表现出花色素颜色因pH值而变的最重要特征,说明其具pH值依赖性[15]。红花檵木叶片花色素随金属离子及其浓度的不同而变化,金属离子A13+、Ca2+、Co2+等具增色作用,Cu2+、Mg2+、Zn2+、Mn2+、K+、Sn2+等有减色作用,而Fe2+、Fe3+、Pb2+等引起色素变色且出现沉淀,主要由于Fe2+等离子与叶片色素形成金属络合物的原故[17]。
[1]夏湘, 赵良忠, 袁其丽, 等. 雪峰蜜橘果皮色素的稳定性研究[J]. 食品科学, 2008, 29(12): 102-106.
[2]MEKKAWY H A, ALI M O, EL-ZAAWAHRY A M. Toxiceffect of synthetic and natural food dyes on renal andhepatic functions in rats[J]. Toxicology Letters, 1998, 95(6): 55.
[3]乔华, 张生万, 李美萍, 等. 天然色素稳定性研究及其新的类型划分[J]. 食品科学, 2006, 27(9): 69-73.
[4]李晨东, 唐前瑞, 陈德富, 等. 不同来源红檵木材料的RAPD分析及分类学探讨[J]. 园艺学报, 2002, 29(3): 358-362.
[5]唐前瑞, 周朴华. 红檵木不同变异类型形态特征与色素含量的比较[J]. 湖南农业大学学报, 2001, 27(5): 362-366.
[6]唐前瑞. 红檵木与檵术叶绿体超微结构比较研究[J]. 湖南农业大学学报, 2003, 29(1): 41-42.
[7]唐前瑞, 陈德富, 陈友云, 等. 红檵木叶色变化的生理生化研究[J].林业科学, 2006, 42(2): 111-115.
[8]VRUGTMAN F. International registration of cultivar names for unassigned woody genera[J]. Hortscience, 1994, 29(9): 970-971.
[9]GAWEL N J, JOHNSON G R, SAUVE R. Identification of genetic diversity amongLoropetalum chinensevar.rubrumintroductions[J]. Journal of Environmental Horticulture, 1996, 14(1): 38-41.
[10]李晨东, 唐前瑞, 陈德富, 等. 红檵木的3'端延长随机引物扩增DNA (3'-ERPAD)标记[J]. 生物技术, 2002, 12(4): 3-5.
[11]唐克华, 于华忠, 龚剑, 等. 红檵木花色素的微波提取与特性研究[J].西北植物学报, 2005, 25(3): 568-574.
[12]HOLTON T A, COMISH E C. Genetics and biochemistry of anthocyanins biosynthesis[J]. Plant Cell, 1995(7): 1071-,1,083.,,
[13]赵昶灵, 郭维明, 陈俊愉. 理化因子导致梅花 南京红 花色色素的颜色变化[J]. 广西植物, 2004, 24(5): 471-477.
[14]唐克华, 陈璇, 陈功锡. 红檵木花色素TLC分离与定性研究[J]. 食品科学, 2005, 26(9): 52-57.
[15]WATERHOUSE A I. Wine phenolics[J]. Annals of the New York Academy of Sciences, 2002, 957(4): 21-36.
[16]MAZZA G, BROUILLARD R. The mechanism of co-pigmentation of anthocyanins in equeous solutions[J]. Phutochem, 1990, 29(4): 1097-1102.
[17]KONDO T K, YOSHIDA A, NAKAGEWA T. Structural basis of bluecolor development in flower petals fromCommelina communis[J]. Nature, 1992, 358(6): 515-518.
Extraction and Characterization of Anthocyanidins fromLoropetalum chinensevar.rubrumYieh Leaves
LI Xin-lei,LI Ji-yuan,FAN Zheng-qi
(The Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Fuyang 311400, China)
The anthocyanidinsins inLoropetalum chinensevar.rubrumYieh leaves were extracted by solvent extraction method and analyzed for their physico-chemical properties. The best extraction conditions were found as follows: 99.5% methanol as extraction solvent at a solid-to-liquid ratio of 1:5 (g/mL) for 2 h extraction at 60 ℃. The pigments were unstable to light and heating but stable to strongly acidic environments and had a different color in slightly acidic and nearly neutral environments. Their tolerance to H2O2 and Na2SO3 was poor and their sensitivity to EDTA and sodium benzoate was high. Glucose and sucrose had little effect on the pigments. Salt, citric acid and some metal ions such as A13+, Ca2+and Co2+had hyperchromic effect on them and vitamin C and other metal ions such as Cu2+, Mg2+, Zn2+, Mn2+, K+and Sn2+had hypochromic effect. Moreover, Fe2+, Fe3+and Pb2+affected the stability of the pigments.
Loropetalum chinense;leaf;anthocyanidin;extraction;property
TS202.3
A
1002-6630(2011)20-0057-06
2010-12-16
浙江省科技计划项目(2007C32035)
李辛雷(1978—),男,助理研究员,硕士,研究方向为观赏植物遗传育种。E-mail:lixinlei2020@163.com



