马永强,韩春然,张 娜,佟晓芳,张毅方,刘 颖
(1.哈尔滨商业大学 黑龙江省食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.黑龙江省食品质量监督检验一站,黑龙江 哈尔滨 150010;3.哈高科大豆食品有限责任公司,黑龙江 哈尔滨 150078)
聚丙烯微孔膜固定化转谷氨酰胺酶在大豆乳清废水处理中的应用
马永强1,韩春然1,张 娜1,佟晓芳2,张毅方3,刘 颖1
(1.哈尔滨商业大学 黑龙江省食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.黑龙江省食品质量监督检验一站,黑龙江 哈尔滨 150010;3.哈高科大豆食品有限责任公司,黑龙江 哈尔滨 150078)
将固定化转谷氨酰胺酶酶膜应用到酶膜反应器中,对大豆乳清废水进行催化使其发生聚合并被截留,从而减轻大豆乳清废水对环境的污染,并确定其最佳影响条件,得出在最佳条件下进行处理的蛋白截留率为78.4%。对处理前后大豆乳清废水进行分析,其主要成分指标发生了很大变化,如蛋白质含量、生化需氧量(biochemical oxygen demand,BOD)值、化学需氧量(chemical oxygen demand,COD)值、灰分含量等指标较处理前发生显着下降。
转谷氨酰胺酶;聚丙烯微孔膜;大豆乳清废水;固定化酶;催化
生产大豆分离蛋白过程中产生的乳清一直是环保治理的难点,乳清中含有乳清蛋白,大豆低聚糖和盐类等物质,这些有效成分排放到自然水体中不仅造成资源浪费,而且对水构成严重污染,生化需氧量(biochemical oxygen demand,BOD)、化学需氧量(chemical oxygen demand,COD)值严重超标[1-2]。因此,设法回收大豆乳清废水中有用成分不仅可提高原料利用率,并且可大大减轻废水对环境的污染。
转谷氨酰胺酶是一种能催化多肽或蛋白质的谷氨酰胺残基的γ-羟胺基团(酰基的供体)与许多伯胺化合物(酰基受体)之间的酰基转移反应的酶[3-4]。经过转谷氨酰胺酶改性后,蛋白质分子可以实现交联,提高其分子质量水平并使其某些物化特性得到改善[5-6]。
目前,大豆乳清废水的处理方法是直接将其进行多级生物处理,利用厌氧和好氧的方法降低废水中的COD及BOD值[7],但是仅此很难达到国家排放标准。固定化酶膜具有聚合大豆乳清蛋白的作用,并且固定化酶膜的一个重要应用领域是酶膜反应器,近年来酶膜反应器用于污水处理,尤其是水中酚的降解也成为研究热点之一[8-10]。酶膜反应器能将酶的催化特性与膜的优良性能结合,使化学反应和产品分离同时进行,并且有效地加速反应,突破化学平衡的限制,提高转化率[11]。因此,酶膜反应器已被广泛地应用于化工、制药、环保、食品工业等领域。通过选择适当大小孔径的膜,使底物在酶膜表面反应,但不透过膜,而小分子物质能透过膜,从而达到纯化的目的[12]。近几年酶的膜固定化技术己有了很大发展,但仍有很大的进步潜力。对现有膜材料的改性、开发新膜材料、采用新的固定化技术、分子识别固定化、定点固定化、多酶系统共固定将成为这一领域的发展方向[13]。
本研究以工业生产大豆分离蛋白的副产物大豆乳清废水为原料,用实验室制备好的固定化转谷氨酰胺酶酶膜应用到酶膜反应器中,使大豆乳清废水中的大豆乳清蛋白凝聚并且被截留,并对催化凝聚前后的大豆乳清废水的主要成分进行分析[14]。
1 材料与方法
1.1 材料、试剂与仪器
固定化转谷氨酰胺酶 实验室自制;大豆乳清废水哈尔滨高科技有限责任公司;标准蛋白(14~100kD) 北京全式金生物技术有限公司;盐酸 哈尔滨市新达化工厂;冰醋酸、醋酸钠 天津市天新精细化工开发中心;磷酸氢二钠、磷酸二氢钠 哈尔滨市新春化工厂;甲醇、硫酸钾、浓硫酸、氢氧化钠硫酸铜 哈尔滨市化学试剂厂;硼酸、葡萄糖、蒽酮、硫脲 北京化学试剂公司。
Spectrum722E型紫外-可见分光光度计 上海光谱仪器有限公司;SY-2-4型恒温水浴锅 天津市欧诺仪器仪表有限公司;固定化酶膜反应器装置 实验室自制。1.2 方法
1.2.1 酶膜反应器装置
根据大豆乳清废水中的分子质量分布,选择截留分子质量分别为25000D的膜进行固定化后,应用到酶膜反应器中进行反应。采用实验室通过臭氧活化方法制备得到的聚丙烯微孔膜-转谷氨酰胺酶进行固定化酶膜反应器的制备。经实验室优化得到的聚丙烯微孔膜上的载转谷氨酰胺酶量为30.23mg/g膜,并且酶膜活力可达16.9U/g。
反应装置主要包括4个部分:预热罐、螺杆泵、酶膜反应器、产物收集器。其主要工作流程为:将预处理后的大豆乳清废水过滤,加入到预热罐中,调节到所需的温度及pH值后,物料经螺杆泵通过转子流量计进入酶膜反应器中,借助酶膜反应器内叶轮的作用使大豆乳清废水与酶膜充分接触,并使其聚合,大分子物质被膜截留,收集到产物收集器中,小分子物质及未被聚合的蛋白透过膜后通过管道再次进入到预热罐中,再次循环作用。本研究采用大量45℃热水反向连续通过酶膜表面的清洗方式。清洗完的酶膜反应器,通透量等恢复正常[15]。
1.2.2 酶膜反应器处理大豆乳清废水条件确定
将大豆乳清废水升温分别为30、35、40、45、50、55℃,缓慢均匀加入NaOH溶液(分别调节pH5.0、5.5、6.0、6.5、7.0、7.5、8、10),然后加入CaCl2溶液,并与直接均匀加入Ca(OH)2并分别调节pH8、10的体系进行对比。通过调节转子流量计的显示,设定不同物料流速分别为50、70、90、110、130、150mL/min。观察絮凝沉淀效果确定最佳预处理方法,通过测定不同条件聚合前后的大豆乳清废水的蛋白质含量,根据蛋白截留率确定最佳聚合温度、最佳pH值、物料流速[16]。1.2.3 酶膜反应器的重复使用性的测定
取反应一段时间后的载荷转谷氨酰胺酶的聚丙烯微孔膜进行酶膜反应器重复使用性测定,酶膜反应器的剩余酶活采用改进的分光Hydroxamate分析法进行测定[17]。以初始酶活力作为100,其余时间的剩余酶活力同其比值作为评价指标。
1.2.4 大豆乳清废水成分分析
采用GB 5009.5—2010《食品中蛋白质的测定》测定大豆乳清废水中蛋白质的含量;采用蒽酮比色法测定大豆乳清废水中多糖含量;取废水样液用pH计直接测定大豆乳清废水的pH值;采用GB 11914—2003《化学需氧量的测定》测定大豆乳清废水中COD值,根据测定的COD值,采用稀释接种法测定大豆乳清废水中的BOD值;采用GB/T 5009.4—2003《食品中灰分的测定》测定大豆乳清废水的灰分含量。
2 结果与分析
2.1 酶膜反应器处理大豆乳清废水条件确定
2.1.1 大豆乳清废水的预处理
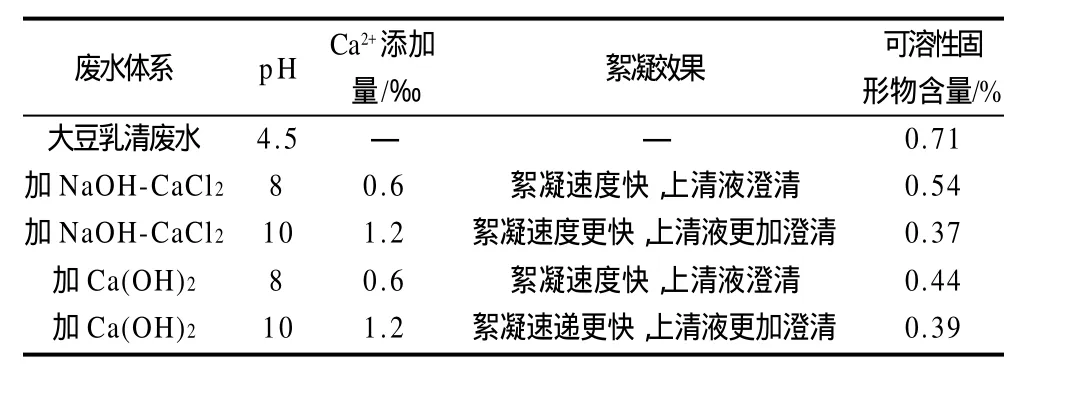
表1 大豆乳清废水预处理方法对比Table 1 Comparison of different pretreatments on protein precipitation in soybean whey wastewater
对大豆乳清废水采用两个方法进行预处理,结果进行对比,如表1所示。对大豆乳清废水进行预处理的目的是为了去除大豆乳清废水中大分子质量蛋白质,澄清
废水,并使该处理后的废水通过酶膜反应器时作用效率更高,同时对酶膜反应器具有一定保护作用。基于处理效果,本实验选择1.2‰的Ca(OH)2作为絮凝剂,此条件下,絮凝速度快,上清液澄清,并且絮凝后上清液的灰分最低。
2.1.2 物料温度对聚合大豆乳清废水的影响

图1 物料温度对蛋白截留率的影响Fig.1 Effect of temperature on interception rate of proteins
由图1可知,当物料温度小于45℃时,蛋白截留率很明显地随物料温度的升高而升高,说明此时的物料温度并不能使废水中的蛋白充分聚合从而截留,但物料温度升至45℃时蛋白截留率达到77%,温度继续升高蛋白截留率趋势稳定,并没有显着变化,但是此时的蛋白有可能发生变性,因此最佳物料温度确定为45℃。
2.1.3 物料pH值对聚合大豆乳清废水的影响

图2 物料pH值对蛋白截留率的影响Fig.2 Effect of pH on retention rate of proteins
由图2可知,当pH值在5~6.5之间时蛋白截留率随pH值的升高而升高,pH6.5时蛋白截留率达到最高76%,而当pH值继续升高,蛋白截留率下降。由此可见,在强酸、强碱性条件下对大豆乳清蛋白的聚合效果较差。物料最佳pH值为6.5。
2.1.4 物料流速对聚合大豆乳清废水的影响
由图3可知,当调节物料流速为30、50、70mL/min时,蛋白截留率没有显着变化。而当流速为大于70mL/min,蛋白截留率呈显着下降趋势,此时由于流速较快,大豆乳清废水中的蛋白在通过酶膜反应器的过程中,与固定化转谷氨酰胺酶的作用有效接触率降低,所以造成蛋白截留率降低,因此,最佳流速设定为70mL/min。

图3 物料流速对蛋白截留率的影响Fig.3 Effect of feed flow rate on retention rate of proteins
2.1.5 酶膜反应器的重复使用性
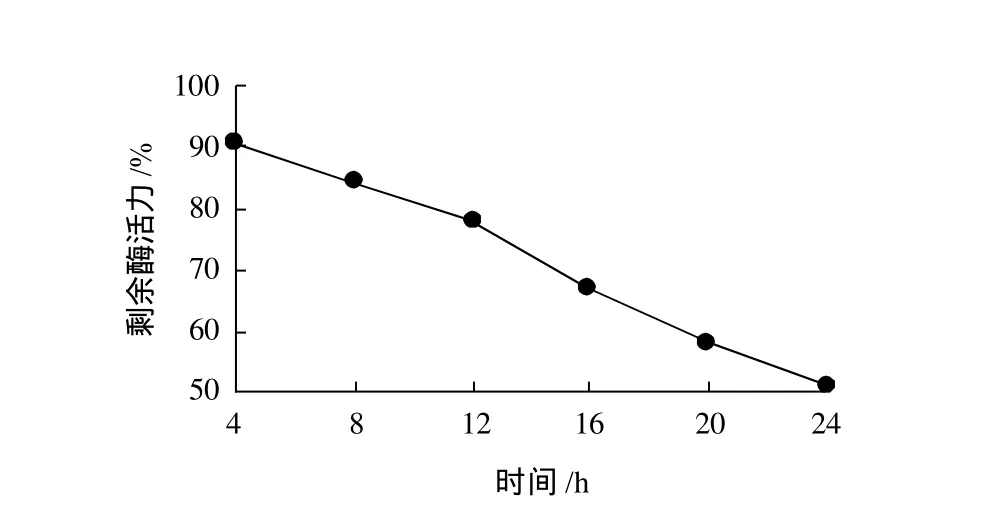
图4 酶膜衰减系数随时间的变化Fig.4 Repeated usability evaluation of MTG-conjugated polypropylene microporous membrane
由图4可知,酶膜反应器中酶膜活力随工作时间的延长缓慢下降,当工作时间为24h后酶活仍然可高达50%以上,由此可证明,本实验所制备使用的转谷氨酰胺酶酶膜的重复使用性较好,较稳定。
2.2 聚合前后大豆乳清废水成分对比分析
2.2.1 主要成分的分析
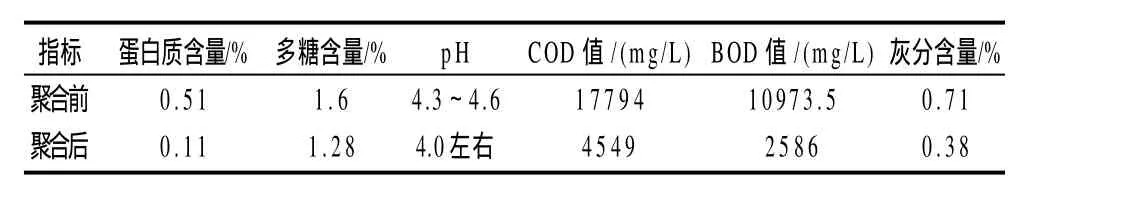
表2 大豆乳清废水聚合前后主要成分分析Table 2 Variations of chemical composition of soybean whey wastewater before and after MTG treatment
大豆乳清废水经聚合前后其主要成分指标发生了很大变化,如蛋白质含量、COD值、BOD值、灰分含量等指标较处理前发生了显着下降,如表2所示。
2.2.2 处理前后蛋白质分子质量的分析
采用SDS-聚丙烯酰胺凝胶电泳法分析原大豆乳清废水和在最佳条件下聚合后收集的乳清蛋白溶液分子质量分布,并做对比。如图5所示,聚合前分子质量分布几乎全部在20kD左右,低于30kD,而聚合后图谱显示,明显在30kD以上出现几条带,说明此时已经有小分子蛋白聚合成大分子蛋白,并且此图同样可证明本实验所选截留分子质量在25000D是符合依据的。
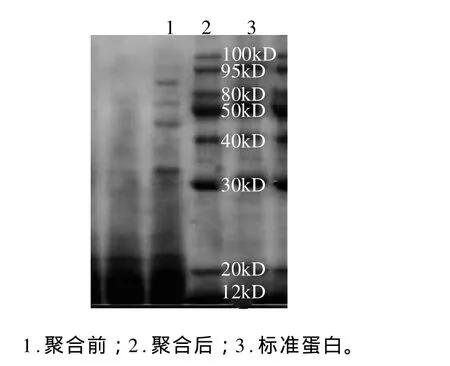
图5 SDS-PAGE电泳图Fig.5 SDS-PAGE of soybean whey wastewater before and after MTG treatment
3 结 论
本研究将制备好的固定化转谷氨酰胺酶酶膜应用到酶膜反应器中,对酶膜反应器聚合并截留大豆乳清废水中蛋白的影响条件:物料温度、物料pH值、物料流速进行考查,最佳条件为:物料温度45℃、物料pH6.5、物料流速70mL/min。在最佳条件下进行处理的蛋白截留率为78.4%。本实验检验了该酶膜的重复使用性,工作时间为24h后酶活仍然可高达50%以上。大豆乳清废水经酶膜反应器处理,蛋白质含量、COD值、BOD值、灰分含量发生了尤其显着的变化。其中蛋白质含量由原0.51%下降至0.11%,COD值由17794mg/L下降至4549mg/L,BOD值由10973mg/L下降至2586mg/L,灰分由0.71%下降至0.11%。
[1]袁其朋, 马润宇. 膜分离技术处理大豆乳清废水[J]. 水处理技术, 2001, 27(3): 161-162.
[2]杜明, 刘鹤楠, 易华西, 等. 大豆乳清蛋白研究进展[J]. 食品工业科技, 2008, 29(2): 302-304.
[3]YAMAGUCHI S, JEENES D J, ARCHER D B. Protein-glutaminase fromChryseobacterium proteolyticum, an enzyme that deamidates glutaminyl residues in proteins. purification, characterization and gene cloning[J]. Eur J Biochem, 2001, 268(5): 1410-1421.
[4]SATO H, HAYASHI E, YAMADA N. Further studies on the sitespecific protein modification by microbial transglutaminase[J]. Bioconjugate Chem, 2001(12): 701-2710.
[5]IKURA K, KOMETANI T, SASAKI R, et al. Crosslinking of soybean 7S and 11S proteins by transglutaminase[J]. Agric Biol Chem, 1980, 44 (12): 2979-2984.
[6]刘心伟, 吕加平, 范贵生. 微生物转谷氨酰胺酶在食品工业中的研究进展[J]. 内蒙古农业大学学报, 2005, 26(4): 54-57.
[7]徐朝辉, 万端极, 崔朝亮, 等. 膜技术在处理大豆乳清废水中的应用[J]. 中国油脂, 2007, 32(1): 68-69.
[8]赵丽颖, 符群. 膜分离技术在大豆乳清废水回收中应用[J]. 粮食与油脂, 2002(9): 48-49.
[9]CHAKRABARTI R, CHAKRABORTY D. Mechanical and thermomechanical characterization of PVC/polyalkylacrylate blends[J]. J Appl Polym Sci, 2006, 102(4): 3698-3703.
[10]梁华民, 田少君, 周怡. 转谷氨酰胺酶对大豆分离蛋白交联聚合作用研究[J]. 粮食与油脂, 2004(2): 3-6.
[11]王文杰, 王璋. 酶膜反应器中水解大豆分离蛋白的研究[J]. 食品与机械, 2008, 24(1): 16-19.
[12]储力前, 付永彬. 膜分离技术在大豆蛋白废水处理中的应用研究[J].给水排水, 2000, 26(5): 36-37.
[13]高安全, 吴景远, 梁伟. 膜分离技术在大豆乳清回收中的应用[J]. 过滤与分离, 2001, 11(3): 26-27.
[14]De JONG G A H, KOPPELMAN S J. Transglutaminase catalyzed reaction: impact on food applications[J]. Journal of Food Science, 2002, 67(8): 2798-2806.
[15]陈爱梅, 江连州. 膜分离大豆乳清蛋白的研究[J]. 粮油加工与食品机械, 2005(10): 79-82.
[16]尹少谦, 王淼. Streptomyces hygroscopicus 谷氨酰胺酶转胺酶分离纯化及其性质研究[J]. 食品与发酵工业, 2005, 31(3): 26-29.
[17]刘颖, 张丹丹, 马永强, 等. 新转谷氨酰胺酶在聚丙烯膜上的固定化研究[J]. 食品工业科技, 2010, 31(6): 49-52.
Application of Polypropylene Microporous Membrane Carrying Transglutaminase to Treat Soybean Whey Waste
MA Yong-qiang1,HAN Chun-ran1,ZHANG Na1,TONG Xiao-fang2,ZHANG Yi-fang3,LIU Ying1
(1. Key Laboratory of Food Science and Engineering of Heilongjiang Province, Harbin University of Commerce, Harbin 150076, China;2. Administration of Quality Supervision, Inspection of Heilongjiang, Harbin 150001, China;3. Harbin Hi-tech Soybean Food Company, Harbin 150078, China)
In this study, we immobilized microbial transglutaminase (MTG) onto polypropylene microporous membrane by ozone activation and then evaluated its application to treat soybean whey waste with the purpose to recover proteins and decrease pollution. The results showed that under optimal technological conditions, MTG-conjugated polypropylene microporous membrane recovered 78.4% of proteins from soybean whey waste, and significantly decreased protein and ash contents, COD value and BOD value of soybean whey waste.
microbial transglutaminase;polypropylene microporous membrane;soybean whey wastewater;enzyme immobilization;atalysis
TS252.41
A
1002-6630(2011)20-0104-04
2011-06-29
黑龙江省高校科技创新团队建设计划项目(2010td04);国家“863”计划项目(2008AA10Z303)
马永强(1963—),男,教授,硕士,研究方向为食品酶学、食品化学。E-mail:mayq@hrbcu.edu.cn



