王雪青,邓 伟,杨进芳,毛羽聪,史中明
(天津市食品与生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
藻蓝蛋白酶解肽的分离纯化及其细胞毒活性
王雪青,邓 伟,杨进芳,毛羽聪,史中明
(天津市食品与生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
研究钝顶螺旋藻(Spirulina platensis)藻蓝蛋白(C-phycocyanin,C-PC)及其胰蛋白酶水解肽的分离纯化。采用反复冻融和超声破碎法破碎细胞,用28~55g/100mL硫酸铵沉淀反复盐析获得纯度(A620nm/A280nm)为2.19的藻蓝蛋白,再通过羟基磷灰石(HA)柱层析和Sephacryl S-200 HR凝胶层析对其进行纯化,得到纯度(A620nm/A280nm)为3.89藻蓝蛋白。纯化后的藻蓝蛋白在40℃条件下经胰蛋白酶酶解60min后,用DEAE-Sepharose Fast Flow柱层析对酶解肽产物进行分离,收集得到4组藻蓝蛋白酶解肽。采用MTT方法,研究藻蓝蛋白、酶解混合液、分离的4个酶解肽组分对肿瘤细胞系HeLa和293T增殖的影响。结果显示:肽组分1和4对HeLa细胞的抑制率分别为37.71%和47.04%,而混合肽和藻蓝蛋白抑制率分别为34.02%和26.03%,因此活性肽组分1和4显示出较好的肿瘤抑制效果,而这两种活性肽组分对正常细胞293T并无细胞毒活性,特别是组分4效果最明显,是极具开发潜力的保健产品。
藻蓝蛋白;纯化;酶解肽;细胞毒活性
藻蓝蛋白(C-phycocyanin,C-PC)是从螺旋藻等藻体中提取的一种光合辅助色素蛋白,无毒呈蓝色。许多研究报道,C-PC具有抗肿瘤[1-5]、抗辐射[6]、免疫调节[7]和保护神经[5,8]等生理作用,因此在西方发达国家,已作为添加剂广泛用于功能性食品和高级化妆品中。按照C-PC在特定波长吸光度的比(A620nm/A280nm)大小,将其分为食品级(A620nm/A280nm≥0.5)、化妆品级(A620nm/A280nm≥2.0)和试剂级(A620nm/A280nm≥4.5)3个级别。不同级别的C-PC,价格和用途也不相同。高纯度的C-PC可制成荧光探针,已在临床诊断和生物分析检测领域中显示出良好的应用开发前景。但由于C-PC提取纯化工艺相对复杂且成本较高,加之其稳定性较差,许多环境因素如温度、光照、pH值和一些食品添加剂均能造成其变性降解[9-10],限制了C-PC的应用。
一些生物活性肽常以非活性状态存在于蛋白质中,这些蛋白质经过蛋白酶的水解作用,使隐藏于其中的活性肽释放出来,有可能发挥出比原有蛋白更多生物活性[11-13]。体内实验显示,经口服或灌胃后,C-PC可显着影响机体的细胞因子网络,如通过调节辅助性T细胞Th1和Th2细胞因子的表达纠正失衡的Th1/Th2的细胞因子网络[14],调节自身免疫平衡状态和炎症反应;通过调节细胞集落刺激因子(CSF)[15]、碱性成纤维细胞生长因子(bFGF)及其受体(FGFR-1) 、胰岛素样生长因子(IGF-1)及其受体(GF-1R)的表达,调节维持多种细胞尤其是神经细胞的再生修复[16];通过明显下调核转录因子NF-κB和白介素IL-6的表达,抑制神经元的凋亡[17],以此调节免疫功能和炎症反应,并加强其他细胞因子的效果。由此推测,C-PC可能正是通过肠胃的消化作用,使其内的功能肽段作用的结果。本课题组发现,在特定条件下经胰蛋白酶水解的C-PC得到的酶解产物具有比C-PC本身更高抗肿瘤活性[18]。
本实验围绕C-PC的分离纯化和纯化的C-PC经过酶解处理,柱层析分离,检测不同组分的抗肿瘤活性进行一系列研究,为C-PC的深加工以及抗癌药物的开发提供基础参数。
1 材料与方法
1.1 材料与试剂
钝顶螺旋藻粉 内蒙怡健生物制品有限公司。
羟基磷灰石(HA)粉 四川大学生物材料工程研究中心;细胞株:人宫颈癌细胞HeLa、表达SV40大T抗原的人肾上皮细胞293T取自中科院北京生物制品研究所;丙烯葡聚糖凝胶(Sephacryl S-200 HR)、DEAE琼脂糖凝胶(DEAE Sepharose Fast Flow)、葡聚糖凝胶(Sephadex G-25) 美国GE公司;DMEM培养基 美国Gibico公司;四甲基噻唑蓝(MTT) 中国医科院血液研究所;胎牛血清(FBS) 兰州民海生物工程有限公司;胰蛋白酶(Trypsin) 美国Sigma公司;二甲基亚砜(DMSO)天津汇英化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
YC-2型低温层析冷柜 北京长流科学仪器有限公司;CO2培养箱SL型 Shellab公司;高速冷冻离心机美国Sigma公司;酶标仪 美国Thermo Labsystems公司;倒置显微镜 北京赛百奥科贸中心;SW-CJ-1F单人双面净化工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 藻蓝蛋白的提取
方案一(传统的二步盐析法):1)细胞破碎:取20g螺旋藻粉溶于400mL的10mmol/L PBS缓冲液中,浸泡4h,于-20~4℃之间反复冻融4次,每次融化后进行超声破碎,条件为:功率400W,时间6s,间隔15s,60次。4℃、10000r/min离心30min,弃沉淀取上清。2)盐析:上清液经28g/100mL饱和硫酸铵沉淀,4℃、10000r/min离心30min,取上清。上清液由55g/100mL饱和硫酸铵沉淀,相同条件离心,弃上清。沉淀溶于PBS缓冲液,透析除盐,得到藻蓝蛋白粗提液。
方案二(改进的四步盐析法):1)细胞破碎:取40g螺旋藻粉溶于400mL的10mmol/L PBS缓冲液中,过程同方案一。2)盐析:按照方案一得到的藻蓝蛋白粗提液,再按照方案一的操作条件,进行两次沉淀,两次离心,得到方案二的藻蓝蛋白粗提液。
两种方案中藻蓝蛋白质量浓度与纯度的计算:对方案一和方案二上清液中蛋白含量较高的粗提液适量稀释后,分别测定其上清液在波长620nm和652nm处的吸光度,并按以式(1)计算藻蓝蛋白的质量浓度和纯度[15]。藻蓝蛋白的纯度用A620nm/A280nm比值来表示。

式中:ρ为藻蓝蛋白的质量浓度/(mg/mL);A620nm为藻蓝蛋白的特征吸光度;A652nm为别藻蓝蛋白的特征吸光度。
1.3.2 藻蓝蛋白的纯化
1.3.2.1 羟基磷灰石柱层析
用5mmol/L pH7.0 PBS缓冲液预平衡层析柱,然后加入粗蛋白提取液上柱,以5~150mmol/L pH7.0的PBS缓冲液加0.1mol/L的NaCl进行浓度梯度洗脱,用紫外检测仪在波长280nm处获得吸收峰位置及强度信息,分部收集洗脱液并计算A620nm/A280nm值。获得的蛋白洗脱液用PEG 20000浓缩。
1.3.2.2 Sephacryl S-200 HR柱层析
用10mmol/L pH7.0 PBS缓冲液预平衡层析柱,经HA柱纯化的蛋白液上柱,用0.02mmol/L PBK缓冲液+0.1mol/L NaCl缓冲液洗脱,于280nm波长处获得吸收峰位置及强度信息,分部收集洗脱液。取藻蓝蛋白部分,经Sephadex G-25脱盐、冻干,-20℃保存。
1.3.3 藻蓝蛋白活性肽的提取
藻蓝蛋白酶解肽的制备参照杨滢滢[19]的方法。具体操作如下:将纯化后的藻蓝蛋白配成质量浓度为100μg/mL溶液,用胰蛋白酶进行酶解处理,操作温度为40℃,pH8.0,酶与底物比1:10,反应时间60min。酶解过程不断搅拌并控制pH值,以1mmol苯甲基磺酰氟(PMSF)终止反应,冻干。
酶解产物的分离采用DEAE Sepharose Fast Flow阴离子交换柱层析和Sephadex G-25凝胶过滤柱层析。DEAE Sepharose FF柱层析,用缓冲液A:20mmol/L PBS (pH6.8),缓冲液B:20mmol/L PBS(pH6.8)+1.0mmol/L的NaCl,洗脱程序为:用缓冲液A平衡层析柱,缓慢上样,用缓冲液A洗脱,待样品完全流穿,再用缓冲液A与B的梯度洗脱,最后用缓冲液B洗脱。控制流速,于280nm波长处检测流出液洗脱峰。
经DEAE Sepharose FF分离出的组分蛋白,经浓缩后,Sephadex G-25除盐,得到的样品冻干保存。
1.3.4 细胞毒活性实验
取生长良好的对数期HeLa细胞,制成浓度为1.5× 105个/mL的单细胞悬液,每孔加入100μL于96孔板中培养。实验设空白:用于调零;阴性对照组:只加 0.01mol/L PBS 10μL;阳性对照组:100μg/mL 5-氟尿嘧啶(5-Fu) 10μL;实验组:1μg/mL C-PC 10μL,酶解混合多肽和4组分离出的酶解产物10μL,每孔补培养基之总体积100μL。不同处理组加样48h后弃去上清液,加入5mg/mL MTT,每孔10μL,再补加90μL的PBS以使MTT终质量浓度为0.5mg/mL,37℃继续培养4h。弃上清液,加入加DMSO 150μL/孔,振荡混匀后,在酶标仪上测定570nm波长处的吸光度,按式(2)计算药物对肿瘤细胞生长的抑制率。

2 结果与分析
2.1 不同提取工艺对藻蓝蛋白提取效果的影响
利用传统的二步盐析法,得到的藻蓝蛋白粗提物其纯度值(A620nm/A280nm)并不高,仅为1.35,因而要达到纯度要求需在后续纯化过程中增加操作步骤。本实验为减轻后期的纯化工作,又综合考虑总操作时间不宜过长,在藻蓝蛋白的粗提取过程中利用反复两次的二步盐析操作对其进行盐析提取。提取工艺效果见表1。

表1 不同盐析工艺对藻蓝蛋白提取率和纯度的影响Table1 Effect of salting-out on the purity of C-PC
由表1可知,4步盐析工艺与二步盐析工艺相比,操作过程中在藻液比提高一倍的基础上,获得了藻蓝蛋白粗提取产物,且蛋白质提取率相差不大。藻液比相比传统分离浓度要大,加之硫酸铵饱和溶液会对溶解在其中的蛋白起到保护作用,因此此操作更加适合大量提取。
尽管增加了提取步骤,但这一步骤耗费的过程并不繁琐,而且藻蓝蛋白在硫酸铵溶液中能够得到保护,并不会因时间过长而产生降解。而粗提过程能够对藻蓝蛋白大量制备,其纯度的提高可明显减少后续纯化的工作量,对藻蓝蛋白的大规模提取和纯化工作有着重要意义。
2.2 藻蓝蛋白的纯化工艺研究
2.2.1 羟基磷灰石柱层析对藻蓝蛋白的分离效果
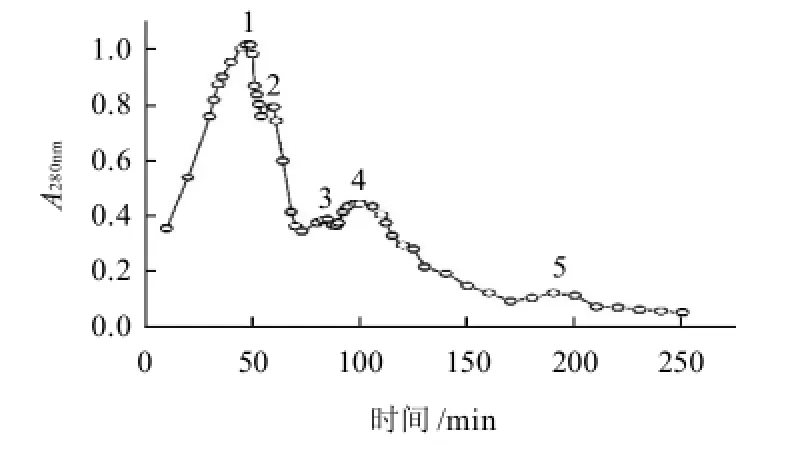
图1 藻蓝蛋白粗品经羟基磷灰石柱层析洗脱曲线Fig.1 Elution profile of crude C-PC on HA column
粗蛋白经过羟基磷灰石柱层析,磷酸盐缓冲液梯度洗脱,结果见图1。经分光光度计检测A620nm/A280nm,发现目标组分藻蓝蛋白主要集中在峰1和峰2。峰3和峰4含有藻蓝蛋白和别藻蓝蛋白,峰5为别藻蓝蛋白。峰1和峰2合并,记为组分I。经检测,组分I的纯度为:A620nm/A280nm=3.18。
2.2.2 Sephacryl S-200 HR柱凝胶层析对藻蓝蛋白的纯化
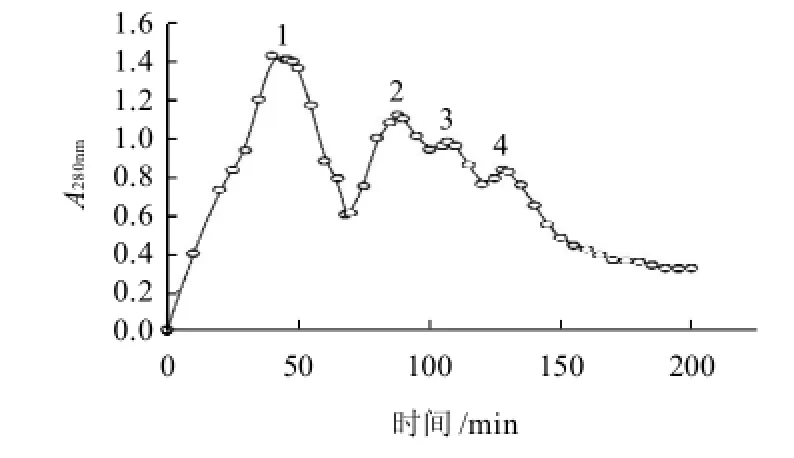
图2 Sephacryl S-200 HR柱层析洗脱曲线Fig.2 Elution profile of peptide fraction I on Sephacryl S-200 HR gel column
收集峰1和峰2的组分,经过Sephacryl S-200 HR柱凝胶层析得到4个洗脱峰,结果见图2。峰1呈深蓝色,主要成分为藻蓝蛋白。收集后经检测,藻蓝蛋白纯度为:A620nm/A280nm=3.89。
目前国内外对藻蓝蛋白的柱层析纯化制备工艺多为两种以上不同分离原理的柱层析交替使用,且多为凝胶层析与吸附层析的3步以上交替纯化过程才能制备出纯度在分析级以上的高纯度藻蓝蛋白。本研究由于先前粗提过程中已将藻蓝蛋白纯度提高到了2.19以上,因此在柱层析纯化过程中仅使用了两步过程已使得藻蓝蛋白纯度达到了3.8以上。
2.2.3 全波长扫描法鉴定纯化后的藻蓝蛋白
为进一步确定纯化出的藻蓝蛋白纯度,对其进行紫外-可见全波长扫描。由图3可知,藻蓝蛋白在280、360nm和620nm波长处均有特征吸收峰,其最大吸收波长为620nm。再从全波长扫描的数据中分别找出620nm与280nm波长处所对应的截距,得到藻蓝蛋白的纯度为3.89。
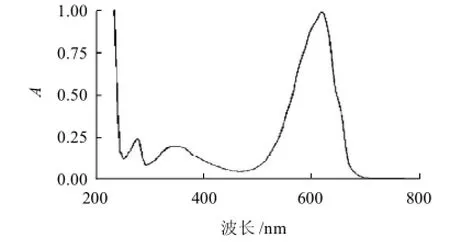
图3 藻蓝蛋白的全波长扫描曲线Fig.3 Full wavelength scanning spectrum of C-PC
2.3 DEAE Sepharose FF柱层析对藻蓝蛋白酶解肽的分离纯化
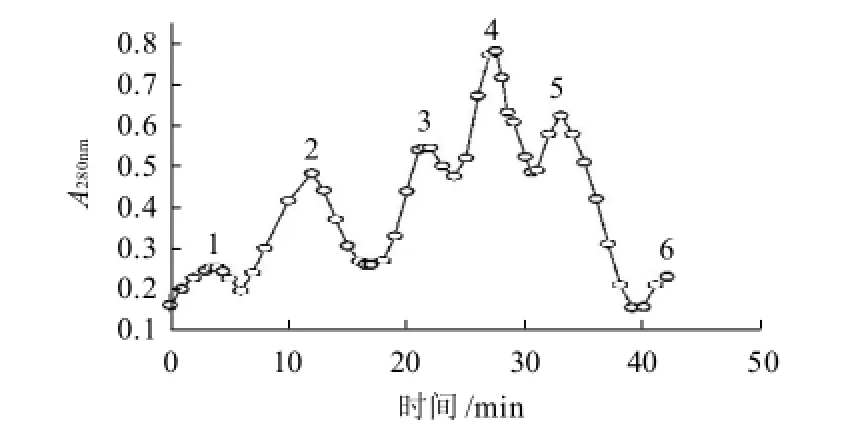
图4 藻蓝蛋白酶解多肽的DEAE Sepharose FF柱层析洗脱曲线Fig.4 Elution profile of C-PC hydrolysate on DEAE Sepharose FF column
酶解后的藻蓝蛋白多肽混合物经DEAE Sepharose FF柱层析分离,得到洗脱曲线见图4。综合波长280nm吸收峰与洗脱时间可判断,其中,峰1与峰6为洗脱过程中的杂质组分,峰2、3、4、5这4个组分,分别标记为T1、T2、T3、T4。
由于本实验室前期的研究中,已通过正交法得到了藻蓝蛋白功能肽的最佳酶解条件,并且酶解出的藻蓝蛋白活性肽的片段分子质量较小,应在5kD以下。因此本实验在此基础上采用目前较流行的DEAE Sepharose Fast Flow弱阴离子交换层析对混合多肽产物进行分离。分离出的各组分再通过Sephadex G-25进行凝胶过滤层析纯化,同时进行脱盐,在此过程中,既根据洗脱峰对目标肽组分进行纯化,同时又可除去分子质量过小的黄绿色小分子和无机盐,使分子筛纯化与除盐过程一并进行。
2.4 藻蓝蛋白、酶解肽及其各分离组分对HeLa细胞的细胞毒活性
藻蓝蛋白、酶解混合肽(标记为TX)、酶解肽组分1~4(标记为T1~T4)及5-Fu(已知的抗癌药物)作用质量浓度均为100μg/mL,作用时间为30h,研究藻蓝蛋白及其活性肽样品对HeLa细胞和正常细胞293T的作用,并与5-Fu进行比较,实验结果见表2。
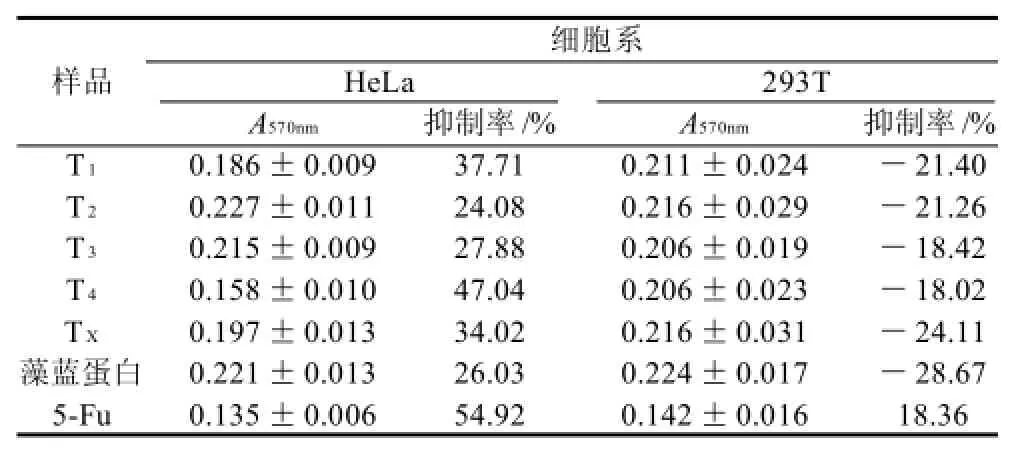
表2 藻蓝蛋白、酶解混合肽、酶解肽组分1~4及5-Fu对细胞生长的影响Table2 Effects of C-PC, its hydrolysate, peptide fractions I through IV and 5-Fu on cell growth
从表2可知,在质量浓度达到100μg/mL时,酶解肽组分1、2、3、4对HeLa细胞的抑制率分别达到37.71%、24.08%、27.88%和47.04%,混合酶解肽的抑制率34.02%,藻蓝蛋白的抑制率为26.03%,5-Fu抑制率为54.92%。分离后的酶解肽组分1和组分4的抑制率均高于混合酶解肽,尤其是组分4显着比混和酶解肽与藻蓝蛋白的抑制率要高,接近于阳性对照组。而相同浓度下的酶解肽分离组分、混合肽、藻蓝蛋白均对正常细胞293T的生长没有表现出任何抑制作用,反而有微弱的促进作用,促进增殖率从18.02%到28.67%不等,实验结果反映出藻蓝蛋白及其酶解肽对正常细胞没有抑制活性。而抗肿瘤药物5-Fu会抑制293T细胞的生长,抑制率达到18.36%,表现出一定的正常细胞毒性,因此藻蓝蛋白及其酶解肽具有选择性的细胞毒活性,而目前的化疗药物,如5-Fu,是无法做到的。相比之下,藻蓝蛋白酶解肽T4则显示出无法比拟的优势。
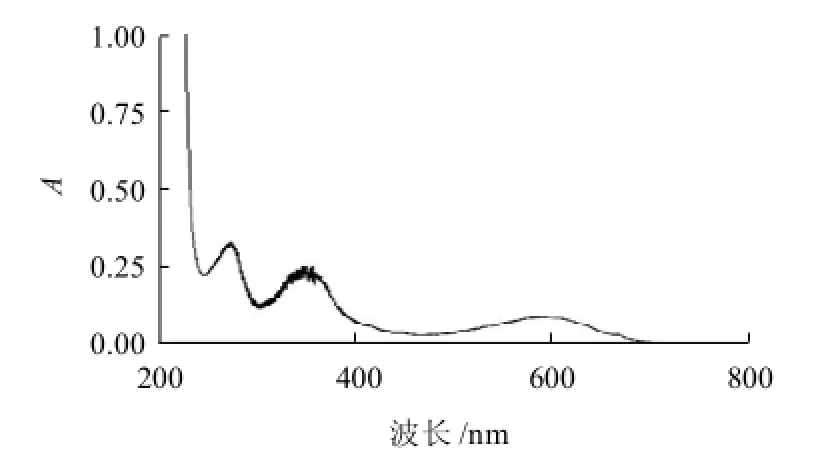
图5 藻蓝蛋白酶解肽混合物的全波长扫描图Fig.5 Full wavelength scanning spectrum of C-PC hydrolysate
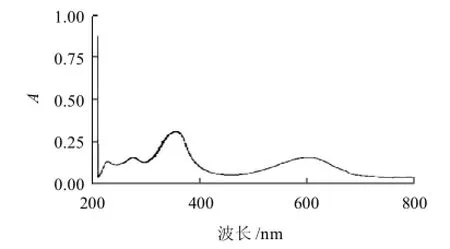
图6 酶解肽T4的全波长扫描图Fig.6 Full wavelength scanning spectrum of peptide T4
为了进一步了解组分4与混合肽一些特性,分别对同样质量浓度的组分4与混合肽作了全波长扫描,结果如图5、6所示。藻蓝蛋白酶解肽在280、360nm和620nm波长处有特征吸收峰,这一点和酶解前的藻蓝蛋白(图3)类似。但620nm波长处的吸收峰强度明显减弱,而280nm和360nm波长处的吸收峰强度增强,且超过了620nm波长处的吸收峰强度。这可能是因为酶解破坏了藻蓝蛋白的三级结构引起的光谱性质变化。同时,经过分离纯化的肽组分4与混合肽相比,在紫外区吸收光谱存在显着差异。同样质量浓度条件下,在360nm处吸收峰强度增强,且在280nm波长处吸收峰明显减弱并在接近200nm处多出一个吸收峰,经数据测量,其在紫外区的3个特征吸收峰分别在228、276nm和356nm处。纯化后的T4与混合肽在光谱扫描曲线的差异也在一定程度上反映了分离纯化的效果。
在藻蓝蛋白酶解产物研究中,黄蓓等[20]报道了3种经过胰蛋白酶水解的藻蓝蛋白色素肽(其分子质量为17.4、7.72kD和6.6kD),并研究了其对小鼠肉瘤细胞S180的细胞毒性实验和荷瘤小鼠的光动力学抗肿瘤(photodynamic therapy,PDT)实验,发现其具有良好体外肿瘤抑制效果和PDT效果。经本实验室前期对藻蓝蛋白酶解工艺条件和对肿瘤细胞研究对象的摸索,发现相同酶解条件的产物对不同的肿瘤细胞系作用差别很大,且用两种蛋白酶通过正交试验等方法得到了抑制HeLa和B16细胞增殖的藻蓝蛋白最佳酶解条件[20],本实验采用胰蛋白酶酶解藻蓝蛋白,以HeLa细胞为作用对象,以期找到藻蓝蛋白分子中包含的相应抗肿瘤活性肽。本实验采用的钝顶螺旋藻其α和β亚基的分子质量分别为17.0kD和19.6kD,通过对T4的HPLC液相色谱分析显示T4主要由两个组分,Maldi-TOF-MS肽谱分析(结果未显示),有两个组分的信号明显高于其他组分,且这两个成分的分子质量分别为1038.459D和1151.556D。根据藻蓝蛋白的α和β亚基的氨基酸序列与结构以及胰蛋白酶对于赖氨酸(K)和精氨酸(R)残基中的羧基特定作用位点,得知α和β亚基各应具有18个酶切位点,因此在本实验理论指导的酶解工艺下和初步分析测定表明,酶解肽组分4的分子质量明显小于5kD。
此外,本实验仅是应用胰蛋白酶简单模拟体内环境对藻蓝蛋白进行酶解加工研究,而当藻蓝蛋白被食用后,经过肠胃道更复杂的消化作用,进而影响机体的细胞因子网络,正应是其内的功能肽段作用暴露出来作用的结果。因此深入研究藻蓝蛋白活性肽段的结构特性及其作用机制,具有很重要的意义。本实验室后期将对T4活性肽进行进一步深入分析与鉴定工作。
3 结 论
采用改进的盐析工艺对藻蓝蛋白粗提液反复盐析,得到纯度为A620nm/A280nm=2.19的藻蓝蛋白粗提物,后经羟基磷灰石柱层析和Sephacryl S-200 HR柱层析纯化,得到纯度为A620nm/A280nm=3.89的藻蓝蛋白。
用胰蛋白酶水解得到的藻蓝蛋白酶解肽,经DEAE Sepharose FF柱层析分离并经纯化得到4个组分。其对HeLa细胞的生长抑制率分别为37.71%、24.08%、27.88%和47.04%,混合肽抑制率34.02%,藻蓝蛋白的抑制率为26.03%。组分1和4的抑制率高于混合肽,其中组分4作用效果最理想,且对正常细胞293T无抑制作用,为潜在的抗肿瘤活性肽组分。
[1]王勇, 钱峰, 钱凯先, 等. 藻蓝蛋白抗癌活性研究[J]. 浙江大学学报, 2001(6): 672-675.
[2]REDDY M C, SUBHASHINI J, MAHIPAL S V, et al. C-phycocyanin, a selective cyclooxygenase-2 inhibitor, induces apoptosis in lipopolysaccharide stimulated RAW264.7 macrophages[J]. Biochem Biophys Res Commun, 2003, 304(2): 385-392.
[3]MORCOS N C, BERNS M, HENRY W L. Phycocyanin: laser activiation cytotoxic effects and uptake in human athersclerotic plague[J]. Lasers Surg Med, 1998, 8(1): 10-17.
[4]ROY K R, ARUNASREE K M, REDDY N P, et al. Alteration of mitochondrial membrane potential by Spirulina platensis C-phycocyanin induces apoptosis in the doxorubicin-resistant human hepatocellular-carcinoma cell line HepG2[J]. Biotechnol Appl Biochem, 2007, 47 (Pt 3): 159-167.
[5]ROMAY Ch, GONZALEZ R, LEDON N, et al. C-phycocyanin: a biliprotein with antioxidant, anti-inflammatory and neuroprotective effects [J]. Curr Protein Pept Sci, 2003, 4(3): 207-216.
[6]张成武, 曾昭琪. 钝顶螺旋藻多糖和藻蓝蛋白对小鼠急性放射病的防护作用[J]. 营养学报, 1996(3): 327-330.
[7]李冰, 张学成, 高美华, 等. 钝顶螺旋藻藻蓝蛋白和多糖的抗肿瘤免疫活性研究[J]. 中国海洋大学学报, 2004(3): 396-402.
[8]RIMBAU V, CAMIS A. Protective effects of C-phycocyanin against kainic acid-induced neuronal damage in rat hippocampus[J]. Neurosci Lett, 1999, 276(2): 75-78.
[9]张少斌, 王瑾, 马镝, 等. 天然食用色素藻蓝蛋白的稳定性研究[J].食品科技, 2007(6): 169-171.
[10]张厚森, 马海乐. 钝顶螺旋藻藻蓝蛋白的稳定性试验研究[J]. 食品研究与开发, 2005, 26(3): 74-76.
[11]KOHAMA Y, SUETSUNA K, WAKO Y, et al. Angiotensin I converting enzyme inhibitors in fish water-soluble protein hydrolysates prepared by bioreactor[J]. Food Sci Technol Res, 1999, 5: 378-380.
[12]SUETSUNA K, CHEN J R. Dentification of ntihypertensive peptides from peptic digest of two microalgae, Chlorella vulgaris and Spirulina platensis[J]. Mar Biotechnol, 2001, 3(4): 305-309.
[13]GUERARD F, DUFOSSE L, BROISE D L, et al. Enzymatic hydrolysis of proteins from yellow fintuna (Thunnus albacares) wastes using Alcalase[J]. J Mol Catal B: Enzymatic, 2001, 11(4/6): 1051-1059.
[14]章诗富, 成丽兰, 徐军发, 等. 螺旋藻对实验性变应性鼻炎大鼠血清Th1/Th2细胞因子表达的影响[J]. 中华微生物学和免疫学杂志, 2004 (8): 628-629.
[15]张成武, 曾昭琪, 张媛贞, 等. 藻蓝蛋白对小鼠粒单系祖细胞生成的影响[J]. 中国海洋药物, 1996(4): 25-28.
[16]郭云良, 丁晓洁, 孙峰, 等. 藻蓝蛋白在脑缺血再灌注损伤过程中的神经保护作用机制[J]. 中国海洋药物杂志, 2006(6): 20-25.
[17]张冬梅, 刘吉东, 陈红兵, 等. 藻蓝蛋白对脑缺血再灌注后NF-κB和IL-6表达及神经细胞凋亡的影响[J]. 中国海洋药物杂志, 2005(6): 6-10.
[18]王雪青, 范敏, 杨春艳. 螺旋藻藻蓝蛋白与其酶解物的生物学功能研究[J]. 食品科学, 2008, 29(10): 433-435.
[19]杨滢滢. 藻蓝蛋白的分离纯化、酶解及其抗肿瘤活性研究[D]. 天津: 天津商业大学, 2009.
[20]黄蓓, 王广策, 李振刚. 藻蓝蛋白色素肽光动力学抗肿瘤作用的实验研究[J]. 激光生物学报, 2002(3): 194-198.
Purification and Cytotoxicity of C-Phycocyanin(C-PC) from Spirulina platensis and Its Tryptic Peptides
WANG Xue-qing,DENG Wei,YANG Jin-fang,MAO Yu-cong,SHI Zhong-ming
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
This paper deals with the separation, purification and cytotoxicity of C-phycocyanin (C-PC) from Spirulina platensis and its tryptic peptides. Repeated freezing and thawing coupled with ultrasonic treatment was used for disrupting the cell wall of Spirulina platensis. The purity (A620nm/A280nm) of C-PC was 2.19 after fractional precipitation by 28-55 g/100 mL (NH4)2SO4 and could reach 3.89 after further purification by sequential chromatography on hydroxylapatite (HA) column and Sephacryl S-200 HR gel column. The purified C-PC was hydrolyzed by trypsin at 40 ℃ for 60 min. Four peptides were obtained from the hydrolysate of C-PC by DEAE-Sepharose Fast Flow column chromatography. The cytotoxicity of C-PC and its hydrolysate as well as the 4 peptides on HeLa and 293T cells was evaluated by MTT assay. The results showed that the inhibition rates of peptide fractions I and IV, C-PC hydrolysate and C-PC on the growth of HeLa cells were 37.71%, 47.04%, 34.02% and 26.03%, respectively. Therefore, peptide fractions I and IV revealed obvious suppressive effect on the proliferation of cancer cells, while neither of them had cytotoxicity on 293T cells. Moreover, peptide fraction IV had the strongest tumor suppression activity, indicating a great potential to be developed as health-care products.
C-phycocyanin;purification;hydrolyzed peptide;cytotoxicity
R284.2;R151.41
A
1002-6630(2012)01-0136-05
2011-07-20
天津市基础研究重点项目(08JCZDJC16600);天津商业大学SRT项目(2011-57)
王雪青(1964—),女,教授,博士,主要从事天然活性物质的研究与开发。E-mail:wxqing@tjcu.edu.cn



