张 旭,尚 楠,张 宝,张志刚,尚庆茂,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业科学院蔬菜花卉研究所,北京 100081)
抗瓜果腐霉芽孢杆菌优良菌株的筛选及生物学特性
张 旭1,尚 楠1,张 宝1,张志刚2,尚庆茂2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业科学院蔬菜花卉研究所,北京 100081)
为获得具有高效抗菌活性的芽孢杆菌用于生物防治与果蔬保鲜,从柠檬、葡萄、红枣、酸奶、腐乳、豆瓣酱、哈尔滨红肠等26种食品样品中分离获得204株芽孢杆菌,通过对峙培养法,初筛得到62株抗瓜果腐霉(P. aphanidermatum)的菌株,选取其中抑菌效果明显的4株菌株,采用牛津杯扩散法经复筛得到1株显着抗瓜果腐霉的芽孢杆菌L-NM62,其发酵上清液对瓜果腐霉的抑菌圈直径达到(24.54±0.13)mm。菌株L-NM62经形态学、生理生化和16S rDNA序列分析,被鉴定为枯草芽孢杆菌L-NM62(Bacillus subtilisL-NM62)。进一步研究枯草芽孢杆菌L-NM62的生物学特性,发现该菌株的最适生长温度37℃,最适pH值7.5,最适接种量1.0%,并测定了该条件下枯草芽孢杆菌L-NM62的生长曲线。在此基础上,考察枯草芽孢杆菌L-NM62的抗菌谱,结果表明,枯草芽孢杆菌L-NM62具有广谱的抗菌活性,尤其对霉菌具有高效广谱的抗菌效果,显示出了很好的潜在开发应用前景。
枯草芽孢杆菌;瓜果腐霉;筛选;抑菌;生物学特性
瓜果腐霉(Pythium aphanidermatum)是重要的植物病原真菌之一,能引起各类农作物腐烂、猝倒等症状,在苗期发病尤为严重,常造成大量死苗。瓜果腐霉可通过其游动孢子对采后果蔬产生毒害作用[1],导致果实腐败。在贮藏期间,其菌丝可以通过病果和健康果实接触而传染,病菌侵入果皮后,在运输、贮存的过程中,遇到合适条件时,就通过水果的伤口侵入果肉,最终导致果实腐烂溃败,失去使用价值[2]。在防治采后果蔬腐败的问题上,化学农药应用历史最为悠久,且效果明显应用广泛。但由于化学保鲜剂、防腐剂在应用过程中,常引起环境污染、残留量较高[3-5]等安全性问题,因而开发高效、广谱、天然的生物抗菌剂受到广泛关注。天然抗菌剂的来源主要是从植物、动物和微生物资源中获取[6]。
生物控制中的微生物称为生防微生物[7-8],微生物相对于植物和动物,具有生长周期短、代谢产物量大、不受季节限制的特点,因而成为生物杀菌剂的研究重点。其中芽孢杆菌的抑菌物质研究相对较多,芽孢杆菌具有营养要求简单,抗逆性强,可以同时产生一种或多种抑菌物质,抑菌谱广泛和抑菌效果好的特点[9]。近年来芽孢杆菌的生防作用在国内外得到普遍认可,在控制柑橘瓜果腐霉病、绿霉病、蒂腐病[10-11]及樱桃褐腐病等果蔬病害中得到广泛应用。因此,寻找来源广泛、高效安全、抑菌谱广的芽孢杆菌,在开发安全、高效、环保的生物防腐保鲜剂中十分重要。本实验通过对峙培养法初筛,牛津杯矿散法复筛,筛选出1株对瓜果腐霉有拮抗作用的芽孢杆菌,并对其生理生化特性进行研究,以便其更好地应用于生物防治领域。
1 材料与方法
1.1 材料、菌种与培养基
样品(市售):酸奶、红糖、芒果、鱼豆腐、小米、茉莉花茶、红枣干、奶粉、油炸虾、海带、咸鸭蛋、普洱茶、蜂王浆、水果糖、葡萄渣、米酒、炒栗子、豆腐乳、酱油、柠檬、柚子、豆瓣酱、榨菜、龙眼、白菜、哈尔滨红肠。
菌种:L-NM62菌株为本实验分离筛选获得;瓜果腐霉ACCC37383(Pythium aphanidermatumACCC37383)中国农业微生物菌种保藏管理中心;黑曲霉AS3.2915 (Aspergillus nigerAS3.2915)、总状毛霉AS3.4941(Mucor racemosusAS3.4941)、黑根霉AS3.4997(Rhizopus nigricansAS3.4997)、白地霉AS2.1062(Geotrichum candidumAS2.1062)、赭曲霉AS3.3931(Aspergillus ochraceusAS3.3931)、赤散囊菌AS3.3551(Eurotium rubrumAS3.3551) 中国科学院微生物菌种保藏中心;金黄色葡萄球菌(Staphyloccocus aureus Rosenbach)、链球菌(Streptococcus)、假单胞菌(Pseudomonadaceae)、肠炎沙门氏菌(Salmonella enteritidis)、大肠杆菌(E. coli)、白色念珠菌(Monilia albican)、单增李斯特氏菌1/2a (Listeria monocytogenes1/2a)、单增李斯特氏菌4b (Listeria monocytogenes4b)、灰霉(Botrytis cinerea)本实验室保存菌种。
LB培养基、PDA培养基 北京奥博星生物技术有限责任公司。
PCR反应用各种试剂 上海英骏生物技术有限公司;其他均为分析纯。
1.2 仪器与设备
DNP-9802型电热恒温培养箱 上海精宏实验设备有限公司;SCL-1300型垂直流洁净工作台 北京赛伯乐实验仪器有限公司;TC512型PCR仪 美国Barloworld Scientific公司;TH500梯度混合器 上海青浦沪西仪器厂。
1.3 方法
1.3.1 芽孢杆菌的分离
取1g样品用无菌研钵研碎并加入到9mL无菌生理盐水中,充分振荡,80℃水浴15min,用无菌生理盐水梯度稀释后吸取0.1mL涂布LB平板,37℃培养24~72h,挑取单菌落划线纯化。对已纯化菌株革兰氏染色后镜检,确认产生芽孢后保存待用[9]。
1.3.2 抗瓜果腐霉芽孢杆菌的筛选
瓜果腐霉的培养:将瓜果腐霉接入PDA平板,28℃培养3~4d,直到菌丝布满整个平板,4℃保存待用。
抗瓜果腐霉芽孢杆菌优良菌株的初筛:将熔化的PDA培养基倒入培养皿中,待培养基凝固后,从平板中心出发画十字形,PDA平板的中央掐块接入瓜果腐霉菌饼(直径5mm),距菌饼中心25mm处点种芽孢杆菌菌株,每个实验设3个重复,37℃培养8h后,28℃培养3d,观察芽孢杆菌菌落周围是否存在抑菌圈并用十字测量法测量芽孢杆菌菌落直径及其产生的抑菌圈直径[12]。
抗瓜果腐霉芽孢杆菌优良菌株的复筛:将初筛出的抗菌效果好的芽孢杆菌菌株,接种于装有30mL LB液体培养基的250mL三角瓶中,置于恒温振荡器中,28℃、140r/min培养48h。发酵液经10000r/min离心15min取得上清液,测定该发酵上清液的抗菌活性。
发酵液抗菌活性的测定:采用杯碟法,用双层平板。底层:在无菌平皿中加入5mL PDA培养基,静置冷却凝固。上层:将PDA培养基分装成15mL/管灭菌,熔化后倒入无菌平皿中,待培养基凝固后,瓜果腐霉菌饼(直径5mm)掐块接于培养皿中心,从平板中心出发画十字形,距菌饼中心25mm放置牛津杯。每个牛津杯中加入100μL无菌滤液及1%的氯霉素20μL,超净工作台中放置30min左右吹干,28℃培养72h后十字交叉法测量抑菌圈直径,以未接种的培养基上清液作为空白对照,每次处理3个重复[13]。
1.3.3 目标菌株的鉴定
形态学鉴定:挑取少量目标菌株在LB平板上划线,28℃培养20h后观察单菌落形态并镜检。继续培养至24h后进行芽孢染色并镜检。
生理生化鉴定:主要包括接触酶实验、甲基红实验、V-P实验、淀粉水解、海藻酸钠降解、柠檬酸盐利用、Tween-80降解、明胶水解、酵母细胞溶解、卵磷脂降解、耐盐性、酪氨酸水解、丙酸利用、葡萄糖、阿拉伯糖、木糖、甘露醇等实验。
16S rDNA鉴定:用于PCR扩增的引物为通用引物,正向引物16Sf:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物16Sr:5'-AAGGAGGTGATCCAGCCGCA-3'。PCR反应体系(25μL)为:10×Buffer 2.5μL、10mmol/L dNTP 2.0μL、10μmol/L引物各2.5μL、Taq酶0.25μL、模板1.0μL、ddH2O 14.25μL,空白不加模板。PCR反应条件为:94℃变性5min;94℃变性30s、54℃引物复性1min、72℃延伸2min,35个循环;最后72℃延伸10min。所得PCR产物用琼脂糖凝胶电泳在标准条件下进行检测后送至北京市擎科生物技术有限公司测序。所得序列利用BLAST程序在GenBank基因库中进行比对,选取相似性较高菌株的16S rDNA序列,用MEGA 3.1软件构建系统发育树。
1.3.4 菌株L-NM62生理特性的研究
最适生长温度确定:将目标菌株L-NM62,接种至含50mL LB培养基的300mL三角瓶中,轻轻振荡,使菌体分布均匀,置于不同发酵温度(20、24、28、32、37、42、45℃),140r/min摇床培养24h,离心收集上清液,测600nm波长处的OD值。
最适pH值测定:将目标菌株L-NM62,分别接种至含不同pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)LB液体培养基中,在最适生长温度140r/min摇床培养24h,取上清液测OD值。
最适接种量的确定:目标菌株采用不同接种量(0.05%、0.10%、0.50%、1.00%、2.00%、3.00%、4.00%),在最适生长温度和pH值条件下,140r/min摇床培养24h,取上清液测600nm波长处的OD值。
最适条件下生长曲线的测定:将目标菌株L-NM62采用最适生长温度、pH值及接种量至含50mL LB培养基的300mL三角瓶中,置于140r/min摇床中振荡培养。每隔一段时间取样,以未接种的液体培养基作对照,测定OD600nm值和发酵液pH值,然后以培养时间为横坐标,OD600nm值及pH值为纵坐标,绘制曲线。
抗菌谱的测定:采用倾注平板法接入各种受试的细菌,然后将芽孢杆菌菌株点种在平板表面,37℃培养,观察芽孢杆菌菌落周围是否存在抑菌圈,并采用十字测量法测量芽孢杆菌菌落直径及其产生的抑菌圈直径。将熔化的PDA培养基倒入培养皿中,待培养基凝固后,从平板中心出发画十字形,PDA平板的中央掐块接入受试的各种霉菌菌饼(直径5mm),距菌饼中心25mm处点种芽孢杆菌株,每个实验设3个重复,28℃培养3d,观察拮抗作用是否存在并测量菌落大小。由于霉菌菌丝生长使抑菌圈形状不规则,因此使用抑菌率衡量抑菌效果。以单独接种各细菌、霉菌的平板作为对照。每处理3次重复。按下式计算抑制率。
2 结果与分析
2.1 芽孢杆菌的分离、筛选
采用稀释倾注法从26种不同食品样品中分离获得204株芽孢杆菌,并分别进行斜面保藏和沙土管保藏。通过对峙培养法,从分离的204株芽孢杆菌,初筛出62株有清晰透明圈形成的芽孢杆菌。通过计算抑菌圈直径与芽孢杆菌菌落直径的比值来确定抑菌效果,结果获得14株抑菌效果显着的菌株见表1,部分初筛效果见图1。

图1 部分芽孢杆菌菌株产生的抑菌结果Fig.1 Inhibitory zone of part of anti-fungal Bacillus spp. to P. aphanidermatum
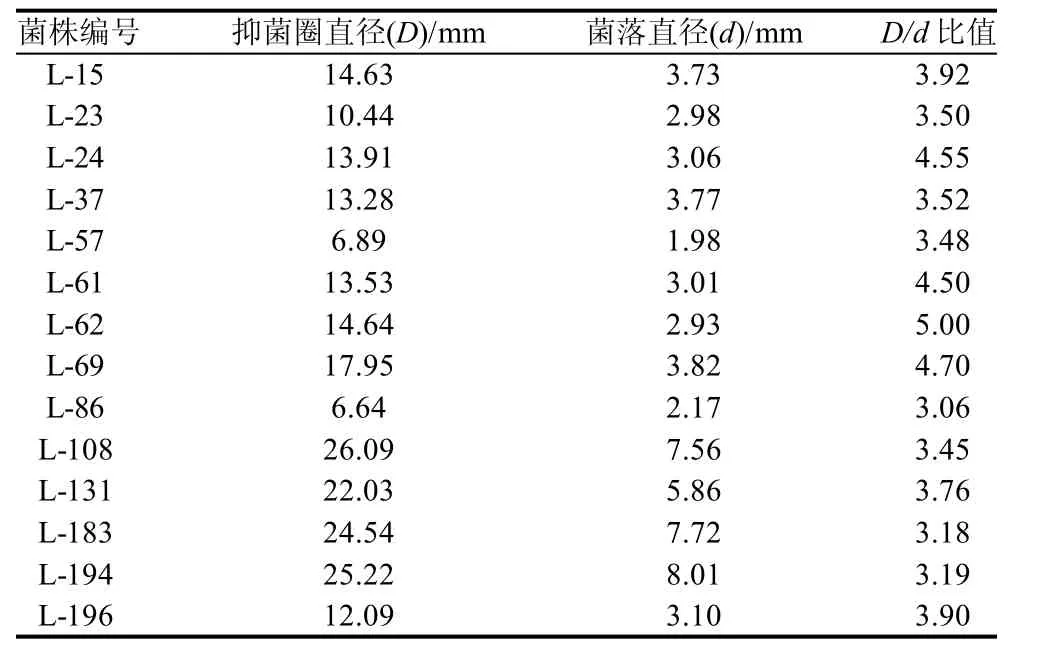
表1 初筛中有拮抗效果的菌株Table 1 Bacillus spp. with high antifungal activity to P. aphanidermatum by the first screening
将初筛得到的抑菌效果明显的4株菌株(L-24、L-61、L-62、L-69)进行液体培养,离心取其上清液,采用牛津杯法测其发酵离心上清液的抗菌效果,发现4株芽孢杆菌发酵液都有抑菌圈产生,L-61、L-69的抑菌效果较差,抑菌圈直径分别为(15.34±0.32)mm、(21.59±0.22)mm,L-24抑菌圈直径为(22.04±0.29)mm,L-62抑菌效果明显,抑菌圈直径达到(24.54±0.13)mm,因此确定其为目标菌株,并命名为L-NM62。
2.2 目标菌株的鉴定
2.2.1 菌落形态学鉴定结果
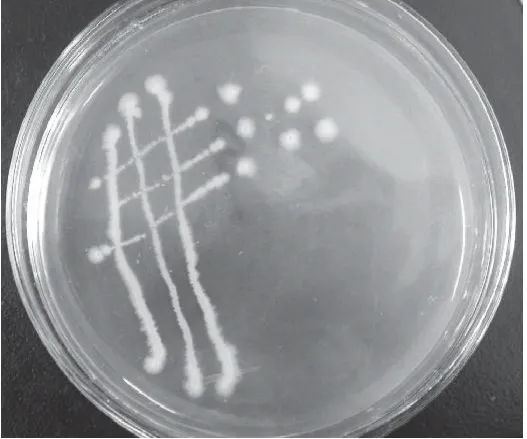
图2 菌株L-NM62菌落形态图(10×100)Fig.2 The morphological characteristic of L-NM62(10×100)
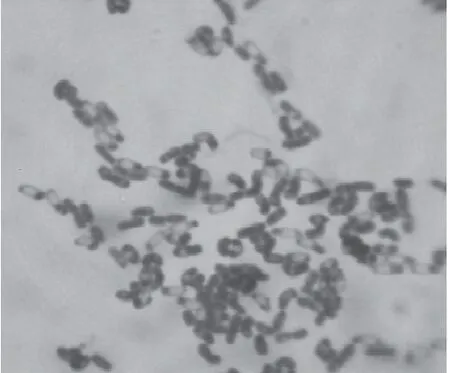
图3 菌株L-NM62菌体形态图Fig.3 The colony characteristic of L-NM62
菌株L-NM62在LB固体培养基中培养24h后发现其菌落形态不规则,近圆,菌落表面褶皱,边缘波状,不透明,湿黏(图2)。显微镜下菌株L-NM62呈短杆状,芽孢形状为椭圆形,膨大,近端生(图3)。
2.2.2 菌株L-NM62的生理生化鉴定
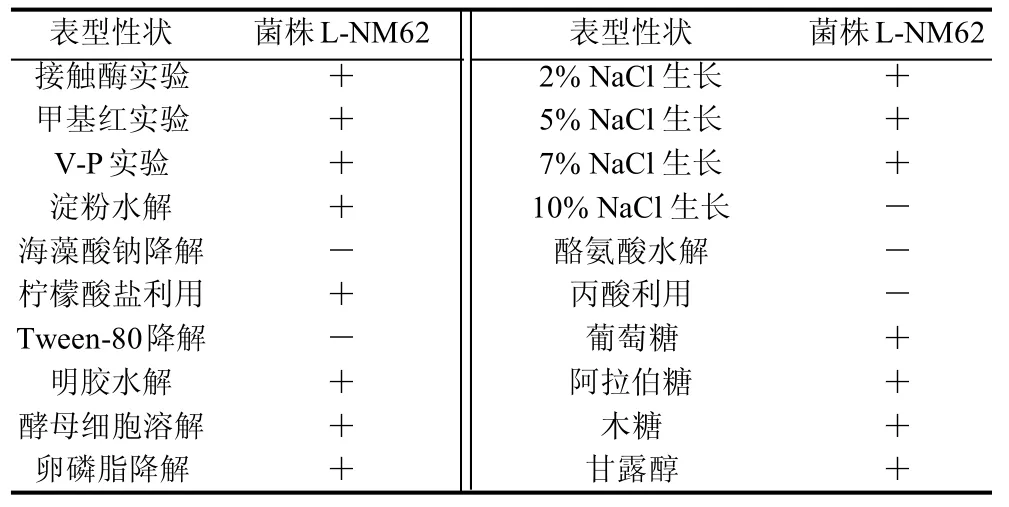
表2 菌株L-NM62的生理生化鉴定结果Table 2 Physiological and biochemical characteristics of L-NM62
从表2可以看出,该菌株接触酶反应、甲基红实验、明胶水解、卵磷脂水解成阳性,能够利用葡萄糖、淀粉,不能在10% NaCl溶液中生长但能够在7% NaCl溶液中生长,初步将菌株L-NM62鉴定为枯草芽孢杆菌[14]。
2.2.3 16S rDNA 同源性的鉴定
进一步采用分子生物学手段对L-NM62菌株进行鉴定,其染色体DNA用PCR扩增出单一条带,PCR产物回收纯化后经DNA测序后与GenBank上序列进行比对发现,菌株L-NM62与枯草芽孢杆菌同源性最高,达95%。使用MEGA 3.1软件建立系统发育树(图4)发现,菌株L-NM62与枯草芽孢杆菌(Bacillus subtilis)处于同一发育水平上。
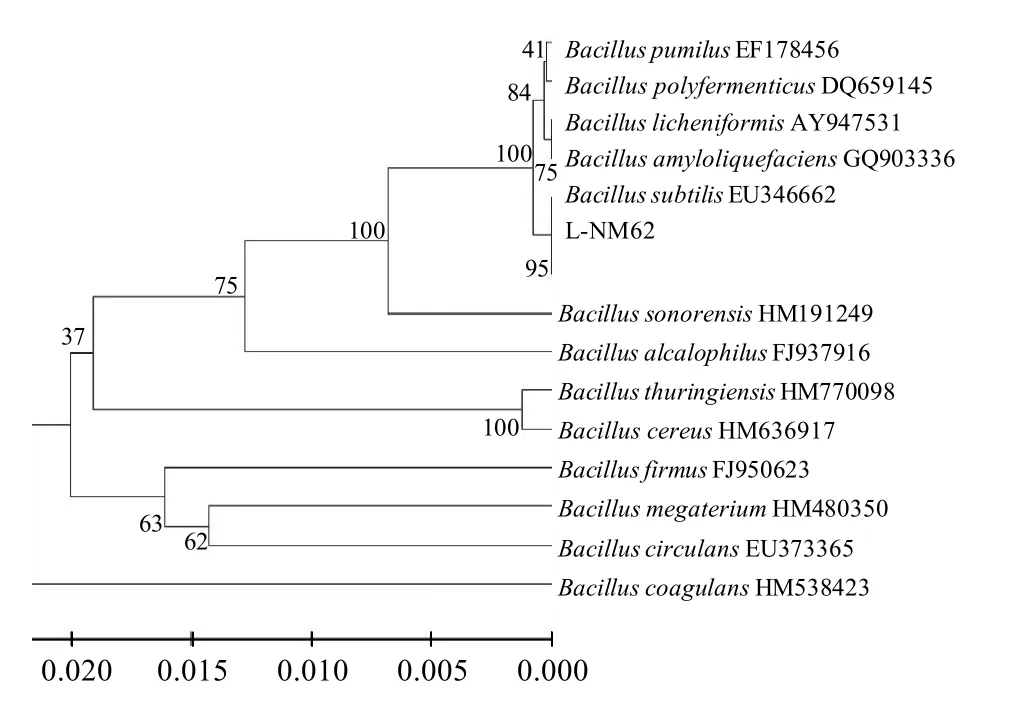
图4 菌株L-NM62的16S rDNAFig.4 Phylogenetic tree based on the 16S rDNA sequence of strain L-NM62
根据表型、生理生化以及16S rDNA鉴定结果,可以判定菌株L-NM62为枯草芽孢杆菌,并将其命名为枯草芽孢杆菌L-NM62(Bacillus subtilisL-NM62)。
2.3 菌株L-NM62的生理特性研究
2.3.1 最适生长温度的确定
由图5可见,Bacillus subtilisL-NM62菌株在20~37℃之间,随温度的升高OD值逐渐增大,37℃达到最大,超过37℃,Bacillus subtilisL-NM62菌株OD值呈现下降趋势,最终确定其最适生长温度为37℃。
2.3.2 最适生长pH值的确定
在37℃测定不同pH值条件下Bacillus subtilisL-NM62生长的OD值,结果见图6。pH值为7.5时OD值达到最大,故将pH值为7.5确定为该菌体的最适生长pH值。2.3.3 最适接种量的确定
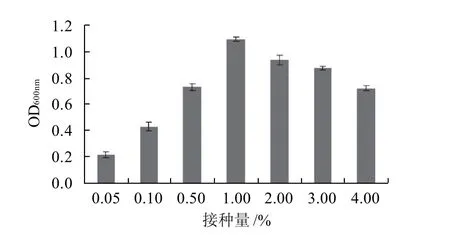
图7 最适接种量的确定Fig.7 Identification of optimal inoculums concentration
在菌株最适生长温度37℃,起始pH7.5的条件下,测定Bacillus subtilisL-NM62在不同接种量下生长的OD值,结果见图7。Bacillus subtilisL-NM62菌株在0.05%~0.50%之间,随着接种量的增大OD值增大,在接种量1.00%处达到最大,故将1.00%作为最适接种量,超过最适接种量,菌株OD值随着接种量的增大而减小。
2.3.4 最适生长条件下目标菌株的生长曲线
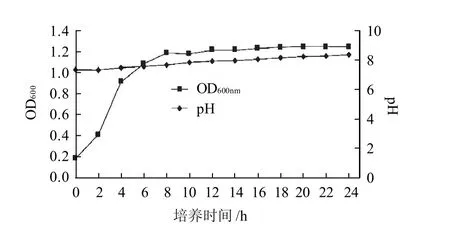
图8 最适条件下枯草芽孢杆菌L-NM62的生长曲线Fig.8 Growth curve of L-NM62 under the optimal conditions
由图8可知,Bacillus subtilisL-NM62在0~8h生长缓慢,随后迅速生长进入对数生长期,20h后生长趋于平稳到达稳定期。同时也可以看出,该菌株稳定期较长。Bacillus subtilisL-NM62在培养过程中,pH值基本稳定,由于胺类物质的分解造成,pH值略有上升趋势。
2.3.5 抗菌谱的测定
采用对峙培养法进一步考察Bacillus subtilisL-NM62对15株常见有害细菌与真菌的抗菌效果,结果如表3所示。
从表3可以明显看出,Bacillus subtilisL-NM62表现出了广谱的抗菌活性,不仅对金黄色葡萄球菌、假单胞菌等细菌具有一定的抑制作用,而且对真菌尤其是病原霉菌表现出了高效的抗菌效果,显示出了很好的开发应用潜力。
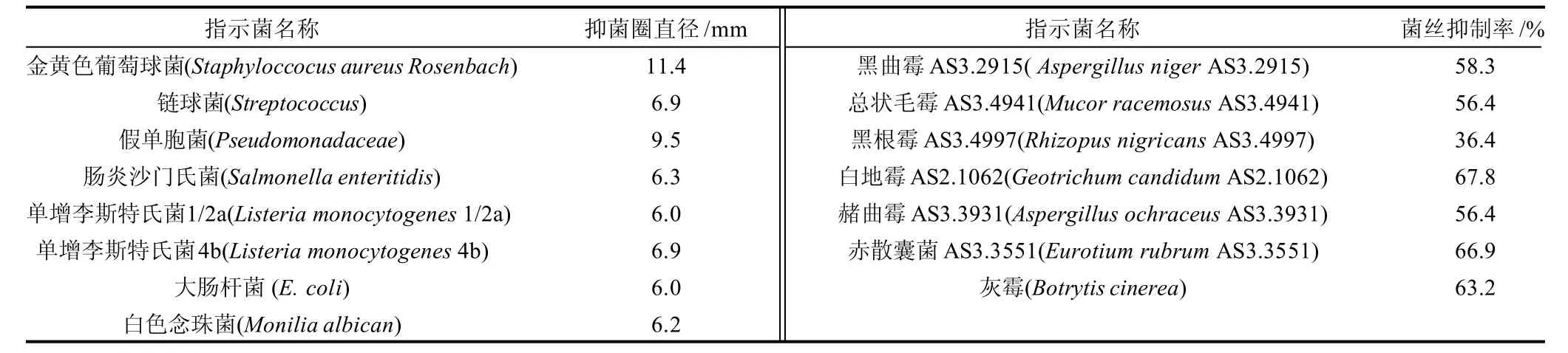
表3 Bacillus subtilis L-NM62的抗菌谱实验结果Table 3 The antibacterial and anti-fungal spectrum of Bacillus subtilis L-NM62
3 讨 论
芽孢杆菌是一群好氧或兼性厌氧、产芽孢的G+杆菌的总称[15]。其典型特点是能产生耐热抗逆的芽孢,因而有利于生防菌剂的生产、剂型加工及在环境中存活与繁殖。国外关于芽孢杆菌对植物病害的防治已做了大量工作,很多菌株已成功用于农业生产。如芽孢杆菌QST713、GBO3、MBI600、FZB24等菌株作为生防菌已得到了美国国家坏境保护局(Environmental Protenction Agenay,EPA)商品化或有限商品化生产应用的许可。其中应用最广泛的是枯草芽孢杆菌[16-19]、纳豆芽孢杆菌、地衣芽孢杆菌及腊状芽孢杆菌等。
已有研究[12]表明,枯芽孢杆菌所产抗菌物质大部分是多肽,主要抑制革兰氏阳性菌,有些还能抑制革兰氏阴性菌、霉菌和酵母菌。芽孢杆菌产生抗菌物质的途径分为核糖体和非核糖体合成两种。核糖体途径产生的抗菌物质包括细菌素与类细菌素、酶类和活性蛋白3类;非核糖体途径产生的抗菌物质包括脂肽和多肽两大类,其中脂肽又包括Surfactin、Iturin和Fengycin 3类[13,20]。本研究分离获得的枯草芽孢杆菌产生的抗菌物质究竟是属于哪类物质还需进一步研究。本实验室将在现有研究基础上,进一步开展Bacillus subtilisL-NM62所产抗菌物质的分离纯化,确定其抗菌类型,研究其理化与应用特性,分析其空间结构,探讨其抗菌机理,为该菌株及其所产抗菌物质的应用提供理论依据及前期工作积累。
本实验选择多种食品作为原料来筛选抗瓜果腐霉的优良芽孢杆菌,主要是考虑到存在于高渗及干燥食品中筛选出芽孢杆菌的概率较大,且芽孢杆菌可能胁迫不良环境的能力更强。从本实验结果可以看出,经初筛后的芽孢杆菌有62株对瓜果腐霉显现出了明显的拮抗作用,而经复筛后确定的目标菌株L-NM62,其菌体细胞及发酵上清液均对瓜果腐霉表现出了强烈的抑制效果。同时通过对目标菌株生物学特性研究还发现,该菌有较为广谱的抗菌活性,不仅对常见的食品腐败细菌有抑制作用,尤其是对真菌中的黑根霉、总状毛霉、白地霉、赤散囊菌、灰霉等均有显着的抑菌效果,显示出了很好的潜在价值和应用前景。本实验所筛选出来的目标菌株L-NM62其发酵上清液对瓜果腐霉具有高效的抑制作用,同时具有较广抗菌范围,尤其表现出对一些真菌有较为强烈的抑制作用,因而,在今后使用目标菌株L-NM62进行生物防治的过程中可以同时对多种致病菌产生抑菌效果,增加其应用空间及开发价值。
4 结 论
本实验从26个食品样品中分离获得204株芽孢杆菌,通过对峙培养法初筛、牛津杯扩散法复筛,最终筛选出一株芽孢杆菌L-NM62,其发酵上清液对瓜果腐霉的抑菌圈直径达到(24.54±0.13)mm,通过形态学、生理生化指标测定及16S rDNA 序列分析,最终将该菌株鉴定为枯草芽孢杆菌L-NM62(Bacillus subtilisL-NM62)。通过对其生物学特性研究发现,Bacillus subtilisL-NM62最适生长温度为37℃,最适生长pH值为7.5,最适接种量为1%,且该菌表现出了广谱的抗菌活性,不仅对金黄色葡萄球菌、假单胞菌等细菌具有一定的抑制作用,而且对真菌尤其是病原霉菌表现出了高效的抗菌效果,具有很好的开发与应用潜力。
[1] 贺水山, 张炳欣, 葛起新. 瓜果腐霉游动孢子对番茄和秋海棠侵染过程的研究[J]. 植物病理学报, 1992, 20(2): 145-148.
[2] 潘金菊, 于婷. 生防菌BMP-11对瓜果腐霉病菌的抑制活性及其鉴定[J]. 植物保护学, 2008, 35(4): 311-316.
[3] DEKKER J, GEORGOPOULOS S G. Fungicide agricultural publishing and documentation resistance in crop protection[J]. Transactions of the British Mycological Society, 1983, 81(1): 188-191.
[4] GEORGOPOULOS S G, SKYLAKAKIS G. Genetic variability in the fungi and the problem of fungicide resistance[J]. Crop Protection, 1986, 5(5): 299-305.
[5] LATORRE B A, SPADARO I, RIOJA M E. Occurrence of resistant strains ofBotrytis cinereato anilinopyrimidine fungicides in table grapes in Chile[J]. Crop Protection, 2002, 21(10): 957-961.
[6] 夏金兰, 王春. 抗菌剂及其抗菌机理[J]. 中南大学学报:自然科学版, 2004, 35(1): 31-38.
[7] 肖春宏. 微生物源抗真菌农用抗生素的研究进展[J]. 科技信息: 学术版, 2008(19): 73-74.
[8] 余凤玉, 李振华, 曾会才. 抗真菌农用抗生素的研究进展[J]. 热带农业科学, 2005, 25(1): 60-65.
[9] 黄继翔. 抑扩展青霉芽孢杆菌的筛选鉴定及抑菌物质研究[D]. 北京:中国农业大学, 2006.
[10] 黄曦, 许兰兰, 黄荣韶. 枯草芽孢杆菌在抑制植物病原菌中的研究进展[J]. 生物技术通报, 2010(1): 24-29.
[11] ABRAHA O, ABRAHAM M D. Isolation andin vivoscreening of yeast andBacillus antagonistsfor the control ofPenicillium digitatumof citrus fruit[J]. Biological Control, 2010, 53(1): 32-38.
[12] 齐东梅. 药食源芽孢杆菌的分类鉴定及枯草芽孢杆菌H110抑菌特性研究[D]. 北京: 中国农业大学, 2005.
[13] 赵一楠. 抗青霉芽孢杆菌的筛选及其抑菌物质的特性研究[D]. 北京:中国农业大学, 2010.
[14] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 67-69.
[15] 张中义. 植物病原真菌学[M]. 四川: 四川科学技术出版社, 1988: 71-73.
[16] 程洪斌, 刘哓桥, 陈红漫. 枯草芽孢杆菌防治植物真菌病害研究进展[J]. 上海农业学报, 2006, 22(1): 109-112.
[17] CELIA M, SONIA S F. Optimisation of physical factors on the production of active metabolites byBacillus subtilis355 against wood surface contaminant fungi[J]. International Biodeterioration & Biodegradation, 2005, 55(4): 261-269.
[18] WICHITRA L, PUNPEN H. Growth inhibitory properties ofBacillus subtilisstrains and their metabolites against the green mold pathogen (Penicillium digitatumSacc.) of citrus fruit[J]. Postharvest Biology and Technology, 2008, 48(1): 113-121.
[19] BESRAT T D, LISE K.Bacillus subtilisattachment, colonization, and survival on avocado flowers and its mode of action on stem-end rot pathogens[J]. Biological Control, 2006, 37(1): 68-74.
[20] 吴艳, 闫豫君, 赵思峰. 组合芽孢杆菌抑菌物质特性及其抑菌效果研究[J]. 西北农业学报, 2007, 16(5): 266-270.
Screening and Biological Characteristics ofBacillussp. with High Anti-fungal activity againstPythium aphanidermatum
ZHANG Xu1,SHANG Nan1,ZHANG Bao1,ZHANG Zhi-gang2,SHANG Qing-mao2,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China) 2. Institute of Vegetables and Flowers, Chinese Academy of Agricultural Science, Beijing 100081, China)
Pythium aphanidermatumis known as an important plant pathogenic fungus that can cause various types of crops rot and damping off, as well as results in spoilage of fruits and vegetables, thus leading to great loss of agricultural production and food industry. In order to obtain spore-forming bacteria with anti-fungal activity for fruit and vegetable preservation and biological control, we have screened 204 strains of spore-forming bacteria isolated from 26 kinds of foods, such as lemon, grape, Chinese date, yogurt, fermented bean curd, Harbin sausage, bean paste and other food samples. Totally 62 strains of sporeforming bacteria were assessed by confrontation culture tests to reveal strong anti-fungal activity againstP.aphanidermatum. The fermentation supernatants of 4 strains with stronger anti-fungal activity through Oxford cup plate assay method were tested for their anti-fungal activity, and L-NM62 revealed the strongest anti-fungal activity againstP.aphanidermatum. The inhibition zone of cell free supernatant was (24.54 ± 0.13) mm in diameter. According to the characteristics of morphology, physiology and biochemistry tests, and the comparison of 16S rDNA sequence, strain L-NM62 was identified asBacillus subtilis. Further study of L-NM62 on physiology characteristics showed that the optimal growth temperature, pH and inoculums were 37 ℃, 7.5 and 1.0%. Under these optimal conditions, L-NM62 had a wide anti-fungal and antibacterial activity and presented a potential prospect.
Bacillus subtilis;Pythium aphanidermatum;screening;anti-fungal activity;biological characteristics
Q936
A
1002-6630(2012)05-0138-06
2011-06-30
国家自然科学基金项目(31172001);北京市大学生科学研究与创业行动计划项目
张旭(1990—),女,本科生,主要从事益生菌研究。E-mail:hangxu19901218@163.com
*通信作者:尚庆茂(1965—),男,研究员,博士,主要从事蔬菜工厂化育苗技术研究。E-mail:shangqm08@yahoo.com.cn



