赵玉红,金秀明
(东北林业大学林学院,黑龙江 哈尔滨 150040)
梅花鹿鹿茸胶原的理化特性研究
赵玉红,金秀明
(东北林业大学林学院,黑龙江 哈尔滨 150040)
对胃蛋白酶法在酸性条件下制备的梅花鹿鹿茸胶原的理化性质进行研究。通过紫外扫描(UV)、傅里叶红外光谱(FTIR)、氨基酸组成测定、聚丙烯酰胺凝胶电泳(SDS-PAGE)和示差量热扫描(DSC)等方法对其理化性质进行分析。紫外扫描图谱可知,胶原纯度较高,在230nm波长处有强吸收峰;红外光谱表明其酰胺A、酰胺B、酰胺Ⅰ谱带等主要吸收峰与Ⅰ型胶原标品一致,具有三螺旋结构;凝胶电泳表明鹿茸胶原含有α1、α2和β链,符合Ⅰ型胶原特征;氨基酸分析说明其具有典型胶原的氨基酸组成;示差量热扫描测得其热收缩温度(ts)为84.05℃。梅花鹿鹿茸具有典型的I型胶原的理化特性。
梅花鹿鹿茸;胶原;大分子蛋白;结构特性;理化性质
胶原是一类富有多样性和组织分布特异性的蛋白质的总称[1],是一种纤维状、大分子结构蛋白,由3条肽链组成螺旋形纤维状,主要分布于动物的皮肤、骨骼、肌腱、角膜等一些器官中。不同种族、不同组织中的胶原有着不同的化学组成和构成,目前,人们已发现26种不同类型的胶原,各类型间结构差异主要在于多肽链的初级结构不同。胶原具有重要的生理功能,起着支撑器官、保护机体,维持机体完整性的作用[2],并与哺乳动物肌肉韧性有关[3]。国内外对胶原的利用主要分为两类:一方面,胶原具有独特的纤维性能,可用于相纸底片、纺织、造纸等[4];另一方面,由于胶原具有良好的生物相容性、生物降解性,低的免疫原性、保湿活性以及大规模生产的可行性优点,正在成为医药、化妆品和食品业的新宠[5]。由于胶原具有广阔的市场前景,近年来对胶原性质的研究也日趋增多,其中主要是对海产品中胶原特性的研究[6-8],而对鹿茸中胶原的研究较少。鹿茸是梅花鹿或马鹿尚未骨化的幼角,含有胶原、多糖、磷脂等多种生物活性物质,具有广泛的生理功能和药理作用。对鹿茸胶原理化性质的研究局限于李银清[9]采用醇法提取鹿茸胶原,并研究其部分理化性质,但未对其结构及热稳定性等性质进行分析。本实验以梅花鹿鹿茸为原料,研究胃蛋白酶法提取的胶原的紫外光谱、红外光谱、氨基酸组成、分子质量和热收缩温度等结构特性,以期为深入研究和利用鹿茸胶原提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
梅花鹿鹿茸 黑龙江大庄园集团。
胃蛋白酶、MD-44透析袋要、标准Ⅰ型胶原蛋白美国Sigma公司;冰乙酸、NaCl均为分析纯。
PowerPac Basic电泳仪 美国Bio-Rad公司;TGL-20M低温离心机 湖南凯达科学仪器有限公司;ALPHA1-2真空冷冻干燥机 德国Christ公司;L-8800氨基酸自动分析仪 日本日立公司;IR 560 E.S.P傅里叶变换红外光谱仪 美国Nicolet公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;Pyris 6热流型示差扫描量热仪 美国Perkin Elmer公司。
1.2 方法
1.2.1 梅花鹿鹿茸胶原的提取纯化
将鲜鹿茸去皮,脱血后,切成2~3mm见方的小块,乙醚浸泡处理2h进行初步脱脂。脱脂后冷冻干燥24h,粉碎,过40目筛。取一定量鹿茸粉末,用10倍体积的0.1mol/L NaOH溶液 4℃浸泡24h,蒸馏水洗至中性。固形物溶于0.5mol/L的醋酸和一定量胃蛋白酶中,4℃条件下提取72h,7600×g低温离心20min,上清液于4℃保存备用。所得沉淀重复提取两次。合并上清液,即为鹿茸胶原粗提液。向胶原粗提液中加入固体氯化钠至其浓度为2mol/L,盐析过夜,10000r/min低温离心30min,弃去上清液,将析出的胶原液移入透析袋中,透析4 8 h。冷冻干燥,得梅花鹿鹿茸胶原。
1.2.2 紫外光谱分析
取一定量的胶原用0.5mol/L的醋酸溶液溶解,配制成胶原溶液。另取0.5mol/L的醋酸溶液作为对照。两种溶液分别加入1cm的石英比色皿后进行紫外分光光度测定,选择波长范围为200~400nm,进行扫描。
1.2.3 红外光谱分析
红外光谱可以检测出胶原特有的基团吸收峰,已成为胶原分析中一种重要方法。取纯化后样品1~2mg,与一定量KBr置于研钵中,研磨成粉末状后装样,手动压片,用傅里叶变换红外光谱仪在400~4000cm-1区间扫描,分辨率设置为4cm-1,扫描40次。
1.2.4 氨基酸分析
采用氨基酸自动分析仪,由哈尔滨市农业部谷物及制品质量监督测试中心测定。检验方法:采用GB/T 5009.124—2003《食品中氨基酸的测定》。
1.2.5 SDS-PAGE分析
参考Laemmli[10]的方法,采用垂直电泳。10%分离胶,5%浓缩胶,考马斯亮蓝R250染色。上样量30μL。
1.2.6 热收缩温度(ts)测定
采用示差扫描量热仪(differential scanning calorimeter,DSC)测定。称取6mg鹿茸胶原放入样品池,放置DSC仪器的样品支持器上,调整好仪器,开始实验,并记录结果。采用的测定温度范围为20~200℃,20℃保持1min,从20℃升温到200℃,升温速率为5℃/min,200℃保持1min,空白用空的样品池作为参照。
2 结果与分析
2.1 鹿茸胶原紫外光谱分析
由于大多数蛋白质中存在酪氨酸和苯丙氨酸,使其在280nm波长附近有吸收峰。而所有蛋白质由于多肽的存在,在230nm波长附近有吸收峰。胶原中几乎不含酪氨酸和苯丙氨酸[11],因此,纯胶原在280nm波长附近无吸收峰,在230nm波长附近有强吸收峰。据此也可检测胶原的纯度。

图1 鹿茸胶原紫外吸收光谱Fig.1 UV spectrum of antler collagen
由图1可知,酶法提取鹿茸胶原在230nm波长处有最大吸收峰,符合胶原紫外吸收特征[12]。在280nm波长处无明显吸收峰,说明胶原纯度较高。前期对鹿骨胶原特性进行研究,发现其最大吸收峰也在230nm波长处[13],与本实验结果相同;高金龙[14]研究山羊皮中胶原的最大吸收峰在233nm波长处,其差异可能是由于提取方法和原料氨基酸组成不同造成的。
2.2 鹿茸胶原红外光谱分析

图2 鹿茸胶原与标准Ⅰ型胶原红外图谱Fig.2 FT-IR spectra of antler collagen and type Ⅰ collagen
由图2 可知,提取的鹿茸胶原与标准Ⅰ型胶原红外图谱基本一致。游离的N-H伸缩振动在3400~3440cm-1,而当N-H参与形成氢键,其振动频率降低[15]。因此,鹿茸胶原3424cm-1是由酰胺A带N-H伸缩振动形成的特征吸收峰,表明存在氢键,证明有三股螺旋结构的存在。酰胺B出现在2935cm-1,是由C-N伸缩振动引起的特征吸收峰。1658cm-1是由酰胺Ⅰ带C=O伸缩振动形成的特征吸收峰,它是多肽二级结构的一个灵敏指标。1558cm-1是酰胺Ⅱ带的特征吸收峰,它是由N-H弯曲振动和C-H伸缩振动引起的。1157cm-1是C-N-C振动或C-O伸缩振动引起的特征吸收峰。红外图谱证明,提取的鹿茸胶原为Ⅰ型胶原,且保持良好的结构。
2.3 氨基酸组成分析

表1 鹿茸胶原的氨基酸组成Table 1 Amino acid composition of antler collagen ‰
由表1可知,鹿茸胶原的氨基酸组成中甘氨酸含量最高,约占氨基酸总量的1/3,丙氨酸和脯氨酸含量也较高,酪氨酸、蛋氨酸和组氨酸含量较低,脯氨酸和羟脯氨酸含量为233,高于Su Xiurong等[16]报道的标准I型胶原标品(215残基/1000总残基)。羟脯氨酸与脯氨酸含量之比为0.75,符合Ⅰ型胶原特征[17]。
2.4 SDS-PAGE电泳分析
由图3可知,胶原主要含有β链及两条α链,即α1和α2,说明鹿茸胶原是Ⅰ型胶原。β链分子质量在200kD以上,α1链分子质量约为170kD,α2链分子质量约为160kD。这与之前研究的鹿骨胶原分子质量有些差异[13],可能由于原料来源不同,其胶原分子质量大小也不相同。图中几乎不含其他杂带,表明提取的鹿茸胶原纯度较高。
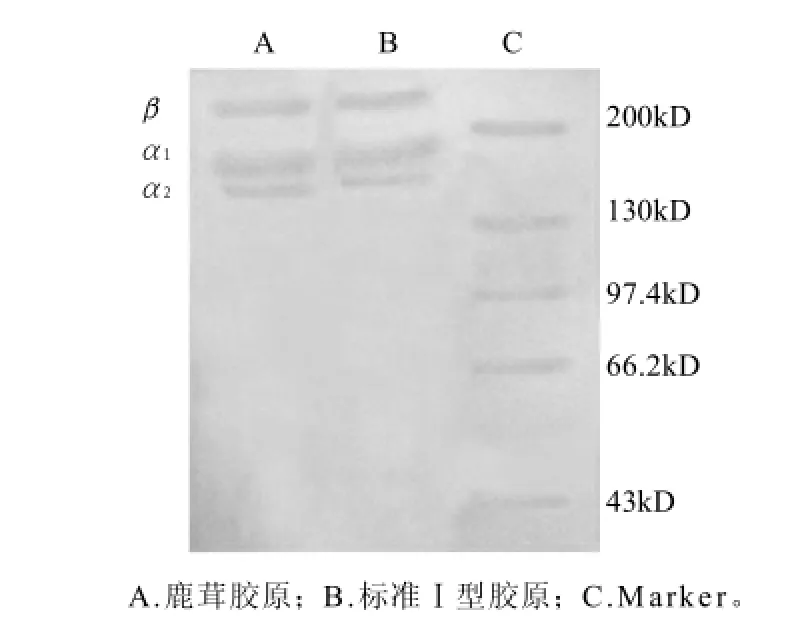
图3 鹿茸胶原电泳图谱Fig.3 SDS-PAGE of antler collagen
2.5 热收缩温度测定
胶原热收缩温度是指蛋白质纤维收缩至1/3长度时的温度。在收缩过程中,胶原结构发生改变,氢键断裂,天然的三螺旋结构被破坏[18]。采用Pyris6.0软件进行数据记录和处理得到的DSC曲线,峰值点温度为热收缩温度,曲线形成的峰包括的面积理论上为蛋白质变性所吸收能量。鹿茸胶原热收缩温度曲线如图4所示。

图4 鹿茸胶原热收缩温度曲线Fig.4 Thermal transition curve of antler collagen
由图4可知,鹿茸胶原tS为84.05℃,高于一般脊椎动物胶原的tS61.67℃[19]。热收缩温度的差异主要与不同物种中胶原亚氨基酸(脯氨酸和羟脯氨酸)含量、身体温度及环境温度有关[20]。亚氨基酸的吡咯环对二级结构有固定化作用,以及羟脯氨酸的羟基所形成的氢键对胶原螺旋的稳定化起着很大作用[21]。
3 结 论
梅花鹿鹿茸胶原在230nm波长处具有强特征峰;其红外光谱吸收峰与Ⅰ型胶原一致;有典型的胶原的氨基酸组成;胶原分子质量较高且分子质量分布与I型胶原一致。鹿茸胶原的热收缩温度较高。本实验提取的鹿茸胶原具有较完整的三螺旋结构,具有典型的I型胶原的理化特性。
[1]卓素珍. 鮟鱇鱼皮胶原蛋白的性质及应用研究[D]. 杭州: 浙江工商大学, 2009.
[2]GELSE K, PO..SCHL E, AIGNER T. Collagen-structure, function, and biosynthesis[J]. Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546.
[3]KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterisation of collagen from the skin of brownbanded bamboo shark(Chiloscyllium puncatatum)[J]. Food Chemistry, 2010, 199(4): 1519-1526.
[4]肖玉良, 郑连英, 韩俊芬, 等. 胶原蛋白研究进展[J]. 泰山医学院学报, 2005, 26(5): 493-496.
[5]王孟津, 汪海波, 桂萌, 等. 草鱼鱼鳞胶原蛋白的提取及理化性质研究[J]. 食品科学, 2009, 30(18): 113-116.
[6]杨贤庆, 张帅, 郝淑贤, 等. 罗非鱼皮胶原蛋白的提取条件优化及性质[J]. 食品科学, 2009, 30(16): 106-110.
[7]NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream(Nemipterus heχodon): characteristics and effect of pepsin hydrolysis[J]. Food Chemistry, 2011, 125(2): 500-507.
[8]崔凤霞, 薛长湖, 李兆杰, 等. 仿刺参胶原蛋白的提取及理化性质[J].水产学报, 2006, 30(4): 549-553.
[9]李银清. 梅花鹿茸胶原的分离提取及活性研究[D]. 长春: 长春中医药大学, 2007.
[10]LAEMMLI U K. Cleavage of structural proteins during assembly of the head of the bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[11]CUI Fengxia, XUE Changhu, LI Zhaojie, et al. Characterization and subunit composition of collagen from the body wall of sea cucumber Stichopus japonicus[J]. Food Chemistry, 2007, 100(3): 1120-1125.
[12]LIN Yungkai, LIU Dengcheng. Comparison of physical-chemical properties of typeⅠcollagen from different species[J]. Food Chemistry, 2006, 99(2): 244-251.
[13]赵玉红, 高天. 鹿骨胶原蛋白特性的研究[J]. 食品科学, 2008, 29(7): 43-46.
[14]高金龙. 山羊皮中胶原蛋白的提取及理化特性研究[D]. 呼和浩特: 内蒙古农业大学, 2010.
[15]DOYLE B B, BENDIT E G, BLOUT E R, et al. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975, 14: 937-957.
[16]SU Xiurong, SUN Bei, LI Yanyan, et al. Characterization of acid-soluble collagen from the coelomic wall of Sipunculida[J]. Food Hydrocolloids, 2009, 23: 2190-2194.
[17]王方, 沈珊安, 陈富强, 等. 正常和病变椎间盘纤维环中胶原的生化研究[J]. 首都医药, 2000, 4(7): 21-22.
[18]ZHANG Yan, LIU Wentao, LI Guoying, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103: 906-912.
[19]庄永亮. 海蜇胶原蛋白理化性质及其胶原肽的护肤活性研究[D]. 青岛: 中国海洋大学, 2009.
[20]SINGH P, BENJAKUL S, MAQSOOD S, et al. Isolation and characterization of collagen extracted from the skin of striped catfish[J]. Food Chemistry, 2011, 124: 97-105.
[21]易继兵, 李八方, 赵雪, 等. 狮子鱼皮胶原蛋白的提取及理化性质研究[J]. 食品工业科技, 2010, 31(4): 65-70.
Physico-chemical Properties of Sika Deer Antler Collagen
ZHAO Yu-hong,JIN Xiu-ming
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
The physico-chemical properties of sika deer antler collagen extracted in acidic solution with pepsin were determined using ultraviolet (UV) spectroscopy, Fourier transform infrared (FTIR) spectroscopy, amino acid analyzer, SDS-PAGE and differential scanning calorimetry (DSC). A typical absorption peak at 230 nm was found in the UV spectrum. The FTIR spectrum showed that the amide A, B and Ⅰ spectral bands were consistent with those standard typeⅠ collagen with threespiral structure. SDS-PAGE results indicated that sika deer antler collagen was composed of one β-chain and two different αchains (α1 and α2), which were the characteristics of type Ⅰ collagen. Amino acid composition analysis revealed the characteristic amino acids of typeⅠ collagen. The tswas 84.05 ℃. On the basis of the analysis above, it could be concluded that sika deer antler collagen had typical physico-chemical properties of type Ⅰ collagen.
sika deer antler;collagen;macromolecular protein;structural characteristics;physico-chemical properties
Q816
A
1002-6630(2012)11-0075-04
2011-05-27
黑龙江省教育厅科学技术研究指导项目(11553036)
赵玉红(1968—),女,副教授,博士,研究方向为林特产品精深加工。E-mail:zhaoyuhong08@hotmail.com



