周 佳,刘书亮*,胡欣洁,张元娥
(四川农业大学食品学院,四川 雅安 625014)
产宽谱pH细菌素乳酸菌的筛选鉴定、毒力检测及细菌素特性研究
周 佳,刘书亮*,胡欣洁,张元娥
(四川农业大学食品学院,四川 雅安 625014)
采用琼脂扩散法从分离自川西高原奶渣的34株疑似乳酸球菌中筛选细菌素产生菌,初筛检测发酵上清液抑菌活性,复筛排除有机酸和H2O2干扰,检测蛋白酶敏感性,测定抑菌物质盐析液和粗提液抑菌活性,确定菌株SAU-2为细菌素产生菌。根据形态、生理生化指标和16S rDNA序列系统发育分析,将其鉴定为Enterococcus。肠球菌SAU-2溶血素表型阴性,agg、gelE、cylM、cylB、cylA、esp、efaAfm、cpd、cob、ccf、cyILL、cyILS、fsrB和hyLEfm等毒力因子基因型阴性,表明肠球菌SAU-2是安全的。所产细菌素可耐受121℃条件20min;在pH2.0~12.0有抑菌活性;对胰蛋白酶和蛋白酶K敏感,对木瓜蛋白酶和胃蛋白酶不敏感;主要对近缘乳酸菌和G+细菌有抑菌活性,除对1株铜绿假单胞菌和1株红酵母有抑菌活性外,对其余G-细菌和真菌无抑制作用。
奶渣;肠球菌;细菌素;毒力因子;特性
乳酸菌素是“公认安全(GRAS)”的乳酸菌在代谢过程中通过核糖体合成的一类有抑菌活性的多肽或前体多肽,其不仅对亲缘关系较近的乳酸菌产生抑制,还对其他G+菌有一定抑制作用[1]。因其具有安全、高效、无残留、无毒副作用和无耐药性等特点,引发了研究热潮。迄今已逾百种乳酸菌素被发现[2],但广泛应用的乳酸菌素仅有Nisin。而Nisin只在酸性条件下才有抑菌活性,严重限制了它的应用。因此,开发高效、广谱、稳定性良好的乳酸菌素具有重要意义。
产细菌素乳酸菌的来源广泛[3-10],但对我国藏区和内蒙古地区日常生活的必备食品——奶渣中乳酸菌产细菌素的研究尚鲜见报道。目前,对奶渣的研究还很缺乏。对奶渣中微生物的研究只停留在分离鉴定酥油奶渣中的乳杆菌[11]。本研究以分离自川西高原奶渣的34株疑似乳酸球菌为实验材料,筛选产耐酸碱性细菌素的乳酸菌,并进行鉴定;检测该菌株的溶血素表型和毒力因子基因型;研究细菌素的生物学特性。这不仅可为深入研究细菌素提供基础材料,还可为其作为天然食品保鲜剂提供参考数据。
1 材料与方法
1.1 菌株
供试菌株:分离自川西高原奶渣的34株疑似乳酸球菌;指示菌:藤黄微球菌(Micrococcus luteus)10209;抑菌谱测试菌:9株G+细菌(4株金黄色葡萄球菌及藤黄微球菌、热死环丝菌、单核细胞增生李斯特氏菌、枯草芽孢杆菌和苏云金杆菌各1株),13株G-细菌(2株假单胞菌、7株沙门氏菌、2株大肠杆菌、沙雷氏菌和发根农杆菌各1株)、7株乳酸菌(2株戊糖乳杆菌、2株植物乳杆菌、弯曲乳杆菌、保加利亚乳杆菌和嗜酸乳杆菌各1株),2株酵母菌(红酵母和啤酒酵母各1株)和5株霉菌(2株米曲霉及黑曲霉、青霉和毛霉各1株),均由四川农业大学食品微生物实验室保存。
1.2 培养基与试剂
MRS培养基用于乳酸菌培养和发酵液制备;H2S实验、V-P实验、动力实验、马尿酸盐水解实验、精氨酸产氨实验、精氨酸双水解酶实验、糖(醇)发酵实验等培养基用于乳酸菌鉴定;营养琼脂培养基用于一般细菌培养;PDA培养基用于真菌培养。
胰蛋白酶(250U/mg) 美国Amersco公司;木瓜蛋白酶(6000U/mg)、胃蛋白酶(3000U/mg) 美国Sigma公司;蛋白酶K 德国Merck公司;Bacteria DNA out抽提试剂盒 四川省绵阳天泽基因工程有限公司;R10T1M PCR反应试剂、DL2000 DNA Marker 宝生物工程(大连)有限公司;琼脂糖 英国Oxoid公司;脱纤维羊血成都奥克公司。
1.3 引物
细菌鉴定通用引物:正向引物5'-AGAGTTTGATC CTGGCTCAG-3'、反向引物5'-CTACGGCTACCTTGTT ACGA-3'。扩增的肠球菌毒力基因分别为agg(聚合物)、gelE(编码明胶酶)、cylM(溶血素的转录后修饰)、cylB(溶血素的运输)、cylA(溶血素的激活)、esp(肠球菌表面蛋白)、efaAfm(屎肠球菌在血清中的细胞壁黏附素表达)、cpd(性信息素)、cob(性信息素)、ccf(性信息素)、cyILL(溶血素前体)、cyILS(溶血素前体)、fsrB(毒力因子调节)和hyLEfm(透明质酸酶),其扩增引物见表1。以上引物均由上海英俊生物技术有限公司合成。

表1 肠球菌毒力因子扩增引物Table 1 Primers used for virulence factors detection
1.4 仪器与设备
TE412-L精密电子天平、PB-2B pH计 德国Sartorius公司;SW-CJ-1F洁净工作台 苏州安泰空气技术有限公司;B4i-BR4i冷冻离心机 美国Thermo公司;1kD透析袋 上海Green Bird公司;游标卡尺 成都量具刃具总厂乐兴商贸公司;HJ-3型磁力搅拌器 常州国华电器有限公司;显微镜 日本Olympus公司;HWS24电热恒温水浴锅 上海一恒科技有限公司;MyCycler PCR仪、PowerPac Basic电泳仪、凝胶成像系统 美国Bio-Rad公司。
1.5 方法
1.5.1 乳酸菌发酵上清液的制备
将待测乳酸菌的18h种龄种子液以5%接种量接入MRS肉汤,30℃静置培养36h,离心收集上清,待用。
1.5.2 产细菌素菌株的筛选
初筛采用打孔法检测发酵上清液活性(指示菌终浓度为106CFU/mL)。复筛排除有机酸(调pH值至6.0)和H2O2干扰,检测蛋白酶敏感性,具体操作参见文献[17]。采用牛津杯双层琼脂法检测盐析液(硫酸铵沉淀)和粗提液(透析浓缩处理)抑菌活性。盐析液和粗提液的制备参见文献[18],其中所用缓冲液为20mmol/L柠檬酸-磷酸钠缓冲液(pH6.0)。
1.5.3 产细菌素乳酸菌的鉴定
1.5.3.1 菌体形态和生理生化实验
MRS琼脂平板上观察菌落形态;革兰氏染色后观察菌体形态;各项生理生化实验参照《乳酸菌分类鉴定及实验方法》[19]。
1.5.3.216 S rDNA序列分析
以基因组DNA为模板,PCR扩增待测菌的16S rDNA片段。PCR反应体系:10μmol/L上下游引物各1μL、模板DNA 1μL、2.5U/mL Taq酶 0.5μL、10× PCR Buffer 2.5μL、25mmol/L MgCl21.5μL、dNTP Mixture 2μL、ddH2O补足25μL,设阴性对照。PCR扩增程序:95℃预变性5min;94℃变性45s,56℃退火45s,72℃延伸90s,30个循环;72℃延伸10min。PCR产物送宝生物工程(大连)有限公司测序。序列通过Blast在GenBank中进行同源性分析,选取与该序列相似度高的序列,采用MEGA4软件的ClustalX2子程序进行多序列比对后构建系统发育树。
1.5.4 肠球菌的毒力检测
1.5.4.1 溶血实验
具体操作参见文献[20]。
1.5.4.2 PCR检测毒力因子
以基因组DNA为模板,PCR扩增待测菌的毒力因子。PCR反应体系同1.5.3.2节。PCR扩增条件,参见文献[12-16]。PCR产物送宝生物工程(大连)有限公司测序。序列通过Blast在GenBank中进行同源性分析。
1.5.5 细菌素的生物学特性研究
1.5.5.1 细菌素对pH值、温度和酶的敏感性
用HCl和NaOH将细菌素发酵上清液、盐析液和粗提液分别调至pH2.0~12.0,采用牛津杯双层琼脂法检测抑菌活性。细菌素样品分别于60、80、100、115、121℃处理20min后,检测抑菌活性。模拟人体内环境条件下,测定细菌素发酵上清液和粗提液的酶敏感性,具体操作参见文献[18]。粗提液做水浴4h和6h的酶解实验。于酶最适作用pH值和最适作用温度下,测定粗提液的酶敏感性。将其酶解2h后调回对照pH6.0,检测抑菌活性。
1.5.5.2 抑菌谱测定
霉菌采用涂布法制备检测平板,其他菌株采用倾注法制备检测平板。加样后,置于适宜温度培养16~48h(培养时间根据菌的生长情况而定),测定抑菌圈直径大小。
2 结果与分析
2.1 产细菌素菌株的筛选
通过打孔法确定34株疑似乳酸球菌中有16株菌的发酵上清液对指示菌有抑制作用,产抑菌物质的菌株占测试菌株的47.06%。将16株菌的发酵上清液调pH值至6.0后,仅有SAU-2对指示菌有抑制作用,抑菌圈直径为9.26mm。菌株SAU-2的发酵上清液排除H2O2后,抑菌活性无变化。该抑菌物质能被胰蛋白酶和蛋白酶K完全降解,确定该抑菌物质为蛋白质。经80%饱和度(NH4)2SO4沉淀的盐析液和粗提液抑菌圈直径约为17mm,抑菌活性显着高于发酵上清液,证明该抑菌物质的蛋白质特性。以上表明菌株SAU-2为细菌素产生菌。
2.2 菌株SAU-2的鉴定
2.2.1 菌体形态和生理生化实验结果
菌株SAU-2在MRS琼脂平板上为大小约1mm、露滴状、光滑、低凸起、边缘整齐、圆形、无光泽、质地松软、乳白色、不透明菌落;革兰氏染色显示其为成对或成堆排列的G+球菌。菌株SAU-2的生理生化特征如表2所示。综合形态特征及生理生化特征,根据《乳酸菌分类鉴定及实验方法》[19],初步将菌株SAU-2鉴定为Enterococcus。

表2 菌株SAU-2的生理生化特征Table 2 Physiological and biochemical characteristics of SAU-2
2.2.2 菌株SAU-2基于16S rDNA基因的分子生物学鉴定
采用NCBI数据库中的Blast程序比对菌株SAU-2的16S rDNA序列(登录号为JF825531)和GenBank中的核酸数据,发现菌株SAU-2与肠球菌(Enterococcus sp.) SL02、SL03、SL04的相似性为98%,与芒地肠球菌(E.mundii) ATCC 43186、芒地肠球菌SS 1232、海氏肠球菌(E.hirae)NRIC 0109及屎肠球菌(E.faecium)SH 632的相似性为98%。因其16S rDNA序列与确定种名的菌株相似度最高仅为98%,故不能确定该菌的种名,仅能将菌株SAU-2鉴定为Enterococcus。菌株SAU-2在系统发育树上与SL02等肠球菌处于发育树的同一分支;与副肠系膜明串珠菌NCFB 2973(L.paramesenteroides)等近缘乳酸菌亲缘关系较远,基于16S rDNA的系统发育树如图1所示。

图1 菌株SAU-2的系统进化树Fig.1 Phylogenetic tree of SAU-2 based on 16S rDNA sequence
2.3 肠球菌SAU-2的毒力检测
2.3.1 溶血性实验
将肠球菌SAU-2划线于含体积分数5%脱纤维羊血的哥伦比亚琼脂上,于37℃培养24h后,未出现溶血圈,表明其不产溶血素。
2.3.2 PCR检测肠球菌SAU-2的毒力因子
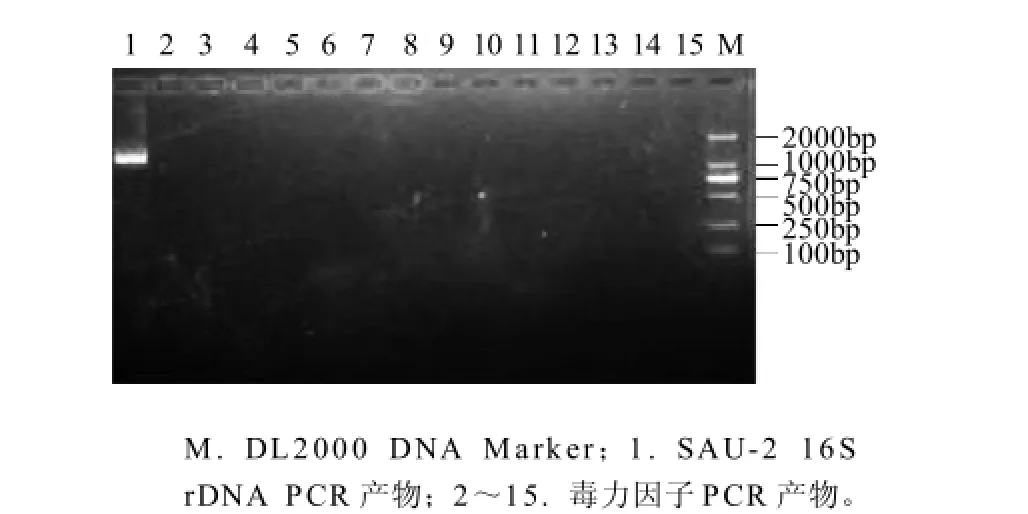
图2 肠球菌SAU-2的毒力因子扩增产物电泳Fig.2 Eelectrophoresis of PCR amplification products of virulence factors
由图2可知,肠球菌SAU-2未扩增出agg、gelE、cylM、cylB、cylA、esp、efaAfm、cpd、cob、ccf、cyILL、cyILS、fsrB和hyLEfm等毒力因子的特异性片段。说明肠球菌SAU-2不存在以上毒力因子,肠球菌SAU-2是安全的。
2.4 SAU-2所产肠球菌素的生物学特性
2.4.1 细菌素的作用pH值范围
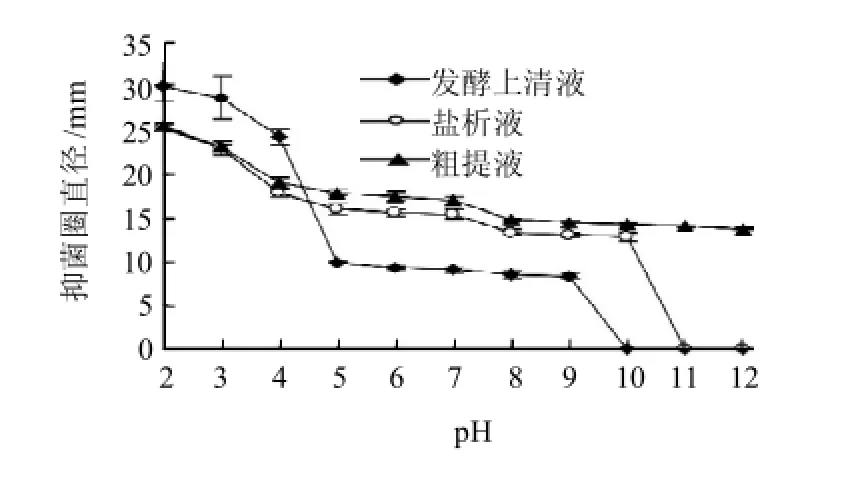
图3 SAU-2所产肠球菌素的活性pH值范围Fig.3 Effect of pH on the antimicrobial activity of bacteriocin produced by SAU-2
由图3可知,细菌素发酵上清液、盐析液和粗提液显示活性的pH值范围很广,发酵上清液显示活性的pH值为2~9,盐析液为2~10,粗提液为2~12。表明随着纯化的进行,肠球菌素SAU-2的活性pH值范围不断扩大。随着pH值升高,发酵上清液、盐析液和粗提液的抑菌活性都呈下降趋势。当pH值为2~5时,细菌素抑菌活性随pH值升高快速下降;当pH>5时,细菌素抑菌活性缓慢下降。
2.4.2 细菌素的热稳定性
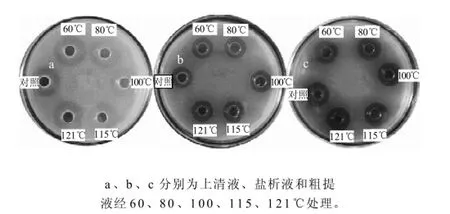
图4 肠球菌素SAU-2的热处理结果Fig.4 Effect of heat on the antimicrobial activity of bacteriocin produced by SAU-2
由图4可知,随着处理温度的升高,细菌素发酵上清液、盐析液和粗提液活性丧失很少。经121℃处理20min,细菌素发酵上清液、盐析液和粗提液残留的活性分别为原液(对照)的92%、97%和96%。表明肠球菌素SAU-2对热很稳定。
2.4.3 细菌素的酶敏感性
由图5可知,模拟人体内环境条件下,细菌素发酵上清液经胰蛋白酶和蛋白酶K处理后抑菌活性完全丧失;经木瓜蛋白酶和胃蛋白酶处理后,活性基本无变化。粗提液经胰蛋白酶和蛋白酶K处理2、4、6h后,抑菌活性有所下降;经木瓜蛋白酶和胃蛋白酶处理2、4、6 h后,活性几乎无损失。表明模拟人体内环境条件下,细菌素发酵上清液和粗提液对胰蛋白酶、蛋白酶K有一定的敏感性,对木瓜蛋白酶和胃蛋白酶不敏感。

图5 肠球菌素SAU-2的酶敏感性Fig.5 Antimicrobial activity of bacteriocin produced by SAU-2 after treatment with various proteases
在酶最适作用pH值和最适作用温度下,细菌素粗提液经胰蛋白酶处理后抑菌活性有部分降低;经蛋白酶K处理后活性损失殆尽;经木瓜蛋白酶和胃蛋白酶处理后活性无变化。表明在酶处于最适作用pH值和最适作用温度下,粗提液对蛋白酶K敏感性强,对胰蛋白酶有一定的敏感性,对木瓜蛋白酶和胃蛋白酶不敏感。
2.4.4 细菌素的抑菌谱
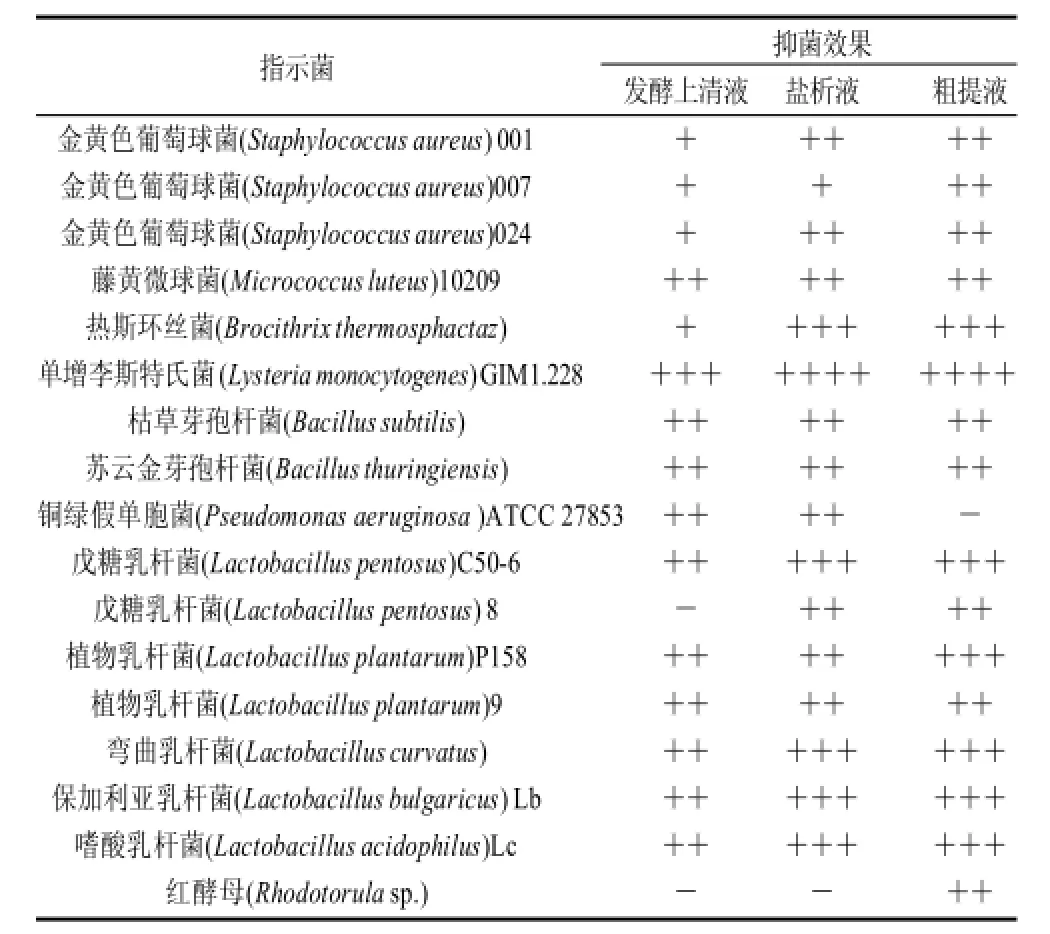
表3 肠球菌素SAU-2的抑菌谱Table 3 Antibacterial spectrum of enterocin SAU-2
由表3可知,肠球菌素SAU-2对测试的9株G+细菌中的8株有抑菌活性,抑菌率为89%(8株/9株)。其对单核细胞增生李斯特氏菌GIM1.228表现出很强的抑菌活性(粗提液抑菌圈为35.02mm);对2株芽孢杆菌有抑制作用;对铜绿假单胞杆菌ATCC 27853有抑菌活性;对测试的7株近缘乳酸菌均具有较强的抑菌活性;粗提液对1株红酵母也具有一定的抑菌活性。对测试的其他细菌和真菌无抑制作用(表3未列出,具体菌种见1.1节)。以上表明该细菌素主要对近缘乳酸菌和G+细菌有抑菌作用,与大多数乳酸菌素的抑菌谱类似。粗提液对1株红酵母产生抑制作用,而发酵上清液和盐析液未表现出抑菌活性,表明随着细菌素纯度的提高,有可能会拓宽其抑菌谱。
3 讨 论
3.1 产细菌素乳酸菌的筛选
迄今,除Nisin之外,已逾百种乳酸菌素被发现[2]。而多数乳酸菌素仅在酸性或中性pH值条件下才稳定。因此,筛选宽谱pH细菌素具有重要意义。本实验采用调节发酵上清液pH值至6.0来筛选产宽谱pH细菌素的潜力菌株,优于敖灵[4]、张艾青[17]等调pH4.5(仅排除有机酸干扰)及李悦[21]、吴荣荣[22]等调pH值至5.0筛选细菌素产生菌。
3.2 肠球菌的益处和潜在危害
肠球菌广泛存在于自然界,其对地中海奶酪等发酵食品形成独特风味具有重要作用。肠球菌还被作为益生菌应用于婴儿配方食品、食品发酵剂和饲料添加剂。一些肠球菌还能产细菌素,从而抑制李斯特氏菌等致腐菌和致病菌,延长食品保质期。但是某些肠球菌携带毒力因子。而且耐万古霉素肠球菌(VRE)菌株数量不断上升,随着菌株的使用,可能会增加耐药基因的传播。因此,将肠球菌用于食品工业前,必须确保该菌株不含任何毒力因子和可传递的耐药基因。本实验对肠球菌SAU-2进行了毒力评价,结果显示肠球菌SAU-2为溶血素表型阴性和毒力因子基因型阴性,表明其是安全的,可作为食品发酵剂的后备菌种。
3.3 肠球菌素的特性
细菌素在适宜pH值环境下,才表现出抑菌活性;pH值过高或过低都会影响细菌素结构,从而降低或丧失抑菌活性。目前,发现的大多数肠球菌素具有较好的pH值稳定性[9,23-25]。本研究的肠球菌素SAU-2活性pH值范围很广,能够适应不同食品的pH值要求。
乳酸菌素对热的稳定性因种类不同有一定差异。而发现的大部分肠球菌素都能耐受巴氏杀菌(65~80℃,15min)及以上温度[9,23-27]。本研究的肠球菌素SAU-2经121℃处理20min,抑菌活性几乎无降低。表明该细菌素对热很稳定,能够满足食品加工过程对添加物质耐热的要求。
细菌素基本属于蛋白质或多肽范畴,往往能被蛋白酶类分解。其若能被酶类分解,就不会在体内蓄积,对评价细菌素的安全性具有重要意义。少数细菌素还能被淀粉酶和脂肪酶分解失活[28-29]。本研究的肠球菌素SAU-2对蛋白酶K和胰蛋白酶敏感,说明其作为食品防腐剂使用的安全性。而酶处于不同作用条件,对细菌素的降解能力有一定差异。本研究的细菌素粗提液在模拟人体内环境条件下,只能被蛋白酶K部分降解;而在酶最适作用pH值和最适作用温度下,能被蛋白酶K完全降解。
目前发现的肠球菌素主要抑制G+细菌,少数肠球菌素还能抑制大肠杆菌、沙门氏菌和假单胞等G-菌[9]。已发现的肠球菌素能抑制真菌和病毒很少。岳喜庆等[27]的屎肠球菌BC-3所产细菌素能抑制米曲霉,Wachsman等[30]的屎肠球菌素CRL35能抑制疱疹病毒。本研究的肠球菌素SAU-2主要对近缘乳酸菌和G+细菌有抑菌作用,与大多数乳酸菌素的抑菌谱类似。其对G-菌和真菌几乎无抑菌性,可以通过添加其他抑菌物质协同抑制得以改善。
本研究从川西高原奶渣中筛选到1株产宽谱pH细菌素的肠球菌SAU-2。肠球菌SAU-2溶血素表型阴性,agg等14个毒力因子基因型阴性,表明肠球菌SAU-2是安全的。肠球菌素SAU-2具有较宽的pH值作用范围、良好的热稳定性和较广谱的抑菌性,具有作为天然食品防腐剂的潜在应用价值。
[1]李平兰, 张篪, 江汉湖. 乳酸菌细菌素研究进展[J]. 微生物学通报, 1998, 25(5): 295-298.
[2]贡汉生, 孟祥晨. 1株产细菌素乳杆菌的鉴定及其所产抑菌物质的特性[J]. 山东大学学报: 理学版, 2008, 43(7): 1-7.
[3]赵慧, 薛平海, 宫正, 等. 女性阴道中产细菌素的乳杆菌筛选与鉴定[J]. 中国微生态学杂志, 2005, 17(3): 172-173.
[4]敖灵, 冯敏, 刘书亮, 等. 肉源产广谱细菌素乳酸菌的筛选及其细菌素特性研究[J]. 中国酿造, 2008(9): 67-70.
[5]PONCE A G, MOREIRA M R, del VALLE C E, et al. Preliminary characterization of bacteriocin-like substances from lactic acid bacteria isolated from organic leafy vegetables[J]. LWT-Food Science and Technology, 2008, 41(3): 432-441.
[6]HUANG Ying, LUO Yunbo, ZHAI Zhengyuan, et al. Characterization and application of an anti-Listeria bacteriocin produced by Pediococcus pentosaceus 05-10 isolated from Sichuan Pickle, a traditionally fermented vegetable product from China[J]. Food Control, 2009, 20(11): 1030-1035.
[7]BRAVO D, RODRIGUEZ E, MEDINA M. Nisin and lacticin 481 coproduction by Lactococcus lactis strains isolated from raw ewes,milk [J]. Journal of Dairy Science, 2009, 92(10): 4805-4811.
[8]郝彦玲, 黄莹, 赵潞, 等. 新疆酸马奶中乳酸片球菌所产细菌素05-8的理化特性及分子量确定[J]. 中国乳品工业, 2009, 37(11): 12-14.
[9]刘国荣, 畅晓渊, 吴寒宇, 等. 屎肠球菌M-2产细菌素的纯化与特性分析[J]. 农业生物技术学报, 2009, 17(5): 925-930.
[10]陈新练, 陈仪本. 从虎皮鹦鹉粪便中分离产细菌素菌株及其细菌素特性分析[J]. 生物技术通报, 2010(9): 185-190.
[11]张以芳, 向文彬, 刘旭川. 酥油奶渣制品中乳杆菌分离鉴定[J]. 食品科技, 2000(1): 54-55.
[12]EATON T J, GASSON M J. Molecular screening of Enterococcus virulence determinants and potential for genetic exchange between food and medical isolates[J]. Applied and Environmental Microbiology, 2001, 67(4): 1628-1635.
[13]MANNU L, PABA A, DAGA E, et al. Comparison of the incidence of virulence determinants and antibiotic resistance between Enterococcus faecium strains of dairy, animal and clinical origin[J]. International Journal of Food Microbiology, 2003, 88(2/3): 291-304.
[14]SEMEDO T, SANTOS M A, LOPES M F S, et al. Virulence factors in food, clinical and reference enterococci: a common trait in the genus[J]. Systematic and Applied Microbiology, 2003, 26(1): 13-22.
[15]KOLODJIEVA V, YAFAEV R, YERMOLENKO E, et al. Incidence of virulence determinants in enterococcal strains of probiotic and clinical origin[J]. International Congress Series, 2006, 1289: 367-369.
[16]VANKERCKHOVEN V, AUTGAERDEN T V, VAEL C, et al. Development of a multiplex PCR for the detection of asa1, gelE, cylA, esp, and hyl genes in Enterococci and survey for virulence determinants among European hospital isolates of Enterococcus faecium[J]. Jounal of Clinical Microbiology, 2004, 42(10): 4473-4479.
[17]张艾青, 刘书亮, 詹莉, 等. 产广谱细菌素乳酸菌的筛选[J]. 中国酿造, 2007(2): 45-48.
[18]刘书亮, 敖灵, 周佳, 等. 戊糖乳杆菌素C50-6 的纯化及特性研究[J].食品与发酵工业, 2010, 36(5): 36-40.
[19]凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 117-129.
[20]CARIOLATO D, ANDRIGHETTO C, LOMBARDI A. Occurrence of virulence factors and antibiotic resistances in Enterococcus faecalis and Enterococcus faecium collected from dairy and human samples in North Italy[J]. Food Control, 2008, 19(9): 886-892.
[21]李悦, 孙玉梅, 杨红, 等. 产细菌素乳酸菌的筛选及其发酵特性[J].大连工业大学学报, 2008, 27(1): 19-21.
[22]吴荣荣, 张良, 王倩. 产细菌素乳酸菌的选育及其抑菌特性的研究[J]. 中国酿造, 2009(6): 20-22.
[23]HERRANZ C, CASAUS P, MUKHOPADHYAY S, et al. Enterococcus faecium P21: a strain occurring naturally in dry-fermented sausages producing the class 2 bacteriocins enterocin A and enterocin B[J]. Food Microbiology, 2001, 18(2): 115-131.
[24]侯运华, 孔健, 郝运伟, 等. 一株乳酸菌产类细菌素Enteriocin LK-S1的初步研究[J]. 山东大学学报: 理学版, 2002, 37(5): 463-466; 470.
[25]de KWAADSTENIET M, TODOROV S D, KNOETZE H, et al. Characterization of a 3944 Da bacteriocin, produced by Enterococcus mundtii ST15, with activity against Gram-positive and Gram-negative bacteria [J]. International Journal of Food Microbiology, 2005, 105(3): 433-444.
[26]程万鹏, 尚楠, 张金兰, 等. 一种抗猪链球菌细菌素的生物学特性研究[J]. 食品科学, 2009, 30(7): 215-219.
[27]岳喜庆, 郭晨, 闵钟熳, 等. 产Ⅱa类细菌素乳酸菌的筛选、鉴定与生物学特性的研究[J]. 中国酿造, 2010(3): 56-59.
[28]LOSTEINKIT C, UCHIYAMA K, OCHI S, et al. Characterization of bacteriocin N15 produced by Enterococcus faecium N15 and cloning of the related genes[J]. Journal of Bioscience and Bioengineering, 2001, 91 (4): 390-395.
[29]YOON M Y, KIM Y J, HWANG H J. Properties and safety aspects of Enterococcus faecium strains isolated from Chungkukjang, a fermented soy product[J]. LWT-Food Science and Technology, 2008, 41(5): 925-933.
[30]WACHSMAN M B, FARIAS M E, TAKEDA E, et al. Antiviral activity of enterocin CRL35 against herpesviruses[J]. International Journal of Antimicrobial Agents, 1999, 12(4): 293-299.
Screening, Identification and Toxicity of a Strain of Wide pH Spectrum Bacteriocin-Producing Lactic Acid Bacteria and Characterization of Bacteriocin Produced by It
ZHOU Jia,LIU Shu-liang*,HU Xin-jie,ZHANG Yuan-e
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
SAU-2, a bacteriocin-producing strain, was screened out of 34 strains isolated from milk residue in West Sichuan plateau. The strain was identified as Enterococcus based on colonial morphology, physiological and biochemical characteristics and 16S rDNA sequence phylogenetic analysis. SAU-2 had no hemolytic activity. All the virulence factors of agg, gelE, cylM, cylB, cylA, esp, efaAfm, cpd, cob, ccf, cyILL, cyILS, fsrB and hyLEfm were negative. These results indicate that SAU-2 is safe. In addition, bacteriocin produced by SAU-2 could tolerate heat treatment at 121 ℃ for 20 min, and exhibited antibacterial activity at pH 2.0—12.0, but was sensitive to trypsin and proteinase K. It showed strong inhibitory effect on relative strains of SAU-2 and Gram-positive bacteria, and could also inhibit one strain of Pseudomonas aeruginosa and one strain of Rhodotorula glutinis, but had no inhibitory effect on other Gram-negative bacteria and fungi.
milk residue;Enterococcus;bacteriocin;virulence factors;characterization
TS201.3
A
1002-6630(2012)11-0194-06
2011-05-31
四川省教育厅重点项目(07ZA054);四川省科技厅泡菜产业链项目(09ZC1270-4)
周佳(1985—),女,硕士研究生,研究方向为食品微生物。E-mail:zj.onef@163.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物。E-mail:lsliang999@163.com



