曹燕妮,岳田利*,袁亚红,高振鹏
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
辅酶Q10高产菌株的诱变选育
曹燕妮,岳田利*,袁亚红,高振鹏
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
以豌豆根瘤菌(Rhizobium leguminosarum 1.1723)为出发菌株,利用紫外-LiCl和超声波进行诱变,以期获得高产辅酶Q10菌株。结果表明:1g/L LiCl诱变能显着提高菌株的正突变率,超声波诱变会引起细胞壁结构与构成发生改变。通过罗红霉素初筛和摇床复筛,获得辅酶Q10突变株C40-05,胞内辅酶Q10产量为1.198mg/g干菌,比出发菌株(0.389mg/g)提高了208%。菌株经5次传代培养,胞内辅酶Q10产量下降了2.67%,突变株遗传形状稳定,可作为辅酶Q10生产菌株。
豌豆根瘤菌;辅酶Q10;紫外-LiCl;超声波;诱变
辅酶Q10(coenzyme Q10)又称癸烯醌、泛醌,是脂溶性醌类化合物,广泛存在于动物、植物和微生物细胞等生物体内,是电子传递的重要组成部分,具有抗氧化、增强免疫力和清除自由基的作用[1]。作为一种重要的生化药剂,辅酶Q10在临床医学中有广泛的应用,对稳定性心绞痛、肌肉疾病、帕金森症等疾病有很好的疗效[2-4]。研究表明,辅酶Q10的基本保健用量为每日20~30mg,长期高剂量服用辅酶Q10可显着改善人体的身体健康状况[5],对一些疾病有缓解和治疗作用,因此辅酶Q10又被称作营养补增剂[6]。
辅酶Q10生产方法有动植物组织提取法、植物细胞培养法[7]、化学合成法和微生物发酵法,其中微生物发酵法成本低、不受原料限制、易大规模生产、易分离纯化、产品活性好[8],因而成为最有发展前景的生产方法。目前,国内制约微生物发酵法生产辅酶Q10的关键在于缺乏优良的辅酶Q10生产菌株。
近年来,紫外与氯化锂(LiCl)复合诱变被应用于刺糖菌素[9]、1,3-丙二醇[10]、L-组氨酸[11]等高产菌株的选育中,多数都以LiCl作为筛选平板与紫外进行复合诱变。超声波诱变在乳链菌肽[12]、L(+)-乳酸[13]、透明质酸[14]等的高产菌株选育中也有较好的突破。本实验选择豌豆根瘤菌为出发菌株,该菌株生物量高、发酵周期短,适合短时间内进行大量的突变株筛选,再对菌株进行紫外-LiCl复合诱变和超声波诱变处理,结合罗红霉素抗性筛选,以期获得辅酶Q10的高产突变株,旨为辅酶Q10的开发利用打下基础。
1 材料与方法
1.1 菌种与试剂
豌豆根瘤菌(Rhizobium leguminosarum 1.1723),购自中国普通微生物菌种保藏中心。
石油醚、无水乙醇、焦性没食子酸均为分析纯 西安化学试剂厂。
1.2 仪器与设备
UV6200紫外-可见分光光度计 日本岛津公司;MCFD5505真空冷冻干燥机 美国SIM公司。
1.3 方法
1.3.1 培养基
基础培养基(g/L):葡萄糖20、胰蛋白胨5、酵母提取物3、CaCl20.6,pH7.0。
初筛培养基:在基础培养基中加入罗红霉素0.09mg/L。
1.3.2 生长曲线的绘制
将活化好的豌豆根瘤菌种子液按2%的接种量接入50mL基础培养基中,于28℃、180r/min条件下摇床培养,每2h取1次样,4500r/min离心10min,以每次所得的上清液校正分光光度计的零点,测波长620nm处菌体光密度(OD)值。以时间为横坐标,OD620nm值为纵坐标绘制生长曲线。
1.3.3 紫外- LiCl诱变
1.3.3.1 菌悬液制备与LiCl诱变处理
分别取10mL培养8h的发酵液于4个无菌离心管中,4500r/min离心10min,弃上清液,收集菌体,沉淀用10mL生理盐水洗涤离心2次。菌悬液的不同处理方式见表1,其中A组为对照组。
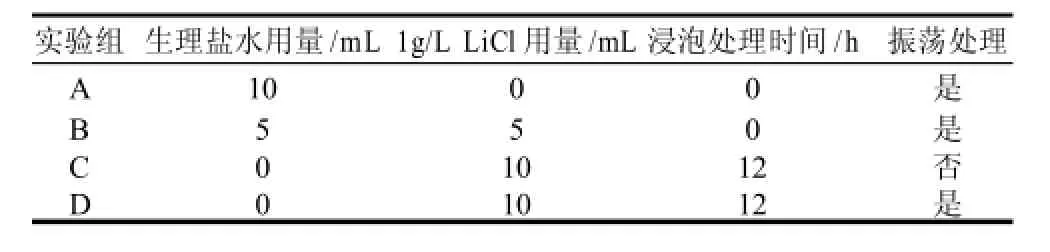
表1 菌悬液的LiCl诱变的不同处理方式Table 1 Different treatment styles for bacterial suspension
1.3.3.2 紫外诱变处理
开启紫外灯预热15min,取表1 中4组菌悬液各0.1mL注入基础培养基平板中,涂布均匀,准备照射。照射需在红光暗室中进行,照射时间为4、8、12、16、20、24s,以未经照射的平板作为对照,每组3个平行,照射后立即取出,用锡箔纸包好,28℃培养24h。根据所得致死率曲线,对菌株采用致死率为70%~80%的处理时间进行诱变[15]。
将上述处理好的菌悬液做适当稀释,调整细胞浓度为107~108个/mL。
1.3.3.3 初筛
根据致死率曲线,确定照射时间,吸取0.1mL菌悬液涂布于罗红霉素筛选平板上,进行紫外照射。
1.3.3.4 复筛
经初筛挑选的突变株,在豌豆根瘤菌种子液中培养16h,按2%的接种量转入发酵液中,于28℃、180r/min摇床培养24h,离心收集菌体,使用醇碱皂化法[16]测定胞内辅酶Q10含量。
1.3.4 超声波诱变
1.3.4.1 菌悬液制备
分别取10mL培养8h的发酵液于5个无菌离心管中,4500r/min离心10min,弃上清液,收集菌体,沉淀用10mL生理盐水洗涤离心2次。
1.3.4.2 超声波处理
超声波工作条件为45kHz、280W、220V,对菌悬液依次诱变10、20、30、40、50min,取诱变后的菌悬液0.1mL涂布于完全培养基平板上,每组3个平行,28℃培养24h。
1.3.4.3 初筛
取超声波处理20、30、40min的菌悬液各0.1mL,涂布于罗红霉素筛选平板上,28℃培养24h后,挑选长势较好的菌落进行复筛。
1.3.4.4 复筛
经初筛挑选的突变株,在种子液中培养16h,按2%的接种量转入发酵液中,于28℃、180r/min摇床培养24h后,离心收集菌体,使用醇碱皂化法测定胞内辅酶Q10含量。
1.3.4.5 突变株基本生物学特性研究
对超声波诱变处理获得的突变株进行革兰氏染色处理和扫描电镜观察。
1.3.4.6 遗传稳定性
复筛出的突变株利用斜面接种作传代实验,传代5次后,考察辅酶Q10产量的稳定性。
2 结果与分析
2.1 豌豆根瘤菌的生长曲线
由图1可知,菌株在培养2h时进入对数期,培养16h时进入稳定期。本实验选取培养8h的发酵液制备菌悬液,调整细胞浓度为107~108个/mL。
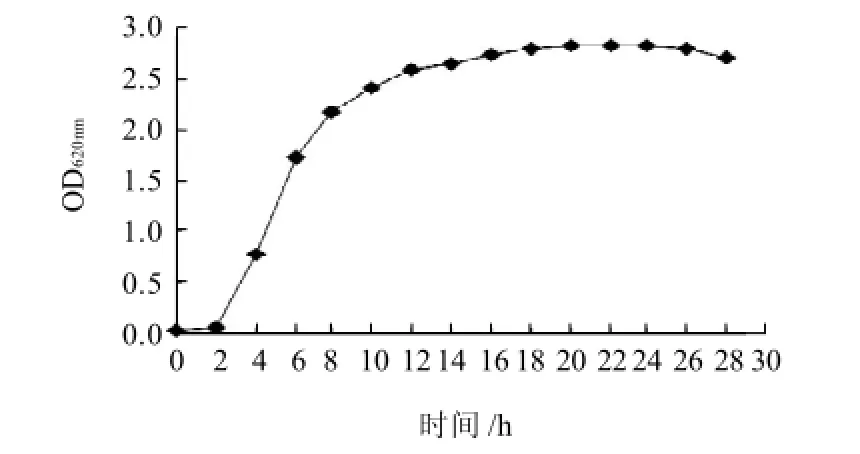
图1 豌豆根瘤菌的生长曲线Fig.1 Growth curve of Rhizobium leguminosarum
2.2 紫外-LiCl复合诱变
2.2.1 LiCl诱变的不同处理方式对菌体的影响
紫外-LiCl复合诱变中,经过LiCl处理后的细胞进行UV处理可能会导致AT-GC碱基对的转换或者导致碱基的缺失,所以会增强正向突变的几率[10],但因为LiCl本身对菌体有毒害作用,高质量浓度的LiCl会抑制菌体生长,因此需研究1g/L LiCl对菌体生长的影响,结果见表2。菌体经4种不同方式处理后培养24h,加入LiCl的实验组与对照组相比,菌落总数基本一致,菌落大小相近,形态正常,实验组用LiCl处理细胞对菌体生长没有显着影响,因此可以采用1g/L LiCl溶液来配制豌豆根瘤菌悬浮菌体。
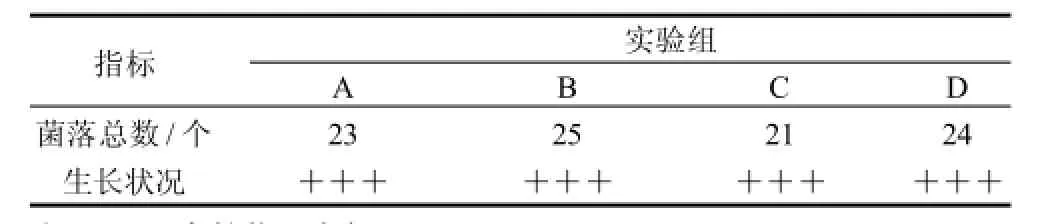
表2 LiCl诱变的不同处理条件下菌体的生长状况Table 2 Effect of LiCl treatment conditions on the growth of Rhizobium leguminosarum
2.2.2 紫外-LiCl诱变的不同处理条件下的豌豆根瘤菌致死率曲线
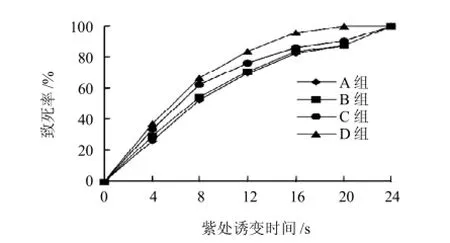
图2 紫外-LiCl诱变的不同处理条件下的豌豆根瘤菌致死率曲线Fig.2 Lethality curve of Rhizobium leguminosarum under different LiCl treatment conditions
由图2可知,紫外照射相同时间下A组和B组之间致死率的变化比较小,但C组和D组的致死率较A组、B组有大幅度提高,表明LiCl在复合诱变中可增加菌体的辐射吸收量,随着LiCl含量的增加,菌体辐射吸收量随之增加,最后导致致死率升高。C组、D组悬浮菌体的溶液中LiCl的含量相同,但D组相同照射时间的致死率明显高于C组,分析D组在对菌体处理的12h中处于匀速振荡环境,菌体能比较均匀的悬浮于溶液中,充分与溶液接触,从而使渗入细胞中LiCl含量高于C组,在辐照处理时,增加的辐射量可直接作用于菌体内部,引发菌体变异,导致菌体死亡,从而使得菌体的致死率有了一定的提高。
为了研究1g/L LiCl在紫外诱-LiCl复合变中对正突变率的影响,应选择两者致死率相近的辐照时间作为诱变处理时间进行实验。因此选择A组照射12s和D组照射8s作为诱变条件。
2.2.3 紫外- LiCl诱变正突变率的比较
取稀释好的A组、D组菌悬液各1mL,涂于初筛培养基平板上,分别进行紫外辐照处理12s和8s,于28℃条件下培养24h,统计菌落数,挑取单菌落保藏于斜面培养基,再经摇床复筛,测突变株辅酶Q10产量。结果见表3。相同致死率的照射条件下,用1g/L LiCl振荡处理12h的菌悬液所得的正突变率较高,LiCl在复合诱变中可以增加菌体的辐射吸收量,渗入细胞内部后效果更加明显,同时在诱导菌体向有利方向突变、提高正突变率方面有一定的贡献。

表3 紫外- LiCl诱变正突变率比较Table 3 Positive mutation rates of Rhizobium leguminosarum after LiCl treatment followed by UV irradiation
通过罗红霉素的抗性初筛,以及进一步的发酵复筛,获得正突变6株,依次编号Z01~Z06,其中菌株Z06产量较高,胞内辅酶Q10含量为0.565mg/g,较出发菌株(0.389mg/g)提高了45.2%。
2.3 超声波诱变
2.3.1 超声波诱变的豌豆根瘤菌的致死率曲线
由图3可知,随着超声波处理时间的加长,豌豆根瘤菌致死率相应提高,当超声波诱变时间为40min时,致死率达到97%。目前对超声波诱变机理尚不明了,因此对超声波诱变20、30、40min的正突变率都进行研究。
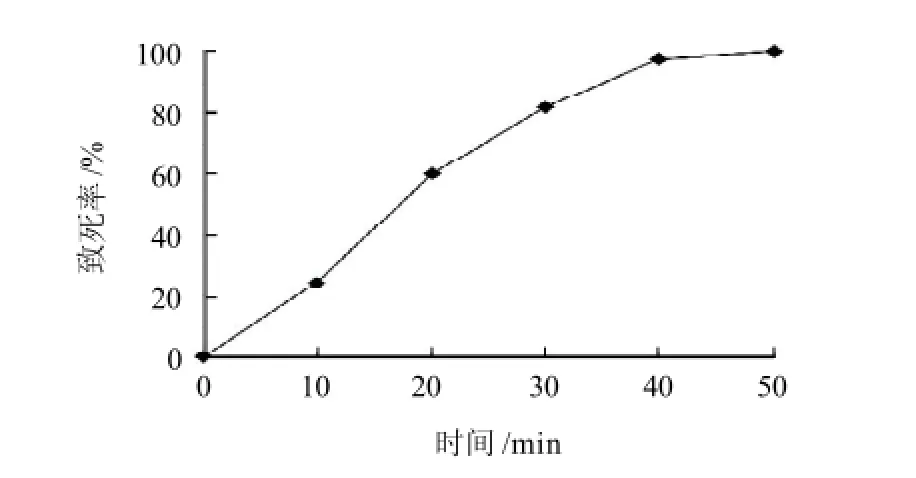
图3 超声波诱变豌豆根瘤菌的致死率曲线Fig.3 Lethality curve of Rhizobium leguminosarum under ultrasonic treatment
2.3.2 超声波不同诱变时间正突变率的比较

表4 超声波不同诱变时间正突变率比较Table 4 Positive mutation rates of Rhizobium leguminosarum after ultrasonic treatment for different minutes
超声波具有很强的生物学效应,其空化作用可产生瞬间高温和射流等,这足以改变细胞壁和细胞膜的结构,使细胞内外发生物质交换,甚至导致突变[13]。由表4可知,超声波诱变40min时,该菌正突变率最高,可能是随着诱变时间的延长,超声波对细胞的作用加强,增加了突变的可能性,因此选择40min为超声波诱变条件。经过筛选共得到5株正突变菌株(编号C40-01~C40-05),其中C40-05的产量最高,胞内辅酶Q10含量为1.198mg/g,比出发菌株(0.389mg/g)提高了208%。
2.3.3 革兰氏染色实验结果
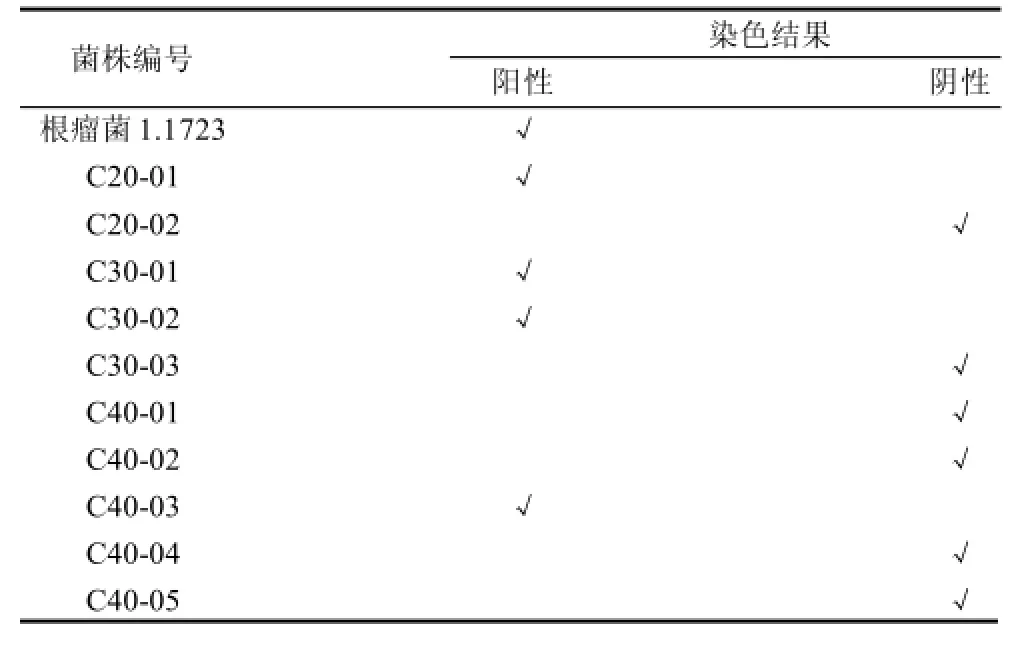
表5 革兰氏染色结果Table 5 Gram staining results
由表5可知,出发菌株豌豆根瘤菌为革兰氏阳性菌,呈紫色,得到的10株突变株中4株为革兰氏阳性菌,6株为革兰氏阴性菌。结果表明经超声波诱变所得的一部分突变株的细胞壁结构与构成发生变化,与原始出发菌株有差异,分析与超声波的空穴作用有关,随着超声波诱变时间的增加,这种作用随之增强,增加了突变发生的几率。
2.3.4 突变菌株C40-05与原始菌株形态比较
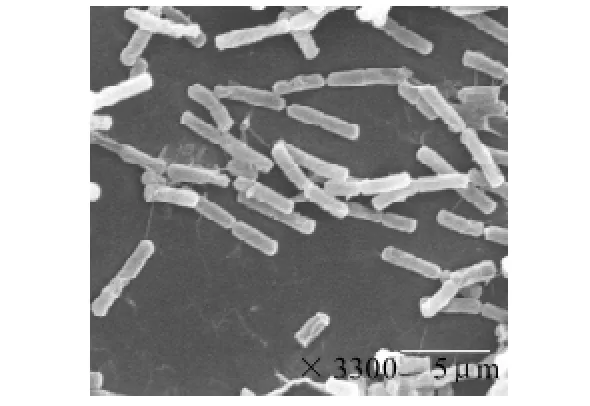
图4 豌豆根瘤菌1.1723(×3300)Fig.4 Scan electron micrograph of Rhizobium leguminosarum RL1.1723 (× 3300)

图5 突变株C40-05(×15000)Fig.5 Scan electron micrograph of Rhizobium leguminosarum C40-05 (×15000)
由图4、5可知,出发菌株豌豆根瘤菌1.1723为杆菌,而突变株C40-05菌体形态接近于椭圆形,与出发菌株相比,其细胞大小有显着变化。在实验过程中开通了循环水并加入适量的冰块,使超声波诱变时菌液处于25~30℃之间,减少了高温对菌体的影响,超声波产生的瞬时高压和冲击力,使菌体细胞壁受到影响甚至一定程度破坏,造成了菌体细胞内物质溶出或交换,最终使突变株的细胞形态发生变化。
2.3.5 突变株C40-05的遗传稳定性

表6 突变株C40-05遗传稳定性Table 6 Genetic stability of Rhizobium leguminosarum C40-05
由表6可知,突变菌株C40-05经5次传代培养,胞内辅酶Q10产量维持在1.166~1.195mg/g之间,下降2.67%,表明突变株C40-05的遗传标记和产辅酶Q10的能力稳定,可用于进一步实验。
3 结 论
采用紫外-LiCl和超声波对豌豆根瘤菌进行诱变处理,LiCl质量浓度为1g/L,处理时间为12h,紫外照射时间为8s,超声波的处理条件为45kHz、280W,处理时间40min,经过平板初筛和摇床发酵复筛,选育出1株辅酶Q10产量比较高的菌株C40-05,其胞内辅酶Q10含量为1.198mg/g,比出发菌株(0.389mg/g)提高了208%。
[1]TIAN Yuting, YUE Tianli, YUAN Yahong. Improvement of cultivation medium for enhanced production of coenzyme Q10 by photosynthetic Rhodospirillum rubrum[J]. Biochemical Engineering Journal, 2010, 51: 160-166.
[2]丁进, 宫剑滨. 辅酶Q10对稳定型心绞痛患者运动耐量的影响[J]. 中西医结合心脑血管病杂志, 2010, 8(4): 398-399.
[3]陆珺, 林洁, 卢家红. 辅酶Q10在肌肉疾病中的应用[J]. 上海医学, 2008, 29(12): 554-556.
[4]赵春玉, 赵宝东, 王雅君. 辅酶Q10在帕金森病治疗中的应用[J]. 中国神经科杂志, 2003, 36(4): 314.
[5]薛茂云. 辅酶Q10的营养作用与应用[J]. 营养与检测, 2010, 27(1): 13-16.
[6]JEYA M, MOON H J, LEE J L, et al. Current state of coenzyme Q10 production and its applications[J]. Appl Microbiol Biotechnol, 2010, 85 (6): 1653-1663.
[7]李英华. 烟草细胞培养生产辅酶Q10的研究[D]. 沈阳: 沈阳农业大学, 2009.
[8]李焱生, 方建军, 钟卫鸿. 微生物法高产辅酶Q10的研究进展[J]. 生物技术报, 2009(2): 59-62.
[9]朱明军, 江丹. 高产刺糖菌素发酵菌株的选育[J]. 农药, 2009, 48(8): 571-575.
[10]刘姜, 陈绮莉, 董鑫, 等. 产1,3-丙二醇菌株克雷伯氏肺炎杆菌的诱变与筛选研究[J]. 化工科技, 2009, 17(6): 36-39.
[11]邱雁临, 梁亮, 汪亮. 紫外线与氯化锂复合诱变选育L-组氨酸产生菌[J]. 现代食品科技, 2008, 24(3): 217-219.
[12]张旭, 张惠文, 徐明恺, 等. 超声波诱变选育乳链菌肽(Nisin)高产菌株[J]. 生物技术, 2009, 19(6): 20-22.
[13]孙波, 张欣, 郭明若, 等. 发酵乳清产L(+)-乳酸菌株的诱变选育[J].食品与发酵工业, 2009, 35(5): 50-53.
[14]叶倩文, 卢陆洋, 李新松. 透明质酸高产菌株选育研究[J]. 化学与生物工程, 2010, 27(3): 51-54.
[15]王海燕, 王腾飞, 王瑞明. 基于氯化锂复合紫外诱变: 10-HDA高产菌株的筛选[J]. 食品科技, 2007(12): 29-32.
[16]李聚海, 岳田利, 袁亚宏. 皂化法提取胞内辅酶Q10的研究[J]. 农产品加工, 2007(3): 14-17.
Induced Mutation Breeding and Screening of a Coenzyme Q10-Producing Strain
CAO Yan-ni,YUE Tian-li*,YUAN Ya-hong,GAO Zhen-peng
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Rhizobium leguminosarum 1.1723 was mutagenized by means of LiCl treatment followed by UV irradiation or ultrasonic treatment alone to yield coenzyme Q10-producing strains. The results showed that 1 g/L LiCl could obviously increase the positive mutation rate and that ultrasonic treatment could change cell wall structure of Rhizobium leguminosarum. A mutant C40-05 with high productivity of coenzyme Q10 was obtained through preliminary screening with roxithromycin and secondary screening by means of shake flask cultivation. Its coenzyme Q10 yield was up to 1.198 mg/g, which revealed a 208% increase compared with the original stain. Only 2.67% reduction in coenzyme Q10 yield of the mutant was observed after the fifth passage. Therefore, the obtained mutant is a stable strain that deserves to be studied further.
Rhizobium leguminosarum;coenzyme Q10;UV-LiCl;ultrasonic;mutagenesis
TS201.3
A
1002-6630(2012)11-0121-05
2011-06-02
国家自然科学基金项目(31071550);农业部“948”项目(2011-G8-04)
曹燕妮(1985—),女,硕士研究生,研究方向为食品生物工程与食品安全控制。E-mail:kuteng8705@163.com
*通信作者:岳田利(1966—),男,教授,博士,研究方向为食品生物工程与食品安全控制。E-mail:yuetl@nwsuaf.edu.cn



