朱春玉,郑方亮,邵丽杰,冯华炜,郭立雄,刘宏生*
(辽宁大学生命科学院,辽宁省生物大分子计算模拟与信息处理工程研究中心,辽宁省动物资源与疫病防治重点实验室,辽宁 沈阳 110036)
桦褐孔菌子实体与菌丝体三萜化合物提取及活性比较研究
朱春玉,郑方亮,邵丽杰,冯华炜,郭立雄,刘宏生*
(辽宁大学生命科学院,辽宁省生物大分子计算模拟与信息处理工程研究中心,辽宁省动物资源与疫病防治重点实验室,辽宁 沈阳 110036)
为探索桦褐孔菌菌丝体与子实体在药用价值上是否存在差别,采用有机溶剂冷浸、超声回流法提取桦褐孔菌菌丝体及子实体的三萜化合物,通过薄层层析和红外光谱分析,确定两种来源的三萜化合物是相同或近似的同系物。四甲基偶氮唑盐比色法(MTT)和杯碟法测定两种来源三萜化合物对癌细胞和细菌的抑制作用,菌丝体三萜化合物对人胃癌细胞株MGC-803的最高抑制率可达到38.27%。结果证实人工培养的桦褐孔菌菌丝体同样具有子实体的药用价值,为人工培养桦褐孔菌菌丝体提供了依据。
桦褐孔菌;三萜化合物;抗肿瘤;抑菌活性
桦褐孔菌(Inonotus obliquus)属于真菌门、担子菌亚门、层菌纲、非褐菌目(无褐菌目)、多孔菌科、褐卧孔菌属(纤孔菌属)。中文名为白桦茸、黑桦菌、桦菌、斜管纤孔菌,被赞誉为“西伯利亚灵芝”[1]。
桦褐孔菌是一种耐寒的高等食药用真菌,主要分布在北纬45°~50°的地区,桦褐孔菌子实体寄生于白桦、银桦、赤杨等的树干或树皮下,形成木腐菌[2]。以往实验对桦褐孔菌的研究表明它不仅对癌症、糖尿病有很好的治疗效果,并且具有增强机体免疫能力和抗辐射抗氧化等功效[3-4]。但桦褐孔菌子实体只有在活的桦木上生长10~15年才具有较高的药用价值,且平均每2万棵桦木中只有一棵生长桦褐孔菌,资源十分稀少[5]。鉴于桦褐孔菌的药用价值和资源现状,人工培养的菌丝体具有巨大的潜在价值,对于菌丝体与子实体药用价值的区别备受关注。本实验以采自长白山的桦褐孔菌子实体及其人工培养的菌丝体为原材料,采用有机溶剂冷浸、超声回流提取法提取桦褐孔菌菌丝体及子实体三萜化合物,对提取的三萜化合物的抗肿瘤和抑菌活性进行比较,旨在为桦褐孔菌菌丝体内三萜类物质的深入研究提供依据。
1 材料与方法
1.1 材料与试剂
桦褐孔菌LNUF008菌株由实验室分离保存。中国典型培养物保藏中心保藏,编号为CCTCC M209280。大肠埃希式杆菌(Escherichia coli)、蜡状芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(B.subtilis)、金黄色葡萄球菌(Staphylococcus aureus)由本实验室提供。人胃癌癌细胞株MGC-803,由辽宁大学陈长兰教授惠赠。
白桦脂醇标准品(纯度为98%) 杭州天草公司;胰蛋白酶、新生小牛血清、Eagle培养基(由Dulbecco改良,DMEM) 美国Gibco公司;RPMI-1640 美国HyClone公司;台盼蓝、青霉素G钠盐、二甲基亚砜(D M S O)、石油醚、氯仿、香草醛、噻唑蓝、溴化钾、浓硫酸、高氯酸、冰乙酸、乙酸乙酯、甲醇、无水乙醇等均为国产试剂纯。
1.2 仪器与设备
DNP-9802电热恒温培养箱 上海精宏实验设备有限公司;RE52CS-2旋转蒸发器、B-260恒温水浴锅 上海亚荣生化仪器厂;SHZ-DⅢ予华牌循环水真空泵 巩义市硬峪予华仪器厂;KQ22DB数控超声波清洗器 昆山市超声仪器有限公司;BB15CO2培养箱 德国Heraeus公司;Multiskan MK3酶标仪 美国Thermo Labsystems公司。
1.3 方法
1.3.1 三萜化合物提取
采用有机溶剂冷浸、超声回流法提取桦褐孔菌体内三萜化合物[6-7],取已收集的桦褐孔菌菌丝体干粉及子实体干粉10g,无水乙醇冷浸24h后,超声回流提取,提取温度为50℃,超声时间1h后,5000r/min离心10min,收集上清液,减压浓缩至干,得到粗三萜化合物,观察其外部形态。称量残渣计算粗三萜化合物回收率。
1.3.2 三萜化合物含量测定
采用分光光度法测定桦褐孔菌三萜化合物的含量,以白桦脂醇标准品作为对照[8]。
标准曲线的制作:精确吸取以无水乙醇溶解的白桦脂醇。对照品标准溶液(0.016mg/mL)0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50、0.55mL,分别置于5mL容量瓶,在100℃水浴上蒸干后加入0.20mL新制的5g/100mL香草醛-冰乙酸溶液和0.80mL高氯酸摇匀,于70℃水浴保温反应15min后流水冷却至室温,再加入乙酸乙酯定量到5mL,摇匀,同时作试剂空白,以试剂空白对照和不同质量浓度水平白桦脂醇对照品溶液分别在400~900nm波长范围内扫描,确定对照品的最大吸收波长为551nm。在551nm波长处以试剂空白为参比,用1cm比色皿测定体系在551nm处的吸光度[9]。以白桦脂醇的毫克数为横坐标,A551nm为纵坐标,建立标准曲线。
三萜化合物含量测定:取适量备用的三萜化合物溶液,按上述操作并在551nm波长处测定吸光度。根据标准曲线计算三萜化合物的含量[10]。
1.3.3 两种来源的桦褐孔菌三萜化合物的薄层层析
将回流提取得到的桦褐孔菌子实体内三萜化合物及菌丝体内三萜化合物分别点样于硅胶层析板上,距端点2~3cm。置于层析缸中,室温展开,取出吹干,喷显色剂,置于烘箱中加热,显色。展层剂:氯仿、乙酸乙酯、乙醚体积比为9:1:1,显色剂:浓硫酸、甲醇体积比为1:1,通过斑点的颜色及位置比较两种粗三萜化合物的组成成分的异同。
1.3.4 两种来源的桦褐孔菌三萜化合物的红外光谱分析
取1~2mg桦褐孔菌三萜化合物样品在玛瑙研钵中,研磨成细粉末与干燥的溴化钾粉末(约100mg,粒度200目)混合均匀,装入模具内,在压片机上压制成片测试。把制备好的样品放入样品架,然后插入仪器样品室的固定位置上,按仪器的操作流程测定。
将桦褐孔菌子实体体内三萜化合物的红外图谱及菌丝体体内三萜化合物的红外图谱相对比,从待测化合物的红外光谱特征吸收频率及红外特性吸收谱带的出现来确定两种来源的三萜化合物的红外光谱是否一致,如果两者光谱吸收峰位置和相对强度基本一致时,可判定待测化合物是相同或近似的同系物。
1.3.5 两种来源的桦褐孔菌三萜化合物的抗癌作用分析
所用癌细胞为胃癌MGC-803。以白桦脂醇为阳性对照通过MTT比色分析法[7]测定桦褐孔菌三萜化合物对癌细胞生长抑制作用。用胰蛋白酶消化汇合的单层细胞,将细胞稀释至1×104CFU/mL,用加样器在平底96孔板中的各孔中加入200μL细胞悬液,于37℃、5% CO2细胞培养箱中温育24h。将各样品稀释5个浓度,做平行实验,每个浓度3次重复,加入孔中。培养68h后每孔中各加入50μL MTT,继续温育4h,离心弃去培养基和MTT,每孔中各加入200μL DMSO,振荡以溶解残留的MTT-甲臜结晶。利用酶标仪测吸光度,计算细胞增殖率。
用胰蛋白酶消化长势良好的单层细胞,吹打成均匀的细胞悬液,平均转入3个细胞培养瓶(A、B、C)中。在培养瓶A中加入新鲜DMEM细胞培养基,培养瓶B中加入新鲜DMEM培养基及桦褐孔菌子实体粗三萜化合物至质量浓度为0.08mg/mL,培养瓶C中加入新鲜DMEM培养基及桦褐孔菌菌丝体粗三萜化合物至质量浓度为0.08mg/mL。于37℃、5% CO2细胞培养箱中温育24h,倒置显微镜下观察细胞长势[11]。
1.3.6 两种来源桦褐孔菌三萜化合物的抑菌作用
抑菌实验方法采用管碟法,混菌平板制好后,用无菌镊子取无菌牛津杯置于混菌平板上,杯中加满试样,细菌在37℃恒温培养箱培养24h后,测量抑菌圈的直径。试样分别为各200μL的桦褐孔菌液体发酵液、桦褐孔菌三萜化合物、子实体三萜化合物,甲醇试剂对照。37℃恒温培养箱培养过夜,24h后观察抑菌实验结果,用十字交叉法测量抑菌圈的直径[12]。
2 结果与分析
2.1 桦褐孔菌三萜化合物的含量测定及形态观察
桦褐孔菌三萜化合物的标准曲线回归方程为y=1.45180.0967(R2=0.9945)。计算提取液的桦褐孔菌菌丝体三萜化合物为93.85mg/g,比子实体中的略高。观察并记录子实体及菌丝体三萜化合物颜色、结晶状态、黏稠度等外部形态,记录如表1所示。
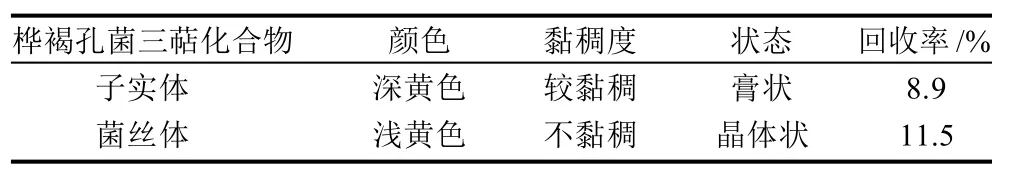
表1 桦褐孔菌三萜化合物比较分析Table 1 Comparative analysis of triterpenoids from cultured mycelia and fruit bodies of Inonotus obliquus
2.2 两种来源的桦褐孔菌三萜化合物的薄层层析结果
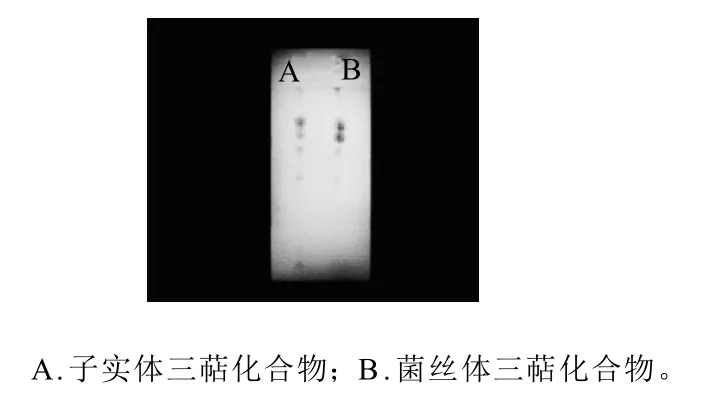
图1 桦褐孔菌子实体与菌丝体三萜化合物TLC结果Fig.1 TLC results of triterpenoids from cultured mycelia and fruit bodies of Inonotus obliquus
将氯仿回流提取得到的桦褐孔菌子实体内三萜化合物及菌丝体内三萜化合物分别点样于硅胶层析板上,展层后显色,结果如图1所示。桦褐孔菌子实体及菌丝体内三萜化合物经薄层层析(TLC)显色后,斑点颜色及Rf值基本一致,初步证明利用氯仿冷浸超声提取法所得三萜类化合物组成成分基本相同。
2.3 两种来源的桦褐孔菌三萜化合物红外光谱分析
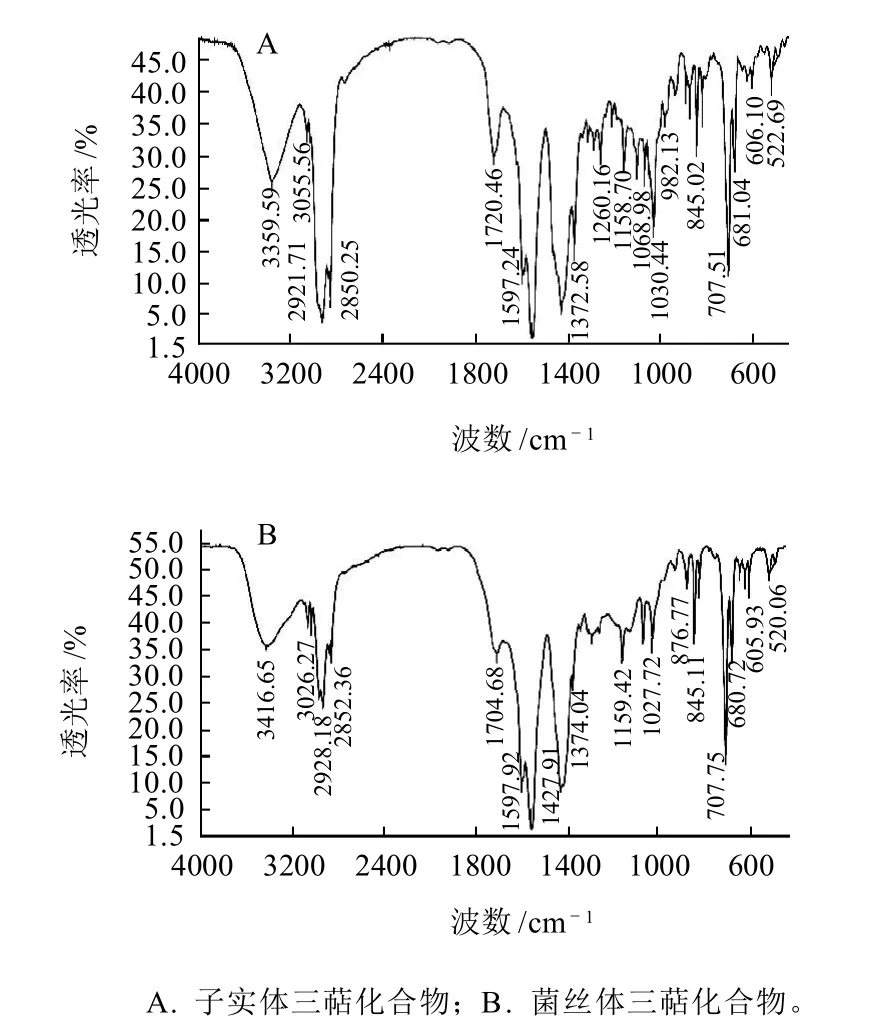
图2 桦褐孔菌体内三萜化合物红外光谱图对比分析Fig. 2 Infrared spectral analysis of triterpenoids from cultured mycelia and fruit bodies of Inonotus obliquus
由图2可知,桦褐孔菌菌丝体及子实体内三萜化合物光谱吸收峰位置和相对强度基本一致,两种来源三萜类物质的红外光谱图都在3050~3057cm-1有烯烃C-H伸缩吸收峰,1060~1070cm-1有羟基吸收峰,1704~721cm-1出现五元环酮的吸收峰等三萜类物质的特征峰并且吸收频率相差不大,由此可判定两种三萜化合物是相同或近似的同系物。
2.4 两种来源的桦褐孔菌三萜化合物抗癌作用分析
采用MTT比色分析法,通过对桦褐孔菌子实体三萜化合物与菌丝体三萜化合物对胃癌MGC-803细胞增殖作用的抑制率的测定,两种三萜化合物的对比关系如图3所示。

图3 桦褐孔菌三萜化合物抑制胃癌细胞MGC-803增殖效果对比Fig. 3 Comparison of inhibitory effects of triterpenoids from cultured mycelia and fruit bodies of Inonotus obliquus on the proliferation of gastric cancer cell MGC-803
由图3可知,桦褐孔菌子实体及菌丝体内三萜化合物对胃癌MGC-803细胞增殖均具有抑制作用。两种三萜化合物的抑制率随着质量浓度的升高显着上升,当三萜化合物的质量浓度达到0.16mg/mL后,随着质量浓度的升高上升速度逐渐缓慢。当质量浓度到达0.32mg/mL菌丝体和子实体三萜化合物对胃癌细胞抑制率分别为(38.3±2.3)%和(28.4±1.9)%,根据统计学原理,采用统计学软件SPSS 17.0处理,组间比较采用t检验,P<0.05表示差异有统计学意义,P<0.01表示差异极显着,检验结果表明桦褐孔菌菌丝体和子实体三萜化合物对胃癌细胞抑制率的差异极显着(P=0.002),其中菌丝体三萜化合物抑制率更高。对照组白桦脂醇的抑制效果明显低于实验组,这可能由于多种三萜类化合物的协同抑癌效果优于单一的三萜化合物白桦脂醇的抑癌效果。
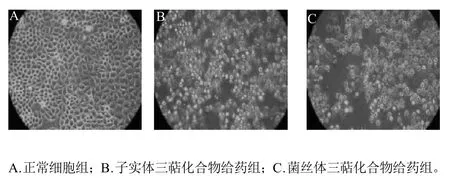
图4 桦褐孔菌三萜化合物抑制胃癌细胞MGC-803显微观察图Fig.4 Microscopic images of gastric cancer cell MGC-803 suppressed by triterpenoids from Inonotus obliquus
将正常细胞及加药细胞于细胞培养箱中培养24h,在倒置显微镜下观察细胞长势。由图4可知,加药细胞明显增殖速度缓慢,细胞壁皱缩,细胞小,胞质突起,细胞器完整,胞膜完整。据细胞形态初步判断,桦褐孔菌三萜化合物可能是通过诱导细胞凋亡,以抑制癌细胞生长。由实验可知,桦褐孔菌菌丝体三萜化合物对癌细胞生长抑制能力高于子实体内三萜化合物。
2.5 两种来源的桦褐孔菌三萜化合物的抑菌活性研究
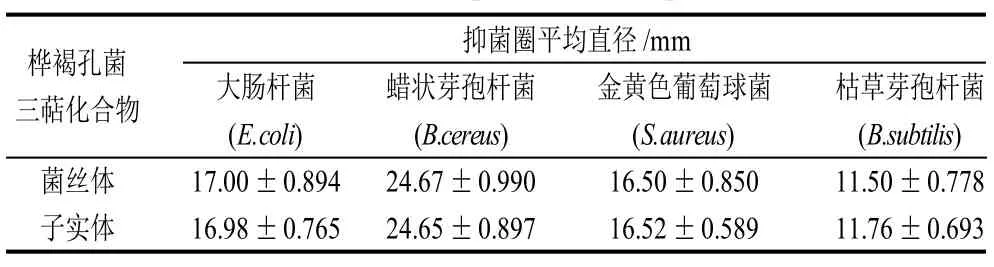
表2 桦褐孔菌三萜化合物对4种细菌的抑制效果Table 2 Inhibitory effects of triterpenoids from cultured mycelia and fruit bodies of Inonotus obliquus on four species of bacteria
由表2可知,桦褐孔菌三萜化合物对蜡状芽孢杆菌(B.cereus)的抑菌效果具有差异性,对其他3种细菌的抑菌效果具有显着性,组间比较对大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)的抑制效果差异不显着,说明桦褐孔菌三萜化合物对大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)的抑制效果相差不大,对枯草芽孢杆菌(B.cubtilis)的抑制效果同其他3种细菌相比较最差,抑菌圈直径仅为11.76mm,对蜡状芽孢杆菌(B.cereus)的抑制效果最为显着,抑菌圈直径为24.67mm。实验显示桦褐孔菌子实体与菌丝体中的三萜化合物的抑菌效果相当,没有明显区别。
3 结论与讨论
采用本实验室优化的桦褐孔菌三萜化合物的提取方法,即用无水乙醇冷浸24h,50℃超声回流提取1h,所得的桦褐孔菌三萜化合物产率最佳,提取的桦褐孔菌菌丝体三萜化合物可达到93.85mg/g,用乙醇作溶剂,避免使用其他有毒有害的试剂,降低了毒性。采用杯碟法测定桦褐孔菌菌丝体及子实体三萜化合物对大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、蜡状芽孢杆菌(B.cereus)、枯草芽孢杆菌(B.subtilis)均有一定的抑制作用,其中对蜡状芽孢杆菌(B.cereus)的抑制效果最为显着,抑菌圈直径为24.67mm。通过MTT比色法测定三萜化合物对人胃癌细胞株MGC-803的最高抑制率可达到38.27%,并且实验证实桦褐孔菌菌丝体三萜化合物对癌细胞生长抑制能力高于子实体三萜化合物。
综上所述,桦褐孔菌发酵菌丝体中的三萜化合物含量高、抗癌抗肿瘤功效显着,优于子实体内三萜化合物。两种来源的三萜化合物的抑菌活性差异不显着。因此,利用桦褐孔菌的深层菌体发酵培养代替有限的野生子实体资源,生产三萜类活性物质合理可行,为桦褐孔菌产品的进一步开发提供了新的途径。经过近几年国内外的研究,特别是欧美国家,人们已经从桦褐孔菌中提取到多种有效成分,进行临床实验,证实桦褐孔菌具有很好治疗糖尿病、防止高血压、抗癌、抗衰老、有效抑制传染性病毒等作用[4,13-15]。鉴于桦褐孔菌的开发应用前景,今后应进一步对桦褐孔菌进行更加深入系统的研究,开发研制桦褐孔菌系列保健医药食品[16-17],使其为人类防病治病发挥更大的作用。
[1] 李建光, 司俊娜, 高愿军. 桦褐孔菌研究综述[J]. 安徽农业科学, 2008,36(2): 571-572; 582.
[2] HYUN K W, JEONG S C, LEE D H, et al. Isolation and characterization of a novel plateletag gregation inhibitory peptide from the medicinal mushroom,Inonotus obliquus[J]. Peptides, 2006, 27: 1173-1178.
[3] KIM Y O, HAN S B, LEE L W, et al. Immuno-stimulating effect of the endopolysaccharide produced by submerged culture ofInonotus obliquus[J]. Life Sciences, 2005, 77: 2438-2456.
[4] SONG Yana, HUI Jing, KOU Wei , et al. Identification ofInonotus obliquusand analysis of antioxidation and antitumor activities of polysaccharides[J]. Current Microbiology, 2008, 57(5): 454-462.
[5] 陈艳秋, 李玉. 桦褐孔茵的研究进展[J]. 微生物学通报, 2005, 32(2):124-127.
[6] 潘春丽, 查勇, 张鑫, 等. 桦褐孔菌三萜化合物提取工艺的优选[J].生物加工过程, 2008, 6(4): 36-39.
[7] 田明月, 俞力, 徐秀泉. 正交设计法优化桦褐孔菌总三萜超声提取工艺[J]. 中国实验方剂学杂志, 2011, 17(12): 31-33.
[8] 周俐斐, 芦柏震, 侯桂兰. 中药三萜类化合物的提取分离及测定方法研究进展[J]. 中药与天然药物, 2007, 19(3): 62-65.
[9] 沈思, 李孚杰, 梅光明, 等. 茯苓皮三萜类物质含量的测定及其抑菌活性的研究[J]. 食品科学, 2009, 30(1): 95-98.
[10] 李 淼, 鲁战会, 孔晓玲, 等. 野生与人工栽培桦褐孔菌提取物抗糖基化终产物及降血压活性比较[J]. 食品科技, 2010, 35(11): 198-202.
[11] 沈蕾. 细胞凋亡与肿瘤的关系[J]. 临床儿科杂志, 2002, 20(l0): 638-640.
[12] 刘高强, 章春莲, 彭广生. 赤芝菌体中三萜抑菌作用研究[J]. 时珍国医国药, 2008, 19(11): 2578-2579.
[13] 李英秀, 崔基成, 孔东植. 桦褐孔菌提取物对胃癌MGC-803细胞株的抗增殖与诱导作用[J]. 菌物研究, 2003, 1(1): 17-23.
[14] 孙常松, 李玛琳. 五环三萜类化合物抗肿瘤活性及其机制研究进展[J]. 中国民族民间医药, 2009, 18(12): 14-15.
[15] ZHENG Weifa, ZHANG Meimei, ZHAO Yanxia, et al. Accumulation of antioxidant phenolic constituents in submerged cultures ofInonotus obliquus[J]. Bioresource Technology, 2009, 100: 1327-1335.
[16] WASSER S P. Medicinal mushrooms as a source of antitumor and immunmodulating polysaccharrides[J]. Apple Microbool Biotechnol,2002, 60: 258.
[17] 卢丹, 刘金平, 李平亚. 三萜类化合物抗癌活性研究进展[J]. 特产研究, 2010, 1(1): 65-68.
Extraction and Bioactivity of Triterpenoids from Fruit Bodies and Mycelia ofInonotus obliquus
ZHU Chun-yu,ZHENG Fang-liang,SHAO Li-jie,FENG Hua-wei,GUO Li-xiong,LIU Hong-sheng*
(Key Laboratory of Animal Resource and Epidemic Disease Prevention, Research Center for Computer Simulating and Information Processing of Bio-Macromolecules of Liaoning, College of Life Science, Liaoning University, Shenyang 110036, China)
In order to explore the difference in medicinal value of cultured mycelia and fruit bodies ofInonotus obliquus, organic solvent cold soaking and ultrasonic reflux were adopted to extract triterpenoids from fruit bodies and mycelia ofInonotus obliquus. The triterpenoids extracted from both sources were determined to be the same or similar homologues by thin layer chromatography (TLC) and Fourier transform infrared (FT-IR) spectral analysis. Both triterpenoid extracts could inhibit the growth of cancer cells and bacteria as determined by tetrazolium salt assay (MTT) and cylinder plate method. The highest inhibitory rate of triterpenoids to human gastric cancer cell line MGC-803 reached up to 38.27%. Therefore cultured mycelia ofInonotus obliquushave the same medicinal value as fruit bodies.
Inonotus obliquus;triterpenes;anti-tumor activity;anti-bacterial activity
Q541
A
1002-6630(2012)15-0161-05
2011-09-28
辽宁省教育厅重点实验室项目(2009S043);辽宁大学青年科研基金项目(488020)
朱春玉(1978—),女,副教授,博士,研究方向为资源微生物学及病毒学。E-mail:zhuchunyu@lnu.edu.cn
*通信作者: 刘宏生(1963—),男,教授,博士,研究方向为资源微生物学及病毒学。E-mail:hongshengl@126.com



