何 娇,黄广民*
(海南大学食品学院,海南 海口 570228)
毛薯粉浆酶法水解的响应面法优化及其动力学研究
何 娇,黄广民*
(海南大学食品学院,海南 海口 570228)
考察毛薯酶法水解液化条件及对酶解动力学进行研究。采用液态高温α-淀粉酶在高温下作用于毛薯粉浆,通过响应面法确定毛薯粉浆最佳水解工艺条件,并对毛薯粉浆酶法水解液化过程进行动力学分析。结果表明:加酶量0.15mL/g、水解温度90℃、pH6.0、毛薯粉浆质量浓度70mg/mL、水解时间50min,毛薯粉浆糖化率可达55.69%。动力学研究表明,米氏常数Km=69.97mg/mL,最大反应速率vm=1.413mg/(mL·min)。
毛薯;响应面;酶解;动力学
目前化石能源的日趋枯竭,开发新能源已成为各国竞相发展的战略决策。开发利用生物质能源是新能源的重要内涵,燃料乙醇是生物质能源的重要组成部分。我国是一个人多地少的国家,粮食供给仅处于紧平衡,没有富余的粮食可供酿制乙醇,发展燃料乙醇产业必须坚持不与人畜争粮食的原则。走非粮型燃料乙醇的道路,是我国开发生物质能源的必然选择。充分利用非粮型高糖、高碳水化合物资源,开发燃料乙醇,对我国燃料乙醇产业规模的拓展及可持续发展至关重要。
毛薯(Dioscorea esculenta (Lour) Burkill)为薯蓣科薯蓣属藤本植物,有甜薯和蒂薯两种。蒂薯属革质攀援藤本,蔓长130~150cm,每株结薯约10个。薯块椭圆或长圆形,味稍淡而甜,煮熟后难脱皮。甜薯属攀绕藤本,茎蔓青紫色,蔓长100~130cm;薯皮革质,肉质细软,糖分高,味甜可口,煮熟后易脱皮。熟吃毛薯能健脾止泻,益肺滋肾,解毒敛疮[1]。自古以来,一直是海南岛上居民的农家杂粮,一年四季均可食用。海南岛优越的地理气候环境,赋予毛薯速生快长的条件,现已成为海南省的一大特产。全省年种植面积2.7万亩以上,亩产鲜薯约2500kg。
海南毛薯富含糖和淀粉,适用于制备燃料乙醇。利用毛薯制备燃料乙醇,须先将毛薯淀粉糖化,使其转化为酵母可发酵的糖类,再接种发酵制备乙醇。酶法水解具有反应条件温和,催化效率高和产物专一性而被广泛用于粮食发酵制备乙醇工业。工业上常采用液态高温α-淀粉酶将粮食淀粉一次性糊化和液化,再用糖化酶糖化,糖化液经接种发酵就可制备乙醇。毛薯含有大量黏性成分,毛薯淀粉被这些黏性成分包埋,液态高温α-淀粉酶很难作用于毛薯淀粉,使其中的淀粉液化,不能简单地套用液态高温α-淀粉酶液化粮食淀粉制备乙醇的工艺。本实验拟采用液态高温α-淀粉酶在高温下作用于毛薯粉浆,通过响应面法确定毛薯粉浆最佳水解工艺条件,并对毛薯粉浆酶法水解液化过程进行动力学分析,以期为毛薯的开发利用提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
新采收的毛薯,洗净、切片、烘干,粉碎至80~100目,得含水量为8%~10%,备用。
苯酚、亚硫酸氢钠、3,5-二硝基水杨酸、盐酸、氢氧化钠、酒石酸钾钠、葡萄糖、磷酸氢二钠、柠檬酸等,所有试剂均为分析纯;液态高温α-淀粉酶(15183U/mL) 山东枣庄市杰诺生物酶有限公司。
1.2 仪器与设备
280-型齿爪式粉碎机 广州广莱农业机械设备有限公司;721-型分光光度计 上海精密科学仪器有限公司; 601BS-型恒温水浴锅 江苏省金坛市晨阳电子仪器厂。
1.3 毛薯粉中淀粉含量的测定[2-3]
毛薯粉中淀粉含量的测定方法按GB/T 5009.9—2003《食品中淀粉的测定》进行。即准确称取5.0000g毛薯粉于装有慢速滤纸的三角漏斗中,用30mL乙醚分数次洗去脂肪,用150mL乙醇分数次洗去糖类,再用100mL水分数次洗涤残渣,转入250mL锥形瓶,加入30mL 6mol/L盐酸,于沸水浴中回流2h,得毛薯淀粉水解液,迅速冷却,加2滴甲基红指示剂,分别用氢氧化钠和盐酸溶液调节pH值至7.0,加20mL乙酸铅溶液(200g/L),摇匀,静置10min,用20mL硫酸钠(100g/L)溶液除去过量的铅。将溶液及残渣全部转入500mL容量瓶,加水稀释定容。过滤,弃去初滤液20mL,滤液供测定用。
准确吸取5.0mL滤液于100mL容量瓶,加蒸馏水稀释定容,摇匀。再准确吸取1.0mL稀释液于50mL容量瓶,采用DNS比色法测定其吸光度,根据吸光度对葡萄糖质量浓度的回归方程,计算出滤液中总还原糖的含量,所得结果再乘以0.9可得到毛薯中淀粉的含量,实测得毛薯粉中淀粉含量为77.87%。
1.4 毛薯粉浆的液化方法[4-8]
1.4.1 葡萄糖溶液标准工作曲线的绘制[9-11]
在0~2.0mL范围,按0.1mL增序,分别准确吸取质量浓度为1.0mg/mL的葡萄糖标准溶液于50mL容量瓶,加入1.5mL DNS溶液,2.0mL蒸馏水,使葡萄糖质量浓度分别为0~0.04mg/mL,在100℃水浴中加热5min,迅速冷却,加蒸馏水稀释定容。选择1cm比色皿,在480nm波长处测定吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标,绘制标准工作曲线。作一元回归分析,得吸光度对葡萄糖质量浓度的回归方程为:
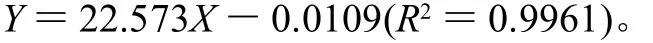
1.4.2 毛薯粉浆的液化
分别准确称取5.0000g毛薯粉于三颈烧瓶,加入一定量的磷酸二氢钠-柠檬酸缓冲溶液,搅拌成浆状,调节至适当的pH值,搅拌中升温至合适的温度,加入适量的液态高温α-淀粉酶,水解一定时间,水解液转入250mL容量瓶,加蒸馏水稀释定容,备用。
1.4.3 毛薯粉浆糖化率的测定方法[12-13]
分别准确吸取5.0mL毛薯淀粉液于100mL容量瓶,加蒸馏水稀释定容,摇匀。再准确吸取1.0mL此稀释液于50mL容量瓶,加入1.5mL DNS溶液,2.0mL蒸馏水,以沸水浴加热5min显色,迅速冷却,加蒸馏水稀释定容,选用1cm比色皿,在480nm波长处,测定其吸光度,同时作空白实验。根据吸光度对葡萄糖质量浓度的回归方程,计算毛薯粉浆的糖化率。
1.4.4 毛薯淀粉液糖化率的计算[14]
根据葡萄糖溶液的吸光度对葡萄糖质量浓度的回归方程:Y=22.573X-0.0109,可导出毛薯粉浆糖化率的计算公式为:
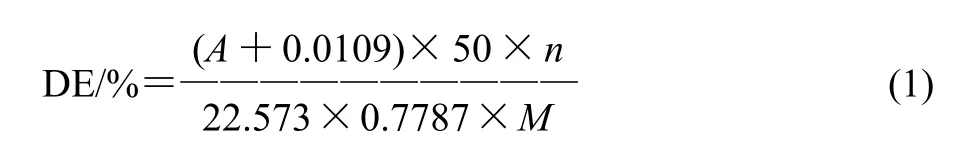
式中:DE为毛薯淀粉液糖化率/%;A为糖化稀释液的吸光度;0.7787为毛薯粉中淀粉含量;n为稀释倍数;M为毛薯粉质量/g。
2 结果与分析
2.1 液态高温α-淀粉酶水解条件
2.1.1 水解温度对毛薯粉浆水解的影响
按照1.4.2节方法,调节粉浆的pH值为6.0,毛薯粉浆质量浓度为50mg/mL,加入预先稀释20倍的液态高温α-淀粉酶0.14mL/g,分别以60~95℃的温度水解50min。水解液按1.4.3节方法测定总还原糖的含量,计算毛薯粉浆的糖化率,结果见图1。
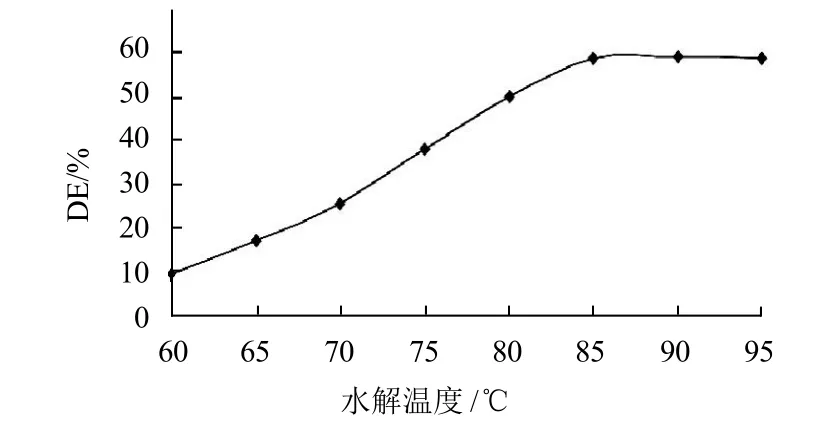
图1 水解温度对毛薯粉浆水解的影响Fig.1 Effect of hydrolysis temperature on the degree of hydrolysis Dioscorea esculenta (Lour) Burkill tubers
由图1以看出,水解温度小于85℃时,毛薯粉浆的糖化率随着水解温度的增大呈线性增大;水解温度为85℃时,毛薯粉浆的糖化率达到最大值,说明在该温度下,液态高温α-淀粉酶的活力最大;水解温度大于85℃时,随着水解温度的增大,毛薯粉浆的糖化率几乎保持不变。这一现象与酶促反应的普遍规律非常吻合。在酶促反应中,温度升高反应速度加快与使酶失活这两个相反的影响同时存在。温度升高,毛薯粉浆中淀粉粒运动加快,使得酶与淀粉分子中的α-1,4糖苷键的接触几率增加,反应速度加快。但并非温度越高越好,若水解温度过高,超过某一范围时,酶蛋白将逐渐变性失活,影响反应的进行。而这个温度是酶的最适作用温度,即毛薯粉浆最适宜的酶解温度为85℃。
2.1.2 粉浆的pH值对毛薯粉浆水解的影响
按照1.4.2节方法,分别调节粉浆的pH值为3.6~7.2,以85℃水解,其他条件同2.1.1节。测定毛薯粉浆的糖化率,其结果见图2。
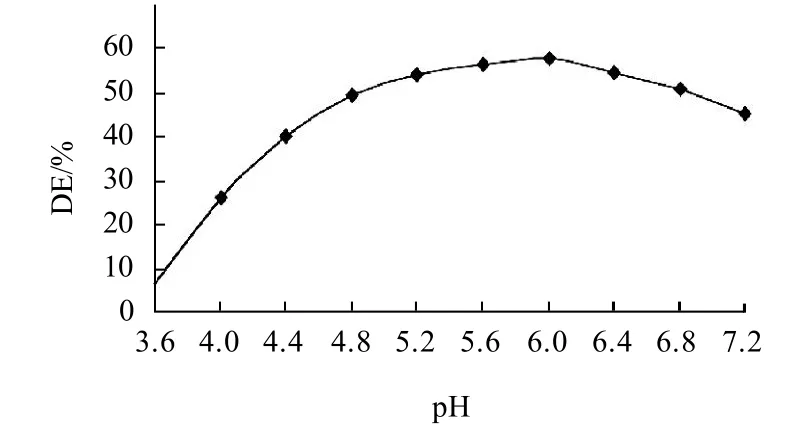
图2 pH值对毛薯粉浆水解的影响Fig.2 Effect of hydrolysis pH on the degree of hydrolysis of Dioscorea esculenta (Lour) Burkill tubers
由图2以看出,毛薯粉浆的pH值对液态高温α-淀粉酶的活力影响极大。毛薯粉浆pH值小于6.0时,毛薯粉浆的糖化率随着粉浆pH值的增大呈线性增大;毛薯粉浆的pH值为6.0时,毛薯粉浆的糖化率达到最大值,表明液态高温α-淀粉酶在此pH值时对毛薯淀粉作用的效果最佳。这与酶的性质有关,即在此pH值,酶的活力最大,pH值高于或低于该值,都会改变酶的活性中心构象,甚至改变酶分子结构使其变性失活。pH值还会影响淀粉分子的结构形态,淀粉分子上某些基团只有在一定的结构形态下,才适宜与酶结合而发生水解反应[13]。因此液态高温α-淀粉酶水解毛薯粉浆最佳pH值为6.0。
2.1.3 底物质量浓度对毛薯粉浆水解的影响
按照1.4.2节方法,调节粉浆pH值为6.0,分别控制毛薯粉浆质量浓度为10~130g/mL,其他条件同2.1.2节,计算毛薯粉浆的糖化率,其结果见图3。
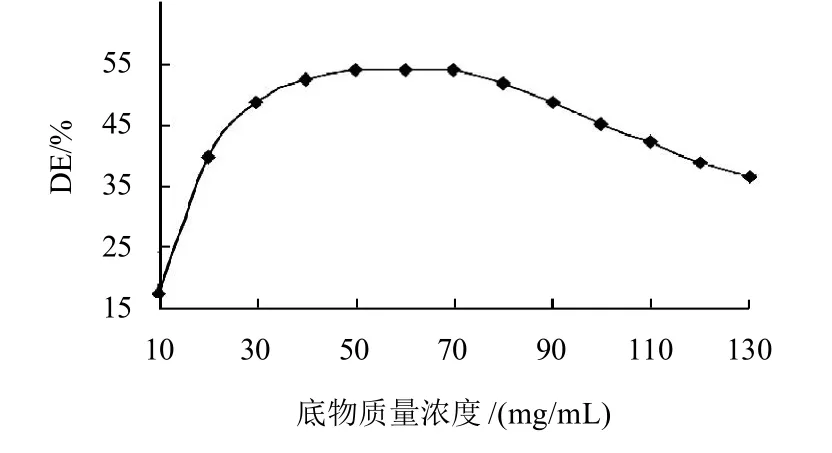
图3 底物质量浓度对毛薯粉浆水解的影响Fig.3 Effect of substrate concentration on the degree of hydrolysis of Dioscorea esculenta (Lour) Burkill tubers
由图3以看出,毛薯粉浆质量浓度小于40mg/mL时,随着底物质量浓度的增大,毛薯粉浆的糖化率呈线性增大;毛薯粉浆质量浓度达到40mg/mL时,酶与底物能完全结合,水解生成葡萄糖的量达到最大,毛薯粉浆的糖化率达到最大值。此后,随着毛薯粉浆质量浓度的增大,毛薯粉浆的糖化率几乎保持不变。当毛薯质量浓度大于70mg/mL时,随着毛薯粉浆质量浓度的增大,毛薯粉浆的糖化率呈线性下降。其原因在于毛薯粉浆质量浓度过高,黏度过大,流动性差,α-淀粉酶在反应系统中运动速度过慢,酶与淀粉接触几率减小,不利于水解反应的进行。为提高毛薯粉浆的糖化率,毛薯粉浆的最佳质量浓度应为70mg/mL。
2.1.4 加入液态高温α-淀粉酶的量对毛薯粉浆水解的影响
按照1.4.2节方法,毛薯粉浆质量浓度为70g/mL,分别加入预先稀释20倍的液态高温α-淀粉酶0.02~0.24mL/g,其他条件同2.1.3节,计算毛薯粉浆的糖化率,其结果见图4。
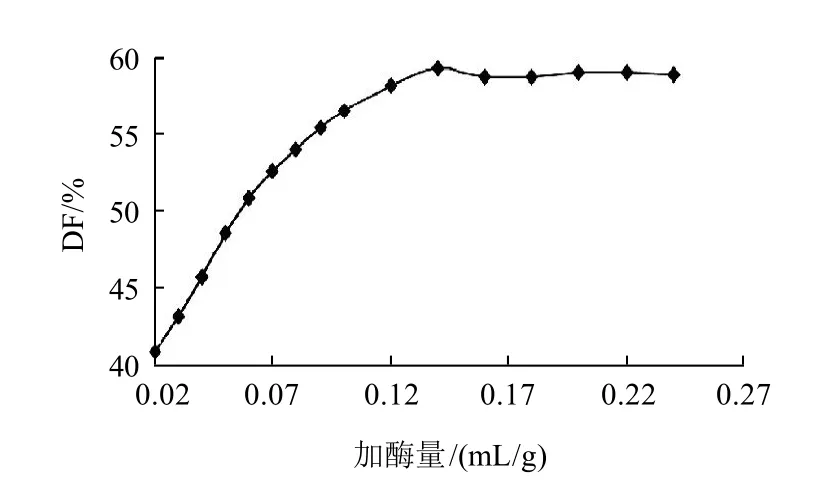
图4 加入液态高温α-淀粉酶的量对毛薯粉浆水解的影响Fig.4 Effect of α-amylase amount on the degree of hydrolysis of Dioscorea esculenta (Lour) Burkill tubers
由图4以看出,液态高温α-淀粉酶加酶量小于0.14mL/g时,随着加酶量的增加,毛薯粉浆的糖化率呈线性迅速增大;液态高温α-淀粉酶加酶量为0.14mL/g时,毛薯粉浆的糖化率达到最大值;液态高温α-淀粉酶加酶量大于0.14mL/g时,继续增加酶量,毛薯粉浆的糖化率几乎保持不变。这是因为底物浓度恒定时,参与酶解反应的位点总是一定的,其底物分子中的α-1,4糖苷键已被饱和,即使继续增加酶量,水解产物的量也不会发生变化。所以为节省成本,液态高温α-淀粉酶加酶量应为0.14mL/g。
2.1.5 水解时间对毛薯粉浆水解的影响
按照1.4.2节方法,加入预先稀释20倍的液态高温α-淀粉酶0.14mL/g,水解时间10~100min其他条件同2.1.4节,计算毛薯粉浆的糖化率,结果见图5。
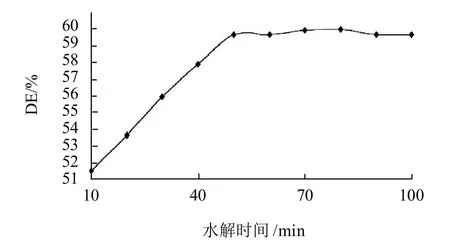
图5 水解时间对毛薯粉浆水解的影响Fig.5 Effect of hydrolysis time on the degree of hydrolysis of Dioscorea esculenta (Lour) Burkill tubers
由图5以看出,水解时间小于50min时,毛薯粉浆的糖化率随着水解时间的延长呈线性增大,水解时间为50min时达到最大值;继续延长水解时间,毛薯粉浆的糖化率几乎变化不大。据张国权等[15]的荞麦淀粉耐高温α-淀粉酶液化工艺条件研究报道,其主要原因是耐高温α-淀粉酶对长链淀粉或糊精水解的速度要比短链淀粉速度快,随着水解的进行,淀粉液中短链淀粉产物的数量逐渐增加,水解的速率逐步减慢。另是淀粉中含有α-1,6糖苷键,也会影响酶解速度。因此,为节约能耗,毛薯粉浆液化水解时间应为50min。
2.2 毛薯粉浆液态高温α-淀粉酶水解条件优化
2.2.1 毛薯粉浆水解条件响应面优化[16]
根据上述单因素试验分析,影响毛薯粉浆水解的因素诸多。如加酶量、粉浆的pH值、水解温度、水解时间、毛薯粉浆质量浓度都是影响因素。为优化毛薯粉浆的水解条件,利用Design-Expert 7.1.6软件,采用中心组合试验设计(central composite design,CCD),分别以加入液态高温α-淀粉酶的量(A)、水解温度(B)、毛薯粉浆的pH值(C)和毛薯粉浆质量浓度(D)为自变量,毛薯粉浆的糖化率(Y)为响应值。采用4因素5水平的响应面分析法,确定最佳水解条件,试验因素水平设计见表1。
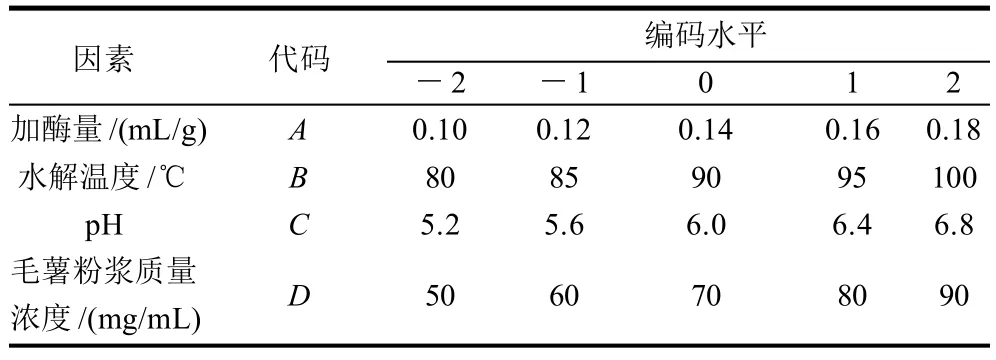
表1 毛薯粉浆酶解条件响应面分析因素和水平表Table 1 Factors and levels of response surface analysis
2.2.2 响应面模型的建立及显着性分析[17]
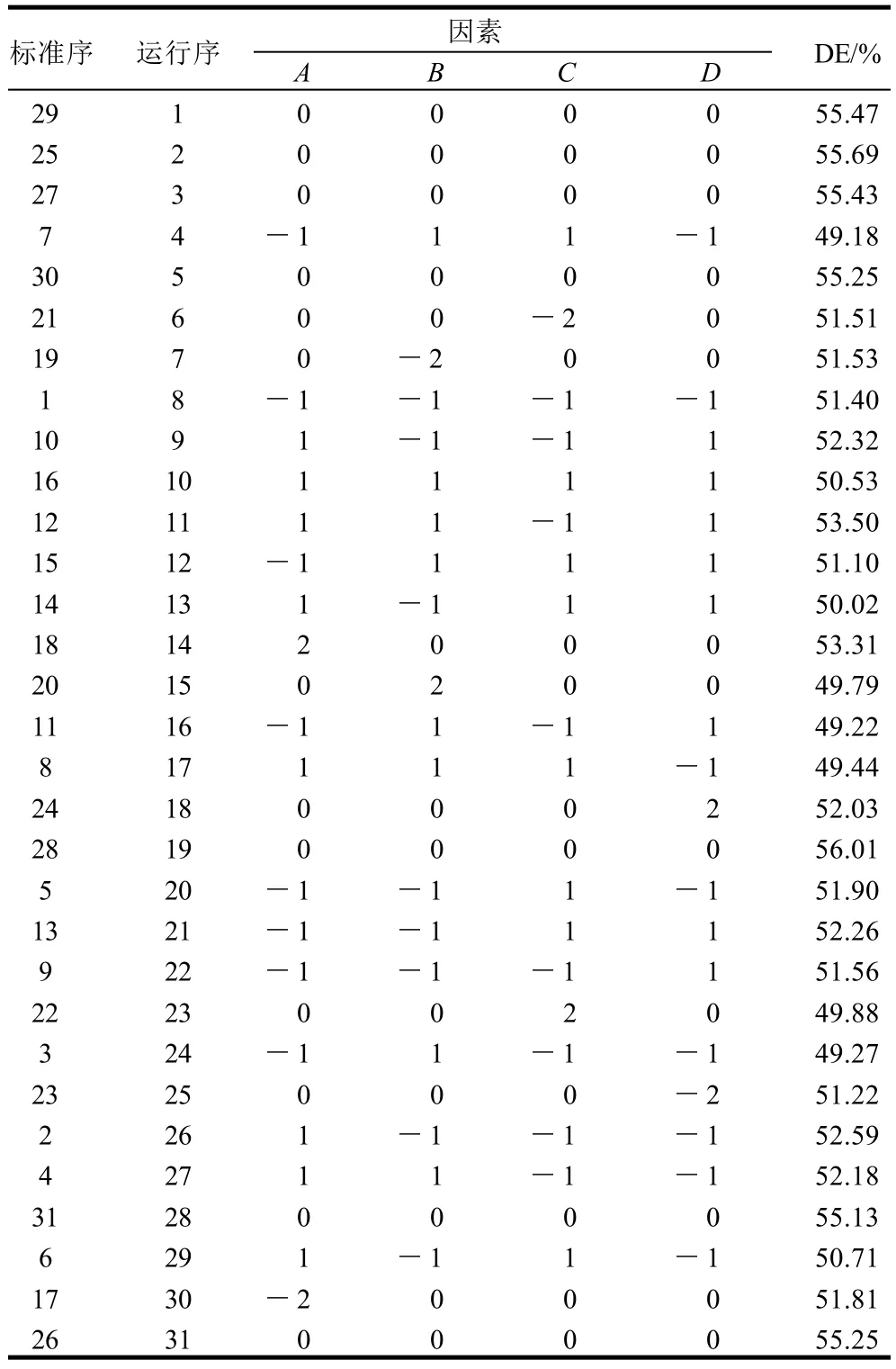
表2 毛薯粉浆酶解条件中心组合试验设计及结果Table 2 Central composite design and corresponding results
中心组合试验结果见表2,将数据用Design-Expert软件进行多元回归拟合,得到以毛薯粉浆糖化率为目标函数Y的二次多项回归方程:
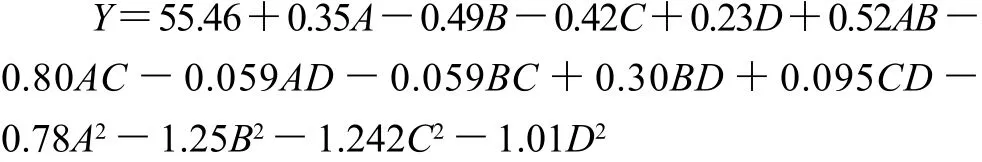
由方程可看出,各因素对毛薯粉浆糖化率的影响顺序为:水解温度(B)>粉浆pH值(C)>加酶量(A)>毛薯粉浆的质量浓度(D)。
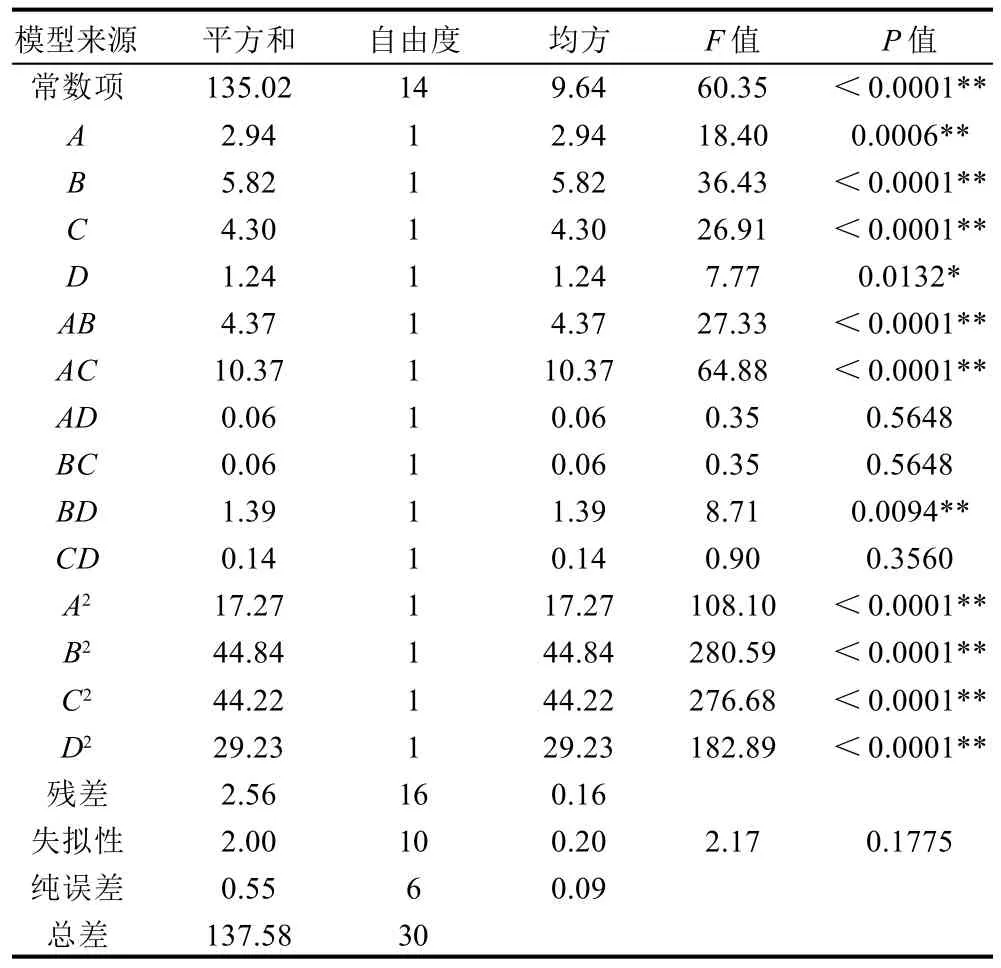
表3 二次回归模型的方差分析结果Table 3 Variance analysis of the fitted quadratic regression model
由表3可知,该模型表现为极显着(P<0.0001);失拟性表现为不显着(P=0.1775);R2和RAdj2分别为0.9814和0.9652,说明该模型拟合度良好,其响应值的98.14%都来自所选因变量,其模型能很好的反映因变量与响应值的关系;而预测拟合度为0.9106,说明该模型预测性良好,其所得预测结果能表现试验的最佳条件。从表中可以看出其中A、B、C、AB、AC、BD、A2、B2、C2、D2对响应值值有极显着的影响(P<0.01),D对相应值则差异显着(P<0.05),其他因素AD、BC、CD间的交互影响表现为不显着(P>0.05)。
2.2.3 因素的响应面分析及最优条件的确定[18]
利用Design-Expert软件,通过多元回归方程做出对毛薯粉浆的糖化率影响极显着的因素响应面图和等值图,如图7所示。
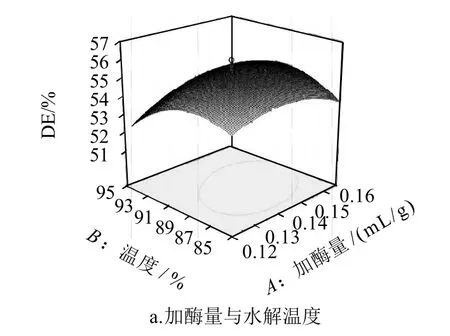
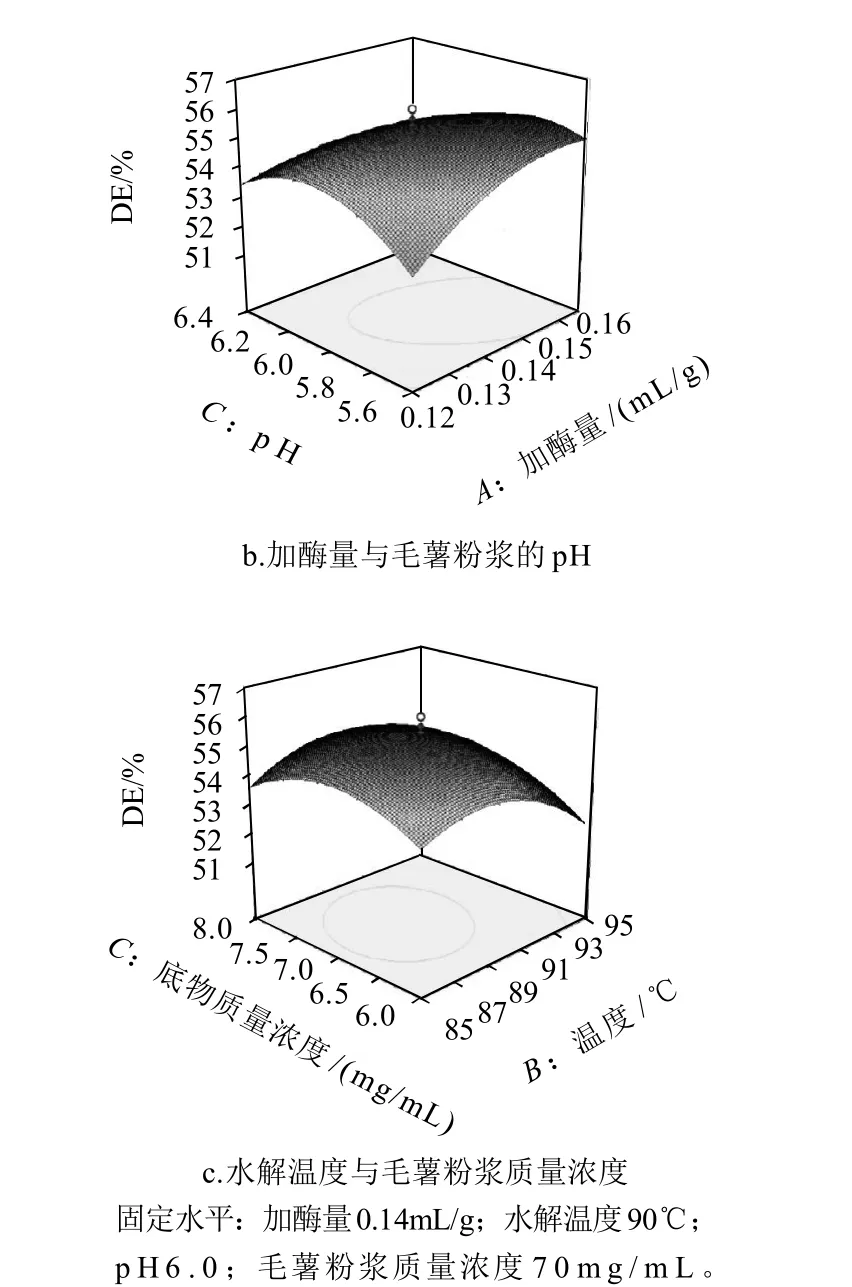
图7 各因素交互作用对糖化率值的影响的响应面图Fig.7 Response surface plots for the interactive effects of hydrolysis conditions on the degree of hydrolysis of Dioscorea esculenta (Lour) Burkill tubers
从图7可以看出,糖化率的等值曲线最圆则相互影响最小,而AC的最扁平,则相互影响最大。
图7a表明,加入液态高温α-淀粉酶的量不变时,毛薯粉浆的糖化率随着水解温度的增大而呈线性增大;水解温度大于92℃时,毛薯粉浆的糖化率 随着水解温度的增大而逐渐减小,故水解温度为87~92℃,加酶量在0.13~0.15mL/g时,毛薯粉浆的糖化率达到最大值。
图7b表明,加入液态高温α-淀粉酶的量不变,毛薯粉浆的糖化率随着粉浆的pH值增大而呈线性增加,pH值大于6.2时,毛薯粉浆的糖化率随着粉浆pH值的增大而逐渐减小;当粉浆的pH值为5.8~6.2,加酶量为0.13~0.16mL/g时,毛薯粉浆的糖化率达到最大值。
图7c表明,水解温度不变时,毛薯粉浆的糖化率随着毛薯粉浆质量浓度的增大而呈线性增大;毛薯粉浆质量浓度大于75mg/mL时,毛薯粉浆的糖化率随着毛薯粉浆质量浓度的增大而逐渐减小。水解温度在86~90℃,毛薯粉浆质量浓度在62~76mg/mL时,毛薯粉浆的糖化率达到最大值。
通过软件分析,得到加入液态高温α-淀粉酶的量0.15mL/g、水解温度89.43℃、粉浆pH5.9、毛薯粉浆质量浓度为70.7mg/mL、水解时间50min,毛薯粉浆的糖化率可达55.61%。取整后得毛薯粉浆最佳水解条件为:加酶量0.15mL/g,水解温度90℃、粉浆pH6.0、水解时间50min,毛薯粉浆质量浓度为70mg/mL。在该条件下,液态高温α-淀粉酶能很好地作用于毛薯粉浆,其糖化率最高,达到55.69%[18-19]。
2.3 液态高温α-淀粉酶水解毛薯粉浆的动力学分析
2.3.1 毛薯粉浆水解动力学模型建立[20-25]
以响应面分析法优化取整所得的最佳结果,选择水解温度为90℃、毛薯粉浆pH6.0、水解时间50min、加酶量0.15mL/g,分别考察底物浓度对液态高温α-淀粉酶水解毛薯粉浆的反应速率。根据毛薯粉浆质量浓度与毛薯粉浆的糖化率的关系,分别计算单位时间、单位体积内总还原糖的生成量,即葡萄糖生成速率。不同毛薯粉浆质量浓度酶水解反应速率见图8[26]。
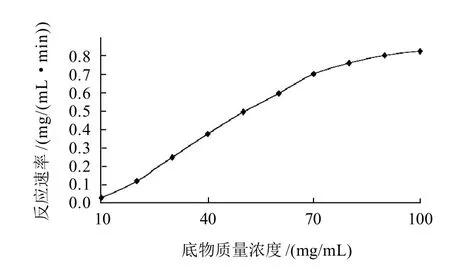
图8 底物质量浓度与反应速率的关系Fig.8 Relationship between reaction velocity and substrate concentration
从图8可以看出,反应初始时,随着底物质量浓度的增加,酶解速率迅速增大,即葡萄糖生成速率呈线性增大;当底物质量浓度达到一定值,酶完全与底物结合,此时葡萄糖生成速率达到最大值。此后尽管底物浓度不断增大,反应速率却不再上升而是趋于平缓[27]。反应速率(v)对毛薯粉浆质量浓度[S]呈近似的双曲线关系,符合表征酶促反应特征的米氏方程所绘制的曲线。
以lnv对ln[S]作图得到图9所示直线,可认为在加酶后很短的时间内液态高温α-淀粉酶水解毛薯粉浆遵循一级反应规律。可用米氏方程对试验数据进行拟合。
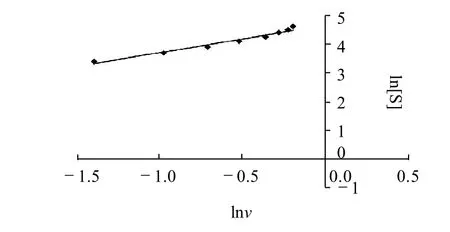
图9 lnv与ln[S]的关系Fig.9 Relationship between lnv and ln[S]
Michaelis-Menten方程提出酶促反应分两步进行:

式(2)中,液态高温α-淀粉酶(E)与毛薯淀粉(S)快速结合生成络合物(ES),而该络合物却以较慢的速度分解为产物(P),同时释放出酶分子(E);k1、k2、k3、k4分别代表各步反应的速率常数。
反应初期,没有反应产物[P]或反应产物浓度[P]很低,k4可忽略不计,故第二步反应可认为是单向不可逆的。由质量守恒定律可得到反应的动力学模型(米氏方程)为:

式(3)中:Km=(k3+k2)/k1,vm=k3[E]总;Km相当于液态高温α-淀粉酶的活性部位一半被毛薯淀粉占据时所需的毛薯粉浆质量浓度;vm表示加入酶的量不变时,液态高温α-淀粉酶被毛薯淀粉饱和,反应速率所达到的最大值。
2.3.2 用Wilkinson[28]统计法求解米氏常数和最大反应速率
Wilkinson统计法包括非线性二乘法求估算解和泰勒展开式求精校解,计算过程分两步,见表4、5。
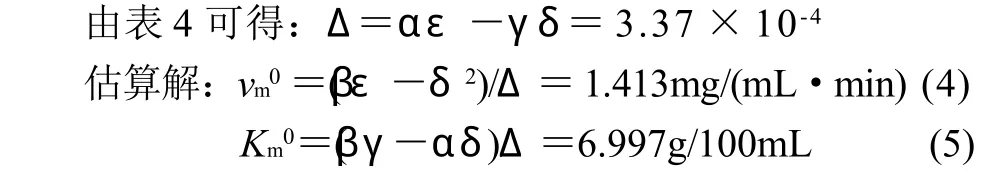
式(4)(5)中:vm0为最大反应速率的估算解;Km0为米氏常数的估算解。
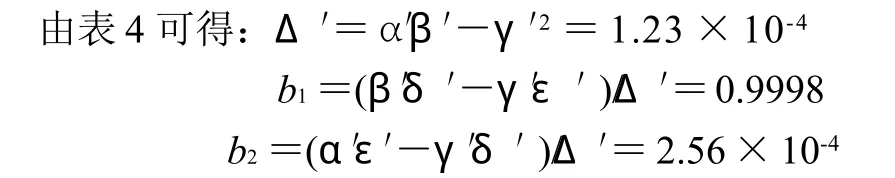
式中:b1、b2分别为vm和Km计算过程中修正常数。
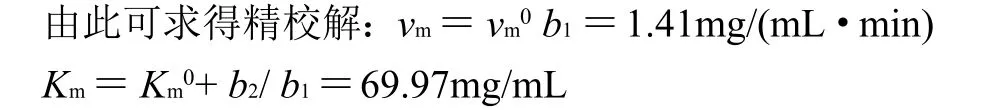
故本实验采用Wilkinson 统计法求解,其结果为:vm为1.413mg/(mL·min),Km为69.97mg/mL。
3 结 论
综上所述,经单因素和响应面分析法对液态高温α-淀粉酶水解毛薯粉浆的条件优化,建立了毛薯粉浆的糖化率与加入酶的量、水解温度、毛薯粉浆质量浓度、粉浆pH值等各因素之间的二次多项式回归模型,取整后得毛薯粉浆最佳水解条件分别为:加酶量0.15mL/g、水解温度90℃、粉浆pH6.0、水解时间50min、毛薯粉浆质量浓度为70mg/mL。在该条件下,其糖化率最高,达55.69%。液态高温α-淀粉酶作用于毛薯粉浆,其酶解反应速率遵循一级反应规律,遵循Michaelis-Menten方程,米氏常数Km=69.97mg/mL,最大反应速率vm=1.413mg/(mL·min)。

表4 Wilkinson法求估算解Table 4 Estimated values of vm and Km by Wilkinson method

表5 Wilkinson法求精校解Table 5 Accurate values of vm and Km by Wilkinson method
上述研究结果表明,液态高温α-淀粉酶作用于毛薯淀粉与作用于粮食淀粉一样,能在高温下一次性将毛薯淀粉糊化和液化,能将粮食淀粉制备乙醇生产工艺直接应用于毛薯淀粉制备乙醇中。这为利用薯蓣科等非粮植物资源制备燃料乙醇提供了依据,且对后续开发利用热带淀粉质生物资源具有良好的应用前景。
[1] 王茀能, 汪飞杰, 王天云. 海南岛大薯毛薯等资源考察初报[J]. 作物品种资源, 1991, 2(3): 8.
[2] 霍兴云, 吴炳炎, 胡学智, 等. QB/T 2306—1997 耐高温α-淀粉酶制剂[S]. 北京: 中国标准出版社, 1997.
[3] 张蔚, 吴炳炎, 郭庆文, 等. GB/T 24401—2009 α-淀粉酶制剂[S].北京: 中国标准出版社, 2009.
[4] 杨小波, 刘敦华. 果胶酶与高效淀粉酶液化澄清枸杞汁的效果对比研究[J]. 食品科技, 2011, 36(5): 95-98.
[5] 陈辉, 磷亲录, 田蔚. 耐高温α-淀粉酶液化大米淀粉制取高麦芽糖浆的工艺研究[J]. 粮食加工报, 2008, 33(3): 39-41.
[6] 王福荣, 唐景春. 耐高温α-淀粉酶活力测定法的研究[J]. 食品与发酵工业, 1995(2): 27-30.
[7] 梁慧, 张贞亮, 刘珊珊, 等. 淀粉糖化工艺研究及制糖业发展现状[J].农产品加工, 2009(8): 36-38.
[8] HIMMEL M E, DING Shuiyou, JOHNSON D K, et al. Biomass recalcit rance: engineering plants and enzymes-forbiofuels production[J]. Science, 2007, 315(15): 804-807.
[9] 黄广民, 刘秋实. 香/芭蕉根部球茎干粉中还原糖含量的测定[J]. 食品科学, 2008, 29(8): 485-488.
[10] 王照利, 吴万兴, 李科有. 魔芋精粉中甘露聚糖含量的测定研究[J].食品科学, 1998, 19(3): 56-58.
[11] 罗志刚, 曾满枝, 凌晨, 等. 3,5二硝基水杨酸比色法测定烟草中水溶性总糖[J]. 中国烟草科学, 2000(2): 34-36.
[12] 钟芳丽, 王慧竹, 王芳. 刺玫果多糖提取工艺的研究[J]. 食品与机械, 2011, 27(1): 43-45.
[13] 张国权, 史一一, 魏益民, 等. 荞麦淀粉的真菌淀粉酶酶解动力学研究[J]. 农业工程学报, 2007, 23(5): 42-46.
[14] 汪东风. 食品化学[M]. 北京: 化学工业出版社, 2007: 62.
[15] 张国权, 史一一, 魏益民, 等. 荞麦淀粉耐高温α-淀粉酶液化工艺条件研究[J]. 中国粮油学报, 2008, 23(3): 73-77.
[16] 涂行浩, 张弘, 郑华, 等. 响应面法优化微波钝化玛珈黑芥子酶活[J].食品科学, 2011, 32(18): 148-152.
[17] 陈琳, 孟祥晨. 响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J]. 食品科学, 2011, 32(3): 176-180.
[18] 王大为, 杜彩霞, 周清, 涛. 响应面法优化玉米皮纤维双螺杆挤出工艺[J]. 食品科学, 2011, 32(18): 6-11.
[19] 王晓阳, 唐琳, 赵垒. 响应面法优化刺玫花多酚的超声提取工艺[J].食品科学, 2011, 32(2): 66-70.
[20] 卢峰波, 刘桂林, 王烁, 等. 响应面法优化果胶酶酶解提取黑莓花色苷的工艺参数[J]. 食品科学, 2010, 31(16):11-15.
[21] 李谊轩, 黄广民. 参薯粉浆酶法水解条件优化与动力学分析[J]. 食品科学, 2011, 32(22): 25-31.
[22] AGBOOLA S O, DALGLEISH D G. Enzymatic hydrolysis of milk proteins used for emulsion formation.1.kinetics of protein break down and storage stability of the emulsions[J]. J Agric Food Chem, 1996, 44 (11): 3631-3636.
[23] FUJII M, MURAKAMI S, YAMADA Y. A kinetic equation for hydralysis of polyssaccharides by mixed exo- and endoenzy mesystems[J]. Biotechnol Bioeng, 1981, 23(6): 1393-1398.
[24] 赵燕, 涂勇刚, 郭建军. 玉米淀粉的β-淀粉酶酶解动力学研究[J]. 食品科学, 2009, 30(17): 190-194.
[25] TURON X, ROJAS O J, DEINHAMMER R S. Enzymatic kinetics of cellulose hydrolysis: AQCM-D study[J]. Langmuir, 2008, 24(8): 3880-3887.
[26] 陈伟, 黄广民. 酶法水解香/芭蕉根部球茎粉浆研究及动力学分析[J].食品科学, 2010, 31(20): 260-264.
[27] 任省涛, 程可可, 宋安东, 等. 蒸汽爆破玉米秸秆酶解动力学[J]. 生物工程学报, 2011, 27(4): 592-597.
[28]夏雨, 徐勇, 李燕杰, 等. 中把大焦淀粉的稳定性及酶解动力学[J].食品科学, 2010, 31(9): 74-78.
Optimization and Kinetics of Enzymatic Hydrolysis of Dioscorea esculenta (Lour) Burkill Tubers
HE Jiao,HUANG Guang-min*
(College of Food Science, Hainan University, Haikou 570228, China)
The hydrolysis of Dioscorea esculenta (Lour) Burkill Tubers by thermostable alpha-amylase for starch liquefaction was optimized by response surface methodology. Meanwhile, the hydrolysis process was studied kinetically. The results showed that under the optimized hydrolysis conditions: enzyme dosage of 0.15 mL/g, hydrolysis temperature of 90 ℃, hydrolysis pH of 6.0, substrate concentration of 70 mg/mL and hydrolysis time of 50 min, the DE (dextrose equivalent) was 55.69%. The vmand Km were determined to be 1.413 mg/(mL·min) and 69.97 mg/mL, respectively.
Dioscorea esculenta (Lour) Burkill;response surface analysis;enzymatic hydrolysis;kinetics
S216.2
A
1002-6630(2012)16-0077-07
2012-04-09
何娇(1987—),女,硕士研究生,主要从事糖及碳水化合物测定研究。E-mail:hejiao_23@163.com
*通信作者:黄广民(1957—),男,研究员,教授,主要从事糖及碳水化合物和生物质能源研究。E-mail:hgmin886699@163.com



