祝儒刚,宋立峰
(1.辽宁大学轻型产业学院,辽宁省食品生物加工工程技术研究中心,沈阳市食品生物加工与质量控制技术重点实验室,辽宁 沈阳 110036;2.辽宁经济职业技术学院,辽宁 沈阳 110122)
肉及肉制品中沙门氏菌活细胞的PCR检测研究
祝儒刚1,宋立峰2
(1.辽宁大学轻型产业学院,辽宁省食品生物加工工程技术研究中心,沈阳市食品生物加工与质量控制技术重点实验室,辽宁 沈阳 110036;2.辽宁经济职业技术学院,辽宁 沈阳 110122)
将荧光染料叠氮溴化丙锭(propidium monoazide,PMA)与普通聚合酶链式反应(polymerase chain reaction,PCR)结合,通过对PMA的曝光时间、浓度进行优化,确定PMA-PCR区别死活细胞的最佳条件,并制作活细胞定量标准曲线,建立肉及肉制品中沙门氏菌活细胞的PMA-PCR检测方法。结果表明:使插入死细胞DNA中的PMA活化并且光解溶液中游离PMA的最佳曝光时间为15min;不抑制沙门氏菌活细胞DNA扩增的最大PMA质量浓度为10μg/mL;完全抑制热致死细胞DNA扩增的最小PMA质量浓度为4μg/mL。经PMA处理,含有不同比例的沙门氏菌热致死细胞和活细胞的混合液中活的沙门氏菌能够通过PCR被选择性的检测,最小检测限为20CFU/PCR。而且,经研究发现在20~2×105CFU/PCR范围内,电泳条带相对荧光强度与活细胞数的对数具有线性关系。采集30份肉及肉制品样品,利用PMA-PCR方法检测出两份生肉样品中存在沙门氏菌,经过6h的富集培养后的活菌浓度分别为2.5×103CFU/mL和3.4×103CFU/mL。
肉及肉制品;沙门氏菌;活细胞;PMA-PCR
沙门氏菌(Salmonella)是肠杆菌科的一类革兰氏阴性肠道杆菌,是细菌性食物中毒中发病率最高的一种。有资料显示,我国细菌性食物中毒中70%~80%是由沙门氏菌引起的,而在引起沙门氏菌中毒的食品中,以肉及肉制品的污染最为严重,世界卫生组织(World Health Organization,WHO)已将沙门氏菌列入具有严重危害和中等危害的食物传播性病原[1-4]。
聚合酶链式反应(polymerase chain reaction,PCR)技术以其自身特异性强、灵敏度高和快速准确等优点已经成各类食品中病原菌快速检测的最主要的手段[5]。然而,PCR技术不能区分所检测到的病原菌是活菌细胞还是死菌细胞,容易导致检测结果的假阳性,从而导致生产的大量浪费。叠氮溴化乙锭(ethidium bromide mo noa z id e,EMA)和叠氮溴化丙锭(p ro pid iu m monoazide,PMA)是两种对DNA具有高度亲和力的光敏染料,能够选择性地穿透死菌细胞的细胞膜,进入到细胞内部,并且插入细胞内DNA双螺旋上[6-8]。随后在强光作用下,已经插入到细胞内DNA双螺旋上的EMA或者PMA可与DNA双螺旋发生交叉偶合作用,阻止了以此DNA为模版的PCR反应的进行。但由于EMA的细胞毒性较大,其应用受到较大的限制[9]。
本研究拟将无细胞毒性的PMA与PCR技术相结合,建立肉及肉制品中沙门氏菌活细胞的定性及定量检测方法,并通过采集实际样品,运用该方法对肉及肉制品中的沙门氏菌活细胞进行定量检测研究。
1 材料与方法
1.1 材料与仪器
沙门氏菌ATCC43975标准菌株 本实验室保存。
PMA(propidium monoazide) 美国Sigma公司;Taq酶、dNTPs等PCR相关试剂 大连宝生物工程有限公司;营养肉汤(牛肉膏3g,蛋白胨5g,加水至1000mL,pH7.2~7.4)。
C-1000梯度PCR仪、Gel Doc XR+型凝胶成像系统美国Bio-Rad公司;CDYCP-31D电泳仪、电泳槽 北京六一仪器厂;752N紫外-可见分光光度计、500W卤钨灯 上海天普分析仪器有限公司。
1.2 方法
1.2.1 沙门氏菌热处理
将沙门氏菌过夜培养,取菌悬液1mL,10000r/min离心1min收集菌体,灭菌生理盐水洗涤2次,重新悬浮于生理盐水中。平板计数法调整菌悬液浓度为4×108CFU/mL,将0.5mL沙门氏菌菌悬液于95℃水浴处理10min,充分冷却后将菌悬液全部涂T1N3平板,37℃条件下恒温培养48h,观察是否有活菌存在[10]。
1.2.2 PMA曝光时间确定
将PMA溶液(0.1mg/mL)加入9支分别装有0.5mL热致死沙门氏菌菌悬液(4×108CFU/mL)的离心管中,使每管PMA终质量浓度达到4μg/mL。充分混匀后,将离心管黑暗中室温放置5min,使PMA充分渗透进入细胞内部,并且与DNA双螺旋进行不可逆结合。将离心管开盖置于冰上,距离灯管16cm,分别曝光0、5、10、15、20、25、30、35、40min。阳性对照不加PMA,阴性对照不加沙门氏菌菌悬液[11]。
1.2.3 不抑制活细胞PCR扩增的最大PMA质量浓度确定
9只完全一样的离心管,每只中取0.5mL活细胞菌悬液(4×108CFU/mL),分别加入PMA溶液(1mg/mL)使其终质量浓度分别为1、5、10、15、20、25、30、35、40μg/mL。混匀后室温下黑暗中放置约5min。离心管开盖放置冰上,距离灯管16cm,曝光15min。阳性对照不加PMA,阴性对照不加沙门氏菌菌悬液。
1.2.4 完全抑制死细胞PCR扩增的最小PMA质量浓度确定
10只完全一样的离心管,每只中取0.5mL热致死沙门氏菌菌悬液(4×108CFU/mL),分别加入PMA溶液(1mg/mL)使其终质量浓度分别为1、2、3、4、5、6、7、8、9、10μg/mL,处理方法如1.2.3节所述。阳性对照不加PMA,阴性对照不加沙门氏菌菌悬液。
1.2.5 PMA抑制热致死沙门氏菌细胞DNA的PCR扩增能力测定
如表1所示,3组分别由活细胞和热致死细胞混合而成的菌悬液:第1组由0.25mL固定数量(5×107CFU/mL)的热致死细胞菌悬液与0.25mL变化数量的活细胞菌悬液(生理盐水漂洗)混合;第2组由0.25mL灭菌生理盐水与0.25mL变化数量的活细胞菌悬液(生理盐水漂洗)混合,作为第1组的对照;第3组由0.25mL固定数量(5×107CFU/mL)的活细胞菌悬液(经生理盐水漂洗)与0.25mL变化数量的热致死细胞菌悬液混合。

表1 死活细胞混合比例Table 1 Mix proportion of viable and dead cells
每个样品中加入PMA(0.1mg/mL)溶液,使其终质量浓度为4μg/mL。依1.2.3节方法处理后,10000r/min离心收集菌体,重悬于0.5mL的生理盐水中,再次离心收集菌体,加50μL生理盐水悬浮。
1.2.6 肉及肉制品中沙门氏菌活细胞检测
样品采自沈阳市各肉菜市场和超市,包括生肉10份(鲜肉、肝等)、熟肉制品10份(正规包装和非包装)、肉肠10份(正规包装和非包装)。生肉和非包装样品用专用的无菌采集袋采集,跟预先准备好的冰袋一起迅速送回分析实验室,并在24h内做分析处理。
1.2.7 DNA 模板制备
DNA提取采用TZ裂解液(0.1mol/L Tris-HCl缓冲液,2.5mg/mL 的叠氮化纳,2.0% Triton X-100,pH8.0)法[12]。
各样品菌悬液与等体积的2×TZ裂解液混匀,沸水浴处理10min,室温下冷却,8000r/min离心5min去掉菌体碎片沉淀,取上清液直接用作PCR模板。
1.2.8 引物及PCR扩增
根据GenBank中已发表的沙门氏菌invA基因序列,利用Primer 5.0软件设计一对PCR引物,上游引物(P1)为:5′-GTG AAA TTA TCG CCA CGT TCG GGC AA-3′,下游引物(P2)为:5′-TCA TCG CAC CGT CAA AGG AAC C-3′,扩增片段长度284bp。PCR反应体系:10×PCR反应缓冲液2.5μL,DNA模板4μL,dNTP(2.5mmol/L)2μL,各引物均为10pmol,MgCl2(25mmol/L)2μL,Taq酶0.2μL,用灭菌水补足到25μL体系。PCR反应程序:94℃预变性 5min,94℃ 1min、58℃ 1min、72℃ 2min,29个循环,最后72℃延伸10min。1.2.9 PCR产物检测及定量分析
1.5%琼脂糖凝胶电泳(6V/cm,1h)检测PCR产物,凝胶成像系统观察结果并成像。各DNA条带的相对荧光强度用NIH 1.61图像分析软件进行相对定量分析,3次独立实验取平均值。
2 结果与分析
2.1 沙门氏菌热处理时间
第五,学习型团队能提高学习效率。学霸寝室学生的学习成绩居于班级前列,但并不意味着他们高考成绩一定最为优异。大学期间,他们之所以表现出众,其中非常重要的原因在于他们融入了一个学习团队,团队成员是他们朝夕相处的室友,他们之间虽然有原生家庭带来的差异,但这些差异并不会给团队合作造成多少负面影响,他们相互激励和启发,你追我赶,因此学习效率很高,为日后成为栋梁之才打下了扎实的基础。
沙门氏菌菌悬液(4×108CFU/mL)经95℃水浴加热10min,冷却,涂平板37℃培养48h,无菌落生长。因此,95℃水浴处理10min,可杀死菌悬液(4×108CFU/mL)中所有沙门氏菌活细胞。
2.2 PMA最佳曝光时间
热致死沙门氏菌菌悬液(4×108CFU/mL)经PMA(终质量浓度4μg/mL)处理,分别曝光0~40min后,提取DNA进行PCR扩增,电泳图谱及对应的相对荧光强度柱状图如图1所示。随着曝光时间的延长,PCR扩增条带逐渐变弱,当曝光时间延长到15min时荧光条带完全消失,其对应的相对荧光强度值为0,热致死沙门氏菌DNA的PCR扩增被完全抑制。因此,在此研究中使荧光染料PMA光活化插入热致死沙门氏菌DNA并且光解过剩的游离PMA的最佳曝光时间为15min。
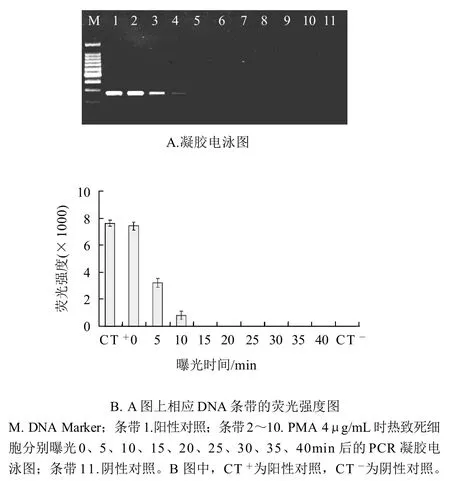
图1 激活和完全光解游离PMA的最佳曝光时间确定Fig.1 Determination of optimal light exposure time to activate and achieve complete photolysis of free PMA
2.3 不抑制活细胞PCR扩增的最大PMA质量浓度
当PMA质量浓度过大时,沙门氏菌活细胞DNA的PCR扩增也会受到不同程度的抑制作用,见图2A。沙门氏菌活细胞菌悬液中,随着PMA质量浓度的不断增大,PCR扩增条带的荧光强度也有不同程度的降低(图2B)。对柱状图进行统计分析表明,当PMA质量浓度小于等于10μg/mL时,PMA对活细胞PCR扩增没有明显抑制作用(P>0.05)。然而,当PMA质量浓度增加到15μg/mL时,PMA对活细胞的PCR扩增有显着的抑制作用。因此,在本实验中选择不抑制活细胞PCR扩增的最大PMA质量浓度为10μg/mL。
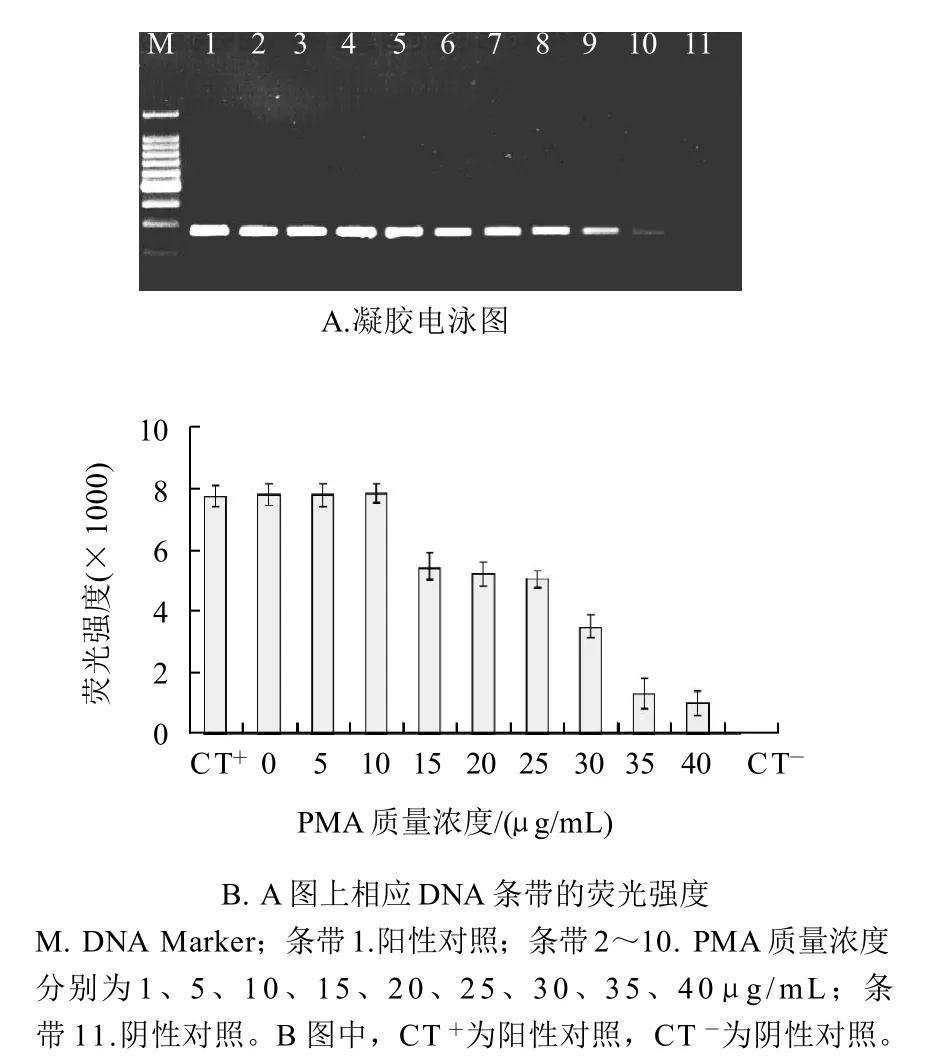
图2 不抑制活细胞DNA扩增的最大PMA质量浓度确定Fig.2 Determination of maximum concentration of PMA without inhibiting amplification of DNA from viable cells
2.4 完全抑制死细胞PCR扩增的最小PMA质量浓度
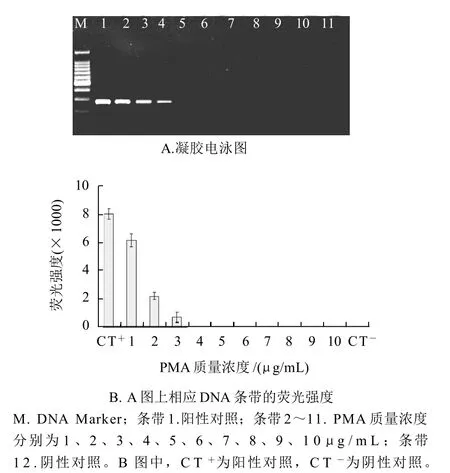
图3 完全抑制死菌细胞DNA扩增的最小PMA质量浓度的确定Fig.3 Determination of minimum concentration of PMA to completely inhibit amplification of DNA from heat-killed cells
如图3所示,对于热致死沙门氏菌细胞,随着PMA质量浓度的不断增大,PCR扩增条带越来越弱,当PMA的终质量浓度等于或者大于4μg/mL时,电泳图谱上没有相应的条带出现,其对应的相对荧光强度值为0,即热致死细胞的PCR扩增被完全抑制。此时,4μg/mL的PMA质量浓度远远小于可以抑制活细胞PCR扩增的PMA质量浓度10μg/mL。
2.5 PMA抑制热致死沙门氏菌细胞DNA的PCR扩增能力确定
由定量的死菌细胞与变化量的活菌细胞以及对照组生理盐水与变化量的活菌细胞的PCR扩增电泳图谱如图4所示。当PMA质量浓度为4μg/mL时,死菌细胞的PCR扩增完全被抑制,活菌细胞的PCR没有受到影响,DNA条带的相对荧光强度随着活细胞数(2×106、2×105、2 × 104、2 × 103、1 × 103、2 × 102、1 × 102、20CFU/PCR)的减少而逐渐减弱,检测限能达到20CFU/PCR。而且,由图4C可知,在20~2×105CFU/PCR体系范围内,DNA条带的相对荧光强度与每个PCR反应体系中所存在的活细胞菌落数的对数值呈现线性关系,在此范围内可以相对荧光强度来对每个PCR体系中的活菌数进行定量。
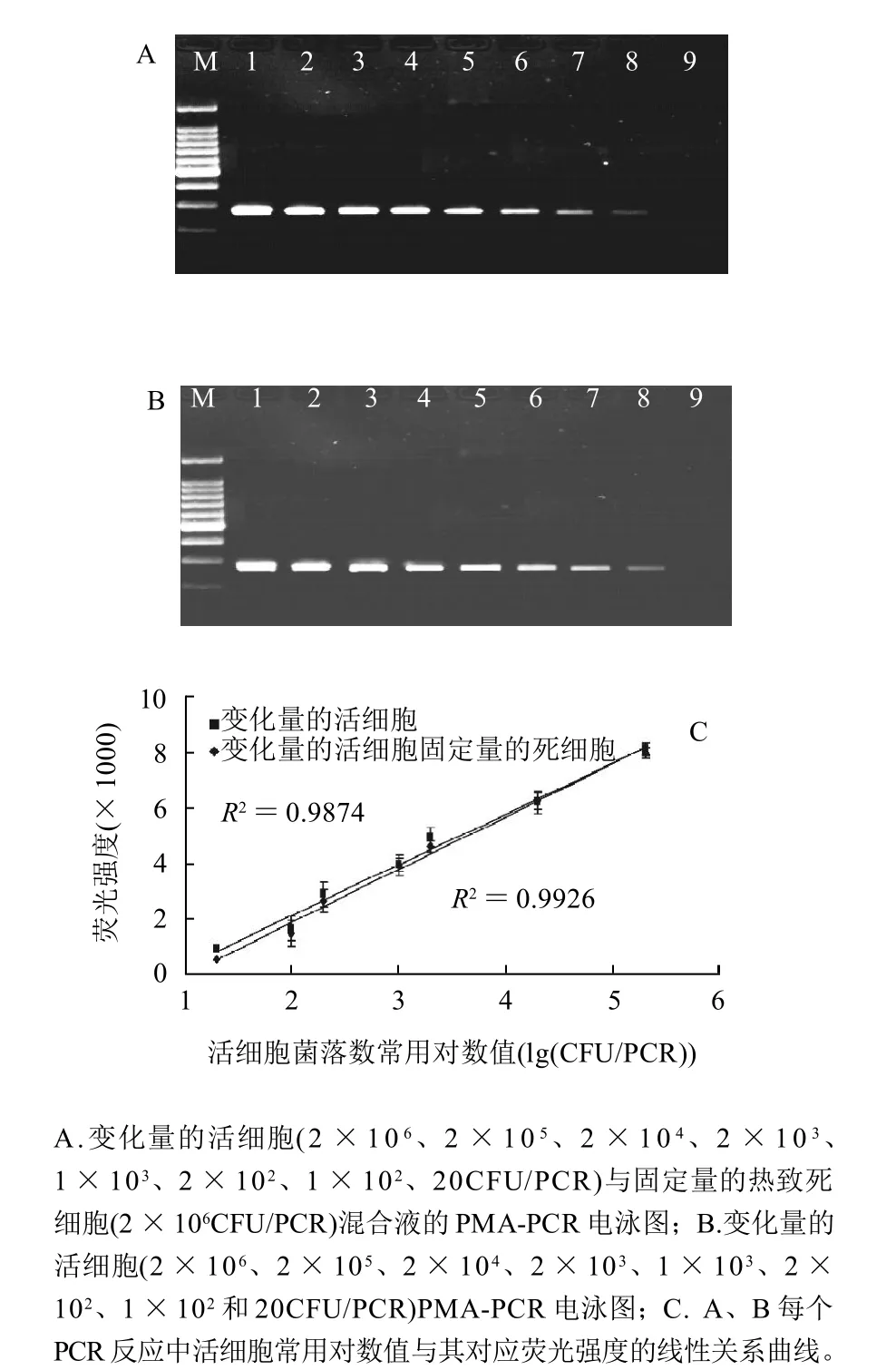
图4 PMA抑制热致死细胞DNA的PCR扩增能力及对活细胞的定量曲线Fig.4 Inhibitory capability of PMA against PCR amplification of DNA derived from heat-killed cells and quantitative curve for viable cells
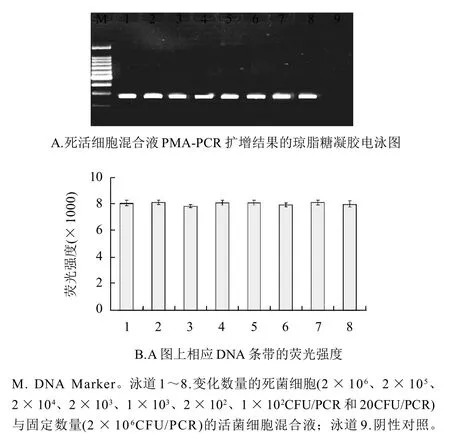
图5 固定量的活细胞与变化量的热致死细胞混合液的PMA-PCR扩增结果Fig.5 PMA-PCR amplification derived from mixtures with a constant number of viable cells and various numbers of dead cells
定量的活细胞与变化量的热致死细胞混合液中(图5),死细胞的PCR扩增完全被PMA抑制,活细胞的PCR没有受到影响。因此,对应PCR扩增电泳图谱每个条带的亮度均匀一致,其对应相对荧光强度值也无显着差异。
2.6 肉及肉制品样品中沙门氏菌活细胞检测
分别利用传统分离培养法和PMA-PCR技术对30份肉及肉制品样品进行了沙门氏菌活细胞检测。结果表明,经过6h的富集培养后,传统分离培养法和PMAPCR法均检测出两份生肉样品中含有沙门氏菌活细胞。利用图4C的标准曲线可得,6h富集后的菌浓度分别为2.5×103CFU/mL和3.4×103CFU/mL。
3 结 论
随着社会的发展和人类文明的进步,人们对食物品质的要求越来越高,因此准确、快速地检测食品中的沙门氏菌,对于预防人类沙门氏菌感染具有十分重要的意义[13-14]。
本研究将荧光染料PMA应用于普通PCR技术,利用PMA不能穿透活细胞的细胞壁和细胞膜却能够渗透到细胞壁或细胞膜不完整的死细胞体内的特性,使其插入DNA并与其共价结合,从而抑制死细胞DNA的PCR扩增,而活细胞的PCR扩增不受影响,更加精确地检测肉及肉制品中沙门氏菌活细胞的存在。结果表明,当PMA质量浓度不低于4μg/mL时,可以完全抑制沙门氏菌死细胞DNA的PCR扩增,高于拟杆菌的2.2μg/mL和大肠杆菌的3μg/mL,但是明显低于军团藻的8.8μg/mL。当PMA质量浓度小于10μg/mL时,PMA不会对活细胞PCR扩增产生显着影响,此时的PMA质量浓度比大肠杆菌的20μg/mL、军团藻的17.6μg/mL以及拟杆菌的10.5μg/mL 都要低[15-17]。
变化量的活菌细胞与定量的死菌细胞混合液,经EMA处理后,在20~2×105CFU/PCR范围内,沙门氏菌活细胞DNA扩增产物的相对荧光强度与每个PCR反应体系中所存在的活细胞DNA的拷贝数的对数值呈现严格的线性关系,据此可对各种肉及肉制品中的沙门氏菌活细胞进行定量分析。
[1] 史沁红, 任秀龙. 肉制品中沙门氏菌检测方法的研究进展[J]. 肉类研究, 2009, 23(10): 75-79.
[2] 方平, 杨永莉, 杨宝, 等. Real-time PCR方法检测肉品中的沙门氏菌[J]. 山西农业科学, 2010, 38(8): 71-76.
[3] 周丽萍, 巢国祥. 生肉制品中沙门菌、单核细胞增生李斯特菌及金黄色葡萄球菌流行特性研究[J]. 中国卫生检验杂志, 2007, 17(3): 505-507.
[4] 许学斌, 顾宝柯, 袁政安, 等. 富营养预增菌液在肉制品沙门菌常规检测方法中替代效果研究[J]. 中国人兽共患病学报, 2006, 22(7): 633-635.
[5] 尹荣焕, 尹荣兰, 杨玉英, 等. PCR技术检测熟肉制品中沙门氏菌的研究[J]. 安徽农业科学, 2006, 34(2): 222-226.
[6] 赵玉玲, 张天生, 张巧艳. PCR法快速检测肉食品污染沙门菌的实验研究[J]. 微生物学杂志, 2010, 30(3): 103-105.
[7] LEE J M, LEVIN R E. A comparative study of the ability of EMA and PMA to distinguish viable from heat killed mixed bacterial flora from fish fillets[J]. Journal of Microbiological Methods, 2009, 64(7): 93-96.
[8] RUDI K, MOEN B, DROMTORP S, et al. Use of ethidium monoazide and PCR in combination for quantification of viable and dead cells in complex samples[J]. Applied and Environmental Microbiology, 2005,71(2): 1018-1024.
[9] NOCKER A, CHEUNG C Y, CAMPER A K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J]. Journal of Microbiological Methods, 2006, 67(2): 310-320.
[10] 祝儒刚, 吕淑霞, 刘月萍, 等. 基于DNA染料EMA的RT-PCR技术定量检测海产品中病原性副溶血弧菌活细胞[J]. 食品科学, 2011, 32(8): 219-225.
[11] 祝儒刚, 吕淑霞, 刘月萍, 等. 基于DNA染料EMA的PCR技术检测鉴别副溶血性弧菌死活细胞[J].食品与发酵工业, 2010, 36(7): 144-149.
[12] ABOLMAATY A, VU C, OLIVER J, et al. Development of a new lysis solution for releasing genomic DNA from bacterial cells for DNA amplification by polymerase chain reaction[J]. Microbios, 2000, 101(4): 181-189.
[13] 周晓红, 孙明华, 徐佩华, 等. 生肉制品中沙门菌污染状况及耐药性分析[J]. 中国卫生检验杂志, 2010, 20(12): 3425-3427.
[14] 王羽, 王贞强, 张伟. 环介导等温扩增技术检测肉及肉制品中的沙门氏菌[J]. 食品科学, 2010, 31(6): 270-273.
[15] SUNGWOO B, STEFAN W. Discrimination of viable and dead fecal bacteroidales bacteria by quantitative PCR with propidium monoazide[J]. Applied and Environmental Microbiology, 2009, 75(9): 2940-2944.
[16] CHANG B, TAGURI T, SUGIYAMA K, et al. Comparison of ethidium monoazide and propidium monoazide for the selective detection of viable legionella cells[J]. Japanese Journal of Infectious Diseases, 2010, 63(4):119-123.
[17] 罗剑飞, 林炜铁, 郭勇. PMA与PCR结合的细菌活细胞检测方法[J].华南理工大学学报, 2010, 38(9): 142-146.
Detection of ViableSalmonellaCells in Meat and Meat Products by PCR
ZHU Ru-gang1,SONG Li-feng2
(1. Shenyang Key Laboratory of Food Biology Processing and Quality Control Technology, Engineering Technology Research Center for Food Biology Processing of Liaoning Province, College of Light Industry, Liaoning University, Shenyang 110036, China;2. Liaoning Economic Management Cadre Institute, Shenyang 110122, China)
A method for the selective detection of viable cells ofSalmonellain meat and meat products was developed using propidium monoazide (PMA) staining in combination with conventional PCR (PMA-PCR). Exposure time and PMA concentration were optimized to find optimal PMA-based PCR conditions for distinguishing between dead and viable cells. The results showed that the optimal light exposure time to activate PMA in dead cells and to photolyze free PMA in solution was 15 min.PMA at a dose of 10 μg/mL or less could not inhibit PCR amplification of DNA derived from viable cells ofSalmonella. The minimum concentration of PMA to completely inhibit PCR amplification of DNA derived from heat-killed cells was 4 μg/mL.After PMA treatment, viableSalmonellacells in a mixture containing different proportions of viable and dead cells could be selectively detected by PCR, and the minimum detection level was 20 CFU/PCR. An excellent linear relationship was observed between relative fluorescent intensity of DNA bands and lgCFU in the range of 20 - 2 × 105CFU/PCR. Among 30 meat and meat product samples, two samples were detected by the developed PMA-PCR method as being positive after 6 h enrichment with average amounts of 2.5 × 103CFU/mL and 3.4 × 103CFU/mL for viableSalmonellacells, respectively.
meat and meat products;Salmonella;viable cells;propidium monoazide-based polymerase chain reaction(PMA-based PCR)
TS201.6
A
1002-6630(2012)16-0199-05
2011-11-11
辽宁大学青年科学基金项目(2009LDQN21)
祝儒刚(1980—),男,讲师,博士,研究方向食品微生物与分子生物学。E-mail:zrg_luck@163.com



