彭虹旎,梁 莉,陈西广
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.青岛康地恩生物科技有限公司技术中心,山东 青岛 266101)
屎肠球菌属肠球菌属,是乳酸菌类益生菌的一种,能调整单胃动物肠道菌群,抑制肠道内致病菌的过度繁殖。屎肠球菌在动物微生态制剂及食品添加剂方面有广泛的应用,作为动物微生态的常用益生菌株,可单独使用或与其他益生菌复配,用于调节动物肠道菌群,提高免疫力及改善生长性能[1-2]。
乳酸菌作为发酵剂或微生态制剂进行产业化开发时,需采用有利于菌体活性和贮存稳定性的生产与保存工艺,使活菌量在干燥和后续保存中都尽可能维持高水平,冷冻干燥法在菌体长期保存方面具有明显优势,且固体产品更易储运和销售应用。同时,产业化的工艺开发必须兼顾技术性和经济性[3]。已往国内外对乳酸菌冻干工艺及存活率的研究中,对不同种类乳酸菌的冻干保护剂组成、冻干速率、预冻条件等内容都有涉及,其中保护剂包括蛋白质类、多糖类、小分子糖类、醇类和维生素类,其中被广泛认可的保护剂常用主要成分包括脱脂乳、蔗糖、海藻糖等[4-6],每种物质使用量10g/L至150g/L不等,在单一保护剂中甚至可达到250g/L[7];其次使用较多的成分如谷氨酸钠、甘油、VC等[8-10],每种物质使用量5g/L至50g/L不等。在不同的实验中,不同的乳酸菌冻干存活率介于6%[13]至93.05%[10]之间。如Volkert等[11]比较气冷式冷冻法(air freezing)、喷淋冻结法(spray freezing)法等方法对鼠李糖乳杆菌活性和细胞膜完整性的影响,发现用20g/100mL脱脂乳作为保护剂时每种方法的冻干存活率都较高。另外,Schwab等[12]通过测定膜流动性和膜侧压,发现蔗糖、果寡糖和脱脂乳都可以明显提高生长对数期罗伊氏乳杆菌的冻干存活率。Schoug等[13]通过响应面法评价不同的蔗糖浓度、细胞密度和冷冻速率对一株棒状乳杆菌冻干存活率的影响,结果不同条件下这株棒状乳杆菌的冻干存活率从低于6%到高于70%不等,他认为各种因素对该菌的存活率都有影响,但最重要的影响因素是冷冻速率,最佳速率应是2.8℃/min。在乳酸菌的保存研究方面,Miyamoto-Shinohara等[14]通过对冻干并真空保存于安瓶的不同种类革兰氏阳性菌及革兰氏阴性菌存放20a后活性的比较,发现细菌在冻干后的存活率与安瓶密封时的真空度有关,每种细菌冻干后的良好保存都有赖于高度的干燥和在高真空度下密封。其中嗜酸乳杆菌和屎肠球菌在冻干后存活率分别为62.5%和85.2%,它们的年存活率近96%。
屎肠球菌作为乳酸菌类益生菌中的一种,在微生态产品中的应用效果同样受活菌量、贮存稳定性的影响。本实验拟对屎肠球菌采用冷冻干燥及加速保存实验[15],寻找适合屎肠球菌规模生产的冷冻干燥保护剂和产品保存条件。
1 材料与方法
1.1 菌种、试剂与培养基
屎肠球菌由青岛康地恩生物研发中心保存。
保护剂种类:脱脂奶粉、海藻糖、麦芽糊精、蔗糖。以玉米淀粉为保护剂对照。
MRS培养基:蛋白胨10g、牛肉膏 10g、酵母膏5g、K2HPO42g、柠檬酸铵2g、乙酸钠 5g、葡萄糖20g、硫酸镁0.58g、硫酸锰 0.25g、吐温-80 1mL,蒸馏水1L,溶解各组分,pH值调节至6.2~6.4,115℃灭菌30min。
1.2 仪器与设备
DH4000A培养箱 天津泰斯特仪器有限公司;PHS-3D pH计 上海精科仪器有限公司;SW-CJ-3D超净工作台 苏州净化设备有限公司;H-1650离心机 湘仪离心机仪器有限公司。
1.3 方法
1.3.1 菌种活化及扩培
取-80℃保存的屎肠球菌冻存管1支,在MRS平板上划线,37℃培养36~48h,挑取单菌落接种于100mL液体MRS培养基中,37℃静置培养24h后,以5%的接种量转接至1L液体MRS培养基中扩大培养20h,进入稳定期,停止培养,测定活菌数,备用。
1.3.2 菌泥与菌悬液制备
将扩大培养好的发酵液置于离心机中,以转速条件为5000r/min离心10min,弃掉上清液,用无菌水重悬,洗涤,按同样转速条件再次离心,即获得冷冻干燥实验所需的菌泥,并测定活菌数。
采用无菌水溶解冻干保护剂,加入菌泥,活菌数调节至1×1010CFU/mL,在磁力搅拌器上充分混匀菌悬液。
1.3.3 冷冻干燥
将添加保护剂的菌悬液倒入平板中,铺成薄层,置于-40℃预冻,使得菌悬液中的水分充分冻结,然后在-80℃、真空度为3.5Pa条件下真空冷冻干燥24h,获得冻干样品。
1.3.4 收集存放条件及样品贮存稳定性评价
冷冻干燥过程结束后,立即取出样品,放置于铝箔袋中,封口,分别放置于4℃和37℃条件下,每周取样测定样品活菌数,并计算样品中剩余活菌存活率,以比较不同温度条件下的贮存稳定性。
1.3.5 活菌数测定
样品溶解于生理盐水中混匀,以10倍梯度进行稀释,取适合的稀释度(最终菌落数约30~300CFU之间适宜)的试管中液体1mL置于平板中,与MRS培养基混匀,37℃培养48h后,计数菌落数,以菌落平均数计为该样品的单位活菌数。
1.3.6 冻干样品存活率计算
设冷冻干燥前菌泥活菌数为N1/(CFU/mL);冷冻干燥后菌粉活菌数为N2/(CFU/mL)。
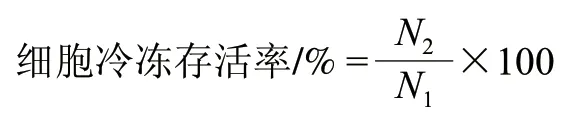
1.3.7 保护剂筛选
首先使用脱脂乳、蔗糖、麦芽糊精、海藻糖进行单因素试验,同时选择玉米淀粉为保护剂对照,无任何保护剂添加组作为空白对照;添加保护剂的处理组,保护剂质量浓度均为10g/100mL。观察单一保护剂条件下的冻干存活率,及37℃(RH 75%)条件下贮存稳定性。
然后根据实验结果及参考文献[4,9-10,13],将脱脂乳、蔗糖、麦芽糊精组合,进行三因素三水平的正交试验,优化保护剂配方,实验采用L9(33)正交表。比较各种保护剂组合的冻干存活率,选择存活率最高的两组,进行4℃和37℃条件下的贮存稳定性实验,筛选出最优的保护剂配方。
2 结果与分析
2.1 单一保护剂对屎肠球菌冻干存活率的影响
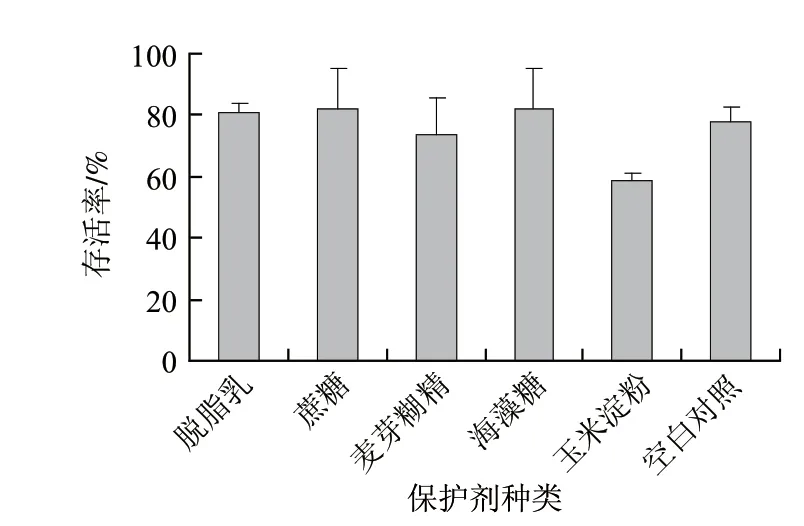
图1 单一保护剂对屎肠球菌冻干存活率的影响Fig.1 Effect of cryoprotectant type on survival rate of lyophilized E.faecium
冷冻干燥过程中会产生低温、冻结及脱水等多种效应,因此,为了防止微生物在冻干过程中变性,选择有效的保护剂至关重要。由图1可知,所选的4种保护剂在相同的质量浓度下分别进行冻干实验,屎肠球菌存活率在70%~80%之间,但玉米淀粉组和无保护剂的空白对照组存活率也分别达到了57%和76%,说明这株屎肠球菌本身有较好的冻干耐受性,而且冻干过程中,单一保护剂对这株屎肠球菌的存活率影响不大。
2.2 单一保护剂对屎肠球菌贮存稳定性的影响
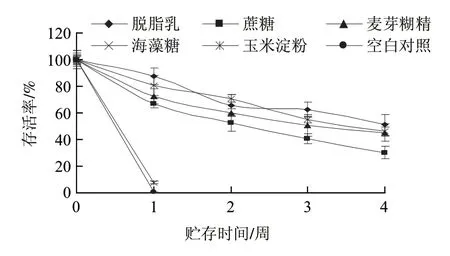
图2 添加单一保护剂后冻干样品稳定性分析Fig.2 Effect of cryoprotectant type on storage stability of E.faecium at 37 ℃ (75% RH)
由图2可知,在为期4周的贮存稳定性加速实验中,各保护剂在贮存过程中对菌体都有一定的保护作用。海藻糖保护效果与其他3种保护剂相当,价格却远高于这些保护剂,不适于实际生产应用。而淀粉组和空白对照组菌量下降迅速,说明在没有适当保护剂的情况下,即使微生物本身冻干耐受性较好,也无法较长期稳定保存。
2.3 正交试验优化复合冻干保护剂
不同的保护剂在冻干过程中发挥着不同的作用,一般认为,低分子化合物(如低聚糖、氨基酸等)在冻干过程中直接发挥作用,而高分子化合物(如蛋白质、多糖等)则是促进低分子化合物的保护作用,本课题预实验中选择脱脂乳、蔗糖、麦芽糊精做单因素保护剂冻干实验,选择质量浓度为10g/100mL,冻干后屎肠球菌存活率在70%~80%之间;而在一般应用中,实验室保存菌种有的单独使用脱脂乳作为冻干保护剂,用量可达20g/100mL,有时则会搭配蔗糖,其用量达7g/100mL;但更多研究中,会配合使用脱脂乳、蔗糖甚至麦芽糊精等成分,各成分的用量在1~10g/100mL居多。如杜磊等[16]在乳酸菌冷冻保护剂的实验中发现保加利亚乳杆菌和嗜热链球菌混菌保护剂最佳配方为10g/100mL蔗糖、10g/100mL脱脂乳及5g/100mL谷氨酸钠,菌体经冷冻处理后存活率可达到95%;而郭云等[17]在研究中发现,以10g/100mL脱脂乳加5g/100mL海藻糖和5g/100mL蔗糖为基质进行喷雾干燥,菌体存活率最高达73.9%;麦芽糊精具有优良的乳化性能,有调整产品组织结构的作用,在食品及保健品中常作为壁材组分之一应用于喷雾干燥等后处理工艺[18-19]。因此,本实验将脱脂乳、蔗糖、麦芽糊精组合,进行三因素三水平的正交试验,优化保护剂配方,采用L9(34)正交表,结果如表1所示。

表1 复合保护剂对菌体冻干存活率的影响Table 1 Effect of complex cryoprotectant on survival rate of lyophilized E.faecium
由表1可知,影响屎肠球菌冻干后存活率的因素主次顺序为B>C>A,即蔗糖的效果最明显,麦芽糊精次之。
经正交试验得到的最佳组合为1号试验组:A1B1C1,即脱脂乳1g/100mL、蔗糖1g/100mL、麦芽糊精10g/100mL,冻干后菌体存活率达到84.4%。其次是4号试验组:A2B1C2(脱脂乳5g/100mL、蔗糖1g/100mL、麦芽糊精5g/100mL),冻干后菌体存活率达到83.1%。
蔗糖和麦芽糊精都属糖类保护剂,糖类保护剂的保护作用在于抑制质膜的相变。即在微生物细胞脱水时进行“水置换”作用。冻干过程中,细胞膜质经历了从液晶态到凝胶态的相的变化,而在室温下复水时处于凝胶态的干燥质膜又经历了从凝胶态到液晶态的转变,由于膜经历了状态的转变,某些区域产生缺陷,使细胞膜发生渗漏。若在干燥前加入二糖,如海藻糖或蔗糖,可降低干燥膜的膜相转变温度,当磷脂干燥脱水时,蔗糖在失水部位以氢键和磷脂的极性端相连,防止状态的转变和复水时的渗漏,从而提高细胞的存活率。
2.4 冻干样品的稳定性分析
生物制品经冷冻干燥后制成冻干样品,还需经历长期储存过程。通常,由冷冻干燥得到的样品在长期的储存过程活性组分会不断变化,因此,以较好的保护剂组合制成的冻干样品通过贮存稳定性的实验分析,更有助于冻干样品效果的评价。本实验选择正交试验中屎肠球菌冻干存活率较高的1号和4号组合进行稳定性实验,分别将冻干样品置于4℃及37℃(RH 75%)条件下,定期测定样品中的活菌数,结果如图3、4所示。
由图3可知,屎肠球菌冻干样品在4℃条件下存放4周后,两个不同保护剂组合的存活率均高于90%(将实验初始测定时样品存活率定为100%),单位活菌量下降小,这说明了4℃的低温存放效果好。而且,4号组合(脱脂乳5g/100mL、蔗糖1g/100mL、麦芽糊精5g/100mL)样品存活率高于1号组合(脱脂乳1g/100mL、蔗糖1g/100mL、麦芽糊精10g/100mL),菌量呈现增长的趋势,这可能是由于在复水培养时保护剂成分有增菌作用所致。
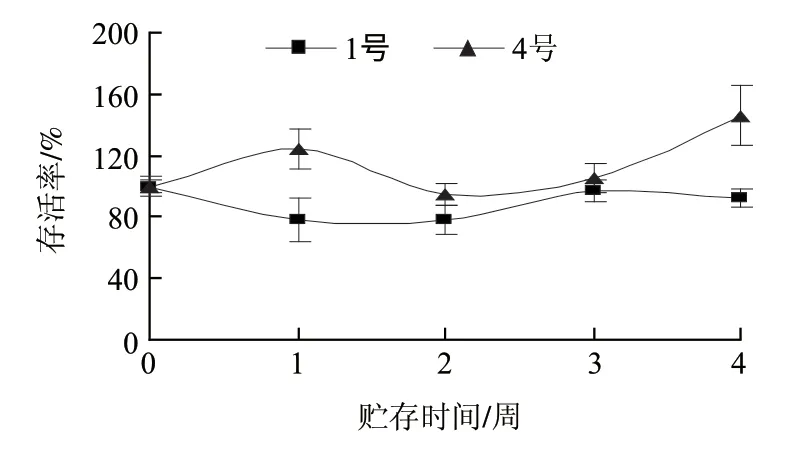
图3 4℃条件下冻干样品的稳定性分析Fig.3 Stability of lyophilized E.faecium during storage at 4 ℃
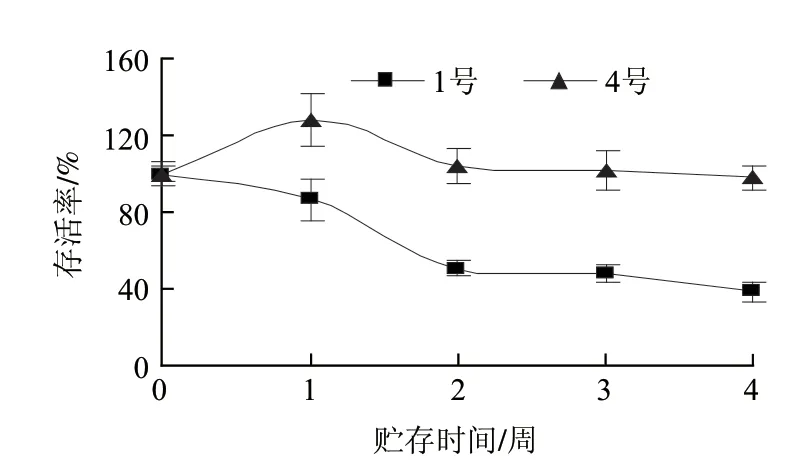
图4 37℃(RH 75%)条件下冻干样品的稳定性分析Fig.4 Stability of lyophilized E.faecium during storage at 37 ℃ (RH 75%)
图4 是屎肠球菌冻干样品在37℃(RH 75%)条件下存放4周后的情况,存放前2周时,1号组合(脱脂乳1g/100mL、蔗糖1g/100mL、麦芽糊精10g/100mL)存活率已经降低至50%,而4号组合(脱脂乳5g/100mL、蔗糖1g/100mL、麦芽糊精5g/100mL)没有明显的存活率下降;4周后,1号组合和4号组合样品的存活率分别降至38.4%和97.9%(将实验初始测定时样品存活率定为100%)。
经过4℃和37℃(RH 75%)的贮存稳定性实验,可知冻干保护剂配方,4号组合稳定性优于1号组合。在贮存过程中,脱脂乳含量较高的组合表现较好,可能是脱脂乳的成分可以更好地直接与细胞膜表面极性磷脂集团相互作用,在菌体外形成蛋白膜,从而降低在贮存过程中细胞膜的损伤。而麦芽糊精在细胞脱水时不能充分置换水分子,所以1号组合,细菌细胞膜结构和功能的完整性不如脱脂乳含量较高的4号组合,在贮存过程中菌量损失相应较多。
3 结 论
屎肠球菌在冻干过程中选择有效的保护剂至关重要,为寻找适于屎肠球菌规模化生产的冻干保护剂,本实验将脱脂乳、蔗糖、麦芽糊精组合,通过正交试验优化保护剂配方,得到的最佳组合为脱脂乳5g/100mL、蔗糖1g/100mL、麦芽糊精5g/100mL,此保护剂组合对屎肠球菌在冷冻干燥和干燥后贮存过程中均有显着的保护作用,如:冻干后菌体存活率达到83.1%;使用铝箔袋密封保存,在37℃(RH 75%)条件下存放4周后存活率为97.9%(将实验初始测定时样品存活率定为100%)。本实验结果为屎肠球菌冻干产品制备和在常温条件下贮运提供了直接参考。
另外,本实验中发现使用此保护剂的屎肠球菌冻干样品在4℃条件下存放4周后存活率高于100%,除球菌本身抗逆性较强外[3],其原因和机理还需要进一步研究。
在乳酸菌的产业化开发过程中,菌株之间的个体差异、干燥方式和相应的保护方法、所生产制剂的贮存稳定性、使用效果评价等,都需要不断的研究完善,以便持续提高微生态制剂的产品品质,保障消费者的健康和利益。
[1]文静, 孙建安, 周绪霞, 等.屎肠球菌对仔猪生长性能、免疫和抗氧化功能的影响[J].浙江农业学报, 2011, 23(1)∶ 70-73.
[2]容庭, 何前, 陈庄, 等.屎肠球菌及其在仔猪生产上的研究现状[J].饲料工业, 2008, 29(22)∶ 55-57.
[3]CARVALHO A S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14∶ 835-847.
[4]徐致远, 刘荣, 郭本恒, 等.保护剂在乳酸菌冻干过程中的应用[J].乳业科学与技术, 2006(4)∶ 155-158.
[5]付艳茹, 靳烨.保加利亚乳杆菌菌粉生产工艺研究[J].食品科技,2009, 34(7)∶ 14-17.
[6]潘艳, 何胜江.保护剂对冻干和贮存过程中乳杆菌存活率的影响[J].饲料工业, 2010, 31(6)∶ 36-39.
[7]郝莹.不同剂型双歧杆菌的制备技术及存活性能的研究[D].西安∶西北大学, 2009.
[8]陈卫, 陆英, 田丰伟, 等.干酪乳杆菌 LC-15 冻干发酵剂制备条件研究[J].中国乳品工业, 2008, 36(7)∶ 9-13.
[9]朱东升, 马鎏鎏, 李青青, 等.嗜酸乳杆菌冷冻干燥过程中保护剂的筛选及液氮预冻[J].食品科学, 2010, 31(1)∶ 198-200.
[10]孙盈, 黄金海, 李莹, 等.耐热型复合乳酸菌冻干保护剂的研究[J].中国乳品工业, 2011, 39(4)∶ 12-15.
[11]VOLKERT M, ANANTA E, LUSCHER C, et al.Effect of air freezing, spray freezing, and pressure shift freezing on membrane integrity and viability ofLactobacillus rhamnosusGG[J].Journal of Food Engineering, 2008, 87∶ 532-540.
[12]SCHWAB C, VOGEL R, GÄNZLE M G.Influence of oligosaccharides on the viability and membrane properties ofLactobacillus reuteriTMW1.106 during freeze-drying[J].Cryobiology, 2007, 55∶ 108-114.
[13]SCHOUG Å, OLSSON J, CARLFORS J, et al.Freeze-drying ofLactobacillus coryniformisSi3∶ effects of sucrose concentration,cell density, and freezing rate on cell survival and thermophysical properties[J].Cryobiology, 2006, 53∶ 119-127.
[14]MIYAMOTO-SHINOHARA Y, SUKENOBE J, IMAIZUMI T, et al.Survival curves for microbial species stored by freeze-drying[J].Cryobiology, 2006, 52∶ 27-32.
[15]张英华, 霍贵成, 郭鸰.乳酸菌冷冻干燥保护剂的筛选及加速储存稳定性试验[J].中国乳品工业, 2007, 35(2)∶ 8-11.
[16]杜磊, 乔东发.乳酸菌冷冻保护剂的选择[J].广东奶业, 2010(1)∶16-17.
[17]郭云, 孟祥晨.喷雾干燥对发酵乳杆菌KLDS1.0709存活影响的研究[J].食品工业科技, 2011, 32(2)∶ 109-111.
[18]孙肖明, 霍学芹.喷雾干燥工艺制备大豆异黄酮微胶囊的研究[J].食品研究与开发, 2011, 32(10)∶ 97-100.
[19]刘玉兵, 肖志刚.山葡萄籽油微胶囊的生产工艺研究[J].黑龙江农业科学, 2011(4)∶ 89-92.



