王今雨,满朝新,杨相宜,董鑫悦,郎 友,闫天文,姜毓君,*
(1. 东北农业大学 国家乳业工程技术研究中心,黑龙江 哈尔滨 150086;2.东北农业大学食品学院 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
植物乳杆菌NDC 75017的降胆固醇作用
王今雨1,2,满朝新1,杨相宜2,董鑫悦2,郎 友2,闫天文2,姜毓君1,2,*
(1. 东北农业大学 国家乳业工程技术研究中心,黑龙江 哈尔滨 150086;2.东北农业大学食品学院 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
植物乳杆菌NDC 75017分离自中国内蒙古传统发酵乳制品。本实验对其体外环境耐受性及其降胆固醇作用进行研究。采用活菌计数法检测植物乳杆菌NDC 75017在pH 2.0~3.0的酸性环境、胆盐质量浓度0.3g/100mL、NaCl质量浓度0~7g/100mL以及模拟人工消化液环境下的耐受情况;同时以邻苯二甲醛法测定其体外降胆固醇能力。结果表明:植物乳杆菌NDC 75017可耐受pH3.0及0.3g/100mL胆盐环境;在7g/100mL的高盐质量浓度条件活菌数仍可达108CFU/mL;可以通过胃进入肠道而保持活性,在肠道处理8h后存活率为58.73%。体外降胆固醇实验测得细菌发酵上清液、菌体洗涤液和细胞破碎液中的胆固醇脱除率分别为16.43%、26.35%和32.87%。植物乳杆菌NDC 75017环境耐受能力良好,具有体外降胆固醇作用,该菌株可以作为降胆固醇的潜在益生菌。
植物乳杆菌;降胆固醇;消化道耐受性
高血压、冠心病、动脉粥样硬化等心血管疾病是当前导致人类死亡的主要原因,研究发现,血脂中总胆固醇的减少能降低高血脂人群患心血管疾病的风险[1]。益生菌是一类能够对人体健康起到促进作用的活体微生物。迄今为止,已发现其具有多种生物活性,降低血清胆固醇水平是其重要的生理活性之一[2]。已有研究证明,适量饮用含有乳酸菌的发酵乳可使血液胆固醇含量降低,其中,乳酸杆菌是一类对人体有重要益生功能的细菌, 作为胃肠道生态系统固有菌种,其益生功能被广泛研究[3-6]。
本实验以分离自中国内蒙古传统发酵乳制品的植物乳杆菌(Lactobacillus plantarum)NDC 75017为研究对象,对其体外耐受能力及其体外降胆固醇作用进行研究,以期为开发具有降胆固醇特性的发酵乳提供参考。
1 材料与方法
1.1 材料与试剂
植物乳杆菌NDC 75017分离自内蒙古通辽地区的牧民自制发酵酸奶。
胆盐、胆固醇(分析纯) 美国Sigma公司;邻苯二甲醛、巯基乙酸钠、冰醋酸、正己烷(分析纯) 国药集团化学试剂有限公司。
MRS培养基:蛋白胨0.5g、牛肉膏0.5g、酵母粉0.5g、胰蛋白胨1.0g、吐温-80 0.1mL、葡萄糖2.0g、磷酸氢二钾0.2g、柠檬酸氢二铵0.2g、乙酸钠0.5g、硫酸镁0.05g、硫酸锰0.025g,蒸馏水定容至100mL,调pH值至5.8。
MRS-CHOL-THIO培养基:MRS液体培养基中加入0.20%的巯基乙酸钠、0.3g/100mL胆盐和100μg/mL胆固醇,加热溶解,121℃灭菌 15min 后备用。
1.2 仪器与设备
BCN1360型生物洁净工作台 北京东联哈尔仪器公司;DU800紫外分光光度计 美国Beckman公司;TGL-16G离心机 上海安亭科技仪器厂;灭菌锅 上海三申医疗器械有限公司;超声波破碎仪 宁波新芝生物科技股份有限公司;DHP-9082型电热恒温培养箱 上海一恒科技有限公司。
1.3 方法
1.3.1 环境耐受性实验
1.3.1.1 耐酸性实验
菌株以2%的接种量接种至MRS液体培养基,37℃活化培养两代,生理盐水洗涤3次,离心收集菌体,制备菌悬液。将菌悬液按2%重悬于pH 3.0和pH 2.0的液体MRS培养基(4.0mol/L HCl调整),置于37℃培养箱中分别培养0、1、2、3h后取样。取菌液用灭菌生理盐水进行10倍稀释,取适量稀释液涂布MRS琼脂培养基平板,37℃培养24h,采用平板计数法进行菌落计数[7],每个梯度设3个平行,以MRS培养基中培养的菌体做对照,计算存活率。

式中:Nt为低pH值MRS培养不同时间后的活菌数;No为pH5.8 MRS中培养不同时间后的活菌数。
1.3.1.2 耐胆盐实验
菌株37℃活化培养两代后,以生理盐水洗涤3次,离心(5000r/min,10min)收集菌体,制备菌悬液。将菌悬液以2%接种量接至含0.3g/100mL胆酸盐的MRS液体培养基中37℃培养12h。取菌液用灭菌生理盐水进行10倍稀释,取适当稀释液涂布MRS琼脂培养基平板,37℃培养24h,进行菌落计数,每个梯度设3个平行,以MRS培养基中培养的菌体做对照,计算存活率。

式中:Nt为 含0.30g/100mL牛胆酸钠的 MRS培养基中活菌数;No为MRS培养基中的活菌数。
1.3.1.3 耐盐实验
菌株以2%的接种量接种至MRS液体培养基,37℃活化培养两代,生理盐水洗涤3次,离心收集菌体,制备菌悬液。将菌悬液按2%分别接种至NaCl质量浓度为0~7g/100mL的MRS液体培养基中,置于37℃培养箱中分别培养24h后取样。取菌液用灭菌生理盐水进行10倍稀释,取适当稀释液涂布MRS琼脂培养基平板,37℃培养24h,进行菌落计数,每个梯度设3个平行,以MRS培养基中培养的菌体做对照,计算存活率。

式中:Nt为不同NaCl质量浓度的MRS培养基中活菌数;No为MRS培养基中的活菌数。
1.3.1.4 人工胃液和人工肠液耐受性实验
菌株以2%的接种量接种至MRS液体培养基,37℃活化培养两代,生理盐水洗涤3次,离心收集菌体,制成菌悬液备用。将制备好的菌悬液按2%接种量接种至过滤除菌的pH3.0的人工胃液中37℃培养0、1、2、3h后取样,测定其活菌数。然后,分别无菌吸取处理0、1、2、3h后的含菌人工胃液[8],以2%接种量接种至过滤除菌的pH8.0的人工肠液中[9],继续置37℃培养,分别在0、3、5、7、8h后测定活菌数。
人工胃液:NaCl 0.2%、胃蛋白酶 0.35%,用1mol/L HCl调整pH值为3.0后,0.22μm滤膜过滤除菌备用。
人工肠液:将下述a液和b液以2:1混合即为人工肠液。a胰腺液:NaHCO31.1%、NaCl 0.2%、胰蛋白酶0.1%,调整pH值为8.0后,过滤除菌备用。b胆液:胆盐1.2%,调整pH值为8.0后,过滤除菌备用。

式中:Nt为菌体在人工消化液培养不同时间后的活菌数;No为菌体在MRS培养基中培养不同时间后的活菌数。
1.3.2 体外降胆固醇能力的测定
1.3.2.1 绘制胆固醇标准曲线
取质量浓度为10~60μg/mL的胆固醇溶液1mL,加入2mL质量浓度为0.5mg/mL的邻苯二甲醛溶液及1mL浓硫酸,振荡混匀后,室温条件下显色10min,在波长550nm处测吸光度。以胆固醇的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,进行函数拟合得到曲线回归方程,用于计算胆固醇的质量浓度。
1.3.2.2 胆固醇质量浓度的测定
植物乳杆菌NDC 75017菌液(2%的接种量)接入MRSCHOL-THIO培养基,培养24h后5000r/min离心10min,取上清液0.5mL于干净试管中,依次加入3mL体积分数为95%的乙醇和 2mL质量分数为33%的氢氧化钾溶液,漩涡振荡混匀后置于60℃水浴中皂化10min,迅速冷却后加入5mL正己烷,漩涡振荡进行萃取,加入3mL水,重复振荡混匀后在室温静置15min使各相分层。准确吸取正己烷层2.5mL于洁净试管中,置于 60℃水浴中用氮气吹干溶剂,加入4mL邻苯二甲醛显色剂,漩涡振荡后静置10min,加入2mL浓硫酸立即混匀,室温静置 10min 后,在90min内于波长550nm 处测吸光度。根据胆固醇与吸光度标准曲线回归方程计算胆固醇的质量浓度,同时测定菌体洗涤液和菌体破碎液中胆固醇的含量,计算胆固醇的脱除率。
菌体洗涤液:倾出上清液,加入5.0mL质量分数为0.85%的生理盐水悬浮,12000r/min离心10min,取上清液即为菌体洗涤液。
细胞破碎液:倾出菌体洗涤液,再加入5.0mL质量分数为0.85%的生理盐水悬浮,置于冰浴中并在超声波破碎仪中破碎(80%输出,10s/次,间隔5s)30min,破碎后4℃,5000r/min离心10min,上清液即为菌体破碎液。

式中:ρ1为菌种接至MRS-CHOL-THIO培养后培养上清液(或菌体洗涤液、细胞破碎液)中胆固醇的质量浓度;ρ0为初始培养基总胆固醇的质量浓度。
2 结果与分析
2.1 环境耐受性实验结果
2.1.1 耐酸性实验结果
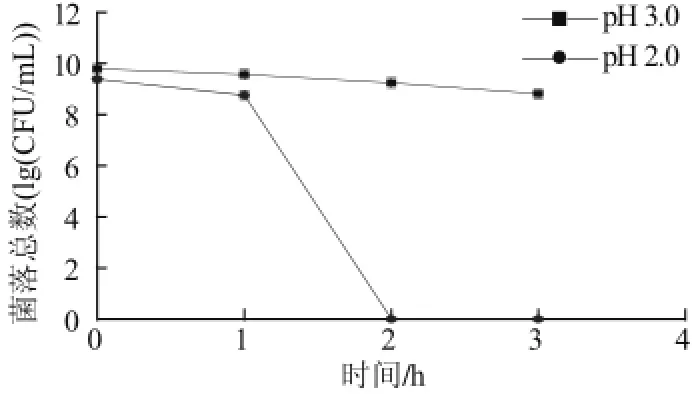
图1 植物乳杆菌NDC 75017对酸的耐受性Fig.1 Tolerance of L. plantarum NDC75017 to acid
通常活菌定植肠道的前提条件是其能够耐受胃中的pH值酸环境,胃液pH值因饮食结构不同而有较大波动,如空腹时胃液的pH值为0.9~1.8,进食过程中pH值在1.8~5.0,通常维持在3.0左右[10]。食物在胃中的消化时间相对较短,一般为1~3h。因此实验选择2个不同pH值(2.0、3.0),培养时间为1、2、3h。
由图1可知,植物乳杆菌NDC 75017不能耐受pH2.0;在pH3.0条件下处理1~3h,存活率分别为53.66%、28.46%和10.57%,对pH3.0具有较强的耐受能力,可见,该菌株具备一定的耐受胃中酸性环境的能力。
2.1.2 耐胆盐实验结果
菌株本身的特性以及胆盐质量浓度可决定菌株对胆盐的耐受能力。人体小肠存在一定质量浓度的胆盐,维持在0.3g/100mL。本实验选用0.3g/100mL胆酸盐质量浓度下来考察菌株的胆盐耐受情况。结果表明,在此条件下,存活率能达到84.31%,这表明,该菌株对胆盐表现出较强的耐受性。
2.1.3 耐盐实验结果
人体细胞的外环境为人的体液,随着饮食变化,体液中的Na+和Cl—等浓度会随之升高,从而改变人体渗透压[11]。微生物对渗透压有一定的适应能力,若渗透压改变较大,则对微生物的生长不利,甚至死亡。人体胃肠道中NaCl质量浓度在1~4g/100mL的范围波动。本实验将植物乳杆菌NDC 75017按2%接种量分别接入NaCl质量浓度为0~7g/100mL的MRS液体培养基中恒温培养24h后采用MRS固体培养基进行活菌计数。
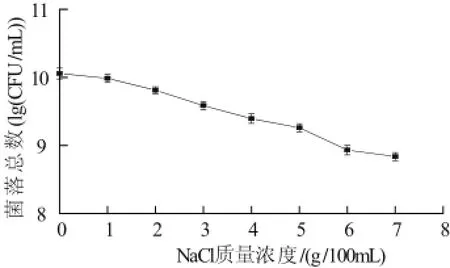
图2 植物乳杆菌NDC 75017对NaCl的耐受性Fig.2 Tolerance of L. plantarum NDC75017 to sodium chloride
由图2可知,培养24h后,植物乳杆菌NDC 75017活菌数随NaCl的质量浓度增加而降低,但在7g/100mL的高盐浓度下,菌数仍然可以达到108CFU/mL以上。卜永士等[12]研究表明,干酪乳杆菌(L.casae)BDⅡ能够耐受6.5%的NaCl;徐义刚等[9]研究表明,重组干酪乳杆菌在盐7.0%的条件下仍可以生长。由此说明,植物乳杆菌NDC 75017耐高渗环境能力较强,可在人体内良好的生存。
2.1.4 人工胃液和人工肠液耐受性实验结果
2.1.4.1 人工胃液耐受性实验结果
益生菌发挥益生功能的基本条件是以活菌状态通过胃肠道。从口腔到肠道过程中,益生菌首先必须以活菌状态通过胃才有可能进入肠道。食物在胃中的停留时间一般为1~2h,人体胃液的pH值随饮食结构的不同而发生变化,通常维持在pH3.0左右[13]。胃蛋白酶原会在胃液的酸性环境下被激活,从而杀死随食物进入胃内的细菌。因此,益生菌若在人体内发挥益生作用,就必须具有一定的耐酸和耐胃蛋白酶的能力。本实验采用植物乳杆菌NDC 75017在pH3.0条件下,与人工胃液作用不同时间后,检测到的活菌数变化。
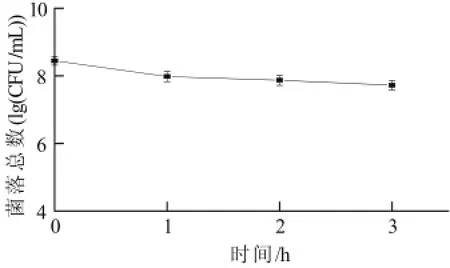
图3 植物乳杆菌NDC 75017对人工胃液的耐受性Fig.3 Tolerance of L. plantarum NDC75017 to artificial gastric fluid
由图3可知,植物乳杆菌NDC 75017在pH3.0的人工胃液中作用1~3h,存活率分别可达到34.23%、26.43%、18.92%,在人工胃液中存活率较高,说明其能耐受胃液酸性及胃蛋白酶环境,可以通过胃进入肠道并保持活性。
2.1.4.2 人工肠液耐受性实验结果
食物经过胃液消化后进入肠道,肠道微生物数量大且种类繁多,肠道菌群的生长受肠液中水分、消化酶、胆汁酸等成分所影响,所以生存在小肠中的益生菌必须具有一定的耐肠液能力并保持一定数量的活菌数才能发挥其益生作用。小肠内是pH值大约为7.6的碱性环境,食物在小肠中的停留时间一般为3~8h。本实验选取植物乳杆菌NDC 75017经过pH8.0的人工肠液作用不同时间后,检测其菌数变化以判定其对肠液的耐受能力。
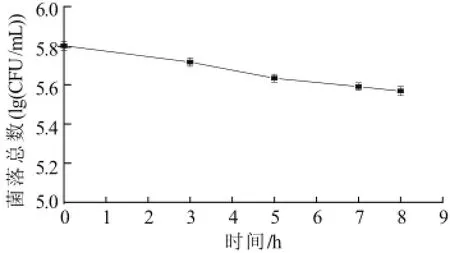
图4 植物乳杆菌NDC 75017对人工肠液的耐受性Fig.4 Tolerance of L. plantarum NDC75017 to artificial intestinal fluid
由图4可知,植物乳杆菌NDC 75017经人工胃液处理后,在人工肠液中分别作用3、5、7、8h后,存活率分别可达到82.54%、68.25% 、63.49%、58.73%,这表明,在模拟小肠中食物消化吸收的时间内,植物乳杆菌NDC 75017可在肠液中保持一定活性,对肠液的耐受性能较好。
2.2 体外降胆固醇实验结果
2.2.1 标准曲线
以胆固醇质量浓度(μg/mL)为横坐标,吸光度(A550nm)为纵坐标绘制曲线。回归方程为y=0.0089x—0.0043(R2=0.9984),式中:y为吸光度(A550nm);x为胆固醇的质量浓度/(μg/mL)。
2.2.2 不同介质中胆固醇的降解情况
乳酸菌降胆固醇的作用机理一直是讨论的热点。有关乳酸菌降胆固醇机制主要有以下几种:同化作用[14-15]、共沉淀作用[15]、胆盐水解酶作用[17-18]。但是随着进一步的研究,乳酸菌降低胆固醇的现象又有了新的解释,如Lye等[19]提出了5种降胆固醇作用机理,并认为是同时起作用。本实验采用邻苯二甲醛法[20]测定菌体发酵上清液、菌体洗涤液以及细胞破碎液3种不同介质中植物乳杆NDC 75017对胆固醇的降解情况。
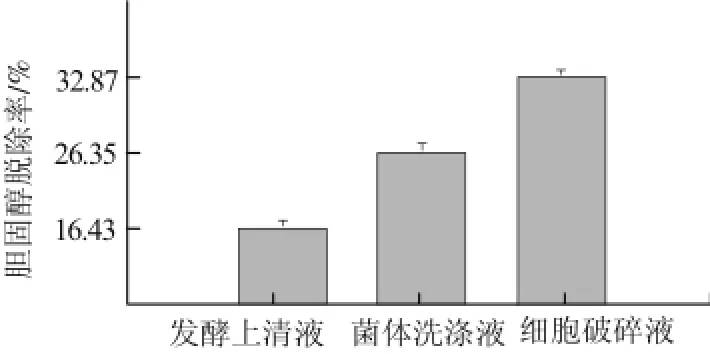
图5 不同介质中胆固醇降解情况Fig.5 Cholesterol degradation in different media
由图5可知,植物乳杆菌NDC 75017在不同介质中的胆固醇降解率分别是发酵上清液为16.43%,菌体洗涤液中为26.35%,细胞破碎液中为32.87%,由此胆固醇降解率可间接说明乳酸菌可以同化胆固醇到自身细胞内。
3 结 论
本实验首先对植物乳杆菌NDC 75017的耐酸、胆盐、人工消化液能力进行了研究,在pH3.0条件下处理1~3h,存活率分别为53.66%、28.46%和10.57%;对胆盐耐受率可达到84.31%;在7g/100mL的高盐浓度下,菌数仍然可以达到108CFU/mL以上,对高渗环境有较强耐受能力;植物乳杆菌NDC 75017可以通过胃进入肠道而保持活性,在肠道处理8h后存活率为58.73%。综上,植物乳杆菌NDC 75017具有较强的体外环境耐受能力。
本研究通过体外降胆固醇研究发现,植物乳杆菌NDC 75017在体外表现出良好的降胆固醇能力,测定发酵上清液、菌体洗涤液以及细胞破碎液中的胆固醇降解率分别为16.43%、26.35%和32.87%,由于对其降胆固醇基因等层面的作用机理还不明确,有待进一步研究。由以上结果可知,植物乳杆菌NDC 75017具有体外降胆固醇能力,为进一步研究植物乳杆菌NDC 75017的降胆固醇作用机理以及开发具有降胆固醇特性的发酵乳提供理论依据。
参考文献:
[1] YUNG L C, LUCY S H. Cholesterol-lowering effect of phytosterolcontaining lactic-fermented milk powder in hamsters[J]. Food Chemistry, 2010, 119: 1121-1126.
[2] MANN G V, SPOERRY A. Study of surfactant and cholsteremia in the Massi[J]. American Journal of Clinical Nutrition, 1974, 27: 464-469.
[3] 李常营, 杨贞耐. 酸菜来源植物乳杆菌S4-5的降胆固醇作用[J]. 食品科学, 2011, 32(7): 69-72.
[4] PEREIRA D, Mc CARTNRY A L, GIBSON G R. An in vitro study of the probiotic potential of a bile-salt-hydrolyzing Lactobacillus fermentum strain, and determination of its cholesterol-lowering properties[J]. Appl Environ Microbiol, 2003, 69: 4743-4752.
[5] KIMOTO H, OHMOMO S, OKAMOTO T. Cholesterol removal from media by lactococci[J]. Journal of Dairy Science, 2002, 85: 3182-3188.
[6] MITCHELL L J, SATYA P. Microencapsulated Genetically Engineered Lactobacillus plantarum 80 (pCBH1) for bile acid deconjugation and its implication in lowering cholesterol[J]. Journal of Biomed & Biotech, 2004,1: 61-69
[7] CHINGWEN Y, JIH T H. Relationship of somatic cell count, physical, chemical and enzymatic properties to the bacterial standard plate count in dairy goat mil[J]. Livestock Production Science, 2002,74 (1): 63-67.
[8] 中华人民共和国卫生部. 中华人民共和国药典[S]. 广州: 广东科技出版社, 1995: 附录64.
[9] 徐义刚, 崔立春, 赵丽丽, 等. 重组干酪乳杆菌在模拟消化环境中生存性能的研究[J]. 中国微生物期刊, 2006, 18(6): 424-426.
[10] PEREIRA D, GIBSON G R. Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J]. Appl Environ Microbiol, 2002, 68: 4689-4693.
[11] 孟丽, 唐善虎. 干酪乳杆菌在模拟人体消化道环境及高盐环境中生长活力的研究[J]. 食品研究与开发, 2009, 30(4): 46-49.
[12] 卜永士, 郭本恒. 一株干酪乳杆菌的生物学特性研究[J]. 乳业科学与技术, 2004(2): 49-51.
[13] HUEY S L, MIN T L. Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract[J]. International Dairy Journal, 2010, 20: 169-175.
[14] DAMBEKODI P C, GILLILAND S E. Incorporation of cholesterol into the cellular membrane of Bif i dobacterium longum[J]. Journal of Dairy Science, 1998, 81(7): 1818-1824.
[15] LAY G O, MIN T L. Cholesterol-lowering effects of probiotics and prebiotics: a review of in vivo and in vitro findings[J]. International Journal of Molecular Sciences, 2010, 11: 2499-2522.
[16] 严玉婷, 潘道东. 发酵乳杆菌SM-7的筛选及对小鼠降胆固醇作用[J]. 食品科学, 2010, 31(9): 224-228.
[17] 邓凯波, 柳国霞, 霍贵成. 乳酸菌胆酸盐耐受性及降胆固醇能力研究[J]. 食品工业科技, 2010, 31(1): 186-189.
[18] NGUYEN T D T, KANG J H, LEE M S. Characterization of Lactobacillus plantarum PH04, a potential probiotic bacterium with cholesterol-lowering effects[J]. International Journal of Food Microbiology, 2007, 113(3): 358-361.
[19] LYE H S, RAHMAT-ALI G R, LIONG M T. Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract[J]. International Dairy Journal, 2010, 20(3): 169-175.
[20] RUDEL L L, MORRIS M D. Determination of cholesterol using o-phthalaldehyde[J]. J Lipid Research, 1973, 14: 364-366.
Cholesterol-Lowering Capability of Probiotic Lactobacillus plantarum NDC75017
WANG Jin-yu1,2,MAN Chao-xin1,YANG Xiang-yi2,DONG Xin-yue2,LANG You2,YAN Tian-wen2,JIANG Yu-jun1,2,*
(1. National Research Center of Dairy Engineering and Technology, Northeast Agricultural University, Harbin 150086, China;2. Key Laboratory of Dairy Science, Ministry of Education, College of Food Science and Engineering, Northeast Agricultural University, Harbin 150030, China)
Lactobacillus plantarum NDC 75017 was isolated from traditional dairy products in Inner Mongolia of China. The aim of this study is to evaluate the environment-tolerant capability and cholesterol-lowering effect of L. plantarum NDC75017. Viable count was firstly used in this study to detect the tolerance characteristics under simulated gastrointestinal tract environment pH 2.0—3.0. Additionally, bacterial growth was evaluated in the presence of 0.3 g/100 mL bile salt and 0—7 g/100 mL sodium chloride. O-phthalaldehyde was used to detect its cholesterol-lowering capability. The results showed that L. plantarum NDC75017 had tolerance characteristics against pH 3.0 and 0.3 g/100 mL bile salt. The viable bacteria can be up to 108CFU/mL at sodium chloride of7 g/100 mL. L. plantarum NDC75017 kept vitality from stomach to intestines. After8 h incubation in artificial intestinal fluid, the survival rate of the strain remained up to 58.73%. Its cholesterol-lowering rates in bacterial fermentation supernatant, bacteria washing solution and cell disruption solution were 16.43%, 26.35% and 32.87%, respectively. These results indicated that L. plantarum NDC75017 had environment-tolerant characteristics and could be as the probiotics with cholesterol-lowering activity.
Lactobacillus plantarum;cholesterol-lowering effect;tolerance
R151.1
A
1002-6630(2013)03-0243-05
2012-10-10
国家“863”计划项目(2011AA100902);国家自然科学基金项目(31171718);黑龙江省教育厅科学技术研究重点项目(12511z005);教育部“长江学者和创新团队发展计划”项目(IRT-0959-203);黑龙江省青年科学基金项目(QC2009C55)
王今雨(1987—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:396359596@qq.com
*通信作者:姜毓君(1971—),男,教授,博士,研究方向为食品微生物与生物技术。E-mail:yujun_jiang@163.com



