陈茜茜,王 俊,黄 峰,黄 明*
(南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
肉类动物在宰后一段时间内,由于肌肉的连续不可逆收缩会形成尸僵,尸僵使肉的食用品质变差。在随后的低温(0~4℃)成熟过程中,肌肉的僵直解除、肌肉变软、系水力提高、风味得到有效改善。然而,在此过程中,脂质和蛋白质极易被氧化,造成肉的品质产生劣变。脂肪氧化会促进肌红蛋白氧化,导致肉褪色并产生酸败味,这方面的内容已经被广泛研究。但有关蛋白质氧化的研究起步较晚,现在主要集中在临床医药方面,在肉品领域相对较少。在肉的宰后成熟过程中,肌肉组织中的蛋白质在活性氧的攻击下,结构改变而导致某些功能也发生显着变化,从而必然会引起肉制品的嫩度、保水性、颜色等品质的劣变[1-2]。本文主要阐述在肉的宰后成熟过程中蛋白质氧化的作用机理,并探讨蛋白质氧化对肉类成熟的影响。
1 肉类成熟过程中的蛋白质氧化机制
1.1 蛋白质氧化机制
蛋白质氧化,是指在体内外环境中,蛋白质在自由基及其相关氧化物的作用下,某些特定的氨基酸残基发生反应,导致结构与功能发生变化,使蛋白质对氧化物的亲和力增强,易于水解、聚合、交联,损害细胞功能甚至导致细胞死亡[3]。蛋白质作为生物功能的主要体现者,广泛分布于细胞内外,因此是生物体内最易被氧化的对象之一。生物体内一些金属或酶催化的氧化反应,如脂质氧化、光敏剂、离子辐照、H2O2激活高铁肌红蛋白以及其他化学和生物过程都可以产生反应性氧系(ROS),ROS主要包括超氧阴离子自由基(•)、羟自由基(•OH)、过氧化氢自由基(HO2•)、单氧(O2)、次氯酸(HOCl)和一些活性的酮基和醛基[4-5]。多数情况下启动蛋白质氧化的自由基都是•OH。见图1。
•OH的化学性质很活泼,可以迅速氧化氨基酸侧链。•OH主要攻击含不饱和键和巯基的氨基酸,可以将组氨酰残基氧化成天冬氨酰残基、将脯氨酰残基氧化成谷氨酰残基等。Sharp等[7]测得不同氨基酸残基与羟基自由基反应的相对活性顺序为:半胱氨酸>色氨酸、酪氨酸>甲硫氨酸>苯丙氨酸>组氨酸>异亮氨酸>亮氨酸>脯氨酸。
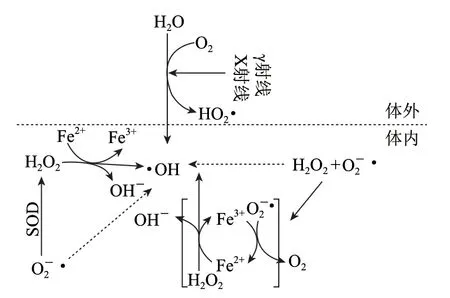
图1 在体内和体外•OH产生的机制[6]Fig.1 Mechanisms of hydroxyl free radical production in vitro and in vivo[6]
根据目前的研究可将ROS介导蛋白质的氧化分为直接和间接两种方式。直接介导,即ROS对主链、脂肪族侧链氨基酸残基或者芳香族侧链氨基酸残基发起攻击,经历去氢、电子传递、加成、断裂和重排、二聚、歧化和取代的历程,使蛋白质氧化。间接介导,指ROS先介导脂质过氧化和非酶糖基化反应,产生的脂质过氧化产物等中间产物随后与蛋白质反应,导致蛋白质羰基化产物和蛋白质-蛋白质交联物的形成[8]。
1.2 肉类成熟过程中的蛋白氧化
蛋白质是机体一切细胞的基本构成物质,在生命活动中起着催化、转运、调节、贮存、免疫等作用。蛋白质在畜肉、禽肉等肉类产品中含量很高,因此蛋白质氧化现象普遍存在于肉类宰后成熟过程中。在正常生理条件下,ROS的产生和清除是动态平衡的,但随着机体的衰老,尤其在处于应激和疾病状态时,会有一部分ROS未能被及时清除。这部分的ROS会损伤蛋白质、核酸以及脂类等生物分子。
1996年,Srinivasan等[9]曾提出假设,认为在肉类成熟过程中,脂类的氧化产物可以引发蛋白质的氧化。后来有研究证实脂质过氧化产物如4-羟基壬烯醛(hydroxynonenal,HNE)和丙二醛(malondialdehyde,MDA)确实可以与赖氨酸、组氨酸及半胱氨酸残基共价结合[10]。蛋白质氧化与脂肪氧化具有类似的自由基链式反应过程,包括起始、传递、终止3个阶段。可能的作用机制[11]如下(L代表脂质,P代表蛋白质):
引发:L→ L•;传递:L•+ O2→ LOO•;抽氢:LOO•+ P→LOOH + P•(—H);延伸:LOO•+ P →•LOOP;复合:•LOOP + P + O2→•POOLOOP;聚合:P—P•+ P•+ P → P—P—P•+ P—P—
在不同的氧化体系中,氨基酸残基被氧化的难易程度存在差异。在相同环境条件下,不同的氨基酸残基的氧化情况差异较大。Park等[12]将肌原纤维蛋白提取物置于肌肉组织中3种不同的氧化体系:铁离子催化氧化体系(iron-catalyzed oxidizing system,IOS)、脂质氧化体系(lipid-oxidizing system,LOS)及高铁肌红蛋白氧化体系(metmyoglobin oxidizing system,MOS)。通过液相色谱对各类氨基酸进行定量分析,结果表明在3种氧化体系中,含硫氨基酸如半胱氨酸和甲硫氨酸最容易被氧化;酪氨酸残基在IOS体系中较在另外2种体系中更易被氧化,形成酪氨酸-酪氨酸交联物;在MOS体系中则是丙氨酸、亮氨酸、组氨酸和赖氨酸较易被氧化。而组氨酸、精氨酸、赖氨酸、脯氨酸、甲硫氨酸和半胱氨酸在金属离子氧化体系中最容易被氧化[13]。
在ROS介导的蛋白质氧化过程中,氨基酸被氧化的优先程度不仅取决于氧化体系,通常也和蛋白质的类型有关。在乳蛋白的氧化过程中,半胱氨酸优先于色氨酸被氧化,而蛋氨酸则未被氧化[14]。大豆的胰蛋白酶抑制剂和溶解酵素在与次溴酸接触后活性丧失,这个过程与组氨酸、色氨酸、酪氨酸残基的氧化修饰有关,而与其他氨基酸如甲硫氨酸的改变无关[15]。
肌肉中的蛋白质氧化会导致芳香族和脂肪族氨基酸的羟基化、芳香族氨基酸残基的硝基化、巯基基团的亚硝基化、甲硫氨酰残基的磺化氧化、芳香基团和主要氨基的氯化,还会使一些氨基酸残基如赖氨酸、脯氨酸、精氨酸等更易转化形成羰基衍生物[16-17]。在肌肉中,这些变化会造成多肽的降解及肌球蛋白中ATP酶活性的降低,并且促使蛋白质与细胞中其他大分子物质交联产生聚合物,会对肉类的品质产生影响[18-20]。
2 蛋白氧化对肉类宰后成熟的影响研究进展
由于肌肉组织中含有各种促氧化因子,肉类制品极易被氧化。在肉的宰后成熟过程中,自由基对蛋白质的攻击会导致氧化程度提高以及肌肉组织抗氧化能力降低[21],由此会引起很多生化变化,包括氨基酸结构被破坏、蛋白质聚合而造成溶解性下降、相关酶活性下降以及蛋白质消化率降低[2]。这些变化会影响肉的品质如颜色、嫩度、风味、持水力及营养价值。目前关于蛋白质氧化对成熟影响的研究主要集中在肉的品质方面。
2.1 蛋白质氧化与肉类的宰后成熟
对成熟机制的相关研究一直是肉品科学领域的热点之一。肉类在宰后成熟过程中品质的改善归功于一些主要肌原纤维蛋白的降解,比如肌联蛋白、伴肌动蛋白、肌钙蛋白-T、肌间线蛋白和纽蛋白等。这些蛋白对维持肌原纤维蛋白结构的完整性极为重要,因此在成熟过程中,它们的水解会破坏肌原纤维的完整性,改变肌细胞内的有序结构,进而提高肉的品质。骨骼肌中存在的酶系统对这些蛋白的降解有一定作用,主要包括钙激活酶、蛋白酶体、溶酶体组织蛋白酶类和细胞凋亡酶类[22]。目前研究最多并得到大多数学者认同的是钙激活酶在肉宰后成熟过程中的作用。这方面的研究较为深入,但成熟机制仍未被阐明,钙激活酶系统并不能完全解释宰后成熟过程中主要骨架蛋白的降解规律。即使在钙激活酶抑制剂存在的情况下,仍然有肌原纤维蛋白能够发生降解[23];另外,钙激活酶的存在与否与成熟中某些蛋白质的降解没有关联。因此,可以推断肉类宰后成熟是一个多酶体系共同作用的过程,在骨骼肌中存在其他的酶系统也能促进蛋白降解。目前研究指出细胞凋亡效应酶也参与了肉的成熟过程,并且作用不容忽视。在自然成熟条件下,细胞凋亡酶-3的专一性抑制剂对钙激活酶影响较小,却能显着抑制肌间线蛋白、伴肌球蛋白和伴肌动蛋白的降解[24]。已有实验证实细胞凋亡酶跟钙激活酶都可以水解一些细胞内共同的蛋白质底物,且细胞凋亡效应酶-3可以降解钙激活酶的专一内源性抑制蛋白[25],充分说明细胞凋亡效应酶对成熟过程中肌原纤维蛋白的降解也有贡献。
肌肉组织中含有亚铁血红素、过渡态的金属离子和各种氧化酶,极易发生氧化反应。不论是肌原纤维蛋白被氧化还是作用于底物蛋白的酶类被氧化,均会对肉类宰后成熟过程产生影响。部分肌原纤维蛋白被氧化后结构改变,对蛋白水解酶的敏感性发生变化,致使其自身的降解程度改变。目前也发现不同浓度的氧化剂对肌原纤维蛋白的降解程度不同,高浓度的氧化剂氧化的肌原纤维蛋白对钙激活酶的敏感性增强,部分蛋白更易被降解。另外,氧化会导致细胞骨架蛋白的降解变化,破坏胞内坏境,从而影响肉的成熟过程。有关钙激活酶系统动力学的研究[26]发现离子强度能影响钙激活酶活性,氧化会改变宰后动物体内的离子水平,使钙激活酶活性变化进而导致底物的降解发生改变。氧化还能直接破坏钙激活酶的结构,通过控制钙激活酶的活性来改变肌原纤维蛋白的降解。因此为了充分地发挥宰后成熟过程对改善肉类品质的作用,对肉的宰后成熟过程中发生的蛋白质氧化进行深入研究是十分必要的。
2.2 蛋白质氧化对肉的品质影响
2.2.1 蛋白氧化对肉色的影响
生鲜肉的颜色是消费者对肉品质量进行评价的主要依据之一,很大程度上影响着消费者的购买欲。肌红蛋白和血红蛋白是肌肉中决定肉色的主要色素物质,其中肌红蛋白的含量和化学状态对肉的色泽起关键性决定作用。
在肉的宰后成熟过程中,肌肉颜色的变化由血红素存在的状态以及铁原子的氧化还原形式所引起的三种肌红蛋白之间的转换所决定。肌红蛋白与氧结合后生成氧合肌红蛋白,肉色由紫色变为鲜红色;氧合肌红蛋白和肌红蛋白都可以被氧化形成高铁肌红蛋白,肉色变暗呈褐色。在肉的成熟过程中,肉色变化主要是高铁肌红蛋白在肉表面的蓄积所致的褐变。宰后的辐照会产生自由基,加速蛋白质的氧化,使高铁肌红蛋白迅速累积形成难以接受的棕褐色。如果在宰前一段时间持续饲喂VE,则能有效降低肌浆蛋白的氧化程度,延长肉色的保持时间[27]。另外在肉的成熟过程中使用其他一些天然抗氧化剂如花青素、VE、VC处理,可以抑制蛋白质氧化并促进高铁肌红蛋白向氧合肌红蛋白转变,从而使肉色保持鲜红[28]。而关于宰后贮存中发生的蛋白质氧化对肉色的影响,近年来研究较多的是生鲜肉的气调包装。气调包装中O2含量是影响新鲜红肉的货架期的重要因素,尽管高氧(50%~70%)会造成脂质氧化,但能显着维持和延长肉色。另外高含量的CO2(50%~70%)虽然能够抑制微生物生长,却会使肉色变暗。因此对于生鲜牛肉,50%O2+30%CO2+20%N2的气调包装是最合适的贮存方式,在14d内可以有效地维持肉色并保证氧化反应稳定,同时微生物数量控制也在可接受范围内[29]。
2.2.2 蛋白氧化对嫩度的影响
影响生鲜肉最终嫩度的因素主要包括肌节长度、结缔组织含量及肌原纤维蛋白的水解程度[30]。其中嫩度得到改善最主要的原因是肌原纤维蛋白的有限降解[31]。早期的实验将肌原纤维蛋白在体外用钙激活酶孵育,结果能完全模拟自然成熟条件下伴肌球蛋白、伴肌动蛋白、肌间线蛋白和肌钙蛋白-T等的降解[32]。因此普遍认为,钙激活酶能控制关键蛋白的降解,最终影响肉的嫩度。然而,μ-钙激活酶和m-钙激活酶的活性位点上都有组氨酸和含有巯基的半胱氨酸残基,这些都是极易被氧化的基团,从而使酶因氧化而失活[33]。
在肉的宰后成熟过程中发生的蛋白质氧化反应主要包括肌原纤维蛋白和相关酶类的氧化,这些氧化都是通过改变肌原纤维蛋白的降解情况,从而影响肉的嫩度。Rowe等[34]曾在牛肉的宰后26h内对其进行辐照处理,结果证实氧化能通过抑制钙激活酶的活性降低成熟过程中蛋白降解的程度,辐照组剪切力明显高于未辐照组,且肌钙蛋白-T和肌间线蛋白的降解产物更少,同时钙激活酶的自溶程度也较低。另外,Martine等[35]从猪肉肌肉中提取的肌原纤维蛋白置于•OH体系中氧化,SDS-PAGE分析显示肌球蛋白重链和轻链条带显着减少,而肌动蛋白的降解条带在氧化剂浓度达到3mmol/L后也存在一定程度的减少。肌球蛋白和肌动蛋白是肌肉中含量最高的蛋白质,作为肌纤维的主要成分对肌肉的收缩功能起着重要作用,因此肌原纤维蛋白的氧化可以降低蛋白质降解程度,造成嫩度降低。
目前的研究表明,蛋白质氧化主要通过两种机制影响肉的嫩度:1)是肉的嫩化过程中蛋白水解酶活性的抑制与肌球蛋白及肌动蛋白的氧化修饰之间的协同作用,氧化导致的肌球蛋白和肌动蛋白结构改变会降低其对蛋白水解酶的敏感性[34,36]。2)是通过改变肌原纤维蛋白的结构,使蛋白质之间产生交联而增强肌纤维结构,从而导致肌肉组织硬化,嫩度下降[33]。
2.2.3 蛋白氧化对肉的持水力的影响
肉的持水力是指当肌肉受到外力作用时,其保持原有水分与添加水分的能力。肌肉的持水力会影响肉的食用品质包括滋味、多汁性、香气等,还会产生PSE肉,造成经济损失。影响生鲜肉持水力的因素很多,如动物品种、性别和肌肉部位,压力、饲喂及运输管理等宰前处理,宰后因素主要包括电击晕和pH值下降等,蛋白质氧化也对其产生了不可忽视的影响[37]。纯化的肌原纤维蛋白在被H2O2氧化后持水力降低,研究[38]发现这与酪氨酸-酪氨酸交联物的形成有关,揭示了蛋白氧化交联产物对持水力存在不利影响。μ-钙激活酶的自溶能促进主要骨架蛋白的降解,从而提高肌肉的持水力,这是由于宰后肌肉中完整的肌间线蛋白将肌原纤维蛋白的收缩转化为整个细胞的收缩,造成水分流失,所以肌间线蛋白降解程度越高,滴水损失就越小。同时,整联蛋白的降解能够促使细胞膜和细胞骨架之间的水通道形成,使肌肉持水力降低[39]。氧化能抑制主要骨架蛋白的降解并且会降低μ-钙激活酶的自溶程度[34],因此在肉的宰后成熟过程中蛋白质氧化会导致滴水损失加重而使肌肉的保水能力下降。然而持水力与蛋白氧化程度间的直接联系还有待深入探究。
2.2.4 蛋白氧化对肉的营养品质的影响
肉类是人类必需氨基酸的重要来源,包括无法从植物性食物中获取的氨基酸。肌肉中蛋白质的氧化对食品营养和消费者健康方面潜在的影响越来越被重视。在蛋白质被氧化形成羰基的过程中,一些必需氨基酸如赖氨酸、精氨酸、苏氨酸结构上会发生不可逆转的氧化修饰,从而导致蛋白质功能丧失,因此可以证实蛋白质氧化对肉中蛋白质的营养价值会产生不良影响[12]。氧化后的肌球蛋白和肌动蛋白被木瓜蛋白酶水解的程度降低,这是由精氨酸和赖氨酸的羰基化造成的[35]。然而,羰基的形成对肉制品营养价值的损害程度尚未见报道。
除了造成必需氨基酸的损失,蛋白质氧化还会影响蛋白质的消化率从而降低其营养价值。氧化程度较低时,蛋白质结构会发生微小的变化使其更易被蛋白酶识别而提高水解速度。但当氧化程度较高时,蛋白质分裂产物和特殊氨基酸侧链的降解将会改变识别位点,从而降低蛋白水解程度[40]。另外蛋白质氧化程度与酪氨酸水解活性之间呈显着的负相关[41],羰基-氨基缩合反应也能促进蛋白质的交联和分裂,从而影响肌球蛋白和肌动蛋白的消化率。
氧化引起的蛋白质消化率降低不仅降低肉的营养品质,而且会损害人体健康。未被水解的氨基酸会被肠道里的菌群发酵,生成苯酚和甲酚,提高患结肠癌的几率[42]。
3 结 语
目前有关肉成熟过程中蛋白质氧化机理及其对品质的影响的研究已经取得一定成果,也已证实氧化所导致的蛋白质结构的变化(包括羰基化和硝基化)会降低肉制品的营养价值和消化率,但具体的机制和影响程度还有待深入探究。另外,在肉的成熟过程中,肌原纤维蛋白和酶被氧化后,底物蛋白的结构变化、降解情况以及酶的活性变化尚未被阐明,而这些方面的近一步研究可以丰富和发展肉的成熟理论,为充分发挥肉的成熟潜能提供理论依据,对提高肉的食用品质和营养价值具有重要的现实意义。
[1]MARTINAUD A, MERCIER Y, MARINOVA P, et al.Comparison of oxidative processes on myofibrillar proteins from beef during maturation and by different model oxidation systems[J].Journal of Agricultural and Food Chemistry, 1997, 45∶ 2481-2487.
[2]DECKER E, FAUSTMAN C, LOPEZ-BOTE C J.Antioxidants in muscle foods[M].New York∶ John Wiley & Sons Inc, 2000∶ 85-95.
[3]WITKO-SARSAT V, GAUSSON V, DESCAMPS-LATSCHA B.Are advanced oxidation protein products potential uremic toxins?[J].Kidney International Supplement, 2003, 63∶ 11-14.
[4]BUTTERFIELD D A, STADMAN E R.Protein oxidation processes in aging brain[J].Advanced in Cell Aging and Gerontology, 1997, 2∶161-191.
[5]李培峰, 方允中.活性氧对蛋白质的损伤作用[J].生命的化学, 1994,14(6)∶ 1-2.
[6]李国林, 印大中.ROS介导的蛋白质氧化的生化机制[J].生命的科学, 2007, 27(6)∶ 517-518.
[7]SHARP J S, BECKER J M, HETTICH R L.Analysis of protein solvent accessible surfaces by photochemical oxidation and mass spectrometry[J].Analytical Chemistry, 2004, 76∶ 672-683.
[8]SHACTER E.Quantification and significance of protein oxidation in biological samples[J].Drug Metabolism Review, 2000, 32∶ 307-326.
[9]SRINIVASAN S, XIONG Y L, DECKER E A.Inhibition of protein and lipid oxidation in beef heart surimi-like material by antioxidants and combinations of pH, NaCl, and buffer type in the washing media[J].Journal of Agricultrual and Food Chemistry, 1996, 44(1)∶119-125.
[10]ALDERTON A L, FAUSTMAN C, LIEBLER D C.Introduction of redox instability of bovine myoglobin by adduction with 4-hydroxy-2-nonenal[J].Biochemistry, 2003, 42∶ 4398-4405.
[11]SCHAICH K M.Free radical initiation in proteins and amino acids by ionizing and ultraviolet radiations and lipid oxidation Ⅲ∶ free radical transfer from oxidizing lipids[J].Critical Reviews in Food Science and Nutrition, 1980, 13(3)∶ 189-244.
[12]PARK D, XIONG Y L.Oxidative modification of amino acids in porcine myofibrillar proyein isolates exposed to three oxidizing systems[J].Food Chemistry, 2007, 103∶ 607-616.
[13]LEVINE R L, MOSONI L, BERLETT B S.Methionine residues as endogenous antioxidants in proteins[J].Proceedings of the National Academy of Sciences USA, 1996, 93∶ 15036-15040.
[14]ELIAS R L, MCCLEMENTS D J, DECKER E A.Antioxidant activity of cystein, tryptophan, and methionine residues in continuous phaseβ-lactoglobulin in oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry, 2005, 53∶ 10248-10253.
[15]HAWKINS C L, DAVIES M J.The role of aromatic amino acid oxidation, protein unfolding, and aggregation in the hypobromous acid-induced inactivation of trypsin inhibitor and lysozyme[J].Chemical Research in Toxicology, 2005, 18∶ 1669-1677.
[16]AMICI A, LEVINE R L, TSAI L.Conversion of amino acid residue in proteins and amino acid homopolymers to carbonyl derivatives by metal-catalyzed oxidation reaction[J].The Journal of Biological Chemistry, 1989, 264∶ 3341-3346.
[17]STADTMAN E R, LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J].Amino Acids,2003, 25∶ 207-218.
[18]QOIZUMI T, XIONG Y L.Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J].Journal of Agricultural and Food Chemistry, 2004, 52∶ 4303-4307.
[19]PARK D, XIONG Y L, ALDERTON A.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry, 2006, 101∶1239-1246.
[20]SRINIVASAN S, HULTIN H O.Chemical, physical, and functional properties of cod proteins modified by a nonenzymatic free radicalgenerating system[J].Journal of Agricultural and Food Chemistry,1997, 45∶ 310-320.
[21]RENERRE M, PONCET K, MERCIER Y, et al.Influence of dietary fat and vitamin E on antioxidant status of muscles of turkey[J].Journal of Agricultural and Food Chemistry, 1999, 47∶ 237-244.
[22]黄明, 黄峰, 周光宏, 等.内源性蛋白酶对宰后肌肉嫩化机制研究进展[J].中国农业科学, 2011, 44(15)∶ 3214-3222.
[23]HOPKINS D, THOMPSON J.Factors contributing to proteolysis and disruption of myofibrillar proteins and the impact on tenderization in beef and sheep meat[J].Australian Journal of Agricultural Research,2002, 53(2)∶ 149-166.
[24]HUANG M, HUANG F, XU X L, et al.Influence of caspase-3 selective inhibitor on proteolysis of chicken skeletal muscle proteins during post-mortem aging[J].Food Chemistry, 2009, 115(1)∶ 181-186.
[25]HUANG M, HUANG F, XUE M, et al.The effect of active caspase-3 on degradation of chicken myofibrillar proteins and structure of myofibrils[J].Food Chemistry, 2011, 128(1)∶ 22-27.
[26]黄明, 汤晓燕, 黄峰, 等.黄牛肉中钙激活酶系统的动力学性质[J].中国农业科学, 2010, 43(8)∶ 1664-1669.
[27]ROWE L J, MADDOCK K R, LONERGAN S M, et al.Influence of early postmortem protein oxidation on beef quality[J].American Society of Animal Science, 2003, 82∶ 785-793.
[28]RUI G, DAVID M, MARIO E.Protein oxidation in emulsified cooked burger patties with added fruit extracts∶ influence on colour and texture deterioration during chill storage[J].Meat Science, 2010, 85∶ 402-409.
[29]ESMER O K, IRKIN R, DEGIRMRNCIOGLU N, et al.The effects of modified atmosphere gas composition on microbiological criteria,color and oxidation values of minced beef meat[J].Meat Science,2011, 88∶ 221-226.
[30]KOOHMARAIE M, KENT M P, SHACKELFORD S D, et al.Meat tenderness and muscle growth∶ is there any relationship?[J].Meat Science, 2002, 62(3)∶ 345-352.
[31]KOOHMARAIE M, GEESINK G H.Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J].Meat Science, 2006, 74(1)∶34-43.
[32]GEESINK G H, KOOHMARAIE M.Effect of calpastatiin on degradation of myofibrillar proteins by mu-calpain under postmortem conditions[J].Journal of Animal Science, 1999, 77(10)∶ 2685-2692.
[33]LAMETSCH R, LONERGAN S M, HUFF-LONERGAN E.Disulfide bond withinμ-calpain active site inhibits activity and autolysis[J].Biochimica et Biophysica Acta, 2008, 1784∶ 1215-1221.
[34]ROWE L J, MADDOCK K R, LONERGAN S M, et al.Oxidative environments decrease tenderization of beef steaks through inactivation ofμ-calpain[J].American Society of Animal Science,2004, 82∶ 3254-3266.
[35]MARTINE M, GATELLIER P, SAYD T, et al.Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J].Meat Science, 2006, 73∶ 536-543.
[36]CARLIN K R M, HUFF-LONERGAN E, ROWE L J, et al.Effect of oxidation, pH, and ionic strength on calpastatin inhibition ofμ- andm-calpain[J].Journal of Animal Science, 2006, 84∶ 925-937.
[37]HUFF-LONERGAN E, LONERGAN S M.Mechanisms of waterholding capacity of meat∶ the role of postmortem biochemical and structural changes[J].Meat Science, 2005, 71∶ 194-204.
[38]BERTRAM H C, KRISTENSEN M, BARON C P, et al.Does oxidation affect the water functionality of myofibrillar proteins?[J].Journal of Agricultural and Food Chemistry, 2007, 55∶ 2342-2348.
[39]ZHANG W G, LONERGAN S M, GARDNER M A.Contribution of postmortem changes of integrin, desmin andμ-calpain to variation in water holding capacity of pork[J].Meat Science, 2006, 74∶ 578-585.
[40]GRUNE T, JUNG T, MERKER K, et al.Decreased proteolysis caused by aggregation, inclusion bodies, plaques, lipofuscin, ceriod, and“aggresomes” during oxidative stress, aging and disease[J].International Journal of Biochemistry & Cell Biology, 2004, 36∶ 2519-2530.
[41]SANTÉ-LHOUTELLIER V, AUBRY L, GATELLIER P.Effect of oxidation onin vitrodigestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry, 2007, 55∶ 5343-5348.
[42]EVENEPOEL P, CLAUS D, GEYPENS B, et al.Evidence for impaired assimilation and increased colonic fermentation of protein related to gastric acid suppression therapy[J].Alimentary Pharmacology and Therapeutics, 1998, 12∶ 10-11.



