张雅君,张 浩,杨 选,韩永斌
花生主要致敏物质及其脱敏方法研究进展
张雅君,张 浩,杨 选,韩永斌*
(南京农业大学 农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
花生作为影响部分人群生活质量的主要过敏食物之一,其中含有的过敏原会引起人体强烈的过敏反应,严重时甚至会导致人的死亡。花生过敏反应因其潜在的危险性、长期性以及不断增加的发病率而日益受到各国的广泛关注。研究花生致敏机理及脱敏方法已成为热点,探索有效脱敏方法,对保证花生食品的安全性具有重要 的现实意义。本文对花生致敏机制,过敏原致敏组分分析和脱敏方法进行阐述。
花生;过敏原;致敏机制;脱敏
食物中能使机体产生过敏反应的抗原分子称为食物过敏原,它们大多数为蛋白质[1]。联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)(1995年)报告了大豆、花生、牛奶、鸡蛋、鱼等8 类过敏食物,约占所有食物过敏原的90%以上[2-3]。花生是目前人类重要的植物蛋白质来源之一,并可以作为多种食品的原辅料。随着食品消费和流通的全球化,花生的致敏已成为重要的食品安全问题而受到各国的广泛关注。人类食用含有鸡蛋和牛奶的食物引起的过敏表现在婴儿期,通常在儿童学龄期消失。花生致敏虽然同其他食物致敏一样属于即时性过敏,但其致敏具有长期性、普遍性,甚至威胁生命。花生过敏患者的这种疾患是终身的,患者对花生的过敏不会随着年龄的增长而消失[4-5]。调查发现有80%的患者对花生的过敏反应持续到成年,这极大地影响了他们的生活质量[6]。
花生过敏患者的临床症状主要表现为轻微咽部刺痛、呕吐,严重时可能会出现危及生命的全身性过敏反应。据报道[7],摄入少量(约200 μg)或通过接吻传递极少量的花生过敏原都可能引起明显的过敏反应,甚至导致过敏性休克和死亡。美国报道的由食物过敏引起的死亡病例中有59%是由花生过敏引起的,列各类过敏致死之首[8]。在过去的几十年里,花生过敏发病率在西方国家不断增加。美国儿童花生过敏的患病率,1997年只有0.4%,2002年则增加了1 倍达到0.8%,2008年 为1.4%[9]。花生过敏发病率在中国亦逐渐凸显,叶世泰等[10]在我国常用食品致喘40 例分析中指出花生等油料作物位居食物过敏原的前列,常用食物组抗原皮肤实验结果显示豆类食物皮肤实验阳性例数大大增加,这可能是豆类与其他食物、特别是同科植物的交叉抗原性有关。根据对中国协和医科大学北京协和医院变态反应科就诊病人的调查,约有4%的病人对花生过敏,有的病人对7 种花生致敏组分过敏,大多数病人对花生中的2 种或2 种以上致敏组分过敏,而少数病人对其中的1 种致敏组分有反应[11]。随着食品的生产、流通和消费的国际化,花生过敏将成为各国共同关注的问题。因此研究花生蛋白致敏的机理,探索有效的脱敏方法,对保证花生食品的安全性具有重要意义。本文对花生致敏机制,过敏原致敏组分分析及其脱敏方法进行了阐述。
1 花生过敏反应机理及其临床症状
食品过敏反应(food allergy)又称食物变态反应,是指食物进入人体后,机体对其产生异常免疫应答,导致机体生理功能紊乱或组织损伤,进而引发一系列临床症状,如皮炎、哮喘等的过程[12]。大多数食物的致敏是由食物过敏原与人体内的免疫球蛋白E(IgE)相互识别引发的[13]。在过敏反应中,来源于骨髓、脐带血干细胞中的肥大细胞是核心细胞,是Ⅰ型过敏反应中最重要的效应细胞。对于哺乳类动物而言,肥大细胞主要分布于机体与外界环境相通的地方,如皮肤、气道和消化道,这些部位经常可以接触到病原体、过敏原以及环境中的其他物质。它的胞质内富含嗜碱性颗粒,颗粒中含有5-羟色胺、组胺、白三烯和各种酶类[14-15]。
在过敏反应中,摄入的过敏原首次进入机体后,抗原会诱导B淋巴细胞产生特异性的抗体IgE、sIgE与肥大细胞表面的特异性受体FcεR相结合,从而使肥大细胞处于致敏状态。当机体再次接触到抗原时,抗原与结合了IgE的肥大细胞再次相遇,肥大细胞表面的FcεR受体发生凝集反应,激活肥大细胞内部信号传导,在短时间内导致肥大细胞“脱颗粒”,释放组胺、白三烯和肝素等介质到组织液中,刺激附近的血管或神经,引起平滑肌收缩、毛细血管扩张等一些过敏反应症状,造成皮肤、消化道和呼吸道,甚至全身性的过敏反应[16]。其中肥大细胞的脱颗粒和活性的改变受细胞内钙离子浓度调节[17]。
花生过敏最常涉及的靶器官是消化道,几乎100%的过敏病人都表现有口周皮肤和口咽黏膜的过敏反应;另外其他主要的过敏靶器官是皮肤和呼吸系统。当然,严重的花生过敏反应是全身性的,可引起过敏性休克、甚至危及生命[18]。
2 花生中主要过敏蛋白组分
食物致敏原一般是具有酸性等电点的蛋白质或糖蛋白,分子质量在10~70 kD[19]。自Lehere等[20]在1981年首次发现花生中第一个致敏蛋白至今,共有11 种能够特异性与IgE结合的花生蛋白被陆续发现,分别命名为Ara h 1~Ara h 11(表1)。花生致敏蛋白属于种子贮藏蛋白,是含有多种高度糖基化的蛋白质组分,它们主要属于两个球蛋白家族,即花生球蛋白和伴球蛋白。Meier等[21]利用免疫印迹法测定,分离鉴定出花生中3 个主要的致敏原,分子质量分别为15、20、66 kD。北京协和医院的李宏共检测出8 条花生蛋白带能特异性与IgE结合,其分子质量分别为63、53、48.5、41.7、39、34.8、23.5、17.9 kD,并认为分子质量为48.5、41.17、23.5 kD的蛋白是引起我国易感人群对花生过敏的主要过敏蛋白[11]。
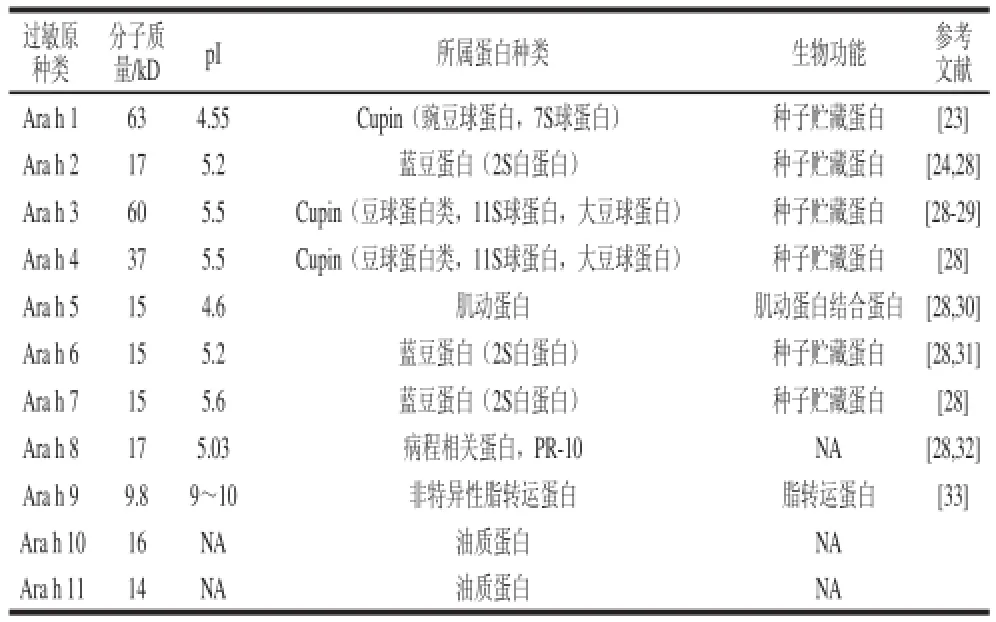
表1 11 种花生过敏原基本性质Table 1 General properties of eleven peanut allergens
2.1 Ara h 1
Arah 1是分子质量为63~63.5 kD的糖蛋白,为最重要的花生过敏原,占花生总蛋白含量的12%~16%,其蛋白和糖基部分均有与IgE结合位点[22],是目前研究最多的花生过敏原之一。Ara h 1表现为高度结构化二级结构和一个复杂的同源三聚体并具有明确三级折叠结构[23],其不同亚基的等电点和分子质量略有不同,可被超过90%的花生过敏患者的血清所识别[24]。丛艳君等[25]采用固相合成肽技术合成了Ara h l的23 条多肽,以花生过敏患者血清为抗体,鉴别和定位Ara h l的抗原决定簇。结果表明:Ara h l第21~34位、第89~98位、第393~403位、第498~507位、第594~605位氨基酸序列识别率均在60%以上,为Ara h l的抗原决定簇,其中第498~507位的多肽识别率为100%。是显性抗原决定簇。用丙氨酸依次取代显性抗原决定簇的每个氨基酸,发现抗原决定簇的致敏性增强或丧失,说明Ara h 1第499位和第503位的精氨酸和第502位的丙氨酸是Ara h 1致敏性的关键氨基酸。
Ara h 1具有热稳定性强、耐酶解和不易消化等特点[26],与其他豆科植物贮藏蛋白中豌豆球蛋白具有高度同源性[27]。Ara h 1在蛋白质水平上与大豆和豌豆中的具有40%的相似性,在DNA水平上与蚕豆和豌豆的豌豆球蛋白有64%的相似性[24]。Ara h 1的IgE结合位点已确定,包含23 个独立结合位点,沿分子的线性序列均匀分布[23]。Ara h 1因具有这些特性已被作为花生过敏原检测的一种理想的生物标记,其分离得到的纯品被用作生产单克隆抗体和酶联免疫吸附测定的标准物。
2.2 Ara h 2
Ara h 2是花生中另一种主要的过敏原,也是一种糖蛋白,约占花生总蛋白量的5.9%~9.3%,可被绝大部分花生过敏患者血清中的IgE识别[34],与过敏原Ara h 6的氨基酸序列有59%的同源性[35]。肽段分析已经确定的Ara h 2一共含有10 个IgE结合表位,其中的3 个抗原决定簇被认为是优势表位,并且在这3 个抗原决定簇中的2 个区域内都有专一的氨基酸序列DPYSPS,该序列被认为是IgE结合所必需的[36]。Stanley等[37]研究发现,10 个IgE结合表位贯穿于Ara h 2蛋白,位于氨基酸残基17~39位置上有3 个表位(aa 15~24,aa 21~30和aa 27~36),其中有些部分相互重叠。在41~80位上含有4 个表位(aa 39~48,aa 49~58,aa 57~66和aa 65~74)。另外3 个表位分布在氨基酸残基114~157位置上(aa 115~124,aa 127~136和aa 143~152)。其中位于aa 27~36,aa 57~66和aa 65~74位置的3 个表位与IgE的结合能力比其他表位都强,被认为是Ara h 2蛋白的优势表位。Ara h 2包含有2 个亚型,分别为Ara h 2.01和Ara h 2.02,与过敏原Ara h 2.01相比,Ara h 2.02多1 个IgE结合表位。这个结合表位由12 个氨基酸组成,刚好形成第3 个重复序列DPYSPS[38]。因此,Ara h 2.02相对分子质量大于Ara h 2.01并且其致敏性更强。
2.3 Ara h 3
Ara h 3有很多分子质量在14~45 kD之间的同源蛋白,能被45%~54%的患者血清IgE识别[29]。Ara h 3热稳定性强,不易被蛋白酶彻底水解。Anboxtel等[39]在研究加热和消化对Ara h 3和大豆球蛋白与IgE结合能力的影响中发现两者在变性过程中表现相对稳定,根据蛋白质的四级结构和所处溶液离子强度的不同,其变性温度范围在70~92 ℃之间。它存在4 个与IgE结合的表位,分别位于氨基酸残基的21~55、134~154、231~269和271~328位置上。Rabjohn等[29]通过对8 个花生过敏患者的血清IgE免疫实验发现,第3个表位(231~269位)为最优势表位,8 个过敏患者的血清IgE均能与之结合。组成Ara h 3表位的氨基酸中有68%为极性不带电或非极性氨基酸。iso-Ara h 3是近年发现的Ara h 3的一个亚型,与Ara h 3在核苷酸水平上约有73%的序列具有同源性,而在氨基酸水平上的同源性约为67%。然而Ara h 3比iso-Ara h 3有更强的致敏性[40]。
2.4 Ara h 5
Ara h 5是一种几乎存在于所有真核细胞的一种蛋白,1977年首次作为肌动蛋白的结合蛋白被报道,在基因库中的登录号为AAU81921[30],目前在国际免疫学会已经公布的11 种花生过敏原蛋白中Ara h 5作为泛过敏原。Ara h 5 共有128 个氨基酸残基,花生中Ara h 5的含量非常低,其纯品很难大量获得。
2.5 Ara h 6
Ara h 6约占花生蛋白总量的4.5%[31]。迄今为止,Marsh[41]和Koppelman[42]等用阴离子交换层析结合凝胶层析和高效液相色谱等技术分离获得了Ara h 6,通过脱脂、蛋白浸提、阴离子交换层析分离得到目的蛋白,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)、基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ ionization time of flight mass spectrometry,MALDI-TOF/MS)及免疫印迹技术(Western blotting)对其进行鉴定[43]。Koppelman等[42]还发现其与Ara h 2的氨基酸序列具有高度的同源性,N端测序结果显示Ara h 6的抗原决定簇与Ara h 2 抗原决定簇当中的7 个相同。
2.6 Ara h 8
Mittag等[32]认为花生蛋白Ara h 8是一种非常重要的过敏原,会使桦树花粉过敏患者过敏,Ara h 8与桦树花粉过敏病人血清中IgE反应强烈,而传统经典的花生过敏原如:Ara h 1、Ara h 2 和Ara h 3,只有很微弱甚至不与桦树花粉过敏病人血清中IgE反应。说明花生蛋白Ara h 8与桦树花粉具有交叉致敏性。研究还发现Ara h 8经胃液消化后其致敏性明显降低,所以有可能是其尚未进入胃部在口腔消化过程中就已引起了过敏反应[44-45]。
3 花生脱敏方法
花生中的过敏原虽然比较稳定,但许多研究表明,一些加工方法可对花生的过敏原产生影响。花生中的致敏蛋白可能在加工过程中发生变性、降解、聚集和化学修饰,其与IgE的结合反应发生改变而使其致敏性发生变化[46]。因此,了解加工过程对花生过敏原的影响是极其重要的。
3.1 物理方法
3.1.1 热加工
热加工因其成本低、操作简单、易实现,是目前改变致敏蛋白质性能最常用的方法之一。
3.1.1.1 水煮
Beyer等[47]研究发现,经水煮后,花生中致敏蛋白质与IgE的结合能力降低了50%,这主要是由于部分过敏原如Ara h 1和Ara h 2等溶解进入了水中,尤其是一些分子质量为10~16 kD的蛋白质或肽片段溶解到水中。另外加热还能改变致敏蛋白的高级结构,当纯化后的Ara h 1加热到80~90 ℃时,二级结构折叠加剧,使得溶解度降低,从而降低了花生的过敏性[48]。Hu Chunqiu等[49]发现热处理也可降低Ara h 2的抗原性,当热处理温度高于85 ℃时,过敏原Ara h 2的抗原性明显降低;当处理温度为115 ℃时,加热1 h后其抗原性降低85%。因此通过水煮可以降低花生部分过敏原的抗原性,该法可能是获得低致敏性花生制品的一个很好途径。
3.1.1.2 煎炸和烘焙干燥
煎炸同样会影响花生的过敏原性,花生经过煎炸之后所含的Ara h 1单体和三聚体数量就会减少,从而降低了Ara h 1与IgE的结合能力[47]。Stark等[50]研究显示,烘焙处理明显增强了Ara h 2与人体肠道上皮细胞的结合力,加速低聚体形成,提高了与IgE、IgG的结合能力。这主要是由于在焙烤过程中花生中蛋白质与还原糖在美拉德反应中形成Amadori产物,这种产物经过一系列作用最终生成结构多样的复合物,而这种最终产物含量的增加会导致IgE结合能力的增强。研究还发现,焙烤过程中Ara h 2分子发生了交叉连接,并形成结构更稳定的三聚体或六聚体等复合物,增强了其与IgE的结合能力[51]。Maleki[51]和Beatriz[52]等的研究证实,焙烤花生的致敏性比水煮花生和生花生都要强,与IgE的结合能力比生花生高90 倍。在花生焙烤过程中一些中间产物的生成可能导致其与IgE结合能力的增强的主要原因,如脂的氧化物等。对花生进行热风干燥时,不同的温度对花生致敏性的影响也不同。Chung等[53]研究发现,当热空气的温度在35~60 ℃时不会改变花生的致敏性,而温度在77 ℃以上时则会提高花生的致敏性。因此经过烘焙处理来降低花生的致敏性是否有效还有待进一步研究,降低烘烤花生致敏性可以结合高压等其他处理,进一步研究来确定具体有效的处理方法。
3.1.1.3 花生油脂精炼过程
Teuber等[54]通过对17 个花生过敏患者的血清池进行免疫印迹实验,结果证明不同精炼等级的花生油与IgE的结合能力不同。与IgE结合能力由强到弱的次序为:非精炼花生油(加工的最高温度为54 ℃)>非精炼花生油(加工温度为63~93 ℃)>精炼的、脱色的、除味的花生油(加工温度为230~260 ℃)。可能因为高温改变了花生蛋白结构,也可能是精炼后花生蛋白含量减少甚至消失,使其精炼制品致敏性降低。
3.1.2 机械研磨
Hourihane等[55]从研磨花生中提取花生蛋白,并对14 个花生过敏患者进行双盲实验,结果发现其中有患者仅食用100 μg的花生蛋白即可出现短期的过敏症状。由此可见,对花生进行研磨加工并未能降低其致敏性。因简单的机械加工不能改变致敏蛋白的分子结构,故很难改变其致敏性。
3.1.3 高温加压处理
Guillamon等[56]先前的研究已经表明,高压灭菌法在138 ℃,2.56 atm条件下处理30 min和在5.9 atm 条件下经过3 min的“瞬时控制降压”可以减少羽扇豆过敏原的IgE结合能力。同样的研究结果在其他豆类研究中得到证实:Malley等[57]研究发现120 ℃高压处理青豌豆15 min可以减少其过敏原。Beatriz等[52]在压力2.56 atm条件下将花生处理15 min后,分子质量在26 kD和33 kD的蛋白的免疫反应依然存在,但是在同样压力下处理30 min后,其免疫反应消失。烘烤过的花生样品在高压处理过程中,随压力增大和时间延长,Ara h 1、Ara h 2和Ara h 3含量有所降低,说明了降低烘烤花生致敏性可以结合高压等其他处理来实现。
当然,每一种方法都有各自不同的优缺点。Hu Chunqiu等[49]分别用辐照、热加工和超高压微射流3 种不同加工方法处理Ara h 2,发现辐照处理对Ara h 2的抗原性降低最为明显,20 kGy的辐照剂量即可使Ara h 2的抗原性降低93%。其次为热加工处理,超高压微射流对于改变Ara h 2的抗原性影响最小,当Ara h 2经180 MPa处理3 次时,其抗原性降低了51%。
3.2 酶处理
酶处理是减少或消除一些食物致敏性的另一个重要方法。近年来,一些研究表明使用酶处理可以减少花生致敏原性。
3.2.1 胃蛋白酶和胰蛋白酶处理
Koppelman等[58]在花生消化性实验评估中,用胃蛋白酶消化花生过敏原,发现Ara h 1、Ara h 3能迅速被消化,而Ara h 2和Ara h 6,即使在很高的胃蛋白酶浓度下也很难被消化。这可能是因为在Ara h 2和Ara h 6分子结构中有二硫键的存在,它们对于过敏原的稳定性起重要作用。同时也说明了胃蛋白酶仅对于二硫键含量少的过敏蛋白有较好的消化效果。进一步将很难被胃蛋白酶分解的Ara h 2和Ara h 6用胰蛋白酶消化,发现胰蛋白酶确实能消化Ara h 2和Ara h 6,但是Ara h 2在消化后仍保留有大量的肽段。Astwood等[59]将花生的过敏蛋白用胰蛋白酶处理45 min后,发现其过敏性显着降低。Yu等[60]的研究表明,胰蛋白酶和糜蛋白酶水解能有效降低花生过敏原Ara h 1和Ara h 2的含量,还增加了可溶性蛋白的含量,并且煮沸能提高酶水解烘烤花生的效率,但这对生花生的影响不大。
3.2.2 其他酶类
除了消化酶外,其他水解酶也能改变其过敏原性,有研究表明,碱性内切蛋白酶比风味蛋白酶能更好地水解烘烤过的花生可溶性蛋白,进而减少了其与IgE反应性[61]。而经多酚氧化酶交联后,无论是生花生,还是烘烤过的花生,粗蛋白中Ara h 1和Ara h 2明显减少,并形成了高聚物,虽然交联产物也会与IgE结合,但是总的结合水平是降低的[62]。Chung等[63]研究表明,在37 ℃分别用过氧化物酶处理焙烤花生和生花生60 min后,焙烤花生的过敏性显着降低,甚至低于生花生的过敏性,而对生花生的过敏性并无影响。Ara h 1被转谷氨酰胺酶交联修饰后,其致敏性变化不大,这是由于疏水氨基酸主要位于Ara h 1单体相互作用的区域,Ara h 1单体可以聚合成高度稳定的同源三聚体,大部分IgE结合位点也位于单体的结合区域,这有利于保护IgE结合位点,使其不易被蛋白酶识别[64]。
由此看来,由于各种酶的催化位点不同对不同的致敏蛋白表现出了各异的脱敏效果,仍需进一步探索研究以应对不同致敏蛋白合适的酶交联反应,同时也表明仅凭一种酶是很难消除花生的致敏性的,酶交联反应脱敏与其他方法结合使用可能会收到更好的脱敏效果。
3.3 分子生物学方法
截止到目前,国际上公认的几种主要花生过敏原的cDNA已经被分离、测序和克隆重组,研究人员正在探索通过基因“沉默”的方式来抑制主要过敏原的表达,从而降低花生的致敏性。相关研究表明:重组表达Ara h 1(rAra h 1)比天然Ara h 1(nAra h 1)在胃肠消化中稳定低,而且它们与IgE的结合形式也不同[65],因此其致敏性在消化后可能会降低。
易海涛等[66]通过已鉴定出的Ara h 2主要的3 个IgE表位( 27~36、59~64、65~72)进行设计新型低致敏原衍生物,同时保留其主要的T细胞表位。将以上这3 个主要的IgE抗原表位断开,并重新组合,按69~157、62~68、32~61、1~31的氨基酸顺序重新排列,并表达出这种新型的低致敏原衍生物。Western blotting和酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)分析结果均表明经基因工程改造的F-Ara h 2蛋白同样能够与花生过敏患者血清中的IgE抗体进行特异性识别,但与未突变的R-Ara h 2相比,其免疫原应性有明显降低。Ramos等[67]对Ara h 2.01上5 个不同位点进行错义突变得到的Ara h 2.01,IgE结合能力降低了56%~99%。
3.4 发芽处理
在Kang等[38]的研究中,将浸泡2 h后的花生在25 ℃避光发芽,在花生萌发和幼苗生长的任何阶段都没有检测到转录的过敏原,并且SDS-PAGE显示其蛋白质成分有较大变化。将不同发芽时间的花生提取的过敏原粗提液进行SDS-PAGE电泳,显示花生在萌发和幼苗生长过程中Ara h 1和Ara h 2含量显着减少。发芽48 h后很容易观察到Ara h 1蛋白质的降解,其降解产物在发芽96 h和144 h时可被明显检测到。另外,Ara h 2在发芽48 h后开始减少并在144 h时检测不到。但是,棉花种子的主要过敏原在发芽过程中表现稳定[68]。通过发芽处理降低种子中过敏原含量与种子种类及种子中蛋白等成分的含量都有关系,相应的研究还需进一步验证发芽处理是否可以有效降低花生种子的致敏性。
4 结 语
目前,国内外对花生致敏原的组分、结构特性和理化性质都做了深入研究,也获得一些与花生致敏反应机制及主要致敏原抗原表位相关的信息,但是新过敏原的不断发现也催促我们去阐明其相关的致敏机理。加工对过敏原的影响研究仍都处于起步阶段,很多工作有待我们继续深入研究。我们目前所知的这些信息还不足于彻底治愈和防范花生过敏反应。预防过敏症的最好办法是不摄入含过敏原的食品,但这种方法是不现实的。为了降低花生的致敏性,各个领域的学者都在做着不懈的努力,目前的脱敏方法主要集中于两个方面: 一是基因工程降低花生品种的致敏性;二是探索合适的加工方式降低花生的致敏性。今后研究方向:1)不同地区的不同花生品种其致敏性不尽相同,故而筛选野生低致敏性的花生品种将成为今后花生种质资源研究的内容;2)过敏原快速定性检测方法的建立:目前常用的血清、SDS-PAGE
甚至质谱检测过敏原的方法花费大、过程繁琐,根据过敏原蛋白质分子水平上的特征探索简便的检测方法将是今后花生乃至整个食品过敏原研究的重点工作之一;过敏原快速定量检测方法的建立:将过敏原在蛋白水平甚至多肽水平上进行定量检测,将为花生制品提供准确的过敏原含量检测数据。这将有利于花生制品的生产和消费,也为花生过敏消费者们提供一定的保护。或许新的分析检测技术的开发能帮助我们更好的发现过敏原和阐明过敏机理;而医学工作者和食品科学工作者的联合攻关,更能有效的解决花生过敏的这一世界性难题。
[1] 杨勇, 阚建全, 赵国华, 等. 食物过敏与食物过敏原[J]. 粮食与油脂, 2004(3): 43-45.
[2] PENNINKS A H, KNIPPELS L M. Determination of protein allergenicity: studiesinmice[J]. Toxicology Letters, 2001, 120(13): 181-186.
[3] FAO. Report of the FAO Technical Consultation on Food Allergies[C]// Rome: Food and Agriculture Organization, 1995.
[4] 刘建欣, 郑昌学. 现代免疫学: 免疫的细胞和分子基础[M]. 北京: 清华大学出版社, 2003: 78-94.
[5] SAMPSON H A, BURKS A W. Mechanisms of food allergy allergy[J]. Annual Review of Nutrition, 1996, 16(1): 161-177.
[6] KEMP A S, HU W. Food allergy and anaphylaxis-dealing with uncertainty[J]. Medical Journal of Australia, 2008, 188(9): 503-504.
[7] RICHARD C N, MARIA P L, JENNIFER M R, et al. What’s in akiss: peanut allergen trnsmission as a sensitizer[J]. Journal of Allergy and Clinical Immunology, 2007, 119(3): 755-755.
[8] ALLAN S, ANNE M F, HUGH A S. Further fatalities caused by anaphylactic reactions to food, 2001—2006[J]. Journal of Allergy and Clinical Immunology, 2007, 119(4): 1016-1018.
[9] SICHERER S H, GODBOLD J H, SAMPSON H A. US prevalence of self-reported peanut, tree nut, and sesame allergy: 11-year follow-up[J]. Journal of Allergy and Clinical Immunology, 2010, 125(6): 1322-1326.
[10] 叶世泰, 傅阳心. 我国常用食品致喘40例分析[J]. 临床荟萃, 1986(12): 427-429.
[11] 李宏, 张宏誉. 花生过敏原致敏组分分析[J]. 中华微生物学和免疫学杂志, 2001, 21(4): 12-15.
[12] HOURIHANE J B, BEDWANI S J, DEAN T P, et al. Randomised, double-blind, crossover challenge study of allergenicity of peanut oils in subjects allergic to peanuts[J]. British Medical Journal, 1997, 314: 1084-1088.
[13] ASERO R, BALLMER-WEBER B K, BEYER K, et al. IgE mediated food allergy diagnosis: current status and new perspectives[J]. Molecular Nutrition and Food Research, 2007, 51(1): 135-147.
[14] BISCHOFF S, CROWE S S. Gastrointestinal food allergy: new insightsinto pathophysiology and clinal perspectives[J]. Gastroenterology, 2005, 128(4): 1089-1113.
[15] MOSMANN T R, COFFMAN R L. Th1 and Th2 cells different pattems of lymphokine secretion lead to different functional properties[J]. Annual Review of Immunology, 1989, 7(1): 145-173.
[16] SHO Y, TAKASHI S. Progress in allergy signal research on mast cells: signal regulation of multiple mast cell responses through FcεRI[J]. Journal of Pharmacological Science, 2008, 106(3): 336-340.
[17] YOSHIHIRO B, KEIGO N, YOKO F, et al. Essential function for the calcium sensor STIM1 in mast cell activation and anaphylacticresponses[J]. Nature Immunology, 2008, 9(1): 81-88.
[18] BOCKS A J. Natural history of severe reactions to foods in young children[J]. Journal of Pediatrics, 1985, 107: 676-680.
[19] YUNGINGER J W, SQUILLACE D L, JONES R T, et al. Fatal anaphylactic reactions induced by peanuts[J]. Allergy and Asthma Proceedings, 1989, 83: 764-770.
[20] LEHERE S B, HORNER W E, REESE G. Why are proteins allergic? Implications for biotechnology[J]. Critical Reviews in Food Science and Nutrition, 1996, 36(6): 553-564.
[21] MEIER D S, TAYLOR S L, NORDLEE J, et al. Identification of peanut allergens by immunoblotting[J]. Journal of Allergy and Clinical Immunology, 1987, 79: 218.
[22] BURKS A W, WILLIAMS L W, HELM R M, et al. Identification and characterization of a second major peanut allergen, Ara h II, with use of the sera of patients with atopic dermatitis and positive peanut challenge[J]. Journal of Allergy and Clinical Immunology, 1992, 90(6): 962-969.
[23] BURKS A W, SHIN D, COCKRELL G, et al. Mapping and mutational analysis of the IgE-binding epitopes on Ara h 1, a legume vicilin protein and a major allergen in peanut hypersensitivity[J]. European Journal of Biochemistry, 1997, 245(2): 334-339.
[24] BURKS A W, COCKRELL J S, STANLEY R M, et al. Recombinantpeanut allergen Ara h 1 expression and IgE binding in patients withpeanut hypersensitivity[J]. Journal of Clinical Investigation, 1995, 96(4): 1715-1721.
[25] 丛艳君, 宋焕禄, 薛文通. 花生过敏原Ara h 1免疫显性抗原决定簇的鉴别[J]. 中国食品学报, 2010, 10(10): 223-230.
[26] BEYRE K, MORROW E, LI Xiumin, et al. Effects of cooking methods on peanut allergenicity[J]. Journal of Allergy and Clinical Immunology, 2001, 107(6): 1077-1081.
[27] BURKS A W, COCKRELL G, CONNAUGHTON C, et al. Epitope specificity of the major peanut allergen, Ara h II[J]. Journal of Allergy and Clinical Immunology, 1995, 95(2): 607-611.
[28] WEN H W, WYSOKI W B, DECORY T R, et al. Peanut allergy, peanut allergens, and methods for the detection of peanut contamination in food products[J]. Comprehensive Reviews in Food Science and Food Safety, 2007, 6(2): 47-58.
[29] RABJOHN P, HELM E M, STANLEY J S, et al. Molecular cloning and epitope analysis of the peanut allergen Ara h 3[J]. Journal of Clinical Investigation, 1999, 103(4): 535-542.
[30] CABANOS C, TANDANG-SILVAS M R, ODIJK V, et al. Expression, purification, cross- reactivity and homology modeling of peanut profiling[J]. Protein Expression and Purification, 2010, 162(1): 36-45.
[31] van WIJK F, NIERKENS S, HASSING I. The effect of the food matrix on in vivo immune responses to purified peanut allergens[J]. Toxicological Sciences, 2005, 86(2): 333-341.
[32] MITTAG D, AKKERDAAS J, BALLMER-WEBER B K, et al. Ara h 8, a Bet v 1-homologous allergen from peanut is a major allergen in patients with combined birch pollen and peanut allergy[J]. Journal of Allergy and Clinical Immunology, 2004, 114(6): 1410-1417.
[33] KRAUSE S, REESE G, RANDOW S, et al. Lipid transfer protein (Ara h 9) as a new peanut allergen relevant for a mediterranean allergic population[J]. Journal of Allergy and Clinical Immunology, 2009, 124(4): 771-778.
[34] WIJK F V, HARTGRING S, KOPPELMAN S J. Mixed anti body and T cell responses to peanut and the peanut allergens Ara h1, Ara h2, Ara h3 and Ara h6 in an oral sensitization model[J]. Clinical and Experimental Allergy, 2004, 34(9): 1422-1428.
[35] KLEBER-JANKE T, CRAMERI R, APPENZELLER U, et al. Selective cloning of peanut allergens including profilin and 2S albumins by phage disply technology[J]. International Archives of Allergy and Immunolog, 1999, 119(4): 265-274.
[36] CHATEL J M, BERNARD H, ORSON F M. Isolation and characterization of two complete Ara h2 isoforms cDNA[J]. International Archives of Allergy and Immunolog, 2003, 131(1): 14-18.
[37] STANLEY J S, KING N, BURKS A W, et al. Identification and mutation alanalysis of the immunodomominant IgE binding epitopes of the major peanut allergen Ara h2[J]. Archives of Biochemistry and Biophysics, 1997, 342(2): 244-253.
[38] KANG I H, SRIVASTAVA P, OZIAS-AKINS P, et al. Temporal and spatial expression of the major allergens in developing and germinating peanut seed[J]. Plant Physiology, 2007, 144(2): 836-845.
[39] ANBOXTEL E L, VANDENBROEK L A, KOPPELMAN S J, et al. Legumin allergens from peanuts and soybeans: effects of denaturation and aggregation on allergenicity[J]. Molecular Nutrition and Food Research, 2008, 52(6): 674-682.
[40] KANG I H, GALLO M. Cloning and characterization of a novel peanut allergen Ara h3 isoform displaying potentially decreased allergenicity[J]. Plant Science, 2007, 172(2): 345-353.
[41] MARSH J, RIGBY N, WELLNER K. Purification and characterisation of a panel of peanut allergens suitable for use in allergy diagnosis[J]. Molecular Nutrition and Food Research, 2008, 52(2): 272-285.
[42] KOPPELMAN S J, JONG G A H, LAAPER-ERTMANN M. Purification and immunoglobulin E-binding properties of peanut allergen Ara h 6: evidence for cross-reactivity with Ara h 2[J]. Clinical and Experimental Allergy, 2005, 35(4): 490-497.
[43] 罗春萍, 高金燕, 胡纯秋, 等. 花生过敏原Ara h 6 的分离纯化及鉴定[J]. 食品科学, 2010, 31(15): 76-80.
[44] VIETHS S, REINDL J. Digestibility of peanut and hazelnut allergens invest-I gated by a simple in vitro procedure[J]. European Food Research and Technology, 1999, 209(4): 379-388.
[45] JENSEN-JAROLIM E, WIEDERMANN U, GANGLBERGER E, et al. Allergen mimot opes in food enhance type I allergic reactions in mice[J]. FASEB Journal, 1999, 13(6): 1586-1592.
[46] MILLS E N, SANCHO A I, RIGBY N M, et al. Impact of food processing on the structural and allergenic properties of food allergens[J]. Molecular Nutrition and Food Research, 2009, 53(8): 963-969.
[47] BEYER K, MORROW E, LI X M, et al. Effects of cooking methods on peanuts allergenicity[J]. Journal of Allergy and Clinical Immunology, 2001, 107(6): 1077-1081.
[48] SHEFCHECK K J, MUSSER S M. Confirmation of the allergic peanut protein, Ara h l, in a model food matrix using liquid chromatography/ tandem mass spectrometry (LC/MS/MS)[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 2785-2790.
[49] HU Chunqiu, CHEN Hongbing, GAO Jinyan, et al. High-pressure microfluidisation-induced changes in the antigenicity and conformation of allergen Ara h 2 purified from Chinese peanut[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1304-1309.
[50] STARK P, KRISHNAMURTHY D, SZALAI K, et al. Heating affects structure, nterocyte adsorption and signalling, as well as immunogenicity of the peanut allergen Ara h 2[J]. The Open Allergy Journal, 2011, 12(4): 24-34.
[51] MALEKI S J, CHUNG S Y, CHAMPAGNE E T, et al. The effects of roastingon the allergenic properties of peanut protein[J]. Journal of Allergy and Clinical Immunology, 2000, 106(4): 763-768.
[52] BEATRIZ C, SOHEILA J, RODRIGUEZ J, et al. Heat and pressure treatments effects on peanut allergenicity[J]. Food Chemistry, 2012, 132(1): 360-366.
[53] CHUNG S Y, BUTTS C L, MALEKI S J, et al. Linking peanut allergenicity to the processes of maturation, curing, and roasting[J]. Journal of Allergy and Clinical Immunology, 2003, 51(15): 4273-4277.
[54] TEUBER S S, BROWN R L, HAAPANEN L A, et al. Allergenicity of gourmet nut oils processed by different methods[J]. Journal of Allergy and Clinical Immunology, 1997, 99(4): 502-507.
[55] HOURIHANE J B, KILBUM S A, NORDLEE J A, et al. An evaluation of the sensitivity of subjects with peanut allergy to very low doses of peanut protein: a randomized, double-blind, placebocontrolled food challenge study[J]. Journal of Allergy and Clinical Immunology, 1997, 100(5): 596-600.
[56] GUILLAMON E, BURBANO C, CUADRADO C, et al. Effect of an instantaneous controlled pressure drop on in vitro allergenicity to lupins (Lupinus albus var. multolupa)[J]. International Archives of Allergy and Immunology, 2008, 145(1): 9-14.
[57] MALLEY A, BAECHER L, MACKLER B, et al. The isolation of allergens from the green pea[J]. Journal of Allergy and Clinical Immunology, 1975, 56(4): 282-290.
[58] KOPPELMAN S J, HEFLE S L, TAYLOR S L, et al. Digestion of peanut allergens Ara h 1, Ara h 2, Ara h 3, and Ara h 6: a comparative in vitro study and partial characterization of digestion-resistant peptides[J]. Molecular Nutrition and Food Research, 2010, 54(12): 1711-1721.
[59] ASTWOOD J D, LEACH J N, FUCHS R L. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14(10): 1269-1273.
[60] YU J M, AHMEDNA M, GOKTEPE I, et al. Enzymatic treatment of peanut kernels to reduce allergen levels[J]. Food Chemistry, 2011, 127: 1014-1022.
[61] CABANILLAS B, PEDROSA M M, RODRIGUEZ J, et al. Influence of enzymatic hydrolysis on the allergenicity of roasted peanut protein extract[J]. International Archives of Allergy and Immunology, 2012, 157(1): 41-50.
[62] CHUNG S Y, MALEKI S J, CHAMPAGNE E T, et al. Polyphenol oxidase/caffeic acid may reduce the allergenic properties of peanut allergens[J]. Journal of the Science of Food and Agriculture, 2005, 85(15): 2631-2637.
[63] CHUNG S Y, MALEKI S J, CHAMPAGNE E T. Allergenic properties of roasted peanut allergens may be reduced by peroxidase[J]. Journal of the Science of Food and Agriculture, 2004, 52(14): 4541-4545.
[64] CLARE D A, GHARST G, SANDERS T H, et al. Transglutaminase polymerization of peanut proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(2): 432-438.
[65] CHRUSZCZ M, MALEKI S J, MAJOREK K A, et al. Structural and immunologic characterization of Ara h 1, a major peanut allergen[J]. The Journal of Biological Chemistry, 2011, 286(45): 39318-39327.
[66] 易海涛, 刘芳, 贾梦阳, 等. 经基因工程改造的花生主要过敏原Ara h 2制备及其低致敏原性鉴定[J]. 江西农业大学学报, 2011, 33(5): 993-998.
[67] RAMOS M L, HUNTEY J J, MALEKI S J, et al. Identification and characterization of a hypoallergenic ortholog of Ara h 2.01[J]. Plant Molecular Biology, 2009, 69(3): 325-335.
[68] DAUSSANT J, ORY R L, LAYTON L L. Characterization of proteins and allergens in germinating castor seeds by immunochemical techniques[J]. Journal of Agricultural and Food Chemistry, 1976, 24(1): 103-107.
Recent Advances in Research on Main Peanut Allergens and Desensitization Methods
ZHANG Ya-jun, ZHANG Hao, YANG Xuan, HAN Yong-bin*
(Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
Peanuts are one of the most dangerous food allergens. Peanut allergens can cause severe and even lethal hypersensitivity reactions in humans. In recent years, peanut allergic reactions have attracted extensive attention worldwide due to their potential lethality and chronicity as well as increasing incidences of peanut allergy. The mechanism of peanut allergy and desensitization to peanut allergens have become hot research topics. Effective desensitization methods are of great practical significance for ensuring the safety of peanut-containing foods. This paper elucidates the mechanism of peanut allergy, main peanut allergens and existing desensitization methods.
peanut; allergen; mechanisms; desensitization
TS210.1
A
1002-6630(2014)17-0312-07
10.7506/spkx1002-6630-201417059
2013-07-10
江苏省优势学科建设工程资助项目(2012BAD28B01)
张雅君(1990—),女,硕士研究生,研究方向为食品科学。E-mail:2012108024@njau.edu.cn
*通信作者:韩永斌(1963—),男,教授,博士,研究方向为农产品加工与综合利用。E-mail:hanyongbin@njau.edu.cn



