舒一梅,李 诚,付 刚,陈姝娟,何 利,杨 勇,胡 滨,张志清,苏 赵
(四川农业大学食品学院,四川 雅安 62 5014)
凝胶层析法分离猪股骨降血压肽及其体外稳定性
舒一梅,李 诚*,付 刚,陈姝娟,何 利,杨 勇,胡 滨,张志清,苏 赵
(四川农业大学食品学院,四川 雅安 62 5014)
将 猪股骨酶解液超滤分离后,对分子质量小于5 kD的酶解滤液(IC50值 为1.362 mg/mL)进行凝胶层析分离,研究洗脱液、流速、上样量 3 个因素对 猪股骨降血压肽分离纯化效果的影响。结果表明:以去离子水为洗脱液,流速0.6 mL/min,上样量体积分数1%时,能够得到最佳分离效果,其最高活性组分IC50值达到 0.401 6 mg/mL。研究凝胶层析分离后抑制率最高的组分的稳定性,发现其有较好的耐热和耐酸碱、耐盐性,在pH 2~6中有良好的溶解性。
猪股骨酶解液;降血压肽;凝胶层析;稳定性;血管紧张素转换酶半抑制浓度
降血压肽是一种血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制剂,对高血压具有一定的防治效果。降血压肽相对于化学降血压药物,具有安全性高、消化吸收性强、降血压效果温和且对正常血压无 影响、无副作用等优点[1]。降血压肽可由植物蛋白[2]、动物蛋白[3]及微生物代谢产物[4]等制备。我国拥有丰富的畜、禽鲜骨资源,回收利用作为下脚料的骨胶原蛋白制备降血压肽具有重要的理论意义和实用价值。
目前关于降血压肽的制备[5]有较多的研究,但其分离纯化大都未能取得深入的进展,难以将降血压肽推向工业化生产。降血压肽分离提纯主要采用超滤[6]、层析[7]等方法,猪股骨降血压肽的分离纯化是猪股骨降血压肽生产的关键步骤之一。如何将具有降压效果的猪股骨降血压肽从猪股骨酶解混合物中分离出来得到尽可能纯的猪股骨降血压肽,对其应用前景有较大的影响,开发以其为功能因子的保健食品或治疗高血压的药物具有较高的实用价值[8]。
本实验采用凝胶层析的方法分离猪股骨降血压肽。它是一种常用的分离手段,具有设备简单、操作方便、样品回收率高、实验重复性好、不改变样品生物活性等优点。
1 材料与方法
1.1 材料与试剂
猪股骨粉 实验室自制;木瓜蛋白酶(800 U/mg)、风味蛋白酶(20 U/mg)、碱性蛋白酶(200 U/mg)荷兰帝斯曼公司;ACE、马尿酰-组氨酰-亮氨酸(Hip-His-Leu,HHL) 美国Sigma公司;其他均为国产分析纯试剂。
1.2 仪器与设备
Sephadex G-25柱 美国Bio-Rad公司;超滤管(5 kD) 德国默克密理博公司;QT-2漩涡混匀器 上海琪特分析仪器有限公司;UV-3200紫外分光光度计 上海美谱达仪器有限公司;Scientz-12型冷冻干燥机、D-37520型高速冷冻离心机、JZ15984型移液枪(100~1 000 μL) 美国Thermo Fisher公司;ULUP-IV-10T型超纯水装置 四川优普科技有限公司;PHS-3C型pH计 上海方舟科技有限公司;层析柱(1.6 cm×60 cm) 上海楚柏实验室设备公司;BSZ-100型自动部分收集器 上海沪西分析仪器厂;WLB-78C型恒流泵 浙江新昌国康仪器厂。
1.3 方法
1.3.1 猪股骨降血压肽的制备
按照实验室前期猪股骨酶解降血压肽的优选条件制备猪股骨降血压肽,其工艺流程为:新鲜猪股骨→清洗→高压蒸煮→粉碎→加酶水解→灭酶→离心→上清液→冷冻干燥。酶解条件为:按底物质量分数6%的比例加入相应比例的蒸馏水,依次按酶活为12 000 U/g加入碱性蛋白酶(调节pH 10,58 ℃反应7 h),100 ℃沸水浴10 min灭活。再按酶活为6 000 U/g加入木瓜蛋白酶(调节pH 6,55 ℃反应4.38 h),100 ℃沸水浴10 min灭活。最后按酶活为12 000 U/g加入风味蛋白酶(调节pH 7.0,53 ℃反应4 h),得到猪股骨降血压肽酶解液[9]。
将酶解液用截留分子质量为5 kD的超滤离心管进行超滤,得到分子质量小于5 kD的组分,测定其ACE半抑制浓度(half maximal (50%) inhibitory eoncentration,IC50)值,冻干备用。
1.3.2 凝胶层析法分离
Sephadex G-25的分离范围在分子质量5~100 D之间,故选用Sephadex G-25作进一步的分离。称取Sephadex G-25 20 g,加入200 mL去离子水,在沸水浴中溶胀2 h,将充分溶胀后的凝胶倒去上层多余的水及细小颗粒,反复洗涤2~3 次,放抽气瓶中抽气以除去气泡,备用[10-11]。
凝胶层析分离猪股骨降血压肽的步骤为:首先用洗脱液平衡柱子,然后上样,再用洗脱液洗脱[12-13](每一条件进行6 次以上平行实验,直到每次平行实验的分离图谱一致)。收集洗脱液,每管收集2 mL,在214 nm波长处测定每管吸光度。本实验选择洗脱液、流速、上样量(上样体积以床体积的百分比计算)3 个因素进行研究。通过以分离色谱图,分离组分的ACE抑制活性为指标,对分离效果进行评价。
1.3.2.1 不同洗脱液的影响
进样及洗脱液流出速率控制在0.5 mL/min,上样量为体积分数1%分别采用pH 7.0、0.05 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)、0.1 mol/L PBS及去离子水为洗脱液。
1.3.2.2 不同流速的影响
采用去离子水为洗脱液,上样量体积分数1%,洗脱液流出速率分别控制在0.4、0.6、0.8、1.0 mL/min。
1.3.2.3 不同上样量的影响
洗脱液流速控制在0.5 mL/min,去离子水为洗脱液,分别进样体积分数1%、1.5%、2%。
1.3.3 猪股骨降血压肽的稳定性
1.3.3.1 猪股骨降血压肽的热稳定性
取凝胶层析分离后的抑制率最高的组分,调节质量浓度0.8 mg/mL,并用盐酸和NaOH调节pH 7.0,分别置于30、40、50、60、70、80、90、100 ℃的水浴中,保温2 h,然后迅速拿出,取样检测其IC50值,重复3 次。
1.3.3.2 猪股骨降血压肽的酸碱稳定性
取凝胶层析分离后的抑制率最高的组分,调节质量浓度0.8 mg/mL(去离子水配制),用适宜的缓冲液分别调pH值为2、4、6、8、10、12,常温放置2 h后,冷藏24 h,取样检测其IC50值,重复3 次。
1.3.3.3 猪股骨降血压肽耐盐稳定性
取10 mg凝胶层析分离后的抑制率最高的组分,分别溶于0.2、0.4、0.6、0.8、1.0、1.2 mol/L NaCl溶液中,调节质量浓度为0.8 mg/mL,室温放置2 h后,分别取样液测定其IC50值,重复3 次。
1.3.3.4 猪股骨降血压肽的溶解性
取凝胶层析分离后的抑制率最高的组分,调节质量浓度为0.8 mg/mL(去离子水配制),并以1 mol/L盐酸和1 mol/L NaOH溶液调节pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,并在10 000 r/min离心20 min,取上清液测定其中蛋白质含量[14],重复3 次。按下式计算溶解性。

式中:X为上清液中蛋白质含量/mg;Y为样品质量/mg。
1.3.4 ACE抑制率的体外测定
采用紫外分光光度法[15-16]。
1.3.5 IC50值的测定
将样品配制成不同的质量浓度,分别测定其ACE抑制率,以样品质量浓度为横坐标,ACE抑制率为纵坐标,绘制圆滑曲线,从曲线中计算出IC50值。
1.3.6 蛋白质质量浓度的测定
采用Lowry法蛋白含量检测试剂盒测定。
2 结果与分析
2.1 凝胶层析法对分离效果的影响
2.1.1 不同洗脱液对分离效果的影响

图1 不同洗脱液的洗脱曲线Fig.1 Separation patterns with different elution solvents
由图1可知,去离子水为洗脱液能得到4 个峰、而0.05、0.1 mol/L PBS为洗脱液,只能得到3 个峰,且峰形都不太理想,前2 个峰未能完全分开,且峰形较宽,分离效果较差。因此,采用去离子水为洗脱液较佳。
2.1.2 流速对分离效果的影响


图2 不同流速的洗脱曲线Fig.2 Separation patterns at different elution flow rates
由图2可知,不同流速对分离效果的影响较大。当流速为0.4、0.6 mL/min能得到4 个峰,且峰形较尖、高。当流速为0.8 mL/min时,能分离出3 个峰,但峰形开始变的圆、宽,未能完全分开。流速增大至1.0 mL/min,只能分离到1 个宽而低的峰和2 个很小的峰,分离效果较差。因此为提高分离效率,采用0.6 mL/min作为分离流速。
2.1.3 上样量对分离效果的影响


图3 不同上样量的洗脱曲线Fig.3 Separation patterns at different sample loadings
由图3可知,上样量对分离效果的影响较小。蛋白过多过少都会导致分离效果不理想,当上样量为体积分数1%、1.5%时,比体积分数2%上样量分离图峰形尖、高。综合考虑分离效果以及成本问题,采用体积分数1%的上样量最为合适。
2.1.4 确定洗脱条件
综合以上得出最佳洗脱条件:采用去离子水为洗脱液,上样量为体积分数1%,洗脱流速为0.6 mL/min。将超滤后小于5 kD的组分冷冻干燥配成一定的蛋白质量浓度,按优选的最佳分离条件再进行多次验证,图4A为最佳洗脱曲线。在此区间形成4 个洗脱峰,平衡各组分的蛋白质量浓度后,测得其中组分2的抑制率最高,见图4B,其IC50值为0.401 6 mg/mL,表明该分离条件稳定可行。
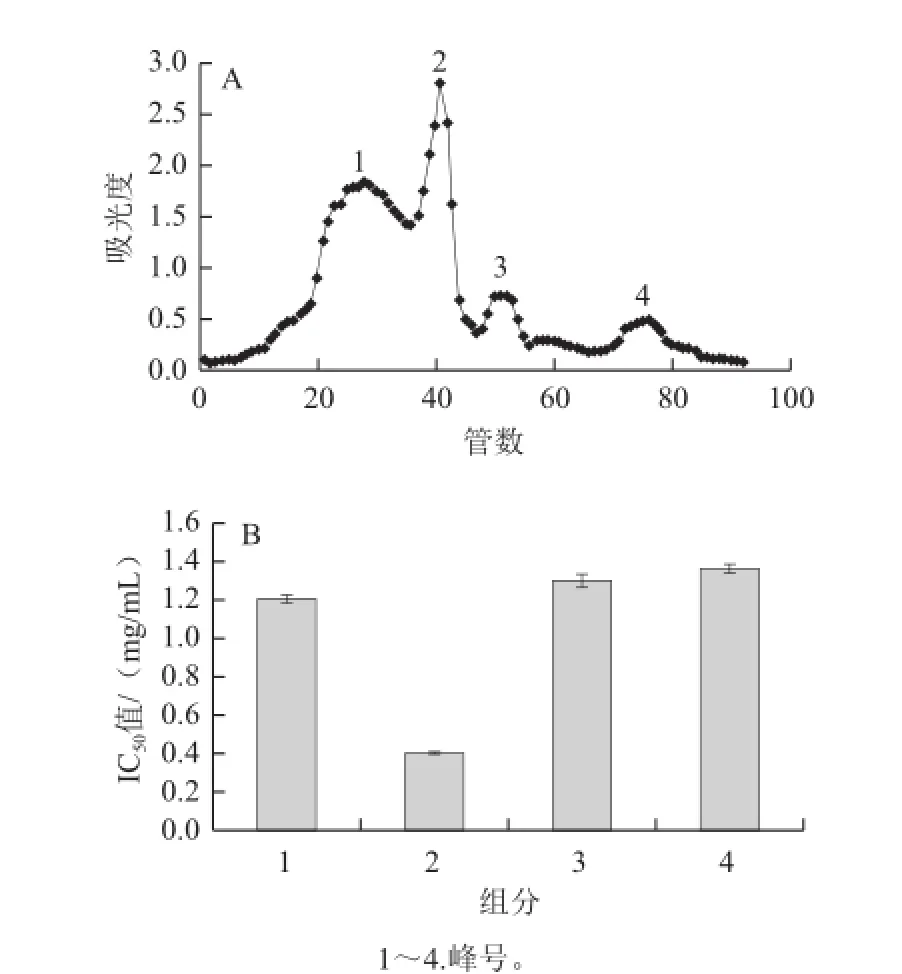
图4 猪股骨降血压肽的分离曲线(A)及各组分的IICC5500值(BB)Fig.4 Separation patterns of antihypertensive peptides from porcine femoral collagen and IC50of each component
2.2 猪股骨降血压肽的体外稳定性
2.2.1 猪股骨降血压肽热稳定性
由图5可知,猪股骨降血压肽(组分2)在不同温度条件下水浴2 h后,其ACE抑制活性差异不显着(P>0.05)。但随着温度的升高,猪股骨降血压肽(组分2)的IC50值也在逐渐增大。当温度在20~60 ℃时猪股骨降血压肽(组分2)ACE活性变化极小(差异:0~0.023 5 mg/mL);当温度达到100 ℃时,其IC50值仍保持在0.610 3 mg/mL以下,具有较高的活性。由此可知,猪股骨降血压肽(组分2)具有良好的耐高温性能。

图5 不同温度对猪股骨降血压肽(组分2)的影响Fig.5 Effect of temperature on the activity of antihypertensive peptides from porcine femoral collagen (peak 2)
2.2.2 猪股骨降血压肽的酸碱稳定性

图6 不同pH值对猪股骨降血压肽(组分2)的影响Fig.6 Effect of pH value on the activity of antihypertensive peptides from porcine femoral collagen (peak 2)
从图6可知,当pH值在2~7之间时,猪股骨降血压肽(组分2)的活性变化幅度很小(P>0.05),差异不显着,猪股骨降血压肽(组分2)的IC50值维持在0.467 8 mg/mL以下。当pH值大于6以后,其ACE抑制活性不断下降。由此可知,猪股骨降血压肽(组分2)在中性和偏酸性的条件下比较稳定。
2.2.3 猪股骨降血压肽的耐盐稳定性

图7 不同NaCl浓度对猪股骨降血压肽(组分2)的影响Fig.7 Effect of NaCl concentration on the activity of antihypertensive peptides from porcine femoral collagen (peak 2)
猪股骨在酶解过程中,需不断地加入盐酸和NaOH溶液维持pH值的恒定。由图7可知,当NaCl溶液浓度为0~0.6 mol/L时,猪股骨降血压肽(组分2)的IC50值在0.401 2~0.402 9 mg/mL的范围内小幅波动,经统计分析(P>0.05),猪股骨降血压肽(组分2)的活性变化小,差异不显着;当NaCl溶液浓度超过0.6 mol/L时,其IC50值开始增大,且随着NaCl溶液浓度的增大就会显着降低猪股骨降血压肽(组分2)的降血压肽活性。
2.2.4 猪股骨降血压肽的溶解性
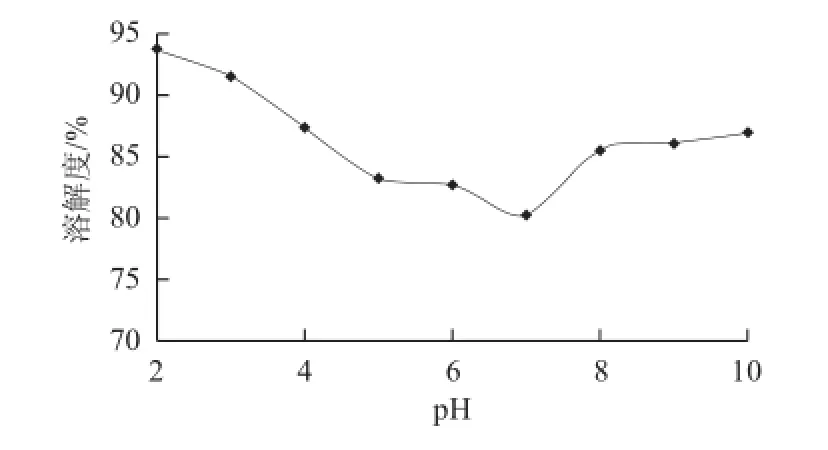
图8 猪股骨降血压肽(组分2)的溶解性Fig.8 Solubility of ACE inhibitory peptides from porcine femoral collagen (peak 2)
从图8可知,猪股骨降血压肽(组分2)的溶解性在pH 7附近最低,溶解度仅为80.21%。而升高或降低pH值,其溶解度均有所提高。可能该降血压肽的等电点位于pH 7附近,而导致其溶解度下降。
3 结论与讨论
通过研究发现,洗脱液、流速对猪股骨降血压肽的分离有显着影响,其中以超纯水为洗脱液的分离效果明显较PBS好,且不引入盐,降低成本,更有利于猪股骨降血压肽的纯化;而当流速为0.4、0.6 mL/min时,分离效果相近,为提高分离效率采用0.6 mL/min的流速适宜。在温度100 ℃时仍具有较高的活性,其IC50值为0.610 3 mg/mL,有良好的热稳定性;在pH值为2~12时,IC50值均能保持在0.47 mg/mL及以下,可耐酸碱;当NaCl溶液浓度为0.2~1.2 mol/L时,IC50值变化不大,有较好的耐盐稳定性;在pH值为2~6时有良好的溶解性。
国内外也有较多的学者研究不同蛋白源的降血压肽[17-18]的分离纯化,如Wu Jianping等[19]用SephadexG-25对大豆降压肽进行分离、Wu Hao等[20]利用凝胶层析分离出了IC50值达到0.4 mg/mL的高活性降血压肽组分等。本实验利用凝胶层析法分离出的猪股骨降血压肽组分,其IC50值达到0.401 6 mg/mL,较刘小红等[9]在超滤之后的用离子交换层析分离的降血压肽组分ACE抑制活性提高了1.2 倍。在纯化降血压肽的过程中,对降血压肽分离纯化设计尤为关键,不仅要保证肽的纯度、回收率,更要保持肽的生物活性。因此,要选择合适的单元操作技术或同时结合各个单元操作技术,如离子交换层析、大孔吸附树脂、反相高效液相色谱法等进行分离,以期达到更好分离效果,促进降血压肽工业化生产。
[1] FITZ G R J, MEISEL H. Milk protein-derived peptide inhibitors of angiotensin-Ⅰ-converting enzyme[J]. British Journal of Pharmacology, 2000, 84(1): 33-37.
[2] 刘勇. 玉米蛋白ACEI活性肽的研究[J]. 江苏大学学报, 2005(6): 12-16.
[3] SUROUKAT K, FIC M. Studies on the recovery of proteinaceous substances from chicken heads[J]. Journal of Food Agriculture and Environment, 1994, 65(2): 289-296.
[4] 吴琼英, 马海乐. 发酵乳中血管紧张素转换酶抑制剂的分离与鉴定[J].食品科学, 2006, 27(7): 81-85.
[5] 安桂香, 庄桂东, 徐振凯, 等. 食物中血管紧张素转化酶抑制肽的研究进展[J]. 食品研究与开发, 2006, 27(6): 173-175.
[6] 李诚, 张小丽, 付刚. 酶解鸭骨制取ACE抑制肽工艺条件的优化[J].中国酿造, 2011, 30(8): 61-65.
[7] 代永刚, 南喜平, 李铁柱, 等. 酪蛋白源ACE抑制肽的分离纯化[J].中国乳品工业, 2010, 38(10): 21-23.
[8] MIGUEL M, CONTRERAS M M, RECIO I, et al. ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry, 2009, 61(12): 211-214.
[9] 刘小红, 李诚, 付刚, 等. 猪股骨头胶原蛋白降血压肽的分离纯化[J].食品科学, 2014, 35(4): 50-55.
[10] 冯雅蓉, 马俪珍, 李黎. SephadexG-25对羊骨胶原降血压肽的分离纯化效果研究[J]. 肉类研究, 2011, 25(6): 30-33.
[11] PATRYCJA P M, LUISA M M, CONCEPCIÓN G. Development of a high-performance liquid chromatography-electrospray ionization quadrupole-time-of-flight-mass spectrometry methodology for the determination of three highly antihypertensive peptides in maize crops[J]. Journal of Chromatography, 2013, 87(7): 69-77.
[12] 马歇克. 蛋白质纯化与鉴定实验指南[M]. 朱厚础, 译. 北京: 科学出版社, 2002: 77.
[13] ELIZABETH E, LETICIA M, PAUL D F, et al. Purification and identification of antihypertensive peptides in Spanish dry-cured ham[J]. Journal of Proteomics, 2013, 78(6): 499-507.
[14] 邓惠玲, 刘嘉, 陈光镜, 等. 猪血红蛋白ACE抑制肽的分离和理化性质研究[J]. 食品工业科技, 2013, 34(10): 281-284.
[15] WANG Jiapei, HU Jianen, CUI Jinzhe, et al. Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysatein spontaneously hypertensive rats[J]. Food Chemistry, 2008, 111(18): 302-308.
[16] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin Ⅰ-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20(9): 1637-1648.
[17] JIANG Zhanmei, TIAN Bo, ANDRÉ B. Production, analysis and in vivo evaluation of novel angiotensin-Ⅰ-converting enzyme inhibitory peptides from bovine casein[J]. Food Chemistry, 2010, 123(7): 779-786.
[18] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purification and characterization of a novel angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33(1): 52-58.
[19] WU Jianping, DING Xiaolin. Characterization of inhibition and stability of soy-protein-derived angiotensin Ⅰ-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35(4): 367-375.
[20] WU Hao, HE Hailun, CHEN Xiulan, et al. Purification and identification of novel angiotensin-Ⅰ-converting enzymeinhibitory peptides from shark meat hydrolysate[J]. Process Biochemistry, 2008, 43(4): 457-461.
Purification of Antihypertensive Peptides from Porcine Femoral Collagen by Gel Permeation Chromatography and Their Stability in vitro
SHU Yi-mei, LI Cheng*, FU Gang, CHEN Shu-juan, HE Li, YANG Yong, HU Bin, ZHANG Zhi-qing, SU Zhao
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
After the enzymatic hydrolysate of porcine femoral collagen prepared by a three-stage hydr olysis procedure sequentially with alkaline protease, papain and flavourzyme was ultrafiltrated, the fraction with molecular weight below 5 kD, showing an IC50of 1.362 mg/mL was purified by gel permeation chromatography. The effects of elution solvent, flow rate and sample loading amount on purification efficiency were examined. The best separation results were achieved by loading 1% (by volume) of the sample onto the column followed by elution with deionized water at a flow rate of 0.6 mL/min. The eluate fraction with the highest antihypertensive activity, showing an IC50of 0.401 6 mg/mL, was harvested. The stability of the antihypertensive peptides was evaluated, and the results demonstrated its good tolerance to heat, acid and alkali and high solubility at pH 2-6.
enzymatic hydrolysate of porcine femoral collagen; antihypertensive peptides; gel permeation chromatography; stability; half inhibitory concentration against ACE
TS251
A
1002-6630(2014)24-0100-05
10.7506/spkx1002-6630-201424019
2014-03-26
舒一梅(1989—),女,硕士研究生,研究方向为畜产品质量与安全。E-mail:symsymtg@163.com
*通信作者:李诚(1964—),男,教授,硕士,研究方向为畜产品加工与质量安全控制。E-mail:lichenglcp@163.com



