夏晓杰,邬应龙,冯 姣,曾丽萍,周 成
(四川农业大学食品学院,四川 雅安 625014)
齐口裂腹鱼生长、肌肉品质和脂蛋白脂酶及脂肪酸合成酶基因表达的研究
夏晓杰,邬应龙*,冯 姣,曾丽萍,周 成
(四川农业大学食品学院,四川 雅安 625014)
目的:研究不同生长阶段齐口裂腹鱼的生长状况、肌肉品质和脂蛋白脂酶(lipoprotein lipase,LPL)及脂肪酸合成酶(fatty acid synthe tase,FAS)的基因表达。方法:分别选取齐口裂腹鱼幼鱼(137.8±1.7) g(S组)、亚成鱼(312.4±11.8) g(M组)、成鱼(500.9±31.4) g(L组),测定形体指标、脏器指数和肌肉主要营养成分含量,并采用实时荧光定量聚合酶链式反应测定LPL及FAS的基因表达水平。结果:与S组相比,M组、L组肥满度、肝体比、肠脂比、水分含量均有所降低(P<0.05),粗蛋白、粗灰分含量变化不大;L组肌间脂肪(intermuscular fat,IMF)含量最低(P<0.05);而S组、M组与L组肝胰脏中LPL mRNA及FAS mRNA表 达水平均基本高于肌肉(P<0.05),且L组肝胰脏中LPL mRNA及FAS mRNA表达水平均最低(P<0.05),M组肌肉中LPL mRNA及FAS mRNA表达水平最高(P<0.05)。结论:齐口裂腹鱼的肌肉主要营养成分含量在成鱼阶段有所降低,且IMF含量与LPL mRNA及FAS mRNA表达水平呈一定正相关。
齐口裂腹鱼;生长;品质;脂蛋白脂酶;脂肪酸合成酶
齐口裂腹鱼(Schizothorax prenanti Tchang)俗称细甲鱼、丙穴鱼、雅鱼,属鲤形目、鲤科、裂腹鱼亚科、裂腹鱼属,是长江上游及其支流的一种亚冷水性底栖鱼类,在天然情况下生活在水温较低(7~10 ℃)、水流湍急、溶氧较高的山区河流中,主要以河底岩石附着固有藻类为食[1]。其肉肥质嫩、味道鲜美,含有丰富的脂肪和氨基酸[2],是产区的名贵鱼类和优质鱼种,具有重要的学术研究价值和经济价值。目前,对齐口裂腹鱼脂质代谢的研究主要集中在常规指标分析方面[3],对脂质代谢相关基因调控及其机理尚缺乏深入研究。
动物脂肪沉积的能力主要取决于组织中脂肪的合成与分解强度,还受制于甘油三酯和脂肪酸的转运速度。脂蛋白脂酶(lipoprotein lipase,LPL)是甘油三酯(triglyceride,TG)降解为甘油和游离脂肪酸(free fatty acid,FFA)反应的限速酶,也是调节脂肪沉积和脂肪代谢的关键酶,它参与各种脂蛋白的代谢并对其进行调控,使血浆中富含脂质的脂蛋白降解。它还以载脂蛋白C-Ⅱ(apolipoprotein C-Ⅱ,ApoC-Ⅱ)为辅因子参与极低密度脂蛋白(very low density lipoprotein,VLDL)和高密度脂蛋白(high density lipoprotein,HDL)之间的载体蛋白和磷脂的转换[4]。因此,脂蛋白脂酶与机体的脂质代谢及肥胖与否密切相关。在不同鱼类中,LPL的组织表达在转录水平上有一定的相似性,但也表现出一定差异,例如:真鲷[5]的LPL在脂肪组织、鳃、心脏、肝脏、肌肉等组织中均有表达,其中脂肪组织、鳃、心脏、性腺和卵巢中含量较高,肌肉和肝脏含量次之;金头鲷[6]肠系脂肪组织LPL高出肝脏和骨骼肌几倍;虹鳟[7]的LPL主要在肝脏中表达。脂肪酸合成酶(fatty acid synthase,FAS)又称脂肪酸合酶,是内源性脂肪酸合成的关键酶,能够催化乙酰辅酶A和丙二酸单酰辅酶A合成TG[8]。因此,脂肪酸合成酶蛋白的多寡、活性的高低对控制动物体脂沉积具有重要意义。实验表明,FAS表达与动物体脂水平呈正相关,可作为脂质代谢候选基因[9-10]。但FAS基因mRNA和蛋白的表达水平是否与鱼类体脂呈正相关,以及在鱼类体脂沉积中的作用报道甚少。
本实验以齐口裂腹鱼为对象,研究其生长性能、肌肉品质,并通过实时定量荧光聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)检测鱼体组织中LPL和FAS基因mRNA的相对表达量,旨在结合分子水平进一步探讨齐口裂腹鱼脂质代谢调节机制,以促进鱼类健康生长,提高鱼肉品质。
1 材料与方法
1.1 材料与试剂
齐口裂腹鱼购买于四川雅安天全雅鱼场,随机选取处于3 个不同生长阶段(幼鱼S组、亚成鱼M组、成鱼L组)健壮无伤的齐口裂腹鱼各36 尾,每组3 个重复,体质量分别为(137.8±1.7) g、(312.4±11.8) g、(500.9±31.4) g,体长分别为(18.8±1.1) cm、(25.7±1.0) cm、(31.2±1.5) cm,暂养1 d,未投喂。
RNAiso Plus、PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)、DEPC水、SYBR Premix Ex TaqTMⅡ(Tli RnaseH Plus) 日本TaKaRa公司;其他试剂均为国产分析纯。
1.2 仪器与设备
超净工作台 苏州净化公司;普通PCR仪、实时荧光定量PCR仪、凝胶成像系统 美国Bio-Rad公司;水平电泳槽 北京六一仪器厂;紫外分光光度计、微量移液枪 德国Eppendorf公司;高速冷冻离心机、超低温冰箱 美国Thermo公司。
1.3 方法
1.3.1 鱼体生长基础指标测定
在实验室测定齐口裂腹鱼的体长、体高、体质量,解剖后称取肝胰脏和肠系脂肪质量,并根据公式(1)~(3)计算生长性能指标。

1.3.2 采样
称鱼体质量后解剖鱼体,分别迅速取出肝胰脏、肌肉(第1根背鳍至最后1根背鳍之间,侧线以上及以下白肌),一部分样品迅速于液氮中冷冻,再转入-80 ℃条件下保存用以提取RNA,另一部分置于-20 ℃冰箱中保存备用。
1.3.3 鱼肉基本成分测定
参照GB/T 5009.6—2003《食品中脂肪的测定》采用索氏抽提法测定粗脂肪和肌间脂肪含量;参照GB 5009.5—2010《食品中蛋白质的测定》采用凯氏定氮法测定粗蛋白质含量;参照GB 5009.4—2010《食品中灰分的测定》采用马弗炉灼烧法测定粗灰分含量;参照GB 5009.3—2010《食品中水分的测定》采用直接干燥法测定水分含量。
1.3.4 LPL、FAS基因表达水平分析
1.3.4.1 引物设计
根据GenBank中已有的齐口裂腹鱼(Schizothorax prenanti)LPL、FAS和β-actin(JQ013000)基因的序列,利用Primer 5.0软件设计引物,用以检测LPL、FAS基因mRNA在鱼体组织中的相对表达量,引物由华大基因有限公司合成。内参基因为齐口裂腹鱼β-actin基因,引物设计见表1。
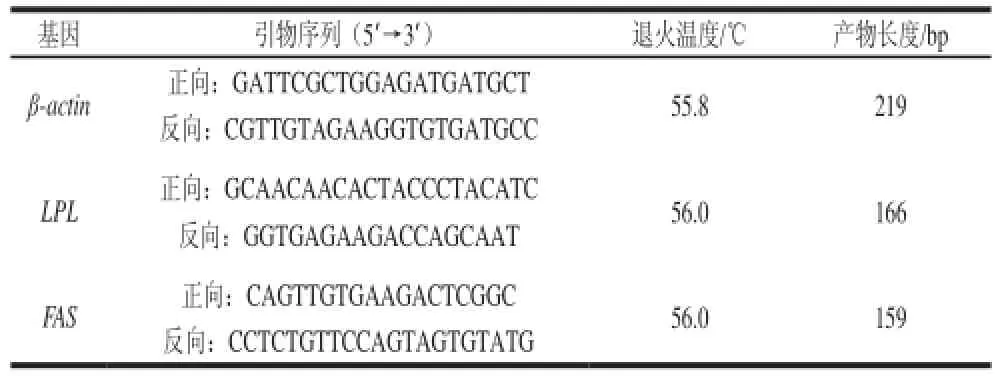
表1 1 β-actinactin、LPLLPL及FASFAS基因引物设计Table 1 Primer sequences and annealing temperatures
1.3.4.2 总RNA提取与cDNA合成
总RNA提取与纯化按试剂盒(TaKaRa)方法进行,10 g/L琼脂糖凝胶电泳分析其完整性,紫外分光光度计测OD260nm、OD260nm/280nm值(1.8~2.0)。
cDNA合成按PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)试剂盒方法进行,反应产物置于-20 ℃冰箱保存备用。用齐口裂腹鱼内参基因β-肌动蛋白(β-actin)进行普通PCR扩增,检测cDNA的存在,扩增产物用15 g/L琼脂糖凝胶电泳检测。
1.3.4.3 Real time-PCR检测鱼体组织LPL和FAS基因mRNA的相对表达量
按以下顺序加样至八连板(总体系10 μL):SYBR Premix Ex TaqTMⅡ 5 μL,DEPC水3.5 μL,上下游引物各0.25 μL,cDNA 1 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 10 s,55.8 ℃(β-actin)/56.0 ℃(LPL)/56.0 ℃(FAS)30 s,39 个循环;95 ℃ 10 s;降温至65 ℃;以2.5 ℃/s升温至95 ℃。为检验反应的特异性,扩增产物用15 g/L的琼脂糖凝胶电泳检测。以齐口裂腹鱼β-actin为内参基因,应用2-ΔCt法[11]确定不同样品mRNA的相对表达量。相对表达量=2-ΔCt,其中:ΔCt=Ct受检基因-Ctβ-actin。
1.4 数据统计
采用SPSS 19.0软件进行单因素方差分析(One-Way ANOVA),多重比较采用Duncan’s法。实验数据用表示,P<0.05为差异显着。
2 结果与分析
2.1 齐口裂腹鱼生长基础指标分析

表2 齐口裂腹鱼形体指标及内脏指数 (x ±s, , n = 8)Table 2 Body size indexes and visceral indexes of Schizothorax prenanti Tchang (x ±s, , n = 8)
由表2可知,与S组相比,M组体长/体高有所上升(P>0.05),L组体长/体高显着升高(P<0.05),M组与L组之间差异不显着(P>0.05);M组、L组肥满度、肝体比均呈下降趋势(P<0.05),M组与L组之间均差异不显着(P>0.05);M组、L组肠脂比显着降低(P<0.05),M组与L组之间差异显着(P<0.05)。
2.2 齐口裂腹鱼背肌和腹肌基本组分分析
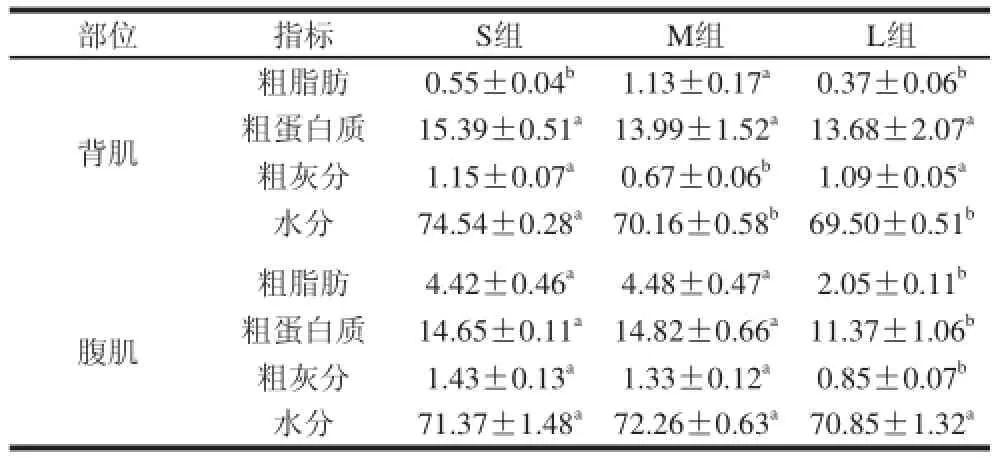
表3 齐口裂腹鱼背肌和腹肌基本组分含量 (x ±s, , n = 8)Table 3 Basic composition of back muscle and abdominal muscle of Schizothorax prenanti Tchang (x ±s, , n = 8) g/100 g
由表3可知,与S组相比,齐口裂腹鱼背肌M组粗脂肪含量显着升高(P<0.05),L组粗脂肪含量呈下降趋势(P>0.05),M组与L组之间差异显着(P<0.05);各组之间粗蛋白质含量差异不显着(P>0.05);与S组相比,M组粗灰分含量显着降低(P<0.05),L组粗灰分含量呈下降趋势(P>0.05),M组与L组之间差异显着(P<0.05);M组水分含量显着降低(P<0.05),L组水分含量有所降低(P>0.05),M组与L组之间差异不显着(P>0.05)。与S组相比,齐口裂腹鱼腹肌M组粗脂肪、粗蛋白质、粗灰分、水分含量均无显着差异(P>0.05),L组粗脂肪、粗蛋白质、粗灰分含量均呈下降趋势(P<0.05),M组与L组之间均差异显着(P<0.05);各组之间水分含量差异均不显着(P>0.05)。
2.3 齐口裂腹鱼肌间脂肪(intermuscular fat,IMF)含量
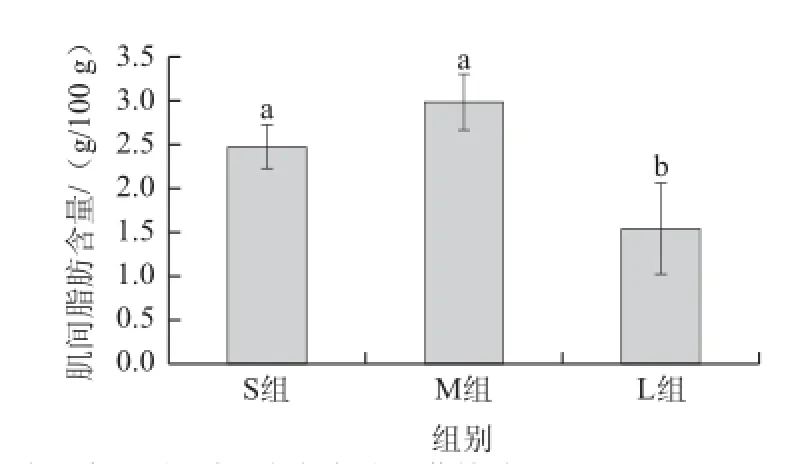
图1 齐口裂腹鱼不同生长阶段的肌间脂肪含量Fig.1 Intramuscular fat contents of Schizothorax prenanti Tchang at different growth stages
如图1所示,与S组相比,M组的IMF含量有升高趋势,但无显着差异(P>0.05),L组的IMF含量显着降低(P<0.05)。结果表明齐口裂腹鱼生长过程中体内IMF含量呈现先上升后下降的趋势,从幼鱼生长到亚成鱼IMF含量有一定增加,而从亚成鱼生长到成鱼IMF含量又显着下降。这可能与鱼类不同生长阶段对能量需求不同有关。
2.4 齐口裂腹鱼LPL和FAS基因mRNA表达水平
2.4.1 齐口裂腹鱼LPL mRNA表达水平
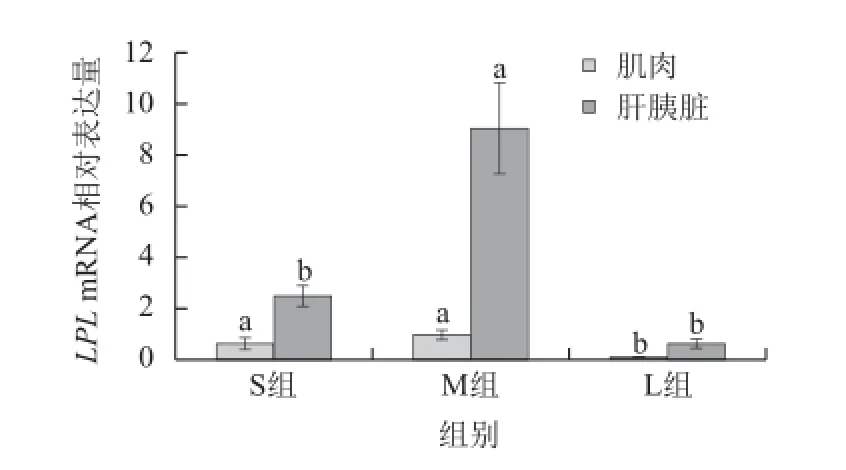
图 2齐口裂腹鱼肝胰脏及肌肉中LPL mRNA表达水平Fig.2 LPL gene expression levels in liver and muscle of Schizothorax prenanti Tchang
如图2所示,齐口裂腹鱼肝胰脏中的LPL mRNA相对表达量高于肌肉。与S组相比,M组肌肉和肝胰脏中LPL mRNA表达水平均显着升高(P<0.05)。与S组相比,L组肌肉中LPL mRNA表达水平显着降低(P<0.05),肝胰脏中LPL mRNA表达水平有下降趋势,但差异并不显着(P>0.05)。L组肌肉和肝胰脏中LPL mRNA表达水平与M组相比均差异显着(P<0.05)。结果表明齐口裂腹鱼生长过程中肌肉LPL mRNA表达水平低于肝胰脏,且两者均呈现先升高后显着降低的趋势,从幼鱼到亚成鱼,肌肉和肝胰脏LPL mRNA表达均升高,尤其是肝胰脏,而到成鱼阶段肌肉和肝胰脏LPL mRNA表达水平均显着降低。
2.4.2 齐口裂腹鱼FAS mRNA表达水平
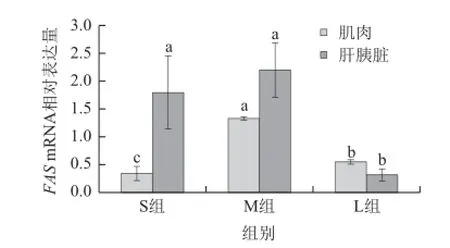
图3 齐口裂腹鱼肝胰脏及肌肉中FAS mRNA表达水平Fig.3 FAS gene expression levels in liver and muscle of Schizothorax prenanti Tchang
如图3所示,齐口裂腹鱼肝胰脏中FAS mRNA相对表达水平高于肌肉。与S组相比,M组肌肉中FAS mRNA表达水平显着升高(P<0.05),肝胰脏中FAS mRNA表达水平升高,但差异并不显着(P>0.05)。与S组相比,L组肌肉中FAS mRNA表达水平显着升高(P<0.05),而肝胰脏中FAS mRNA表达水平显着降低(P<0.05)。L组肌肉和肝胰脏中FAS mRNA表达水平与M组相比均差异显着(P<0.05)。结果表明齐口裂腹鱼生长过程中肝胰脏FAS mRNA表达水平基本高于肌肉,且两者均呈现增加后降低趋势,从幼鱼到亚成鱼,肌肉和肝胰脏FAS mRNA表达水平均有一定增加,尤其是肌肉,而到成鱼阶段肌肉和肝胰脏FAS mRNA表达水平均显着降低。
3 讨 论
鱼类主要富含营养成分的部位是肌肉,鱼类肌肉含有丰富的蛋白质、脂肪酸及微量矿物质[12],它们的种类和含量是鱼肉营养价值的体现,对鱼肉品质的建立与评价具有重要意义。鱼类肌肉营养成分的含量与其生长期、生存环境、饵料成分都有着密切的关系。本实验中,齐口裂腹鱼肌肉中水分含量最高,蛋白质、粗脂肪含量次之,粗灰分含量最少;肥满度、肝体比、肠脂比、水分含量为L组最低;粗脂肪含量同样为L组最低,与肥满度、肠脂比等指标测定结果相符;粗灰分和粗蛋白质含量有微小变化,但无规律性,与周兴华等[2]研究结果一致。在相同生存环境下,可能由于鱼类在不同生长阶段鱼体自身对营养物质需求不同[13],在幼鱼及部分亚成鱼阶段鱼类新陈代谢旺盛、生长快、处于氮正平衡状态、蛋白转换率高,而亚成鱼阶段脂肪及部分蛋白质则开始贮存在体内,供机体利用;在达到成鱼阶段主要能量用于性腺的发育,以致鱼体脂肪含量有所下降。陈静等[14]对体质量50、150、300、600 g的匙吻鲟进行了肌肉成分分析,证明随着体质量增加,鱼体水分含量依次有所降低,粗蛋白质和粗脂肪含量依次升高;施培松[15]对鳙鱼进行研究得出,鳙鱼肌肉蛋白质含量为亚成鱼>幼鱼>稚鱼,而粗脂肪含量则为幼鱼>稚鱼>亚成鱼。这可能与鱼类对食物的消化能力、营养成分积累能力及相关蛋白代谢基因、脂质代谢基因的表达不同有关。Fortin等[16]认为,肌肉脂肪含量在2%~3%时适合食用,本实验S组与M组含量在此范围内。
鱼类对脂肪的利用过程主要包括:脂肪的合成、脂肪的分解与转运。脂肪的合成是在一系列的脂肪合成酶的作用下进行的;在脂肪的分解与转运过程中,鱼体中的脂肪通过脂蛋白从肠道转运到体内各处,在一系列酶及辅助因子的参与下,分解并释放出脂肪酸。在上述过程中,脂肪酸合成酶是脂肪合成的关键酶,当FAS酶活力高时,丙二醛CoA源源不断地被催化成脂肪酸,鱼体内多余的脂肪酸能够通过酯化作用形成脂肪,增加脂肪在体内的沉积[17];脂蛋白酯酶是脂肪分解与转运的关键酶,它通常以同源二聚体的形式发挥甘油三酯水解酶和在受体介导的脂蛋白摄入时作为配体或桥接因子的双重功能[18]。鱼类LPL转录水平上具有组织特异性,如吉红等[19]对草鱼LPL mRNA表达水平的研究表明,脂肪组织、心脏中LPL mRNA表达量最高,其次是肝胰脏、肌肉、鳃;奥斯卡[20]对鲤鱼LPL mRNA表达水平研究表明,肝组织>脑组织>肌肉。本实验结果表明:齐口裂腹鱼肝胰脏LPL mRNA表达量高于肌肉,与丁雪芬[21]对鳜鱼、Li Xiangfei等[22]对武昌鱼的研究结果一致;且肝胰脏及肌肉LPL mRNA表达量为亚成鱼>幼鱼>成鱼,与Saera-Vila等[6]对金头鲷的研究结果相似。这可能与机体成熟及肌肉生长强度有关,齐口裂腹鱼在幼鱼、亚成鱼阶段处于生长旺盛时期,肌肉生长强烈,等达到成鱼阶段,生长减缓,脂肪酸氧化供能代谢需求降低,同时受激素影响,肝胰脏、肌肉LPL mRNA的表达水平下调[23]。刘茜[24]研究发现,草鱼LPL在肌肉中的表达量稍高于肝脏,这可能是由于齐口裂腹鱼和草鱼的脂肪蓄积模式不同,也可能与研究条件不同有关。大量研究还表明,LPL表达还受水温、季节、营养水平等的影响,其具体分子机制还待进一步探究。
Semenkovich[25]研究表明,机体组织中FAS表达水平的升高会显着增加甘油三酯在体内的沉积,从而导致肥胖。目前,关于动物不同生长阶段FAS mRNA表达的研究主要集中在猪。单体中等[26-27]研究28 周龄前及90 kg以下的猪腹部组织FAS mRNA表达水平,结果表明猪在一定生长阶段,腹部组织中FAS mRNA表达水平与日龄呈正相关。韩光明[28]对吉富罗非鱼的研究表明,肝脏是鱼类合成脂肪酸的主要场所[29],也是鱼类随营养状况而改变脂肪蓄积的主要调节性储脂器官[30],肝脏FAS mRNA表达水平略高于肌肉。覃川杰[31]对瓦氏黄颡鱼的研究发现,肝脏FAS mRNA表达水平高于肌肉。本实验研究表明:齐口裂腹鱼肝胰脏FAS mRNA表达量高于肌肉;且肝胰脏FAS mRNA为M组表达量最高,S、L组次之;肌肉FAS基因mRNA的表达为M组显着高于S、L组,与IMF的趋势一致。这可能是由于齐口裂腹鱼在幼鱼阶段外源性脂肪酸足够鱼体生长,FAS mRNA表达量较低,而在亚成鱼阶段,体内需要合成大量的脂肪酸来参与脂肪的合成与沉积,从而导致FAS mRNA表达量升高,到成鱼阶段性腺发育,FAS mRNA表达被抑制,降低了肝胰脏及肌肉中脂肪酸沉积。
肌间脂肪的沉积主要是肌肉内脂肪细胞对甘油三酯的合成与分解能力的综合体现,而参与脂肪合成和分解的脂肪代谢酶有多种,其对脂肪沉积的调控机制也十分复杂。王刚等[18]对猪肌肉组织LPL基因表达的发育性变化及其与肌间脂肪沉积关系的研究发现,肌肉组织中LPL基因的表达对于IMF的沉积有积极的影响,而杨海玲等[32]研究表明,猪肌间脂肪沉积主要是脂肪酸合成酶活性较高所致,与脂肪分解酶关系不大。由此可见,脂蛋白酯酶和脂肪酸合成酶基因表达共同影响IMF沉积。本研究表明肌间脂肪含量为M组最高,S、L组次之,与LPL mRNA及FAS mRNA表达水平呈一定正相关,而IMF决定鱼肉品质的高低,因此,研究鱼类脂质代谢相关基因表达的差异,可以从分子生物水平控制鱼类体脂沉积,为提高鱼肉品质、优化鱼种提供理论依据。
[1] 苏传福. 齐口裂腹鱼的营养需要[J]. 天津水产, 2007(增刊1): 25-29.
[2] 周兴华, 郑曙明, 吴青, 等. 齐口裂腹鱼肌肉营养成分的分析[J]. 大连水产学院学报, 2005, 20(1): 20-24.
[3] 向枭, 陈建, 周兴华, 等. 5种脂肪源对齐口裂腹鱼生长性能及血清生化指标的影响[J]. 动物营养学报, 2010, 22(2): 498-504.
[4] MEAD J R, IRVINE S A, RAMJI D P. Lipoprotein lipase: structure, function, regulation, and role in disease[J]. Journal of Molecular Medicine, 2002, 80(12): 753-769.
[5] OKU H, KOIZUMI N, OKUMURA T, et al. Molecular characterization of lipoprotein lipase, hepatic lipase and pancreatic lipase genes: effects of fasting and refeeding on their gene expression in red sea bream Pagrus major[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 145(2): 168-178.
[6] SAERA-VILA A, CALDUCH-GINER J A, GÓMEZ-REQUENI P, et al. Molecular characterization of gilthead sea bream (Sparus aurata) lipoprotein lipase. Transcriptional regulation by season and nutritional condition in skeletal muscle and fat storage tissues[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 142(2): 224-232.
[7] ALBALAT A, SÁNCHEZ-GURMACHES J, GUTIÉRREZ J, et al. Regulation of lipoprotein lipase activity in rainbow trout (Oncorhynchus mykiss) tissues[J]. General and Comparative Endocrinology, 2006, 146(3): 226-235.
[8] CHIRALA S S, WAKIL S J. Structure and function of animal fatty acid synthase[J]. Lipids, 2004, 39(11): 1045-1053.
[9] ZHENG Jialang, LUO Zhi, ZHU Qingling, et al. Molecular cloning and expression pattern of 11 genes involved in lipid metabolism in yellow catfi sh Pelteobagrus fulvidraco[J]. Gene, 2013, 531(1): 53-63.
[10] TIAN Juan, WEN Hua, ZENG Lingbing, et al. Changes in the activities and mRNA expression levels of lipoprotein lipase (LPL), hormone-sensitive lipase (HSL) and fatty acid synthetase (FAS) of Nile tilapia (Oreochromis niloticus) during fasting and re-feeding[J]. Aquaculture, 2013, 400: 29-35.
[11] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[12] ZHAO Feng, ZHUANG Ping, SONG Chao, et al. Amino acid and fatty acid compositions and nutritional quality of muscle in the pomfret, Pampus punctatissimus[J]. Food Chemistry, 2010, 118(2): 224-227.
[13] 尹洪滨, 孙中武, 孙大江, 等. 6种养殖鲟鳇鱼肌肉营养成分的比较分析[J]. 大连水产学院学报, 2004, 19(2): 92-96.
[14] 陈静, 梁银铨, 黄道明, 等. 不同生长阶段匙吻鲟肌肉成分的研究[J].水生态学杂志, 2008, 1(1): 65-68.
[15] 施培松. 匙吻鲟和鳙的生长、肌肉品质比较及FAS基因克隆与表达[D].武汉: 华中农业大学, 2013.
[16] FORTIN A, ROBERTSON W M, TONG A K W. The eating quality of Canadian pork and its relationship with intramuscular fat[J]. Meat Science, 2005, 69(2): 297-305.
[17] SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317.
[18] 王刚, 曾勇庆, 武英, 等. 猪肌肉组织LPL基因表达的发育性变化及其与肌内脂肪沉积关系的研究[J]. 畜牧兽医学报, 2007, 38(3): 253-257.
[19] 吉红, 苏尚顺, 刘茜, 等. 草鱼LPL基因的表达及饥饿和再投喂对其影响[J]. 水产学报, 2009, 33(6): 981-986.
[20] 奥斯卡. 日粮脂肪对鲤鱼脂蛋白脂酶和脂肪酸合成酶基因表达的影响[D]. 重庆: 西南大学, 2012.
[21] 丁雪芬. 鱼类脂蛋白脂酶(LPL)和肝脂酶(HL)基因及其分子进化研究[D]. 广州: 暨南大学, 2007.
[22] LI Xiangfei, JIANG Guangzhen, QIAN Yu, et al. Molecular characterization of lipoprotein lipase from blunt snout bream Megalobrama amblycephala and the regulation of its activity and expression by dietary lipid levels[J]. Aquaculture, 2013, 416: 23-32.
[23] JOSÉ IBÁÑEZ A, PEINADO-ONSURBE J, SÁNCHEZ E, et al. Lipoprotein lipase (LPL) is highly expressed and active in the ovary of European sea bass (Dicentrarchus labrax L.), during gonadal development[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 150(3): 347-354.
[24] 刘茜. 草鱼LPL基因克隆及草鱼脂肪细胞提取与培养的研究[D]. 杨凌: 西北农林科技大学, 2007.
[25] SEMENKOVICH C F. Regulation of fatty acid synthase (FAS)[J]. Progress in Lipid Research, 1997, 36(1): 43-53.
[26] 单体中, 汪以真, 刘建新, 等. 不同日龄猪腹脂中脂肪酸合成酶(FAS)基因表达规律的研究[J]. 畜牧兽医学报, 2006, 37(7): 662-666.
[27] 单体中, 汪以真. 猪不同生长阶段脂肪酸合成酶基因的表达差异[J].农业生物技术学报, 2006, 14(2): 293-294.
[28] 韩光明. 饲料脂肪水平对吉富罗非鱼生长、体脂沉积、脂肪酸组成及脂肪酸合成酶的影响[D]. 南京: 南京农业大学, 2009.
[29] LIKIMANI T A, WILSON R P. Effects of diet on lipogenic enzyme activities in channel catfi sh hepatic and adipose tissue[J]. The Journal of Nutrition, 1982, 112(1): 112-117.
[30] LIANG X F, OGATA H Y, OKU H. Effect of dietary fatty acids on lipoprotein lipase gene expression in the liver and visceral adipose tissue of fed and starved red sea bream Pagrus major[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2002, 132(4): 913-919.
[31] 覃川杰. 瓦氏黄颡鱼(Pelteobagrus vachelli)脂肪代谢相关基因cDNA的克隆及表达分析[D]. 上海: 华东师范大学, 2010.
[32] 杨海玲, 曾勇庆, 魏述东, 等. 莱芜猪脂肪代谢酶活性的发育性变化及其对肌内脂肪沉积的影响[J]. 畜牧兽医学报, 2005, 36(11): 1150-1154.
Growth, Muscle Quality and Gene Expression of Lipoprotein Lipase and Fatty Acid Synthase of Schizothorax prenanti Tchang
XIA Xiaojie, WU Yinglong*, FENG Jiao, ZENG Liping, ZHOU Cheng
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Objective: To investigate the growth, muscle quality and gene expression of lipoprotein lipase (LPL) and fatty acid synthase (FAS) of Schizothorax p renanti Tchang (SPT) at different growth stages. Methods: SPT with body weights of (137.8 ± 1.7) g (small, juvenile), (312.4 ± 11.8) g (medium, subadult) and (500.9 ± 31.4) g (large, adult) were collected, respectively. Their body condition indexes, visceral indexes and major muscle nutrients were determined. Meanwhile, LPL and FAS mRNA levels in liver and muscle of SPT at the juvenile, subadult and adult growth periods were evaluated by realtime PCR. Results: Compared with the small group, boby condition indexes, hepatopancreas index (HIS), mesenteric lipid index and water content were reduced in the medium group and large group (P < 0.05). The contents of crude protein and crude ash showed no signifi cant change in muscle. The intermuscular fat was the least abundant in the large group (P < 0.05). The LPL and FAS mRNA expression levels in liver for the small group, medium and large group were signifi cantly higher than in muscle (P < 0.05). The LPL mRNA and FAS mRNA expression levels in liver were the lowest in the large group (P < 0.05). The LPL mRNA and FAS mRNA expression levels in muscle were the highest in the medium group (P < 0.05). Conclusion: The essential nutrients in muscle are reduced at the adult stage, and the content of intramusclar fat is correlated with the expression of LPL mRNA and FAS mRNA.
Schizothorax prenanti Tchang; growth; quality; lipoprotein lipase; fatty acid synthase
TS241.1
A
1002-6630(2015)01-0164-06
10.7506/spkx1002-6630-201501031
2014-03-12
四川农业大学“211”工程双支计划项目(2013)
夏晓杰(1988—),女,硕士研究生,研究方向为功能性食品。E-mail:472269396@qq.com
*通信作者:邬应龙(1963—),男,教授,博士,研究方向为功能性食品。E-mail:wuyinglong99@163.com



