高 娜,张玉斌,韩 玲,*,保善科,郭文瑞,余群力
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.青海省海北州畜牧兽医科学研究所,青海 海北 812200)
牦牛背最长肌高铁肌红蛋白还原酶提取工艺的优化
高 娜1,张玉斌1,韩 玲1,*,保善科2,郭文瑞1,余群力1
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.青海省海北州畜牧兽医科学研究所,青海 海北 812200)
为研究牦牛背最长肌高铁肌红蛋白还原酶的最佳提取条件,本实验以牦牛背最长肌为研究对象,以高铁肌红蛋白还原酶活力为考察指标,在单因素试验的基础上,采用响应曲面分析法,以高铁肌红蛋白还原酶活力为响应值,对磷酸盐缓冲液、Tris-HCl和柠檬酸-柠檬酸钠缓冲液3 种提取液的pH值、浓度和料液比3 个因素进行优化。结果表明:各因素对酶活力的影响大小顺序依次为提取液的pH值>料液比>浓度;最佳提取参数为磷酸盐缓冲液pH 7.22、料液比1:2.25(m/V)、浓度 2.12 mmol/L,在此条件下酶活力为73.92 U/L,与理论预测值的相对误差为0.86%,说明本实验所建立的模型在实践中具有可行性。
高铁肌红蛋白还原酶;牦牛背最长肌;提取工艺;响应面法
肌细胞内部存在着一系列能将高铁肌红蛋白(MetMb)还原为氧合肌红蛋白(MbO2)的酶,研究者称之为高铁肌红蛋白还原酶(metmyoglobin reductase,MetMbR)[1]。高铁肌红蛋白还原酶不是单独的一种酶,而是和肉色相关的一类酶[2-3],其理化性质不稳定,很容易在光线和有氧环境下迅速发生改变[4]。MetMbR可以阻抗引起肉品褐变的MetMb的积累,从而稳定肉色,延长肉品货架期[5]。
肉色是鲜肉的重要感官特性之一,直接影响消费者的购买意愿[6-7]。肉色鲜红富有光泽表明肉品新鲜、质地优良,这与肉中肌红蛋白的数量和状态以及高铁肌红蛋白还原酶体系密切相关[8-11]。肉中MetMbR首次报道于20世纪60年代初,Dean和Ball在真空包装的鲜肉表面观察到MetMb的还原,提出肉中天然还原系统(metmyoglobin reducing system)的存在[12]。随后有人分别报道了牛骨骼肌、背最长肌和腰大肌、蓝鳍金枪鱼肌肉中的酶促反应与肉色变化的关系[13-15],证实了Dean和Ball的发现。Ledward[16]研究认为,MetMbR对肉类色泽稳定性有决定性作用,研究MetMbR与MetMb的相互作用,需要得到比较理想的MetMbR生物材料作为基准物,从而提高研究的科学性和可靠性[8]。尽管对肉中高铁肌红蛋白还原酶测定方法的研究报道很多,然而,目前国内外对高铁肌红蛋白还原酶的研究主要集中在普通牛和猪等畜类上,尚未见针对牦牛背最长肌中高铁肌红蛋白酶提取条件优化的研究报道,所以,研究高铁肌红蛋白酶的提取工艺对实践有指导意义。
牦牛生存在我国高海拔低氧环境中,体内肌红蛋白含量比低海拔地区的牛种高,而这一特性又导致了其肉色较差,不易被消费者接受[17-18]。因此,研究牦牛相关产品的肉色稳定体系,对于提升冷鲜牦牛肉品质,扩大我国牦牛肉的消费市场,开发中国特色畜种资源都具有极其重要的意义。本研究以牦牛背最长肌为原料,在单因素试验结果的基础上,采用响应面分析法,研究3 种提取液对高铁肌红蛋白还原酶活力的影响,并确定高铁肌红蛋白还原酶的最佳提取条件,旨在为牦牛高铁肌红蛋白还原酶的深入研究提供基础资料,为宰后生鲜牦牛肉的自我护色及肉色稳定性提供理论依据,为深入研究不同部位肌肉间肉色差异的机制及肉品学、运动医学和心血管疾病的研究奠定基础。
1 材料与方法
1.1材料与试剂
牦牛背最长肌 临夏康美牧业有限公司;马心肌肌红蛋白标准品 美国Sigma公司;乙二胺四乙酸二钠、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、磷酸盐缓冲液(phosphate buffered saline,PBS)、Tris-HCl缓冲液、柠檬酸-柠檬酸钠缓冲液、铁氰化钾、亚铁氰化钾均为分析纯。
1.2仪器与设备
SP-756P紫外-可见分光光度计 上海光谱仪器有限公司;TGL-24MC台式高速冷冻离心机 长沙平凡仪器仪表有限公司;AL204型电子天平 梅特勒-托利多仪器公司;Haier立式超低温保存箱 青岛海尔特种电器有限公司。
1.3方法
1.3.1高铁肌红蛋白还原酶的提取方法
参照Reddy等[19]的方法并改进:将贮存于-80 ℃的背最长肌样品于4 ℃恒温恒湿箱解冻至半冻状态,除去表皮脂肪和筋膜,切成小块。准确称取10 g样品加入20 mL冰提取液,4 ℃条件下,经组织捣碎机处理1 min,再用高速组织分散器连续均质处理1 min(10 000×g,4 ℃),均质液离心(10 203×g,4 ℃,20 min),得到上清液经中速定性滤纸过滤除去脂肪,滤液中氧合肌红蛋白用稍过量的铁氰化钾氧化后,再用冰提取液于4 ℃条件下透析(透析袋截留相对分子质量为14 000)24 h,期间换液5 次,为除去过量的高铁氰化钾。透析完毕后离心(14 692×g,4 ℃,20 min),取上清液用PBS(2.0 mmol/L,pH 7.0)定容至20 mL,-80 ℃贮藏备用。
1.3.2高铁肌红蛋白标准溶液的制备
将在-20 ℃条件下冻存的肌红蛋白标准品溶于PBS(2.0 mmol/L,pH 7.0)中,用稍过量的铁氰化钾氧化,4 ℃条件下先蒸馏水后PBS(2.0 mmol/L,pH 7.0)透析。将高铁肌红蛋白溶液浓缩至0.75 mmol/L,用紫外-可见分光光度计分别测定525、545、565、572 nm波长处的吸光度,并计算高铁肌红蛋白的含量,使其含量高于93%。将高铁肌红蛋白溶液在50 ℃水浴加热10 min,长时间高温使可能存在的MetMbR失去活性,然后将此高铁肌红蛋白标准品溶液分装贮藏于-80 ℃冰箱备用。高铁肌红蛋白含量测定公式如下。

式中:R1、R2、R3分别是吸光度比值
1.3.3高铁肌红蛋白还原酶活力的测定
配制标准高铁肌红蛋白还原酶反应体系,成分如表1所示,空白对照以去离子水代替NADH,其他反应组分不变。

表1 高铁肌红蛋白还原酶活性测定的反应组分Table1 Reactants used for determination of metmyoglobin reductase activity
反应前30 min将各反应物置于25 ℃恒温水浴锅中,使反应体系温度维持在25 ℃。待体系中加入NADH后启动反应,用紫外-可见分光光度计在λ=580 nm波长处测定MetMb与MbO2的吸光度,两者摩尔消光系数为12×103L/(mol·cm)。MetMbR活力单位定义为:每分钟每克肉样被还原1 nmol的MetMb为一个酶活力单位,单位为U。重复3 次。酶活力计算见下式。

式中:ΔA为每分钟吸光度的变化;V为反应体系体积/mL;ε为摩尔消光系数/(L/(mol·cm));v为样品体积/mL;l为比色杯光径/cm;m为样品的质量/g;109为mol换算成nmol。
1.4高铁肌红蛋白还原酶提取工艺的单因素试验
1.4.1提取液种类和pH值范围的确定
分别配制pH值为6.0、6.5、7.0、7.5、8.0,浓度为2.0 mmol/L的PBS,以1:2(m/V)的料液比按照1.3.1节的操作方法提取高铁肌红蛋白还原酶粗酶液,分别测定酶活力。Tris-HCl和柠檬酸-柠檬酸钠缓冲液的操作同PBS。
1.4.2提取液种类和浓度范围的确定
分别配制pH值为7.0,浓度为1.0、2.0、5.0、10.0、20.0 mmol/L的PBS,以料液比1:2按照1.3.1节的操作方法提取粗酶液,分别测定酶活力。Tris-HCl和柠檬酸-柠檬酸钠缓冲液的操作同PBS。
1.4.3提取液种类和料液比范围的确定
配制pH值为7.0,浓度为2.0 mmol/L的PBS,按照1.3.1节的操作方法分别以1:1、1:2、1:3、1:4和1:5的料液比提取粗酶液,并测定酶活力。Tris-HCl和柠檬酸-柠檬酸钠缓冲液的操作同PBS。
1.5高铁肌红蛋白还原酶提取工艺参数的优化
在单因素试验的基础上,选取提取液pH值、浓度和料液比这3 个因素作为多因素交叉组合试验的考察因素,以酶活力为响应值,采用响应面中心旋转组合方式对高铁肌红蛋白还原酶提取的工艺参数进行优化,共设计20 组试验,每组做3 个平行,利用Design-Expert 8.05对试验数据进行分析处理,以获得最佳参数。
1.6数据处理
使用Microsoft Excel和Design Expert进行数据处理和分析。
2 结果与分析
2.1单因素试验结果
2.1.1提取液种类和pH值对酶活力的影响

图1 提取液种类和pH值对酶活力的影响Fig.1 Effects of extraction buffer type and pH on metmyoglobin reductase activity
由图1可知,用PBS提取的粗酶液酶活力大于用Tris-HCl和用柠檬酸-柠檬酸钠提取的酶液,且在pH值为7.0时达到最大值,而用Tris-HCl和用柠檬酸-柠檬酸钠提取的酶液分别在pH 8.0和pH 6.0处酶活力达到最大值,确定提取缓冲液为PBS。当PBS pH值在6.0~7.0范围内时,酶活力随pH值的增大而增大,当pH值大于7.0后,酶活力先减小后略微增大,所以,选择PBS pH 6.0~8.0作为响应面试验的范围。
2.1.2提取液种类和浓度对酶活力的影响

图2 提取液种类和浓度对酶活力的影响Fig.2 Effects of extraction buffer type and concentration on metmyoglobin reductase activity
由图2可知,用PBS提取的粗酶液酶活力大于用Tris-HCl和用柠檬酸-柠檬酸钠提取的酶液,而且PBS浓度为2.0 mmol/L时酶活力最大,当Tris-HCl浓度为1.0 mmol/L时酶活力达到最大值,柠檬酸-柠檬酸钠浓度为10.0 mmol/L时有最大酶活力,因此选择提取缓冲液为PBS,且浓度在2.0 mmol/L左右。酶活力随PBS的浓度从1.0 mmol/L增大到2.0 mmol/L,当浓度超过2.0 mmol/L时酶活力基本稳定,所以,选择PBS浓度1.0~3.0 mmol/L作为响应面试验的范围。
2.1.3提取液种类和料液比对酶活力的影响

图3 提取液种类和料液比对酶活力的影响Fig.3 Effects of extraction buffer type and solid-to-solvent ratio on metmyoglobin reductase activity
由图3可知,结果与图1和图2一致,用PBS提取的粗酶液酶活力大于用Tris-HCl和用柠檬酸-柠檬酸钠提取的酶液,且当料液比为1:2时酶活力高于其他。当样品与PBS的比例从1:1减小到1:2时,酶活力明显增大,当料液比小于1:2后,酶活力逐渐减小,但变化不明显。所以,选择料液比1:1~1:3为响应面试验范围。
2.2响应面分析法对提取工艺参数的优化
2.2.1回归方程及方差分析
对提取液pH值(A)、浓度(B)和料液比(C)进行了三因素三水平响应面分析,高铁肌红蛋白还原酶提取缓冲液的三因素二次回归旋转组合试验设计方案及结果见表2。

表2 响应面分析试验设计方案及结果Table2 Response surface design with experimental values of metmyoglobin reductase activity
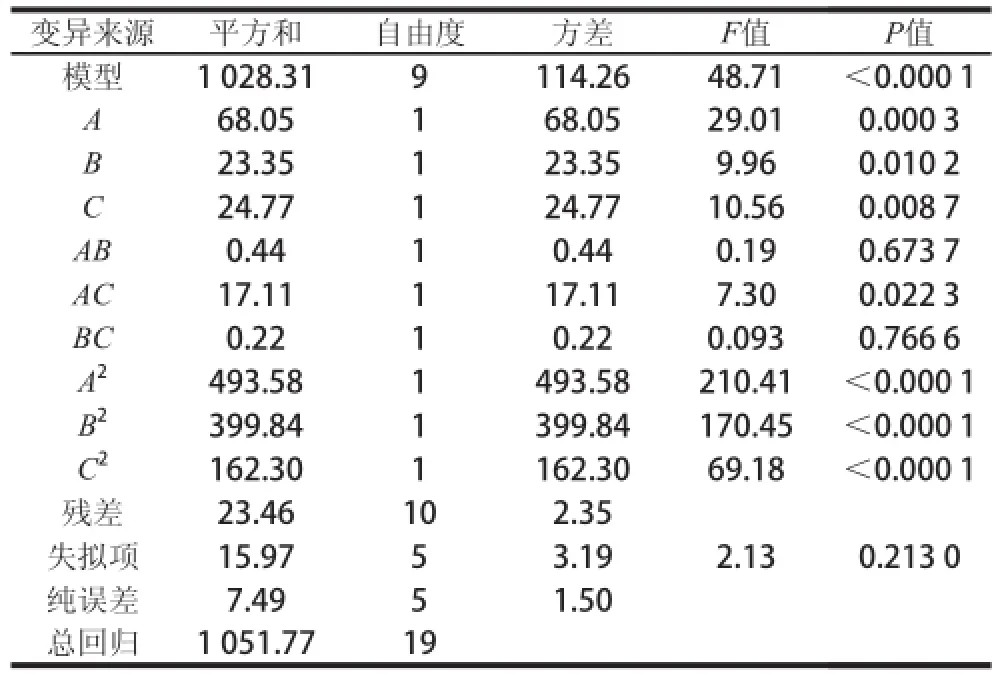
表3 中心组合试验回归模型方差分析Table3 Analysis of variance for the fitted regression model
使用Design-Expert 8.05对试验结果进行回归分析,得到回归模型方程为Y=74.06+2.23A+1.31B+1.35C-0.23AB+1.46AC+0.17BC-5.85A2-5.27B2-3.36C2。由表3可知,该模型在α=0.01的水平上高度显着,提取液pH值和料液比的一次项(A、C),提取液pH值、浓度、料液比的二次项(A2、B2、C2)对高铁肌红蛋白还原酶活力的影响均极显着(P<0.01),缓冲液pH值和料液比的交互作用对酶活力有显着影响(P<0.05)。决定系数R2为0.977 7,说明模型的拟合度好,酶活力的实际值与预测值之间具有较好的拟合相关性。方差分析表明,参试因子对高铁肌红蛋白还原酶活力的影响大小顺序为:提取液的pH值>料液比>提取液浓度。
2.2.2响应面分析及最佳工艺参数的确定

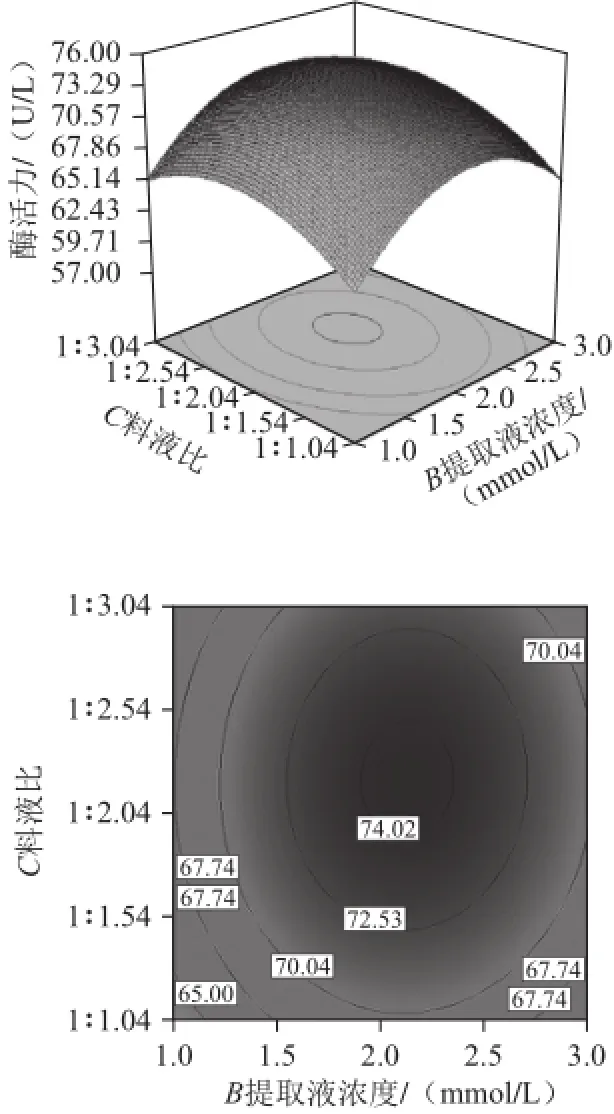
图4 高铁肌红蛋白还原酶活力响应面分析Fig.4 Response surface plots for metmyoglobin reductase activity
对提取缓冲液pH值(A)、浓度(B)、料液比(C)3 个因素两两交互作用进行分析,做出相应的响应面曲面,如图4所示。响应面能够直观地反映各试验因子对响应值影响的大小,并通过等高线图得最优条件下各试验因子的取值。响应曲面坡度陡峭表明高铁肌红蛋白还原酶的活力对试验因子的改变敏感;反之,则表明酶活力的大小受试验因子的影响小。等高线越密集且越趋向椭圆形表示两因素交互作用显着,反之则表明交互作用不显着。料液比与提取液pH值的响应曲面坡度陡峭并且等高线扁而密集,说明酶活力受提取缓冲液pH值与料液比两因素间的交互作用趋势比较明显;提取液浓度与pH值及料液比与提取液浓度交互作用的等高线则相对较圆,说明缓冲液pH值与浓度、料液比与浓度之间的交互作用不显着,该结果与表3的方差分析结果一致。
通过对回归模型进行数学分析,得出牦牛背最长肌高铁肌红蛋白还原酶提取的最佳工艺参数为:PBS pH值为7.22、浓度为2.12 mmol/L、料液比为1:2.25,在此工艺条件下,高铁肌红蛋白还原酶活力为74.56 U/L。
2.2.3验证实验
为进一步验证该模型的可靠性,在PBS pH值为7.22、浓度为2.12 mmol/L、料液比为1:2.25的条件下对牦牛背最长肌高铁肌红蛋白还原酶进行提取,实得其酶活力为73.92 U/L,与理论值相比,相对误差为0.86%。因此,该模型设计合理且结果有效,得到的最佳提取工艺参数准确可靠,可以应用于实际生产。
3 结 论
单因素试验结果表明,3 种提取液中磷酸盐缓冲液的效果最佳。通过响应面试验结果,各提取因素对高铁肌红蛋白还原酶活力的大小顺序依次为提取液的pH值>料液比>提取液浓度。响应面分析法得到的最优工艺参数为:提取液pH 7.22、浓度2.12 mmol/L、料液比1:2.25,该条件下测得酶活力为73.92 U/L,与理论预测值接近,说明本实验建立的模型与实际情况吻合,可作为进一步探索牦牛高铁肌红蛋白还原酶酶学性质的基础资料。
[1] 孙学朋. 高铁肌红蛋白还原酶及其对肉色稳定性的作用综述[J]. 江西农业学报, 2008, 20(5): 91-93.
[2] DEAN R W, BALL C O. Analysis of the myoglobin fractions on the surfaces of beef cuts[J]. Food Technology, 1960, 14(6): 271-286.
[3] 白凤霞, 戴瑞彤, 苏春元, 等. 高铁肌红蛋白还原酶与肉色关系研究进展[J]. 食品工业科技, 2008, 29(11): 276-280.
[4] 王玮. 高铁肌红蛋白还原酶分离纯化及表征[D]. 南京: 南京师范大学, 2009.
[5] 白凤霞, 戴瑞彤, 孔保华. 高铁肌红蛋白还原酶活力测定方法的优化[J]. 农产品加工: 学刊, 2009(12): 4-7.
[6] GAO Xiaoguang, XIE Li, WANG Zhenyu, et al. Effect of postmortem time on the metmyoglobin reductase activity, oxygen consumption,and colour stability of different lamb muscles[J]. European Food Research and Technology, 2013, 236(4): 579-587.
[7] MOHAN A, HUNT M C, BARSTOW T J, et al. Effects of malate,lactate, and pyruvate on myoglobin redox stability in homogenates of three bovine muscles[J]. Meat Science, 2010, 86(2): 304-310.
[8] 王玮, 金邦荃. 从心肌中提取纯化高铁肌红蛋白还原酶的方法: 中国, 200810123840[P]. 2010-11-10.
[9] BEKHIT A E D, GEESINK G H, MORTON J D, et al. Metmyoglobin reducing activity and colour stability of ovine longissimus muscle[J]. Meat Science, 2001, 57(4): 427-435.
[10] MIKKELSEN A, JUNCHER D, SKIBSTED L H. Metmyoglobin reductase activity in porcine m. longissimus dorsi muscle[J]. Meat Science, 1999, 51(2): 155-161.
[11] 谢丽, 高晓光, 苗敬, 等. 牛不同部位肌肉高铁肌红蛋白还原酶活力及耗氧率对肉色稳定性的影响[J]. 食品工业科技, 2012, 33(16): 342-346.
[12] BEKHIT A E D, FAUSTMAN C. Metmyoglobin reducing activity[J]. Meat Science, 2005, 71(3): 407-439.
[13] MADHAVI D L, CARPENTER C E. Aging and processing affect color, metmyoglobin reductase and oxygen co nsumption of beef muscles[J]. Journal of Food Science, 1993, 58(5): 939-942.
[14] ARIHARA K, CASSENS R G, GREASER M L, et al. Localization of metmyoglobin-reducing enzyme (NADH-cytochrome b (5) reductase)system components in bovine skeletal muscle[J]. Meat Science, 1994,39(2): 205-213.
[15] PONG C Y, CHIOU T K, NIEH F P, et al. Purification and characterization of metmyoglobin reductase from ordinary muscle of blue-fin tuna[J]. Fisheries Science, 2000, 66(3): 599-604.
[16] LEDWARD D A. Post-slaughter influences on the formation of metmyoglobin in beef muscles[J]. Meat Science, 1985, 15(3): 149-171.
[17] 李永鹏, 韩玲, 张丽, 等. 宰后牛肉色泽稳定性及其影响因素[J]. 肉类研究, 2012, 26(6): 38-41.
[18] 孙烨琨, 王淼, 杨虎, 等. 牦牛肉脂肪酸组成与肌红蛋白氧化的关系[J].食品科学, 2010, 31(21): 62-64.
[19] REDDY L M, CARPENTER C E. Determination of metmyoglobin reductase activity in bovine skeletal muscles[J]. Journal of Food Science, 1991, 56(5): 1161-1164.
Optimization of Extraction Process for Metmyoglobin Reductase from longissimus dorsi Muscle of Yak
GAO Na1, ZHANG Yubin1, HAN Ling1,*, BAO Shanke2, GUO Wenrui1, YU Qunli1
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. Animal Husbandry and Veterinary Institute of Haibei State in Qinghai Province, Haibei 812200, China)
This study aimed to find the optimum extraction conditions for metmyoglobin reductase (MetMbR) from longissimus dorsi muscle of yak. The selection of extraction buffer and the optimization of important extraction parameters for enhanced MetMbR activity were carried out by combined use of single factor method and response surface methodology. PBS buffer was found to be the most suitable for the extraction of MetMbR. The pH and concentration of PBS buffer, and solid-to-solvent ratio were identified as main extraction parameters, and their importance showed a decreasing order of pH > solid-to-solvent ratio > concentration. The optimum extraction conditions were determined as extraction using 2.12 mmol/L PBS buffer (pH 7.22) with a solid-to-solvent ratio of 1:2.25 (m/V). Under these conditions, the metmyoglobin reductase activity was 73.92 U/L, which coincides with the theoretical value with a relative error of 0.86%. In conclution,the model developed in this study is feasible in practice.
metmyoglobin reductase; longissimus dorsi muscle of yak; extraction process; response surface methodology
TS251.1
A
1002-6630(2015)03-0094-05
10.7506/spkx1002-6630-201503018
2014-03-11
国家自然科学基金地区科学基金项目(31260380);国家现代农业(肉牛牦牛)产业技术体系建设专项(CARS-38)
高娜(1990—),女,硕士研究生,研究方向为食品工程。E-mail:15294209826@163.com
韩玲(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:hanl@gsau.edu.cn



