王振强,李孝坤,王 浩*
(1.黄河水利职业技术学院环境与化学工程系,河南 开封 475003;2.天津科技大学食品工程与生物技术学院,食品营养与安全省部共建教育部重点实验室,天津 300457)
响应面试验优化超声辅助提取番茄皮渣中番茄红素工艺及其HPLC-MS测定
王振强1,李孝坤1,王 浩2,*
(1.黄河水利职业技术学院环境与化学工程系,河南 开封 475003;2.天津科技大学食品工程与生物技术学院,食品营养与安全省部共建教育部重点实验室,天津 300457)
以番茄皮渣为原料,采用超声辅助提取工艺,研究提取溶剂种类、超声功率、液固比、提取时间、提取温度对番茄红素提取效果的影响,通过响应面试验分析,确定最佳工艺条件为:皮渣经95%乙醇溶液处理后,以乙酸乙酯为提取溶剂,提取温度50℃、提取时间45 min、液固比5∶1(mL/g)、超声功率270 W。产物经高效液相色谱-质谱测定,番茄红素提取量可达到250.1 mg/kg。通过组织结构观察,与传统提取方法相比,超声提取能有效破坏植物组织结构,提高提取效果。
番茄红素;番茄皮渣;超声辅助提取;优化;测定
番茄红素是一种脂溶性天然色素,由11个共轭及2个非共轭碳-碳双键组成,具有抗氧化、抑制癌细胞增殖、抑制低密度蛋白氧化等生理功能[1-2]、广泛用于保健食品、药品、化妆品领域。目前,国内对番茄红素的提取主要以番茄[3-5]或番茄酱[6]为原料,采用回流浸提[7-8]和微波辅助提取[9],提取成本较高。超声提取法利用超声波所产生的超声能、强烈机械振动和空化效应等作用,从而缩短提取时间,提高提取效率[10-12],已成为现代天然产物活性成分分离提取研究领域的新技术、新方法之一。
我国是番茄生产大国,在番茄制品的工业化生产中剥离的蜡质表皮常带有部分表层果肉,此部分称为番茄皮渣,常被废弃。研究[13-14]表明与表皮相连部分果肉中番茄红素的含量较果实其他部位要高的多,因此,为充分利用资源,本实验对从番茄皮渣中提取番茄红素的超声辅助提取工艺进行了初步研究。
1 材料与方法
1.1材料与试剂
番茄皮渣 新疆万选千挑农产有限公司;番茄红素标准品(纯度95%) 美国Sigma公司;乙醇 天津四通化工厂;6#溶剂油 洛阳市奥达化工有限公司;石油醚、正己烷、丙酮、乙酸乙酯均为分析纯。
1.2仪器与设备
KQ-300E超声槽 昆山超声波清洗器有限公司;LCQ高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用仪美国Thermo公司。
1.3方法
1.3.1工艺流程
番茄皮渣→水洗(去籽)→乙醇预处理→超声辅助提取→离心→减压浓缩→番茄红素油树脂
1.3.2提取溶剂的选择
选取石油醚、正己烷、丙酮、乙酸乙酯、6#溶剂油5种试剂作为提取溶剂[15]。称取95%乙醇溶液预处理的番茄皮渣5.0 g,按照液固比6∶1(mL/g)加入上述溶剂,提取温度50℃、超声功率300 W、提取时间50 min,离心、减压浓缩,HPLC测定番茄红素提取量。
1.3.3提取温度的选择
称取95%乙醇溶液预处理的番茄皮渣5.0 g,按照液固比6∶1(mL/g)加入乙酸乙酯,超声功率300 W,分别在30、40、50、60、70℃条件下提取50 min,离心、减压浓缩,HPLC测定番茄红素提取量。
1.3.4液固比的选择
称取95%乙醇溶液预处理的番茄皮渣5.0 g,提取温度50℃、超声功率300 W,分别按照液固比3∶1、4∶1、5∶1、6∶1、7∶1(mL/g)加入乙酸乙酯,提取50 min,离心、减压浓缩,HPLC测定番茄红素提取量。
1.3.5提取时间的选择
称取95%乙醇溶液预处理的番茄皮渣5.0 g,按照液固比5∶1(mL/g)加入乙酸乙酯,提取温度50℃、超声功率300 W,提取时间分别为25、35、45、55、65 min,离心、减压浓缩,HPLC测定番茄红素提取量。
1.3.6超声功率的选择
称取95%乙醇溶液预处理的番茄皮渣5.0 g,按照液固比5∶1(mL/g)加入乙酸乙酯,提取温度50℃,分别在超声功率180、210、240、270、300 W条件下提取45 min,离心、减压浓缩,HPLC测定番茄红素提取量。
1.3.7超声辅助提取工艺优化
在单因素试验基础上,选取温度、液固比、提取时间、超声功率为试验因素,以番茄红素提取量为指标,利响应面法优化工艺参数,数据采用SAS 8.0软件处理。
1.3.8番茄红素的HPLC测定
1.3.8.1标准曲线的绘制
称取番茄红素标准品4.0 mg,二氯甲烷定容于100 mL棕色容量瓶,配成番茄红素质量浓度为3 8 ☒g/m L的标准液。色谱条件为C18柱(4.6 mm×250 mm,5 ☒m);流动相为V(二氯甲烷)∶V(甲醇)∶V(乙腈)=0.25∶1∶1;流速0.8 mL/min;检测波长472 nm;进样量20 ☒L。以进样量(μg)为横坐标、峰面积为纵坐标作图,得番茄红素标准曲线。
1.3.8.2样品中番茄红素含量测定
取适量样品用二氯甲烷定容于25 mL棕色容量瓶,按色谱条件分析,计算番茄红素含量[16]。
1.3.8.3番茄红素提取量的计算

1.3.9番茄红素的MS测定
采用电喷雾离子源,正离子检测,全离子扫描范围100~500 nm,归一化碰撞能量35%,毛细管电压-10.0 V,毛细管温度275 ℃,电喷雾电压4.5 kV,鞘气(N2)流速30 arb、辅助气(N2)流速5 arb,套管透镜补偿电压-50.0 V。
2 结果与分析
2.1提取溶剂种类的确定
石油醚、正己烷、丙酮、乙酸乙酯、6#溶剂油5种试剂作为常用的提取溶剂,对番茄红素的提取效果如图1所示。

图1 提取溶剂种类对提取量的影响Fig.1 Effect of solvents on the extraction yield of lycopene
由图1可知,乙酸乙酯提取番茄红素提取量为251.2 mg/kg,提取效果明显优于石油醚和6#溶剂油,此外,考虑正己烷和丙酮的价格及安全性等因素,选择乙酸乙酯作为提取溶剂。
2.2单因素试验结果
2.2.1提取温度的确定
由图2可知,提取温度的升高有利于番茄红素的有效溶出,随着温度的升高,提取量相应升高;当温度为50 ℃时,提取量最大,之后温度升高而提取量缓慢降低,可能是由于温度升高导致番茄红素稳定性降低。因此,提取温度为50 ℃较适于番茄红素的提取[17]。

图2 提取温度对提取量的影响Fig.2 Effect of extraction temperature on the extraction yield of lycopene
2.2.2液固比的确定

图3 液固比对提取量的影响Fig.3 Effect of ratio of solvent to solid on the extraction yield of lycopene
由图3可知,液固比为5∶1(mL/g)时,番茄红素提取量较高,此后加大溶剂用量,提取效果增加不显着;考虑实际生产中溶剂回收损耗、能耗消耗等因素,选择液固比为5∶1(mL/g)[18]。
2.2.3提取时间的确定

图4 提取时间对提取量的影响Fig.4 Effect of extraction time on the extraction yield of lycopene
由图4可知,提取时间的延长有利于番茄红素的有效溶出,随着提取时间的延长,提取量相应升高[19]。当提取时间为45 min时,提取量达到最大,之后延长提取时间,提取量缓慢下降,提取时间为45 min较合适于番茄红素的提取。
2.2.4超声功率的确定

图5 超声功率对提取量的影响Fig.5 Effect of ultrasonic power on the extraction yield of lycopene
由图5可知,超声提取过程中产生的超声能、强烈机械振动和空化效应等作用有利于番茄红素的提取[20],随着超声功率的增大,提取量逐渐提高,超声提取功率为270 W时,番茄红素的提取量达到最大,之后增大超声功率提取效果增加不显着,因此,超声功率选择270 W较合适于番茄红素的提取。
2.3工艺参数的优化
根据Box-Behnken设计原理,以番茄红素提取量为响应值,设计四因素三水平响应面分析试验,试验设计与结果见表1,方差分析见表2。

表1 响应面试验设计及结果Table 1 Experimental designs and results for response surface analysis
以番茄红素提取量为评价指标,用SAS程序进行分析,经回归拟合后,得到番茄红素提取量预测值(Y)对编码自变量X1、X2、X3和X4的回归方程:


表2 方差分析Table 2 Analysis of variance of regression model
用SAS程序对27个试验点的响应值进行回归分析,得回归方程方差分析如表2所示:回归方程描述各因子与响应值关系时,其因变量与自变量之间的线性关系显着,模型的确定系数R2=97.3%,说明回归方程拟合度较好,可用此模型对番茄红素的提取效果进行分析和预测。由表2回归方程系数显着性检验可知:模型一次项X1极显着;二次项极其显着,均处于显着水平。
2.4响应面分析
根据回归方程,分析提取温度、液固比、提取时间、超声功率对番茄红素提取量的影响,响应面等高线分析如图6所示。


图6 超声辅助提取试验等高线图Fig.6 Contours showing the effect of UAE parameters on the extraction yield of lycopene
由图6可知,提取温度在40~51 ℃范围内,提取温度的升高有利于番茄红素的提取,此后提高温度提取量呈下降趋势;液固比在4∶1~6∶1(mL/g)范围内,溶剂用量的增加有利于番茄红素的溶出,提取量逐渐增加;提取时间在33~45 min范围内,提取量随提取时间的延长而提高;番茄红素提取量随超声功率的增加先增加,达到一定值后,呈逐渐下降的趋势。
根据单因素试验和响应面试验设计结果综合分析,超声作用下番茄红素提取的最佳工艺条件为:提取温度50 ℃、提取时间45 min、液固比5∶1(mL/g)、超声功率270 W。在最优条件下进行验证实验,提取量为250.1 mg/kg,和响应面试验优化结果理论值249.0 mg/kg基本一致。
2.5不同提取方法工艺条件比较
不同提取方法工艺条件比较见表3,番茄皮渣经不同提取方法处理后用显微镜观察组织形态如图7所示。

表3 不同提取方法提取效果比较Table 3 Comparison of extraction efficiency between UAE method and the conventional solvent extraction

图7 番茄皮渣组织形态图(×1 000)Fig.7 Micrographs of tomato peel(×1 000)
采用乙醇预处理有利于番茄红素的提取,超声辅助提取较热回流提取,可大大缩短提取时间,避免因提取时间过长而造成的番茄红素氧化损失[21]。由图7番茄皮渣经乙醇、超声处理前后的组织形态图可知,未经处理的番茄皮渣细胞为圆形,细胞壁较厚,颜色较深,经乙醇处理后细胞壁变薄;热回流提取后细胞形状不规则,壁上有许多破损且细胞间隙明显增大;经超声波提取过后细胞上遍布微孔,细胞间隙更加明显[22]。这些宏观表症与各工艺提取作用的机理密切相关,乙醇处理有助于番茄红素的溶出,超声波辅助提取较热回流提取能更有效地破坏细胞结构,增加细胞壁的通透性,从而使有效成分得以快速释放溶出,加速番茄红素的提取[23]。
2.6番茄红素含量的HPLC-MS分析
番茄红素HPLC标准曲线方程为y=187.64x-2.364 6,R2=0.998 6,在1.5~76.0 ☒g/mL范围内具有良好的线性关系[24]。番茄红素标品与提取产物的HPLC测定结果如图8所示。
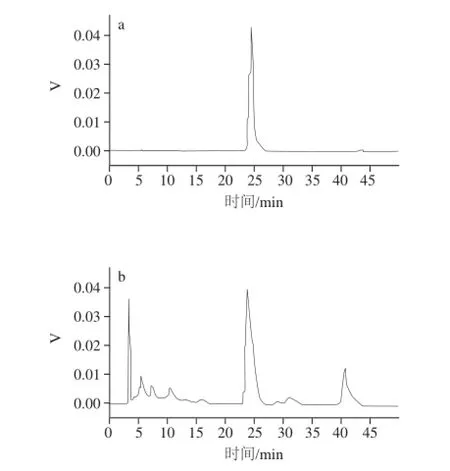
图8 番茄红素标准品(a)与番茄红素提取物(b)的液相色谱图Fig.8 HPLC profiles of lycopene standard (a) and lycopene extracted from tomato peel (b)
经HPLC-MS分析,提取物质谱分析结果如图9所示,提取物m/z为536.15,与番茄红素的相对分子质量536.88一致[25],由此可断定提取物为番茄红素。


图9 番茄红素提取物质谱图Fig.9 Mass spectrum of lycopene extract
3 结 论
超声辅助提取番茄皮渣中番茄红素的最优工艺条件为:95%乙醇对番茄皮预处理后,以乙酸乙酯为提取溶剂,提取温度50 ℃、提取时间45 min、液固比5∶1(mL/g)、超声功率270 W。番茄红素提取量可达到250.1 mg/kg。采用超声辅助提取,超声能量可有效破坏组织结构,加速番茄红素溶出,缩短提取时间,提高提取效率。
[1]李蓓蓓.番茄红素的生理活性研究进展[J].广东药学, 2002, 12(3): 60-62.
[2]韩美清,赵致.番茄红素研究进展及应用前景[J].山地农业生物学报, 2003, 10(5): 45-48.
[3]秦楠.番茄红素的综合研究[J].中国食品添加剂, 2006, 15(1): 71-73.
[4]闫春芳,刘子贻.番茄红素保健功能的研究现状[J].浙江大学学报, 2002, 31(2): 139-142.
[5]张泽生,蔺娜,陈小龙.超声波湿法提取番茄酱中番茄红素工艺的研究[J].食品研究与开发, 2006, 27(10): 185-189.
[6]金声琅,殷涌光.高压脉冲电场辅助提取番茄皮渣的番茄红素[J].农业工程学报, 2010, 36(9): 36-39.
[7]马卡迪,陆维敏.浸提法提取番茄红素工艺的研究[J].食品与发酵工业, 2003, 25(11): 72-74.
[8]陈剑波,郭利平,孟巨光.表面活性剂协同微波辐射萃取番茄红素的研究[J].食品与发酵工业, 2006, 32(12): 161-163.
[9] LEVY J D, SHARONI Y. The tomato carotenoid lycopene and cancer[J]. Food Factors Cancer Prevent, 1995, 213(2): 209-212.
[10] HU M, SKIBSTED L H. Antioxidative capacity of rhizome extract and rhizome kont extract of edible lotus (Nelumbo nufi cera)[J]. Food Chemistry, 2002, 76: 327-333.
[11]孙新虎,李伟,丁霄霖.超声波处理对番茄红素的影响[J].食品与发酵工业, 2003, 29(6): 44-46.
[12]左爱仁,范青生.超声波萃取番茄红素的研究[J].食品工业, 2003, 24(5): 36-38.
[13]张卫强,邓宇.微波辐射萃取番茄红素的研究[J].食品工业科技, 2002, 23(5): 36-37.
[14]孙庆杰,张运涛,肖刚.番茄油树脂中番茄红素的HPLC测定[J].无锡轻工大学学报, 2001, 20(5): 506-509.
[15]陈剑波,孟巨光,谢峰,等.微波法提取番茄红素的工艺研究[J].食品研究与开发, 2006, 25(4): 45-48.
[16]李伟.差示扫描量热法测定番茄红素的纯度[J].食品科学, 2002, 23(9): 87-89.
[17]舒伯.番茄红素的微胶囊化研究[D].上海:上海交通大学, 2005.
[18]赵晓燕.番茄红素的优化萃取及微胶囊化研究[D].乌鲁木齐:新疆农业大学, 2004.
[19]赵功玲,娄天军.酶法提取番茄红素的工艺研究[J].食品工业科技, 2003, 24(4): 60-61.
[20]赵功玲,娄天军,赵大克,等.微波酶法对提取番茄红素的影响效率研究[J].食品与机械, 2004, 20(1): 8-10.
[21]任红霞, 刘海洋, 丰淑红, 等. 番茄红素提取工艺的优化研究[J]. 中国食品添加剂, 2002, 25(5): 33-35.
[22]范永仙.番茄红素的生产工艺研究进展[J].食品科技, 2002, 27(3): 53-55.
[23]刘鑫,熊武,张耀华,等.番茄红素的提取工艺探讨[J].食品研究与开发, 2011, 32(10): 46-50.
[24]左爱仁.番茄红素HPLC测定的研究[J].中国食品添加剂, 2004, 10(1): 106-110.
[25]孙国新.反相高校液相色谱法测定番茄红素[J].中国公共卫生, 2003, 19(12): 15-17.
Lycopene from Tomato Peel: Optimization of Ultrasonic-Assisted Extraction by Response Surface Methodology and Identification by High Performance Liquid Chromatography
WANG Zhenqiang1, LI Xiaokun1, WANG Hao2,*
(1. Department of Environmental and Chemical Engineering, Yellow River Conservancy Technical Institute, Kaifeng 475003, China; 2. Key Laboratory of Food Nutrition and Safety, Ministry of Education, School of Food Engineering and Biological Technology, Tianjin University of Science & Technology, Tianjin 300457, China)
The extraction of lycopene from tomato peal by ultrasonic-assisted extraction (UAE) was studied. To obtain the optimal conditions, the effects of operating conditions such as solvent to solid ratio, ultrasonic power, extraction time and temperature on the extraction yield of lycopene were studied through response surface methodology. The best extraction conditions were determined as follows: pretreatment with 95%ethanol, ethyl acetate as extraction solvent, extraction temperature 50℃, extraction time 45 min, a solvent to solid ratio of 5:1 (mL/g) and ultrasonic power 270 W. Under these conditions 250.1 mg of lycopene was obtained from 1 kg of tomato peal by UAE. The lycopene compositions of extracts were identified by high-performance liquid chromatography-mass spectrometry (HPLC-MS). Compared with the conventional solvent extraction, UAE was more efficient and rapid to extract lycopene from tomato peel, due to the strong disruption of the structure of peel tissue under ultrasonic irradiation, as observed by microscopy.
lycopene; tomato peal; ultrasonic-assisted extraction (UAE); optimization; identification
TS202.3
A
1002-6630(2015)12-0070-06
10.7506/spkx1002-6630-201512013
2015-01-06
王振强(1979—),男,讲师,硕士,主要从事食品检测分析教学与研究。E-mail:wangzhenqiang_42@163.com
*通信作者:王浩(1979—),男,副教授,博士,主要从事食品营养与安全教学与研究。E-mail:46654859@qq.com



