岳四海,刘献志,张宏凤
(郑州大学第一附属医院神经外科/郑州市神经病学重点实验室 450000)
动脉瘤性蛛网膜下腔出血是一种具有较高病死率与病残率的神经外科急症,近年来大量的基础及临床研究表明早期脑损伤(early brain injury,EBI)可能在蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后的病理进程中起着重要的作用,这使得近年来人们的注意力开始转向SAH后的EBI[1]。EBI包含众多病理机制,其中血脑屏障(blood brain barrier,BBB)的破坏是EBI的重要病理机制之一,而导致BBB破坏的诸多因素中细胞外基质的损伤非常重要[2-3]。ADAMTS-4(a disintegrin-like and metalloproteinase with thrombospondin type l motifs-4)是ADAMTSs家族中一员,是一种新发现的金属蛋白酶,ADAMTS-4可通过降解细胞外基质参与多种病理生理过程[4],本研究旨在对ADAMTS-4在SAH后早期脑损伤中的作用进行初步探讨。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠72只,体质量250~300 g。大鼠随机分为对照组和SAH组,其中对照组共12只,6只用于检测ADAMTS-4mRNA及蛋白表达水平,6只用于血脑屏障通透性检测,且均于术后72h处死。SAH组(60只),按处死时间6、12、24、48、72h分为5个亚组。
1.2 方法
1.2.1 SAH模型的制作 采用改良的Sheffield大鼠SAH模型[5],向颈内动脉插入长约5cm前端锐化的3-0尼龙线,SAH组在插入2.0~2.5cm时多感到明显阻力,克服阻力再插入2mm后,迅速退出尼龙线,恢复颈内动脉血流并结扎颈外动脉残端,缝合颈部切口,对照组插入尼龙线约1.5~2.0 cm后不再继续插入。
1.2.2 大鼠海马组织ADAMTS-1的 Western blotting分析 提取含30μg蛋白的样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳。加入 Anti-ADAMTS-4(1∶1000,Abcam,美国)并4℃孵育过夜,羊抗鼠IgG-HRP(1∶2000,中杉金桥,中国)室温孵育2h,显色后由quantityone软件系统计算ADAMTS-4和β-actin的光密度值,二者比值作为该样品ADAMTS-1蛋白的表达量。
1.2.3 ADAMTS-4的mRNA的检测 按Trizol试剂盒说明提取海马组织总RNA。根据RNA浓度(μg/mL)=OD206×40μg/mL×稀释倍数,计算RNA浓度。采用两步法逆转录-PCR(RT-PCR)试剂盒配置反应体系。ADAMTS-4上游引物:5′-GTG AAT ACA CGC TGA TGC C-3′下游引物:5′-AGC CGG GAC AGT GAG GTT-3′扩增片断为312bp。内参GAPDH 上游引物:5′-GTG CTG AGT ATG TCG TGG AGT CT-3′,下游引物:5′-GTG GAA GAA TGG GAG TTG CTG T-3′扩增片段610bp。RT-PCR产物在2% 琼脂糖凝胶上电泳,采用quantity-one图像处理系统分析比较电泳条带相对光密度值。
1.2.4 脑伊文氏蓝(Evans blue,EB)浓度的检测 经股静脉注向已麻醉大鼠注射2%EB(5mL/kg),1h后经左心室注入37℃生理盐水,待流出液清亮后迅速断头取脑,置37℃恒温水浴箱中,48h后离心取上清液,紫外分光光度计波长632nm比色测定吸光度(OD)值,根据标准曲线计算脑组织EB浓度(mg/g脑湿重)。
1.2.5 α2巨球蛋白抑制ADAMTS-4表达在EBI病理过程中的作用 此部分研究共分为3个组,分别为:假手术组、药物干预组和非干预组,每组各6只SD大鼠,模型制作方法同上,药物干预组为:术后股静脉注射ADAMTS-4抑制剂α2巨球蛋白每次120mg,每12小时1次。各组大鼠均于术后48h后处死,分别进行蛋白提取测定及EB浓度检测,方法同上。比较3组的蛋白表达及EB浓度,进一步检测ADAMTS-4在SAH后的EBI过程中对血脑屏障的作用。
1.3 统计学处理 采用SPSS13.0统计软件进行数据分析,计量资料用表示,多组间均数的比较采用单因素方差分析,用LSD-t检验比较两组间的差异,变量之间采用pearson相关分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠海马组织ADAMTS-4蛋白表达水平变化 SAH后6、12h组与对照组相比差异无统计学意义(P>0.05);SAH后24hADAMTS-4蛋白与对照组相比表达显着增高(P<0.05);SAH后72hADAMTS-4蛋白活性仍然维持在较高水平,与对照组相比差异有统计学意义(P<0.05)。见图1、表1。
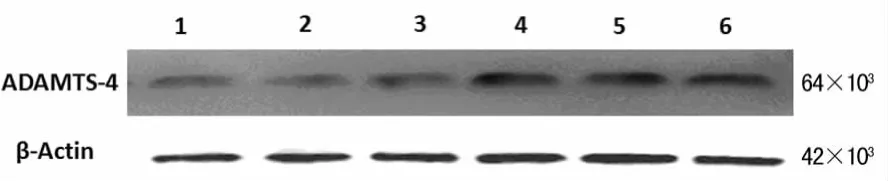
图1 Western blotting检测各组ADAMTS-4及β-Actin的表达
2.2 大鼠海马组织ADAMTS-4mRNA表达变化 SAH 后6、12h组大鼠海马组织ADAMTS-4mRNA表达与对照组相比差异无统计学意义(P>0.05);SAH 后24hADAMTS-4 mRNA表达开始增高,与对照组相比差异有统计学意义(P<0.05);SAH 后48hADAMTS-4mRNA 表达 达到高峰;72h ADAMTS-4mRNA表达较48h开始下降,与对照组相比差异有统计学意义(P<0.05)。见图2、表1。
2.3 SAH后大鼠血脑屏障通透性改变 SAH后12hEB浓度较对照组开始显着增加(P<0.05);SAH后48hEB浓度最高,72hEB浓度较48h有所降低但仍维持在较高水平,与对照组相比差异有统计学意义(P<0.05),见表1。
2.4 大鼠海马ADAMTS-4蛋白表达与脑内EB浓度的相关性 SAH后ADAMTS-4蛋白表达与脑内EB浓度整体呈正相关(r=0.917,P<0.05)。
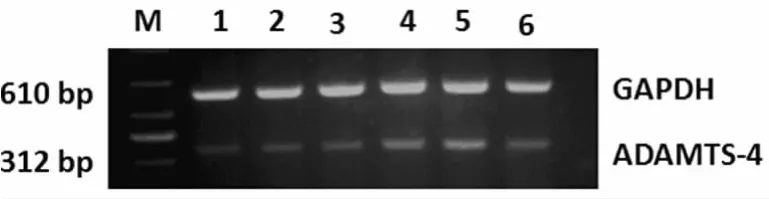
图2 RT-PCR检测每组 ADAMTS-4及GAPDH的mRNA的表达
表1 ADAMTS-4mRNA和蛋白的表达变化及大鼠脑内EB浓度的变化()
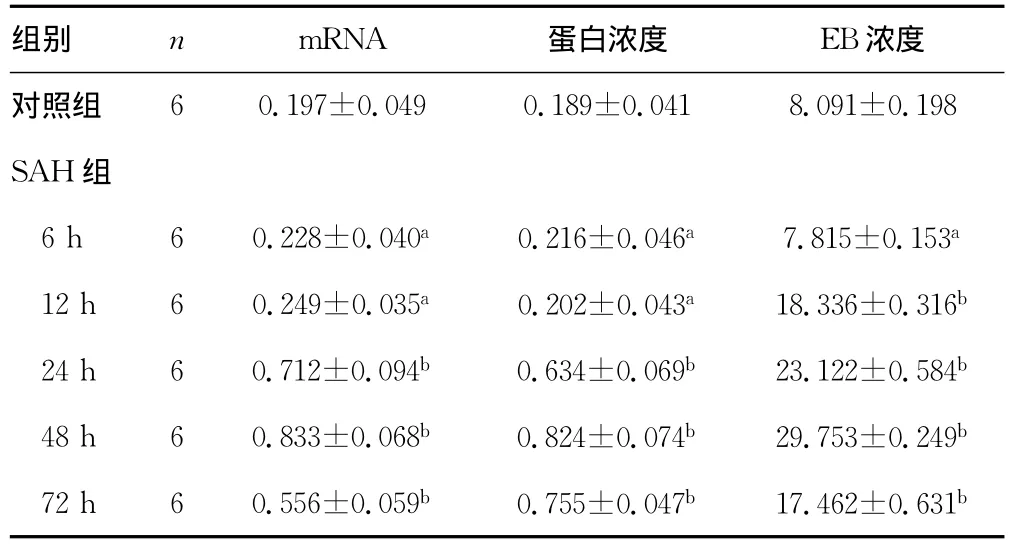
表1 ADAMTS-4mRNA和蛋白的表达变化及大鼠脑内EB浓度的变化()
a:P<0.05:与SAH后24h相比;b:P<0.05,与对照组相比。
组别 n mRNA 蛋白浓度 EB 60.197±0.049 0.189±0.041 8.091±0.198 SAH组6h 60.228±0.040a 0.216±0.046a 7.815±0.153a 12h 60.249±0.035a 0.202±0.043a 18.336±0.316b 24h 60.712±0.094b 0.634±0.069b 23.122±0.584b 48h 60.833±0.068b 0.824±0.074b 29.753±0.249b 72h 60.556±0.059b 0.755±0.047b 17.462±0.631浓度对照组b
2.5 α2巨球蛋白干预后ADAMTS-4的蛋白表达及EB浓度的变化 经α2巨球蛋白干预后,SAH后48hADAMTS-4蛋白表达较非干预组明显降低,差异有统计学意义(P<0.05)。且干预组脑内EB浓度较非干预组亦有显着减少(P<0.05)。见图3、表2。
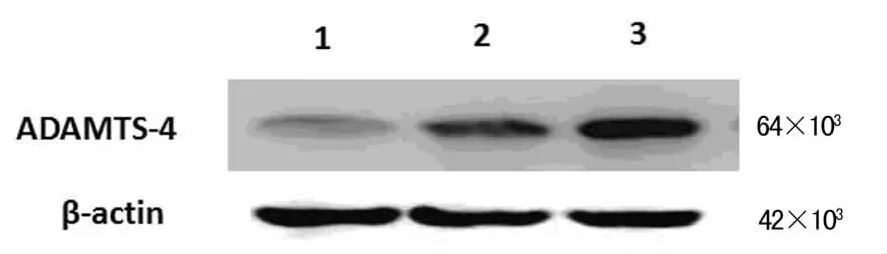
图3 Western blotting检测各组ADAMTS-4及β-Actin的表达
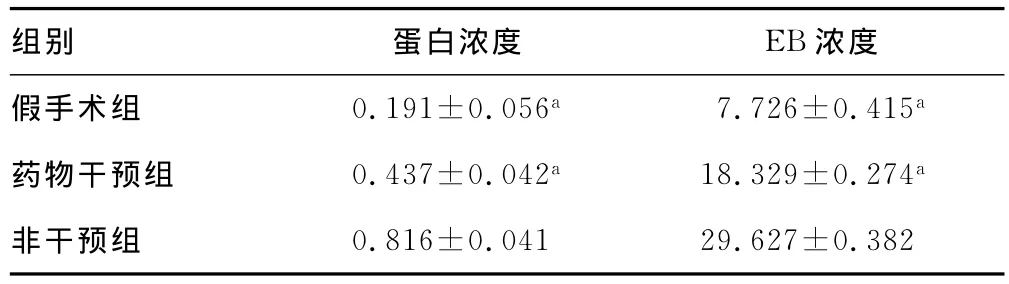
表2 ADAMTS-4蛋白的表达变化及大鼠脑内EB浓度的变化
3 讨 论
自发性SAH是一种严重的神经外科急症,颅内动脉瘤破裂是自发性SAH的最主要原因[6]。近年来SAH后EBI越来越引起人们的重视,并认为其在SAH后的病理进程中起着重要的作用,EBI指的是SAH后72h以内脑内所发生的病理改变,其包含众多复杂病理机制,如包括颅内压升高、脑灌注压降低、血脑屏障破坏、血管收缩、细胞死亡途径的激活、坏死、凋亡及自噬性死亡离子稳态的失衡、NO/NOS途径的活化、氧化应激、炎症因子释放等[7-9],其中BBB的破坏是EBI的重要组成部分,其早期功能障碍促进了脑水肿的发生,而细胞外基质的降解是导致BBB破坏的重要原因[10]。ADAMTS意为含I型血小板结合蛋白基序(TSP)的解聚蛋白样金属蛋白酶,是继基质金属蛋白酶MMPs后新发现的一类Zn2+依赖的分泌型金属蛋白酶,ADAMTS-4的功能是ADAMTSs中研究较为透彻的成员之一,可以特异性降解aggrecan,brivecan和versican[11-13]。目前已知的ADAMTS酶系的调节机制是它可以被金属蛋白酶抑制剂调节,其中金属蛋白酶抑制剂(TIMP)是内源性的,且金属蛋白酶抑制剂TIMP-3及α2巨球蛋白是ADAMTS-4和-5的重要的抑制剂[17]。有研究显示在恶性胶质瘤中,ADAMTS-4的表达水平明显升高,通过降解brivecan,介导了神经胶质瘤的侵袭与转移[14-15]。Cross等[16]研究显示早期脑梗死时ADAMTS-4表达上调,并参与破坏了BBB的完整性。但有关SAH后EBI中ADAMTS-4与BBB的关系尚未见报道。
本研究采用改良的血管内穿刺法建立大鼠SAH的动物模型,定量检测了ADAMTS-4在SAH后72h内多个时间点的表达,同时与之对应的检测了大鼠脑内EB浓度以衡量其BBB的变化。结果显示ADAMTS-4的mRNA和蛋白表达高峰均出现在出血后48h,且此时EB浓度亦达到最大值。统计分析证实:SAH后早期大鼠脑内EB浓度与ADAMTS-4蛋白活性呈正相关,提示SAH后大鼠BBB损害可能与ADAMTS-4降解细胞外基质,导致BBB结构破坏有关。随后通过应用ADAMTS-4抑制剂α2巨球蛋白进行干预,并检测干预后ADAMTS-4的蛋白表达与脑内EB浓度变化,进一步证实ADAMTS-4可能参与了SAH后BBB的损害这一病理过程。
ADAMTSs底物谱相对基质金属蛋白酶MMPs选择性较高、特异性较强,所以进一步深入研究ADAMTS-4在SAH后EBI及整个病理过程中的相关机制,可能为SAH的治疗提供新的方向。
[1]Luo C,Yi B,Tao G,et al.Adenosine a3receptor agonist reduces early brain injury in subarachnoid haemorrhage[J].Neuroreport,2010,21(13):892-896.
[2]Duris K,Manaenko A,Suzuki H,et al.α7nicotinic acetylcholine receptor agonist PNU-282987attenuates early brain injury in a perforation model of subarachnoid hemorrhage in rats[J].Stroke,2011,42(12):3530-3536.
[3]Lee JY,Keep RF,Hua Y,et al.Deferoxamine reduces early brain injury following subarachnoid hemorrhage[J].Acta Neurochir Suppl,2011,112:101-106.
[4]Haddock G,Cross AK,Plumb J,et al.Expression of ADAMTS-1,-4,-5and TIMP-3in normal and multiple sclerosis CNS white matter[J].Mult Scler,2006,12(4):386-396.
[5]Ansar S,Svendgaard NA,Edvinsson L.Neurokinin-1receptor antagonism in a rat model of subarachnoid hemorrhage:prevention of upregulation of contractile ETB and 5-HT1Breceptors and cerebral blood flow reduction[J].J Neurosurg,2007,106(5):881-886.
[6]Velat GJ,Kimball MM,Mocco JD,et al.Vasospasm after aneurysmal subarachnoid hemorrhage:review of randomized controlled trials and meta-analyses in the literature[J].World Neurosurg,2011,76(5):446-454.
[7]Wan H,Loch Macdonald R.Circulatory and vascular changes after aneurysmal subarachnoid hemorrhage[J].J Neurosurg Sci,2011,55(4):329-341.
[8]Sehba FA,Bederson JB.Nitric oxide in early brain injury after subarachnoid hemorrhage[J].Acta Neurochir Suppl,2011,110(Pt 1):99-103.
[9]Hasegawa Y,Suzuki H,Sherchan P,et al.Tyrosine phosphatase inhibition attenuates early brain injury after subarachnoid hemorrhage in rats[J].Acta Neurochir Suppl,2011,110(Pt 1):67-70.
[10]Loftspring MC.Iron and early brain injury after subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2010,30(11):1791-1792.
[11]Moncada-Pazos A,Obaya AJ,Viloria CG,et al.The nutraceutical flavonoid luteolin inhibits ADAMTS-4and ADAMTS-5aggrecanase activities[J].J Mol Med,2011,89(6):611-619.
[12]Wayne GJ,Deng SJ,Amour A,et al.TIMP-3inhibition of ADAMTS-4(Aggrecanase-1)is modulated by interactions between aggrecan and the C-terminal domain of ADAMTS-4[J].Biol Chem,2007,282(29):20991-20998.
[13]Liacini A,Zafarullah M,Induction of ADAMTS-4by interleukin-1:comment on the article by Pratta et al[J].Arthritis rheum,2004,50(6):2038-2039.
[14]Tortorella MD,Arner EC,Hills R,et al.Alpha2-macroglobulin is a novel substrate for ADAMTS-4and ADAMTS-5and represents an endogenous inhibitor of these enzymes[J].Biol Chem,2004,279(17):17554-17561.
[15]Cudic M,Burstein GD,Fields GB,et al.Analysis of flavonoid-based pharmacophores that inhibit aggrecanases(ADAMTS-4and ADAMTS-5)and matrix metalloproteinases through the use of topologically constrained peptide substrates[J].Chem Biol Drug Des,2009,74(5):473-482.
[16]Cross AK,Haddock G,Stock CJ,et al.ADAMTS-1and-4are up-regulated following transient middle cerebral artery occlusion in the rat and their expression is modulated by TNF in cultured astrocytes[J].Brain Res,2006,1088(1):19-30.
[17]Glasson SS,Askew R,Sheppard B,et al.Deletion of active ADAMTS5prevents cartilage degradation in a murine model of osteoarthritis[J].Nature,2005,434(7033):644-648.



