杨 丽,杨冬平,孙 静,董 玲,陈建波
(1.北京中医药大学,北京 100029;2.中国中医科学院中药研究所,北京 100700)
大黄药用历史悠久,始载于《神农本草经》,有泻下攻积、清热泻火、利湿退黄、凉血解毒、逐瘀通经之效,因其功效独特而被广泛应用于内科、外科、妇科、儿科、骨伤科等各科[1]。大黄泻下作用较强,是治疗积滞便秘的要药,其中热结便秘尤为适宜[2]。因大黄生品苦寒,容易损伤脾胃,历代医家往往通过炮制改变其药性,以增强药物疗效,纠正其偏性[3],扩大临床应用范围。大黄炭是大黄的炮制品之一[4],其降低了大黄泻下的作用,保留并增强凉血化瘀等功效[5]。然而,由于缺乏具体的客观量化指标来衡量炒炭的程度[6-7],大黄炭在炮制过程中的火候和时间很难准确把握,导致市场上大黄炭的化学成分含量差异较大,难以充分保障临床用药的安全性和有效性。
从古至今,药工通常以判断大黄炭“表面焦黑色、内部焦褐色”为炮制适中的条件,而这种判断方式仅靠人工观察颜色,不仅没有客观量化指标,也没有从药效物质方面阐释颜色判断的合理性。同时,2020年版《中华人民共和国药典》质量标准检测的大黄炭指标成分与生大黄一致,规定大黄炭总蒽醌含量不得少于0.9%,游离蒽醌不得少于0.5%[4],只是二者的最低含量发生了变化。大黄炭具有凉血、化瘀、止血的多重功效,通过单一的化学成分来表征大黄炭的质量不够完善[8-10]。所以,本研究尝试从质量标志物的角度,找出可反映大黄炒炭前后药效变化的标志性成分,通过进一步研究这些标志性成分与颜色的量化关系,为大黄炒炭的终点判断提供合理、客观的理化指标。
1 材料
1.1 药材与试剂 原药材采集于四川省成都大顺中药材责任有限公司,采集前均经过厂家阴干处理。经中国中药协会首席科学家张世臣教授鉴定为蓼科植物掌叶大黄Rheum palmatumL.、药用大黄Rheum officinaleBaill. 的干燥根和根茎。
没食子酸(批号:201605,纯度:98%)、5-HMF(批号:H12M9Z61023,纯度:98%)、番泻苷A(批号:P01S8F42887,纯度:98%)和番泻苷B(批号:P20A9F59262,纯度:98%)均购自上海源叶生物科技有限公司。芦荟大黄素-8-O-β-D葡萄糖苷(批号:6457,纯度:98.4%)、大黄酸-8-O-β-D葡萄糖苷(批号:6474,纯度:99.4%)、大黄酚-8-O-β-D葡萄糖苷(批号:6473,纯度:99.3%)、大黄素-8-O-β-D葡萄糖苷(批号:6443,纯度:99.2%)和大黄素甲醚-8-O-β-D葡萄糖苷(批号:6551,纯度:99.1%)均购自上海诗丹德生物技术有限公司;芦荟大黄素(批号:110795-201710,纯度:98.1%)、大黄酸(批号:110757-201607,纯度:99.3%)、大黄素(批号:110756-201512,纯度:98.7%)、大黄酚(批号:110796-201621,纯度:99.2%)和大黄素甲醚(批号:110758-201616,纯度:99.0%)均购自中国食品药品检定研究院;分析纯甲醇(批号:190214)购自广东省精细化学品工程技术研究开发中心;色谱级甲醇(批号:191614)购自赛默飞世尔科技(中国)有限公司;分析纯醋酸(批号:20171026)、分析纯磷酸(批号:20170225)均购自北京化工厂;娃哈哈纯净水购自杭州娃哈哈集团有限公司;去离子水自制。
1.2 仪器 LC-20AT高效液相色谱仪,配备SPD-20A型紫外检测器、SIL-20A自动进样器(日本岛津公司);DHG-9070C型烘箱(上海培因实验仪器有限公司);BJ-800A型多功能粉碎机(拜尔);BT-25S电子分析天平[赛多利斯科学仪器(北京)有限公司];KH7200DB型数控超声波清洗器(昆山超声仪器有限公司)。
2 方法
2.1 网络药理学预测 首先进行网络药理学研究,即通过TCMSP[11]、TCM@Taiwan及TCMID数据库平台[12],输入大黄的中药名称,搜索后得到大黄的化学成分,以口服生物利用度(OB)及类药性(DL)的筛选条件(OB≥30%,DL≥0.18)进行筛选。除此之外,查阅文献资料,找到因上述筛选条件而被删除但对大黄炭的研究有一定潜在价值的化学成分,再通过TCMSP数据库,将文献搜索的结果进行筛选,得到药物潜在靶点。采用DAVID 6.7数据平台对所收集到的有效成分进行KEGG通路富集分析[13],预测基因功能与差异基因所在的信号通路。为进一步明确大黄炭活性成分、潜在靶点与通路之间的相互作用,将活性成分利用DAVID 6.8数据库将筛选出的核心靶点进行生物信息分析,对大黄炭的KEGG通路进行富集分析,并以P<0.05作为显着功能与通路的临界值,通过Cytoscape 3.7.2软件构建药物-成分-靶点-通路的互作网络,并分析关键通路的靶点和所涉及的主要生物活性成分,得出大黄炭的活性成分。
2.2 样品制备 分别称取100 g掌叶大黄和药用大黄各31份样品饮片,运用烘箱分别在160、180、200、220、240 ℃下加热10、20、30、40、50、60 min,待样品冷却后称重。取一定量样品粉碎后测定色度值和没食子酸、5-HMF、芦荟大黄素-8-O-β-D-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、番泻苷A、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的化学成分含量。
2.3 含量测定 色谱柱:Kromasil C18色谱柱(4.6 mm×250 mm,5 μm),检测波长为260 nm,体积流量为1 mL/min,进样量为10 μL,柱温35 ℃。以1%磷酸水溶液(A)-甲醇(B)为流动相,梯度洗脱程序:0~25 min:5%B~30%B;25~40 min:30%B~60%B;40~60 min:60%B~60%B;60~70 min:60%B~100%B;70~95 min:100%B~100%B。
2.3.1 对照品溶液的制备 精密称取14种对照品适量,分别置于若干个25 mL和50 mL容量瓶中,加70%的甲醇溶解,摇匀,配制成对照品溶液,质量浓度分别为没食子酸0.003~0.120mg/mL、5-HMF为0.002 5~0.050 0 mg/mL、芦荟大黄素-8-O-β-D-葡萄糖苷0.002 8~0.280 0 mg/mL、大黄酸-8-O-β-D-葡萄糖苷0.006 5~0.2500mg/mL、大黄素-8-O-β-D-葡萄糖苷0.012~0.240 mg/mL、大黄酚-8-O-β-D-葡萄糖苷0.008~0.160 mg/mL、大黄素甲醚-8-O-β-D-葡萄糖苷0.008~0.160 mg/mL、番泻苷A0.028~0.560 mg/mL、番泻苷B0.01~0.14 mg/mL、芦荟大黄素0.005~0.200 mg/mL、大黄酸0.009~0.270 mg/mL、大黄素0.001~0.080 mg/mL、大黄酚0.01~0.40 mg/mL、大黄素甲醚0.007~0.210 mg/mL。
2.3.2 供试品溶液的制备 将不同批次的样品粉碎过5号筛后,分别准确称取各批次粉末0.25 g,置于50 mL锥形瓶中,精密加入25 mL 70%甲醇,称定质量后超声处理30 min,超声功率为400 W,频率为30 kHz,超声结束后放冷再次称定质量,用70%甲醇补足至超声前的质量。采用0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.4 体外抗炎活性评价 本部分基于中医理论,选择大黄炭“凉血化瘀”的传统功效,以广泛应用于抗炎活性药物筛选的LPS诱导的人脐静脉血管内皮细胞(human umbilical vein endothelium cells,HUVEC)作为“凉血化瘀”体外研究模型[14]。将所筛选得到的潜在质量标志物作用于细胞模型,进一步筛选出潜在质量标志物的生物活性差异。
2.5 色度测定 将紫外可见分光光度计起止波长设为780~380 nm;测量时按设定的条件进行基线校正操作,校正完成后取出样品的标准白板,取适量大黄加热样品粉末(过五号筛)压制于石英测色皿中,盖上石英玻璃片。然后将石英玻璃片与石英皿外侧用擦镜纸擦拭干净放入测量仪中进行测量,变换位置,平行3次拍照,计录样品颜色的L*、a*、b*数值。
2.6 数据分析 通过SPSS、SIMCA 14.1、GraphPad Prism 8.0.2等软件对样品所得生物活性结果、化学成分含量和颜色量化值进行数值的关联性分析和数学模型建立。
3 结果
3.1 大黄炭潜在质量标志物筛选
3.1.1 大黄炭的化学成分及靶点信息 通过TCMSP等数据库和文献共检索到大黄炭的成分86个,包括没食子酸、大黄酸等。接着从TCMSP数据库中获取每种活性成分的靶蛋白,将相关靶点合并去重后共得到121个相关靶点,主要包括白细胞介素-6(IL-6)、细胞间黏附分子1(ICAM1)等炎症因子,还有花生四烯酸盐-脂氧合酶、腺苷受体A1、丝氨酸/苏氨酸蛋白激酶ATR及PI3激酶等。
3.1.2 KEGG通路富集 为了阐明大黄炭靶点的生物学功能,利用David数据库对所得靶点进行了KEGG通路富集。KEGG通路富集分析共得到75条通路。其中24条通路的P<0.05,见图1。大黄炭化学成分与乙型肝炎(Hepatitis B)、TNF信号通路(TNF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、胰岛素抵抗(Insulin resistance)等疾病通路关系密切。其中以TNF和MAPK通路为代表的多个疾病相关通路均与调控炎症活性相关,抗炎相关通路在数量上占据优势且具有较高的富集因子值(Rich Factor)。大黄炭中的化学成分可能主要通过这些炎症通路发挥作用,进而影响多种疾病的生理过程。
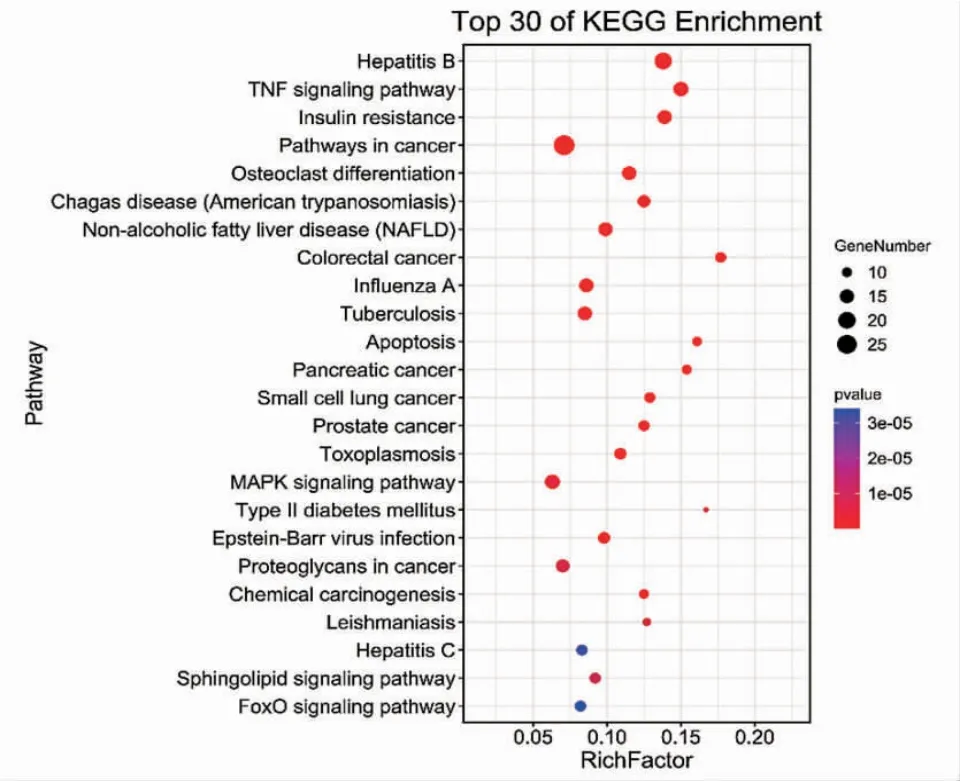
图1 大黄炭通路气泡图
3.1.3 基于大黄炭活性成分、作用靶标的质量标志物初步预测 通过Cytoscape3.7.2软件建立大黄炭“成分-靶标-通路”网络关系(见图2),并对结果进行综合分析。结果显示,没食子酸、大黄酸、芦荟大黄素、大黄素、儿茶素、槲皮素的靶点、通路呈高度相关,推测其在功效上存在叠加效应。而5-HMF具有相对独立的靶点ADH1B和ADH1C,可能是通过不同的靶点发挥药效,其他化合物则没有作用靶点或作用靶点较少。在以上这6种化合物中,因槲皮素在多种中药中均有所分布[15],并且其药理作用广泛[16],故选择暂不纳入大黄炭的化学指标中。此外,由于没食子酸和儿茶素在止血方面的作用机理一致[17],故选择现代研究方法较多、范围较广的没食子酸作为大黄炭的药效成分。最后网络药理学部分验证出可将没食子酸、5-HMF、大黄酸、芦荟大黄素、大黄素初步作为大黄炭的潜在质量标志物。
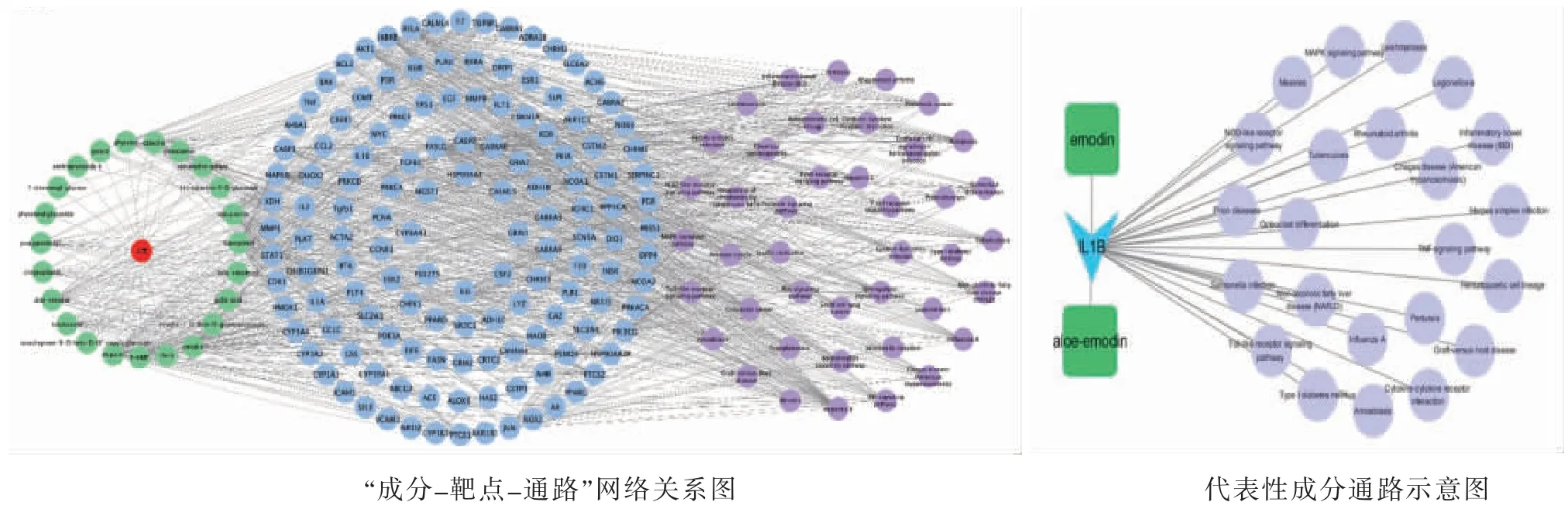
图2 大黄炭“成分-靶标-通路”网络关系图
3.1.4 含量测定方法学考察
3.1.4.1 线性关系考察 将“2.3.1”项下的对照品溶液分别按一定的倍数稀释为一系列不同质量浓度的对照品溶液,采用0.22 μm微孔滤膜滤过后分别进样测定,每次10.0 μL,检测完毕后记录各个待测物质的色谱峰面积。以进样质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制各个成分的标准曲线。结果表明14个待测成分在一定进样质量浓度范围内,峰面积与质量浓度呈良好的线性关系。(见表1)
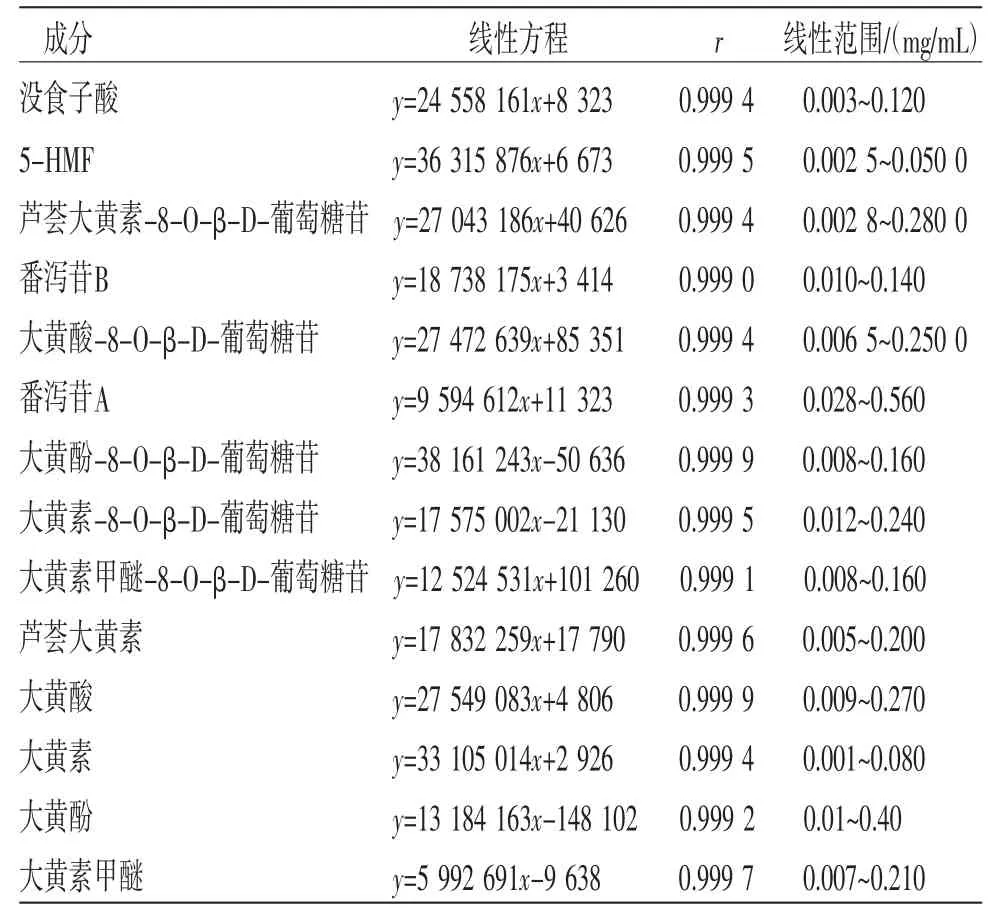
表1 18 批样品中14 种成分的线性考察结果
3.1.4.2 精密度试验 取同一混合对照品溶液,连续进样6次,每次10.0 μL,记录各待测成分的色谱峰面积。结果显示没食子酸、5-HMF、芦荟大黄素-8-O-β-D-葡萄糖苷、番泻苷B、大黄酸-8-O-β-D-葡萄糖苷、番泻苷A、大黄酚-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚14个待测物质峰面积的RSD值分别为0.40%、0.45%、0.40%、0.65%、0.34%、1.08%、0.87%、1.28%、1.78%、0.36%、0.85%、1.75%、0.82%、1.80%,均小于2.00%,表明仪器的精密度良好。
3.1.4.3 稳定性试验 取同一供试品溶液,分别于制备后0、2、4、6、12、24 h内进样测定,记录各待测物质的色谱峰面积,计算没食子酸、5-HMF、芦荟大黄素-8-O-β-D-葡萄糖苷、番泻苷B、大黄酸-8-O-β-D-葡萄糖苷、番泻苷A、大黄酚-8-Oβ-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚14个待测物质峰面积的RSD值。结果显示,14个待测物质在24 h内色谱峰面积的RSD值均小于3.00%,表明供试品溶液在24 h内稳定性良好。
3.1.4.4 重复性试验 取同一批次(S2)的大黄样品粉末0.25 g(过5号筛),共6份,精密称定,按照“2.3”项下方法制备供试品溶液。准确吸取各供试品溶液各10.0 μL注入HPLC进行测定,记录各色谱峰面积。结果显示6份供试溶液中没食子酸、5-HMF、芦荟大黄素-8-O-β-D-葡萄糖苷、番泻苷B、大黄酸-8-O-β-D-葡萄糖苷、番泻苷A、大黄酚-8-O-β-D-葡萄糖苷、大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的RSD值分别为0.68%、0.73%、0.85%、0.78%、0.28%、0.79%、1.95%、2.13%、1.42%、1.71%、1.79%、1.29%、1.52%、2.54%。
3.1.4.5 加样回收率试验 取同一批次已测定的大黄样品(S2)粉末0.10 g(过5号筛),精密称定,置于50 mL棕色量瓶中,分别加入相同质量的对照品物质,最后加入70%甲醇溶液25 mL,按照“2.3”项方法制备供试品溶液,进样测定各成分的色谱峰面积,计算含量和回收率。结果显示14个待测成分的平均回收率为95.78%~102.84%,RSD值为3.25%~4.98%,表明方法的准确性较好。
3.1.5 基于抗炎活性筛选大黄炭的潜在质量标志物 以文献内容为基础,本部分增加了大黄酚和大黄素甲醚2个游离蒽醌类化合物,同时增加了与游离蒽醌可互相转化[18]、具有泻下作用的结合蒽醌大黄酸-8-O-β-D-葡萄糖苷、大黄素-8-Oβ-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷、芦荟大黄素-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷,且泻下成分番泻苷A和番泻苷B[19]同时作为大黄炭的潜在质量标志物。结合网络药理学中没食子酸、5-HMF、大黄酸、芦荟大黄素、大黄素共14个成分作为大黄炭的潜在质量标志物,通过研究潜在质量标志物的抗炎活性进一步筛选大黄炭的质量标志物。
研究表明,大黄酸在大黄中含量最高,且是游离蒽醌类成分入血后体内的主要存在形式[20],故选取大黄酸及其苷类大黄酸-8-O-β-D-葡萄糖苷,同时选取泻下成分番泻苷A、止血作用的没食子酸和颜色相关的成分5-HMF[7]共5类成分为化学指标进行大黄炭“凉血化瘀”的生物活性的研究。其中,大黄酸浓度为1~50 μmol/L(浓度为100 μmol/L时有细胞毒性),大黄酸-8-O-β-D-葡萄糖苷为1~100 μmol/L,其他成分浓度为1~200 μmol/L。
各化合物对肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和NO释放量的作用所得结果见图3。其中游离蒽醌大黄酸及结合蒽醌大黄酸-8-O-β-D-葡萄糖苷均随着浓度的增加,对TNF-α、IL-1β和NO释放量的抑制作用增加,与模型组比较,差异均有统计学意义(P<0.05)。没食子酸、5-HMF和番泻苷A不同浓度中,抑制TNF-α、IL-1β和NO作用在较低浓度下无差异(P>0.05),而在较高浓度100 μmol/L和200 μmol/L时,各指标均具有差异(P<0.001)。比较5个化合物抑制TNF-α、IL-1β和NO释放量的水平,在相同浓度下大黄酸抑制作用最强,大黄酸-8-O-β-D-葡萄糖苷次之,没食子酸、5-HMF和番泻苷A的抑制作用最弱。因此,推测相同浓度下抗炎活性强弱为:游离蒽醌>结合蒽醌>没食子酸、5-HMF和番泻苷。说明游离蒽醌在大黄炭发挥抗炎作用时是起到主要作用的一类化合物。
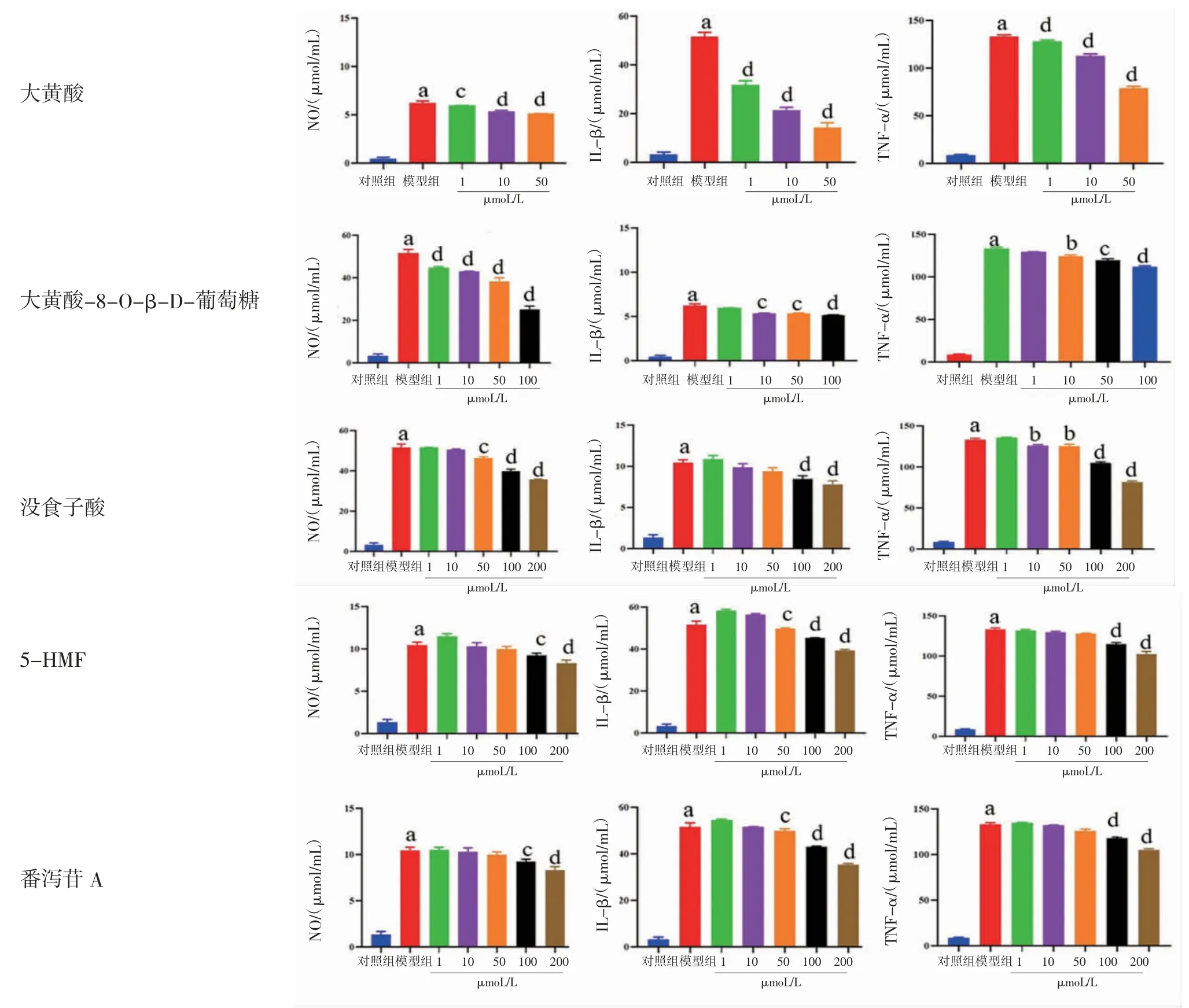
图3 各化合物对LPS 诱导的HUVEC 细胞NO、IL-1β 和TNF-α 释放量的影响 (,n=3)
3.2 大黄炭潜在质量标志物与炮制过程颜色变化的关联性
3.2.1 大黄炭潜在质量标志物在加热过程中的变化规律 通过HPLC法测得没食子酸、5-HMF等14种化学成分含量,掌叶大黄和药用大黄各成分总含量见图4~5。掌叶大黄结果表明,大黄在不同条件加热过程中14种化合物呈两种模式的变化模式,即在180 ℃和200 ℃温度下,加热前期游离蒽醌、5-HMF和没食子酸含量出现峰值,后随着加热时间的延长,三者含量均下降,呈先增加后减少的变化模式。在160 ℃和240 ℃温度下,主要泻下成分番泻苷和结合蒽醌均呈单向递减的变化模式,表明炒炭减弱了大黄泻下的作用。此外在160 ℃和240 ℃时没食子酸、5-HMF或游离蒽醌呈递增或递减的模式,说明加热不及时成分未被完全分解而未达到含量最大值,或加热太过时成分被破坏。同样药用大黄在加热过程中14种化合物也呈两种变化模式,在180 ℃和200 ℃温度下,随着加热时间的延长,没食子酸、5-HMF和游离蒽醌呈先增加后减少的变化模式,番泻苷和结合蒽醌则均呈单项递减的变化模式。
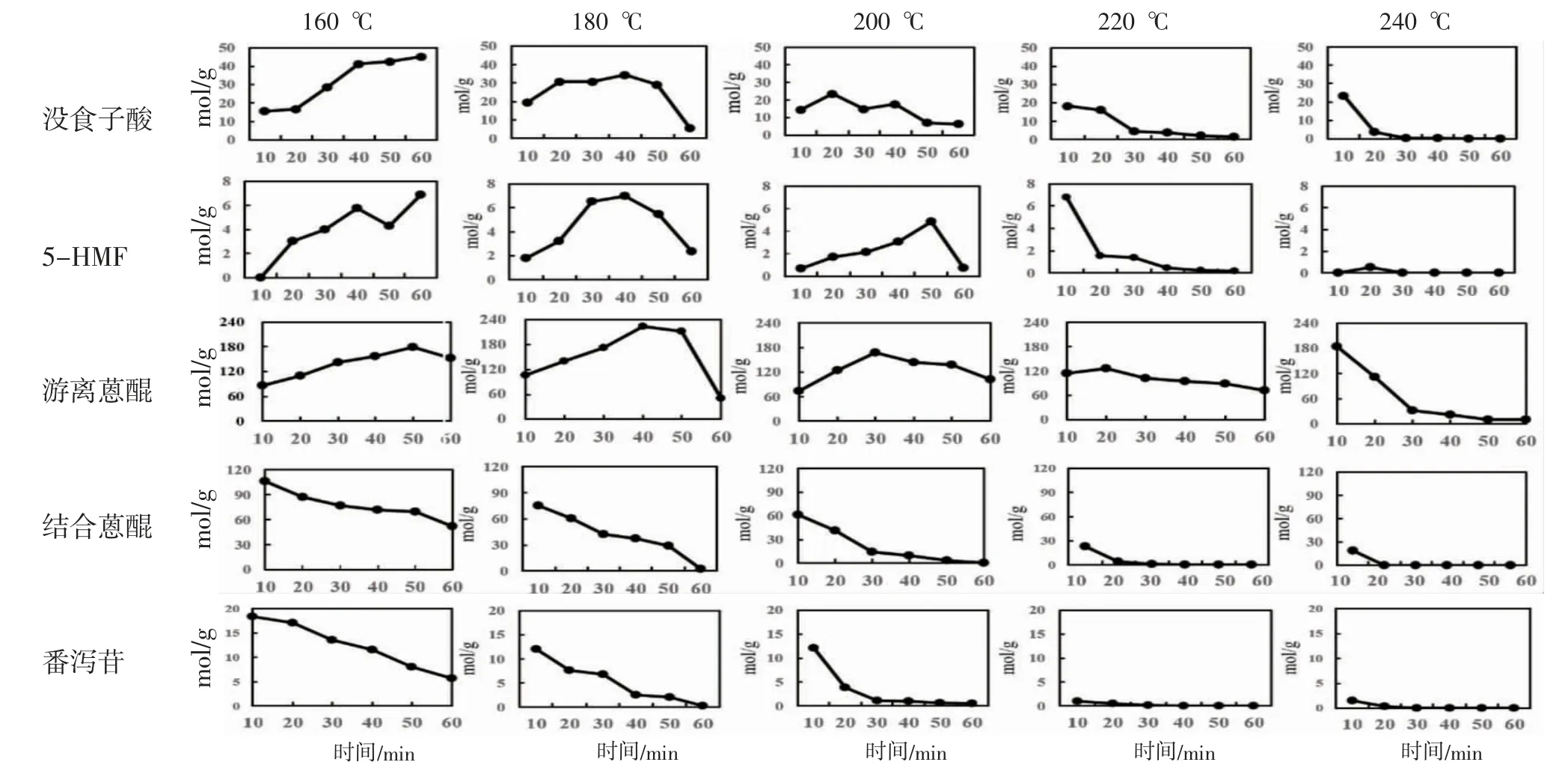
图4 掌叶大黄不同加热程度样品含量变化趋势图

图5 药用大黄不同加热程度样品含量变化趋势图
3.2.2 大黄炭颜色量化值分析 本部分将传统大黄炭表面“焦黑色”,内部“焦褐色”的主观颜色量化,得到掌叶大黄、药用大黄色度值得率、L、a、b变化图见图6。结果表明粉末的色度值E*ab随着加热程度的增加而下降,其中在较低温度160 ℃的样品总E*ab值的下降趋势较小,而超过这一温度后的下降程度增大,说明温度越高,样品颜色变黑的程度越明显,加热样品为240 ℃条件下40~60 min时,总色值的变化趋于稳定,也说明加热太过,样品趋于黑色几乎不发生改变。
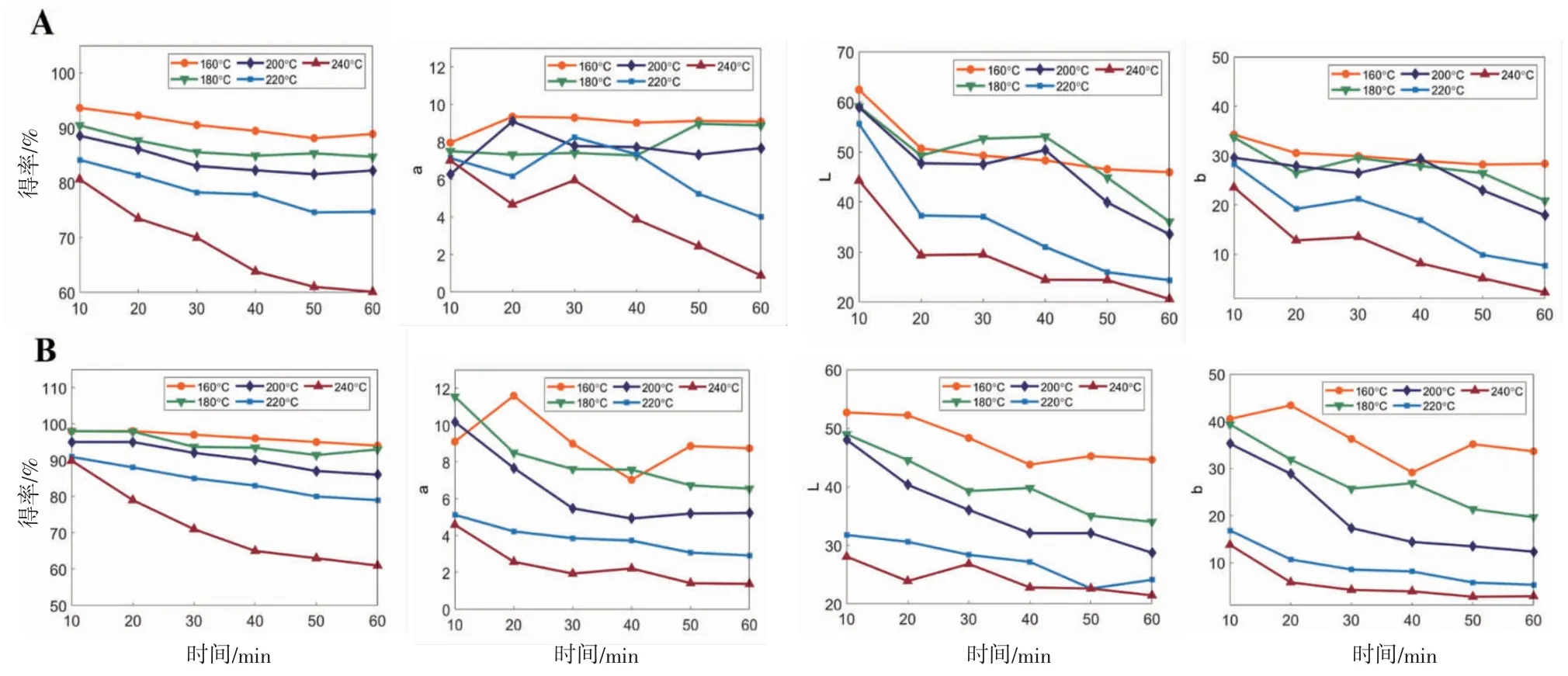
图6 不同加热程度样品色度变化图
3.2.3 大黄炭颜色量化值和含量相关性分析 进一步运用Graphad等软件将色度量化值与成分含量进行线性或二次函数拟合。得出大黄在炭化过程中随着颜色的逐渐加深,与结合蒽醌和番泻苷类呈线性相关。与游离蒽醌、没食子酸和5-HMF二次相关,如图7所示。根据大黄炭表面“焦黑色”,内部“焦褐色”的传统经验,颜色值L、a和b下降到某一范围,潜在质量标志物番泻苷和结合蒽醌含量接近为0可能是大黄炭合理的炒炭终点,对应游潜在质量标志物离蒽醌含量达到抛物线的顶峰、上升或下降趋势的某一高点时,炮制最佳,即符合传统经验鉴别的要求[21]。
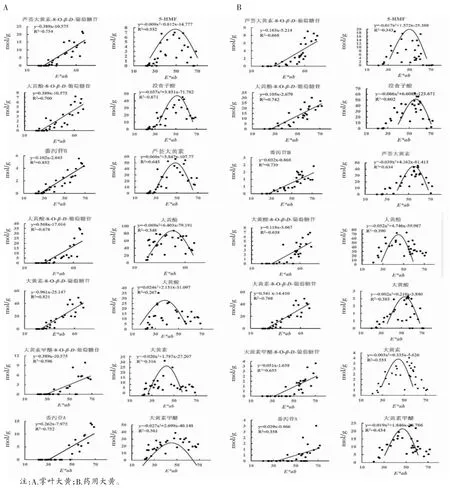
图7 样品粉末E*ab与成分变化关系图
4 讨论
本研究发现,掌叶大黄和药用大黄在加热过程中,游离蒽醌、没食子酸和5-HMF呈先增加后减少的变化模式,结合蒽醌和番泻苷呈单项递减的变化模式,课题组此前的研究亦发现唐古特大黄中的这5类化合物具有与上述一致的变化规律[22]。本研究中单向减少的有泻下成分番泻苷和结合蒽醌,因结合蒽醌与番泻苷含量变化规律一致,且结合蒽醌含量较高,可选择结合蒽醌作为代表性的“减毒”质量标志物(Negative Q-marker)。炒炭过程中,先增后减的有抗炎止血等活性成分游离蒽醌、没食子酸和5-HMF,因三者含量变化规律一致,且游离蒽醌的活性、含量都显着高于没食子酸、5-HMF,结合三类成分在大黄炭中含量高低:游离蒽醌(按成分最高含量计)>没食子酸(12倍)>5-HMF(70倍)。此外后两个成分在其他炭药也普遍存在,故游离蒽醌的专属性、特征性也优于没食子酸和5-HMF,可以选择游离蒽醌作为代表性的“增效”质量标志物(Positive Q-marker)。最终表明,在大黄炭炮制过程中,“减毒”质量标志物含量降低,对应大黄的苦寒之性下降,泻下作用减弱;“增效”质量标志物含量升高,对应大黄炭凉血化瘀的功效增强。这也是大黄炭“减毒增效”的炮制变化机制。
通过本研究可以看出,炒炭的原理可能是减少“减毒”质量标志物含量,增加“增效”质量标志物含量,推测大黄炭炒炭的终点处“减毒”质量标志物应基本消失,“增效”质量标志物相对于生大黄应有所增加而没有显着的降低趋势则较好。本研究发现减毒标志物最低点与增效标志物最高点并不一致,这种情况下可结合传统经验找出最佳的炮制点。
5 小结
本研究筛选出游离蒽醌是大黄炭的“增效”质量标志物,结合蒽醌是“减毒”质量标志物,为大黄炭的质量研究和炮制工艺考察提供了一种新思路。
中医学认为血瘀证是由血行不畅或血流瘀滞而形成,即“脉道以通,血气乃行”,“脉不通而血不流”,“其结络者,脉结血不行,决之乃行”,可见脉的功能受损与血瘀证的发生有密切关系[23-24]。同时,人们在外感风温之邪或热病后遗毒于内或情志郁结、饮食不节,造成热毒内盛,此时正气耗伤但邪热未去,热毒内陷营血,灼伤脉络,致血液溢出脉管化为瘀血引起气机逆乱。此种病因病机多是由体内残留的炎症引起,使脏腑功能失调,呈现邪实未去、正气虚耗的虚实夹杂证候。本研究运用HUVEC细胞筛选大黄炭质量标志物即很好的符合了大黄炭“凉血化瘀”的功效。
大黄药材在炮制为大黄炭后,游离蒽醌作为大黄炭发挥“凉血化瘀”的主要化合物,含量明显升高,故相关标准中应规定游离蒽醌含量的下限值。结合蒽醌和番泻苷作为大黄泻下的主要成分,在大黄炭中的含量较少,所以相关标准应规定二者在大黄炭中的上限值,以有效控制大黄和大黄炭的质量。同时,企业在炮制大黄炭时,可先测定大黄药材中游离蒽醌和结合蒽醌的含量,炮制为大黄炭后,再通过二者的数值大小比较二者之间的成分变化情况,如此可判断炮制的程度是否合理。同时,从节省能源和提高效率的角度考虑,生产工艺应以“高温度、少时间”的原则进行炮制。需要强调的是,本研究是实验室规模实验,具体的上下限值应结合中试实验得到最佳的参考范围。



