董华强,甄畅迪,张 毅,李 梅,刘富来,黄剑波
南山楂叶黄酮抑制α-葡萄糖苷酶和清除DPPH自由基的作用
董华强1,甄畅迪1,张 毅2,李 梅1,刘富来1,黄剑波1
(1.佛山科学技术学院食品科学系,广东 佛山 528231;2.华南理工大学轻工与食品学院,广东 广州 510641)
目的:研究南山楂叶黄酮提取物(SZ)对α-葡萄糖苷酶活性的抑制作用和抗氧化活性。方法:检测SZ对来源于酵母菌的α-葡萄糖苷酶活性抑制作用,并采用Lineweave-Burk双倒数曲线研究其抑制机理;测定SZ对DPPH自由基的清除率,考察其抗氧化活性。结果:SZ对α-葡萄糖苷酶的抑制率可达到64.3%,属于非竞争性抑制;对DPPH自由基的清除率可达52.8%,IC50值为0.57mg/mL。结论:SZ对α-葡萄糖苷酶有较强的抑制作用和具有一定的抗氧化活性。
南山楂叶;黄酮;α-葡萄糖苷酶;抑制作用;抗氧化
山楂为蔷薇科植物山里红(C. pinnatifida Bunge var. major N. E. Br.)、山楂(C. pinnatifida Bge)或野山楂(C. cuneata Sieb. et Zucc.)的干燥成熟果实。前两种习称北山楂,后一种习称南山楂。除了果实,山楂叶也可入药,用于活血化淤,理气通脉[1]。2005年版《中国药典》也正式收载山楂叶。近年来,用山楂治疗心血管方面疾病的研究较多。叶希韵等[2-4]研究表明,山楂叶黄酮对防治糖尿病及其并发症有积极的作用。1990年版中国药典一部未将南山楂收入[5],对南山楂的研究报道也很少。一些学者对此有不同看法,虞人荣[6]甚至认为南山楂的治疗作用优于正品山楂。
α-葡萄糖苷酶(EC 3.2.20)是位于小肠黏膜上的寡糖水解酶,与餐后血糖水平升高密切相关[7]。阿卡波糖(acarbose)是临床上广泛应用的控制餐后血糖的有效药物,其药效机理就是抑制小肠黏膜的α-葡萄糖苷酶活性[8]。由于阿卡波糖存在明显的副作用[9-12],人们一直在寻找天然无副作用的α-葡萄糖苷酶抑制剂[13-15]。有报道从植物中提取分离得到一些天然α-葡萄糖苷酶抑制剂,没有阿卡波糖等药物的副作用[16]。本实验对南山楂叶黄酮提取物的α-葡萄糖苷酶抑制活性和抗氧化活性进行研究。
1 材料与方法
1.1 材料与试剂
南山楂(C. cuneata Sieb. Et Zucc.)干叶购于广东阳山县城。
α-葡萄糖苷酶(EC 3.2.1.20)、DPPH、对硝基苯-β-D-半乳糖吡喃糖苷 美国Sigma公司;阿卡波糖(acarbose) 德国拜耳公司;95%乙醇、甲醇、乙酸乙酯均为分析纯 上海化学试剂厂;茶多酚(TP,含量70%)、芦丁(含量95%) 上海同田生物技术有限公司。1.2仪器与设备
UV-260紫外-可见分光光度仪 日本岛津公司;M2e 酶标仪(micro-plate reader) 美国Molecular device公司;HH数显恒温水浴锅 金坛市金城国胜实验仪器厂;TGL-16台式离心机 长沙市平凡仪器仪表有限公司;旋转真空蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 南山楂叶黄酮提取
称取南山楂叶40g,粉碎后移入圆底烧瓶,加入500mL 80%乙醇溶液,置于75℃水浴锅中回流2h,过滤并收集滤液。重复3次,合并滤液,挥干,得到粗提物。称取粗提物约5g,用50mL的20%乙醇溶液溶解后,加入等体积的乙酸乙酯萃取两次,合并两次乙酸乙酯层萃取液,挥干,得到南山楂叶黄酮提取物(SZ)。黄酮提取率和提取物的黄酮纯度分别按式(1)、(2)计算:
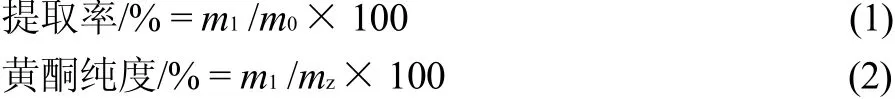
式中:m1为南山楂叶黄酮提取物中黄酮质量/g;m0为南山楂叶中黄酮质量/g;mz为南山楂叶黄酮提取物质量/g。
1.3.2 黄酮含量测定
1.3.2.1 标准曲线的绘制
取0.05g芦丁,充分溶解于50mL无水乙醇,分别取溶液0.1、0.2、0.3、0.4、0.5mL,加蒸馏水定溶至5mL制成梯度浓度。在波长260nm处测定吸光度(A260nm);以芦丁质量浓度(ρ)为横坐标、A260nm为纵坐标作标准曲线,得回归方程:A260nm=5.623ρ+0.2203,r=0.9897。
1.3.2.2 样品黄酮含量测定
测定样品液的A260nm值,根据公式A260nm=5.623ρ+ 0.2203,计算出样品黄酮含量。
1.3.3 α-葡萄糖苷酶活性测定
参照文献[17]的方法,略作修改。取60μL待测液于96孔酶标板中,加入50μL α-葡萄糖苷酶溶液,摇匀后于37℃水浴保温10min,50μL PNPG溶液摇匀,在37℃水浴中反应20min,加入160μL Na2CO3溶液中止酶促反应,置于405nm波长处测吸光度。由于SZ本身有颜色,因此每个样品需要测定背景吸收,并对最终测定结果进行校正。每个样品重复3次取平均值。抑制率按式(3)计算。
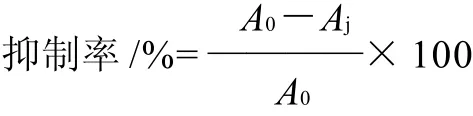
式中:Aj为样品组吸光度;A0为空白对照组吸光度。
采用Lineweaver-Burk作图法,对SZ抑制α-葡萄糖苷酶活性的机理进行分析。
1.3.4 清除DPPH自由基能力测定
参照文献[17]方法,略作修改。以甲醇为溶剂,配制不同质量浓度的样品溶液,吸取50μL待测液于96孔酶标板中,加入150μL DPPH溶液,摇匀,25℃条件下避光静置30min,于波长517nm处测定吸光度。按式(4)计算DPPH自由基清除率。

式中:Q为DPPH自由基清除率;A0为不加试样DPPH溶液的吸光度;At为加试样反应后 DPPH 溶液吸光度。
以清除DPPH自由基达到稳定态50%清除率所需加入样品的质量浓度为IC50,用以表示其抗氧化能力。
2 结果与分析
2.1 南山楂叶提取物的黄酮含量
按照前述黄酮提取分离和测定方法,得到SZ的黄酮含量为3.35%,纯度为58.2%,提取率为86.9%。
2.2 SZ对α-葡萄糖苷酶活性的抑制
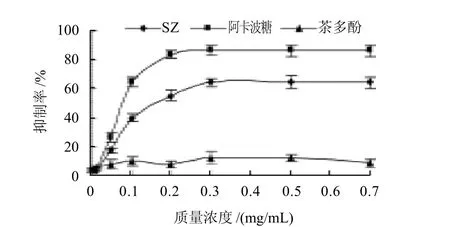
图1 SZ对α-葡萄糖苷酶活性的抑制作用Fig.1 α-glucosidase inhibiting effect of the flavonoid-rich extract studied using acarbose and tea polysaccharide as the controls
由图1可知,阳性对照阿卡波糖对α-葡萄糖苷酶活性的抑制作用很强,而SZ对α-葡萄糖苷酶的活性抑制作用也很明显,茶多酚对α-葡萄糖苷酶活性也有一定抑制作用,但抑制率很低。在0.01~0.3mg/mL质量浓度范围内,SZ对α-葡萄糖苷酶活性的抑制作用呈一定量效关系,抑制效果随SZ质量浓度的增加相应增强,在0.3mg/mL时抑制率达到64.3%。
2.3 南山楂叶黄酮对α-葡萄糖苷酶的抑制机理
以不同质量浓度(0.2mg/mL和0.5mg/mL)SZ作为抑制剂,测定不同底物质量浓度α-葡萄糖苷酶酶促反应速率(V),以1/[S]为横坐标,1/V为纵坐标作Lineweave-Burk双倒数曲线,结果如图2所示。
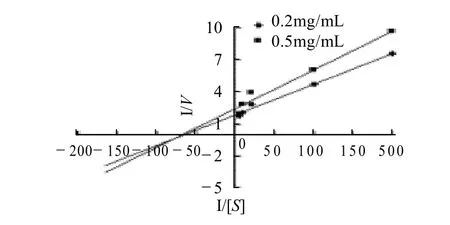
图2 南山楂黄酮提取物抑制α-葡萄糖苷酶的Lineweave-Burk双倒数曲线Fig.2 Lineweaver-Burk plot of inhibitory effect of the flavonoid-rich extract onα-glucosidase
由图2可见,两条不同质量浓度的SZ的Lineweave-Burk双倒数曲线相交于X轴的负值区,呈现出较典型的非竞争性抑制剂特征,反应速率随抑制剂质量浓度增大而变小,米氏常数保持不变,说明SZ对α-葡萄糖苷酶的抑制作用属于非竞争性抑制。
2.4 南山楂叶黄酮提取物对DPPH自由基的清除效果
2.4.1 SZ清除率随时间的变化
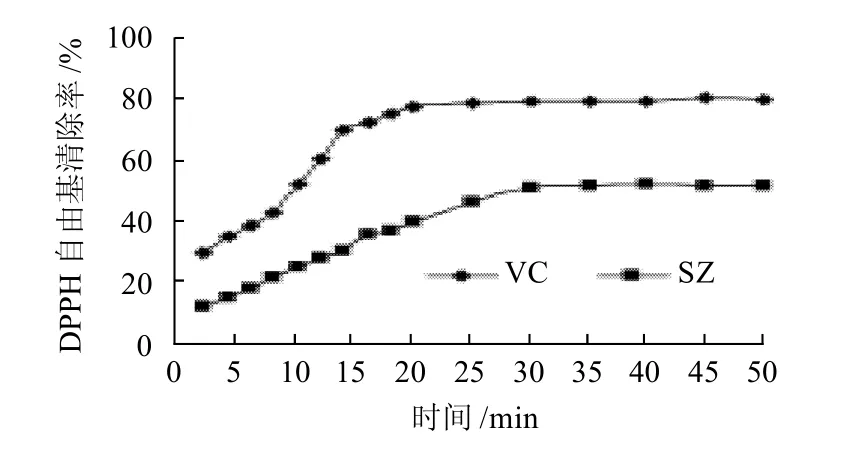
图3 SZ对DPPH自由基的清除率随时间的变化曲线Fig.3 Time courses of DPPH free radical scavenging effect of the flavonoid-rich extract and vitamin C
由图3可见,SZ对DPPH自由基的清除率随时间的延长而逐渐增大,在开始反应30min后,对DPPH自由基的清除率达到最大值51.5%。而VC对DPPH自由基的清除率在反应后20min已接近最大值,达到78.3%。说明在本实验体系中,SZ具有一定的抗氧化能力,但清除DPPH自由基的速率比VC慢。
2.4.2 不同质量浓度SZ对DPPH的清除率和IC50值
由图4可知,在0.1~1.2mg/mL范围内,SZ对DPPH自由基的清除率随质量浓度的增大而增大,呈现一定的量效关系,在1.2mg/mL时达到最大值52.8%,IC50值为0.57mg/mL。而VC在0.6mg/mL时清除率达到84.5%, IC50值为0.28mg/mL。可见,SZ具有一定的抗氧化活性。但无论最大抗氧化能力和达到一半最大抗氧化能力所需的质量浓度(IC50值),都不如VC。

图4 不同质量浓度SZ、VC对DPPH自由基的清除率Fig.4 Concentration dependence of DPPH free radical scavenging effect of the flavonoid-rich extract and vitamin C
3 结 论
3.1 SZ对α-葡萄糖苷酶有较强的抑制活性,抑制率可达到64.3%,抑制机理属于非竞争性抑制。
3.2 SZ具有明显的清除DPPH自由基能力,清除率可达52.8 %,IC50值为0.57mg/mL。
综上所述,SZ对α-葡萄糖苷酶有较强的抑制活性,并具有一定的抗氧化能力,具有很好的抗糖尿病活性开发潜力,值得进一步深入研究。
[1]国家中医药管理局. 中华本草: 第四卷[M]. 上海: 上海科学技术出版社, 1999: 126.
[2]叶希韵, 徐敏华, 李晓峰, 等. 山楂叶总黄酮降血脂防治鹌鹑脂肪肝形成的实验研究[J]. 复旦学报: 医学版, 2009, 36(2): 142-148.
[3]叶希韵, 张隆, 张静, 等. 山楂叶总黄酮对乳鼠心肌细胞缺血缺氧损伤的实验研究[J]. 中国现代应用药学杂志, 2005, 22(3): 202-204.
[4]叶希韵, 张隆, 江菊, 等. 山楂中总黄酮对糖尿病小鼠糖脂代谢的影响[J]. 中草药, 2005, 36(11): 1683-1686.
[5]齐平. 中国药典1990年版一部情况介绍[J]. 中国中药杂志, 1990, 15 (12): 53-55.
[6]虞人荣. 山楂的临床应用[J]. 浙江中医杂志, 1986, 21(10): 471-473.
[7]HAFFNER S M. The importance of hyperglycemia in the nonfasting state to the development of cardiovascular disease[J]. Endocrine Rev , 1998, 19: 583-592.
[8]HANEFELD M. The role of acarbose in the treatment of non-insulin-dependent diabetes mellitus[J]. J Diabetes Complications, 1998, 12(4): 228-237.
[9]HARRIGAN R A, NATHEAN M S, BEATTIE P. Oral agents for the treatment of type 2 diabetes mellitus: pharmacology, toxicity, and treatment[J]. Annals of Emergency Medicine, 2001, 38(1): 68-78.
[10]YEE H S, FONGE N T. A review of the safety and efficacy of acarbose in diabetes mellitus[J]. Pharmacotherapy, 1996, 16: 792- 805.
[11]GRAY D M. Carbohydrate digestion and absorption-role of small intestine [J]. New England Journal of Medicine,1995, 29: 1225- 1230.
[12]HORII S, FULASSE K, MATSUA T. Synthesis and α-D-glucosidase inhibitory activity of N-substituted valiolamine derivatives as potent oral antidiabetic agents[J]. Journal of Medicinal Chemistry, 1987, 29: 1038-1046.
[13]JONG K, CHONG K, KUN H. Inhibition of alphα-glucosidase and amylasw by luteolin, a flavonoid[J]. Biosci Uiotechnol Biochem, 2000, 64(11): 2458-2461.
[14]沈忠明, 丁勇, 施堃, 等. 菝葜降血糖活性成分及对相关酶的抑制作用[J]. 中药材, 2008, 31(11): 1717-1720.
[15]康文艺, 贺光东, 李晓梅, 等. 卷柏酸性成分提取工艺及活性研究[J].精细化工, 2008, 25(12): 1201-1205.
[16]KWON Y I, VATTEM D A, SHETTY K. Clonal herbs of Lamiaceae species against diabetes and hypertension[J]. Asia Pacific Journal of Clinical Nutrition, 2006, 15: 107-118.
[17]KWON Y I, APOSTOLIDIS E, SHETTY K. in vitro Studies of eggplant (Solanum melongena) phenolics as inhibitors of key enzymes relevant for type 2 diabetes and hypertension[J]. Bioresource Technology, 2008, 99(8): 2981-2988.
Alpha-glucosidase Inhibiting Effect of DPPH free Radical Scavenging Activity of Flavonoid-rich Extract from Leaves of Crataegus cuneata Sieb. et Zucc
DONG Hua-qiang1,ZHEN Chang-di1,ZHANG Yi2,LI Mei1,LIU Fu-lai1,HUANG Jian-bo1
(1. Department of Food Science, Foshan University, Foshan 528231, China;2. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China)
A flavonoid-rich extract obtained by ethyl acetate extraction from the 80% ethanol extract from the leaves of Crataegus cuneata Sieb. et Zucc was evaluated for its alpha-glucosidase inhibiting effect and DPPH free radical scavenging activity. The extract had an inhibitory effect on alpha-glucosidase derived from yeast, and the maximum inhibitory rate was up to 64.3%, and the inhibition was uncompetitive according to the Lineweaver-Burk plot. The maximum DPPH free radical scavenging rate of the extract was up to 52.8%, and the IC50 was 0.57 mg/mL. In conclusion, the extract had strong ability to inhibit yeast-derived alphaglucosidase and certain antioxidant activity.
leaves Crataegus cuneata Sieb. et Zucc;flavonoids;alpha-glucosidase;inhibiting effect;antioxidation
TS201.2
A
1002-6630(2010)19-0179-03
2010-07-05
广东省自然科学基金项目(8152800001000023)
董华强(1958—),男,教授,博士,研究方向为农产品贮藏与加工、食品功能性成分化学与活性评价。E-mail:huaqiangdong@163.com



