张海华,朱科学,陈 晔,周惠明,*
(1.江南大学食品学院,江苏 无锡 214122;2.广西粮油科学研究所,广西 南宁 530001)
微波处理对小麦面筋蛋白结构的影响
张海华1,朱科学1,陈 晔2,周惠明1,*
(1.江南大学食品学院,江苏 无锡 214122;2.广西粮油科学研究所,广西 南宁 530001)
采用傅里叶红外光谱(FTIR)对小麦面筋蛋白二级结构进行分析。结果表明:微波处理后面筋蛋白的二级结构随微波功率不同而发生不同变化;通过测定FTIR光谱的羟基振动、表面疏水度以及游离巯基和二硫键(—SH/S—S)含量的变化间接反映微波对面筋蛋白空间结构的影响,结果得出经微波处理后面筋蛋白的羟基振动峰强度减弱、疏水性显着提高、S—S发生断裂并转化为—SH,这表明面筋蛋白的空间结构赖以支撑的次级键受到微波的影响;借助粒径仪、流变仪对微波处理面筋蛋白的粒径分布以及表观黏度进行测定,得出面筋蛋白体积粒径减小、静态流变表观黏度降低,表明面筋蛋白链间紧密的微结构经微波处理后变得松散。
面筋蛋白;微波;傅里叶红外光谱(FTIR);疏水性;粒径;流变特性
微波是指频率为300MHz~300GHz的电磁波,能够引起物料分子振动从而在分子级对物料产生影响。微波使食品物料中的水在高频电磁场作用下发生随着外电场的变化而变化的极性取向,引起分子的运动与相互摩擦,此时微波场能转化为介质内的热能,使物料温度升高,产生热化和膨化等一系列物化过程[1-2]。微波在食品工业的应用主要是微波杀菌[3]、微波干燥[4]、微波烘焙[5]三方面。除此而外,还有微波辅助酶解[6]、微波辅助检测[7]、微波萃取[8]、微波改性[9]等。据报道,在这些应用中微波对物料的结构产生了影响,例如Byaruhanga等[10]采用FTIR对微波加热的高粱醇溶蛋白的结构进行研究时发现微波加热后高粱醇溶蛋白二级结构中β-折叠结构含量增加。
面筋蛋白是小麦的主要贮藏蛋白,是由麦胶蛋白和麦谷蛋白组成的聚合体。面筋蛋白是大分子链蛋白,具有不同于其他蛋白的独特的黏弹性及特殊的理化性质,例如溶解度低、乳化性差等。因此,Yalcin等[11]采用微波法对面筋蛋白的乳化性、起泡性等理化性质进行了改善。归根结底,微波处理后面筋蛋白物理化学性质的变化是由于微波引起了面筋蛋白结构的变化。因此,本实验以此为切入点,对微波处理面筋蛋白的结构进行研究,以弥补微波处理面筋蛋白结构方面信息的不足,同时期望研究结果能够为微波对食品物料结构影响提供参考,特别是微波烘焙食品,从而更好的控制微波食品的品质。
1 材料与方法
1.1 材料、试剂与仪器
小麦面筋蛋白(蛋白质干基含量78%) 河南莲花有限公司。
1-苯氨基萘-8-磺酸(ANS)、5,5'-二硫代-2-硝基苯甲酸(DTNB) 美国Sigma公司;其他所用化学试剂均为分析纯,均购自国药集团化学试剂有限公司。
MZG1500S型微波实验仪 中国南京汇研微波系统工程有限公司;Nexus 470傅里叶变换红外光谱仪 美国Thermo Nicolet公司;Hitachi 650-60型荧光分光光度计日本日立公司;Mastersizer 2000激光散射粒径仪 英国Malvern公司;AR-G2型流变仪 美国TA公司。
1.2 方法
1.2.1 微波处理小麦面筋蛋白
在室温条件下,量取100mL去离子水置于500mL的高脚烧杯中,调整磁力搅拌器转速为300r/min。然后准确称量6.0g小麦面筋蛋白,边搅拌边缓慢加入烧杯中,待小麦面筋蛋白完全加完后继续搅拌5min使小麦面筋蛋白充分水合。调整微波炉的功率输出分别为600、800、1000W,设置加热时间为1min、磁力搅拌转速300r/min,此时将充分水合的小麦面筋蛋白悬浮液置于微波炉物料仓中,启动微波按钮。微波处理结束后,立即测量小麦面筋蛋白悬液的温度并记录。此后,将微波处理小麦面筋蛋白悬液冷却、冻干,留样待测。对应于微波功率600、800、1000W,将微波处理小麦面筋蛋白样品分别记为MW600、MW800、MW1000;未经微波处理的小麦面筋蛋白作为对照样品,记为RG。
1.2.2 微波处理小麦面筋蛋白的二级结构测定
采用傅里叶变换红外光谱测定微波处理小麦面筋蛋白的二级结构。具体步骤如下:将1g小麦面筋蛋白冻干样品与1mL重水(D2O)混合均匀,于25℃、相对湿度80%的条件下平衡48h,形成面筋糊。参照Mejri等[12]的方法,在分辨率为2cm-1、扫描次数128次/s的条件下,采用衰减全反射附件进行蛋白结构测定。在同样处理和扫描条件下,采用普通蒸馏水分散样品,在2800~3800cm-1采集面筋蛋白样品中羟基(—OH)红外吸收信息。
1.2.3 微波处理小麦面筋蛋白的表面疏水性测定
表面疏水性(H0)是用1-苯氨基萘-8-磺酸(ANS)作为荧光探针进行测定的。称取0.05g超声波处理小麦面筋蛋白,溶于0.01mol/L、pH8.0的磷酸缓冲液中,配成1mg/mL的分散体系。在高速均质机上均质1min,然后在3000r/min条件下离心15min,用Folin-酚法测定上清液中的蛋白浓度。用0.01mol/L、pH8.0的磷酸缓冲液稀释蛋白质量浓度在0.02~0.30mg/mL之间。取不同质量浓度的稀释样品4mL,加入20μL的ANS溶液(采用0.01mol/L、pH8.0的磷酸缓冲液配制成8mmol/L的溶液)。立即采用荧光分光光度计在405nm的激发波长(狭缝5nm)和480nm的发射波长(狭缝5nm)下测定样品的荧光强度,以荧光强度对蛋白质浓度作曲线,外推至蛋白质浓度为0,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数。
1.2.4 —SH/S—S含量测定
蛋白质的巯基(包括游离的和埋藏在疏水基团内部的—SH)和总巯基基团(包括—SH和还原的S—S)含量,利用游离巯基、总巯基和二硫键的关系计算二硫键含量。
游离巯基含量的测定:取3mL约5mg/mL的蛋白质悬液,加入3mL 0.1mol/L含有lmmol/L EDTA和1g/100mL SDS的磷酸盐缓冲液,再加入0.1mL 10mmol/L的DTNB,剧烈振荡后25℃水浴1h,10000r/min离心30min。以不加DTNB的溶液为对照,取上清液于412nm波长处测定吸光度,以13600L/(mol·cm)消光系数计算巯基含量。
总巯基含量的测定:取1mL约5mg/mL的蛋白质溶液,加入0.05mL的β-巯基乙醇和4mL的尿素-盐酸胍溶液,25℃放置1h后加入10mL 12g/100mL的三氯乙酸(TCA),25℃再水浴1h。然后5000r/min离心10min。沉淀分散在5mL TCA中5000r/min离心10min,如此重复两次除去β-巯基乙醇。沉淀溶解在10mL 0.1mol/L的磷酸盐缓冲液,加入0.08mL DTNB,剧烈振荡后25℃水浴1h,并于10000r/min离心30min,取上清液于412nm波长处测定吸光度。

1.2.5 粒径分布
将超声处理后的样品马上采用马尔文激光散射粒径仪Mastersizer2000进行粒径分布测定。测定参数为:进样器Hydro2000MU(A),光束长度2.35mm,样品折射率1.5,设置遮光率为10%~20%,测定时遮光率为10%~15%。每个样品平行采集6次,取平均图谱。
1.2.6 微波处理小麦面筋蛋白的静态流变特性测定
采用TA-G2型流变仪对微波处理小麦面筋蛋白的静态流变特性进行测定,选用直径20mm不锈钢平行板,设置间隙为2mm,剪切速率为0.1~100s-1,25℃条件下测定微波处理对面筋蛋白黏度、剪切应力随剪切速率变化的关系。
1.3 数据处理
各实验重复3次,结果以平均值表示。数据在P<0.05水平上的显着性采用SPSS 13.0 软件进行分析。
2 结果与分析
2.1 微波对小麦面筋蛋白二级结构的影响

图1 微波处理小麦面筋蛋白的去卷积红外酰胺I'带图谱Fig.1 Deconvoluted amide I' bands in FTIR spectra of microwave treated WGP
对未经微波处理的小麦面筋蛋白的红外光谱酰胺I'带(1600~1700cm-1)进行去卷积、二阶导数拟合处理得到7个二级结构子峰,如图1所示。参照Mejri等[12]在前人用FTIR研究小麦面筋蛋白二级结构的基础上,对小麦面筋蛋白的7个结构子峰进行归属,结果见表1。对比微波处理小麦面筋蛋白与未经微波处理的二级结构峰位,发现微波处理使得小麦面筋蛋白的各子峰发生了不同程度的蓝移,其中MW800样品蓝移程度最大。根据各子峰面积占总峰面积的比等于对应结构含量的原则,对面筋蛋白样品中各结构的含量进行了计算,结果如表1所示。经微波处理后,除面筋蛋白二级结构中1609cm-1处β-折叠含量无显着变化和1675cm-1处β-折叠含量显着下降外,其他峰位的结构含量均发生了与微波功率非线性相关的变化。从表1可以看出,MW800处理显着促进分子间β-折叠结构(1618cm-1处)和扩展结构(1627cm-1处)的形成,而其他两个功率的处理更利于扩展β-折叠结构(1638cm-1处)和α-螺旋(1650cm-1处)的形成;此外,MW600处理还促进了β-转角结构(1661cm-1处)的形成。
微波对蛋白结构的影响主要有两方面:一是微波热效应,Barak等[13]认为绿荧光蛋白荧光光谱500~540nm段的变化主要是由微波热效应引起的,而540~560nm段的变化与传统热效应不同;二是微波的非热效应,微波非热效应使得牛血清清蛋白形成类淀粉质结构[14]。微波热效应使得面筋蛋白悬液温度升高(MW600:74℃;MW800:84℃;MW1000:90℃),从而引起蛋白二级结构的变化。另外,又与传统加热不同,微波引起面筋蛋白二级结构的无规律变化很可能是由于微波非热效应作用的结果。在本研究中,由于设备限制未能直接检测到非热效应,只能从实验结果推测出非热效应的存在,这一点希望在以后设备满足的条件下继续深入研究。

表1 微波处理小麦面筋蛋白的二级结构及各结构含量Table 1 Determined frequencies of amide I' component bands, relative assigned structures and their distributions for microwave treated WGP
2.2 微波对小麦面筋蛋白空间结构的影响
蛋白质的空间结构主要由氢键、疏水作用、范德华力等非共价作用和二硫键支撑形成的。由于小麦面筋蛋白空间结构过于复杂,现在还无法直接进行测定,只能通过测定这些非共价作用来间接表征,因此本实验通过测定小麦面筋蛋白的水合作用、疏水性和-SH/S-S含量来表征微波处理对小麦面筋蛋白空间结构的影响。
2.2.1 微波对小麦面筋蛋白的水合作用的影响
红外光谱2800~3800cm-1主要表征水的羟基键合,还是蛋白质的羟基伸缩振动吸收峰。谱带的强度表征蛋白质水合作用的强弱,吸收越强表示水合作用越强,则样品水合的水分子量就越多[15]。微波对小麦面筋蛋白羟基伸缩振动的影响如图2所示。

图2 微波处理小麦面筋蛋白的红外羟基伸缩振动吸收带Fig.2 Infrared spectrum in OH stretching region of microwave treated WGP
从图2可以看出,经微波处理后,小麦面筋蛋白的羟基伸缩振动吸收峰强度下降,且降低程度随着微波功率增加而降低。这表明微波处理后小麦面筋蛋白的水合作用下降,即样品水合的水分子数量下降。水合作用的降低表明微波使得面筋蛋白中与水的羟基可能形成氢键的键合位点数量的减少,从而影响了面筋蛋白的空间构象。Banik等[1]认为微波对蛋白质的作用有两种可能:一种可能是微波使得蛋白质中产生随电场方向变化而变化的极化分子或离子,从而加速与其他分子间的碰撞;另一种可能是微波引起偶极子旋转并随着交互电场(2.450×109次/秒)的变化迅速排成一行,从而导致蛋白质二级和三级结构的变化。当蛋白质的二级和三级结构在微波场中展开时,蛋白质的亲水基团之间发生相互作用从而水合作用下降。这也是当在28~98℃条件下采用微波提取小麦籽粒中水溶性蛋白时提取率降低的一个原因[16]。
2.2.2 微波处理对小麦面筋蛋白表面疏水度的影响
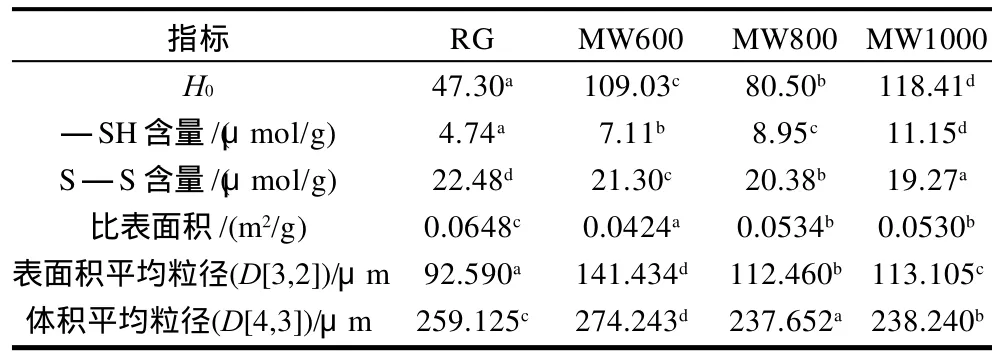
表2 微波处理小麦面筋蛋白的表面疏水度、游离—SH、S—S含量以及粒径分布Table 2 Surface hydrophobicity (H0) and free sulfhydryl group and disulphide bond contents of microwave treated WGP
表面疏水度是表征蛋白质表面非共价作用的一个定量指标,与蛋白质微结构中长波长区变化相关。从表2可以看出,小麦面筋蛋白经微波处理后,其表面疏水度提高,而且从所得数据来看这种提高与微波的功率变化很明显呈非线性相关的关系。表面疏水度的提高与水合作用下降一致,也和微波加热后小麦淀粉-小麦面筋蛋白-水复配体系中水的扩散常数降低相吻合[17]。表面疏水度的提高还与小麦面筋蛋白经微波辐照后溶解度降低有关[11]。蛋白质的溶解度与蛋白质表面疏水作用(蛋白与蛋白间)与亲水作用(蛋白与水之间)相关,因此Qasem[18]推测经微波处理后小麦面筋蛋白链间可能发生了交联,而且这种交联作用只限于亲水基团间,而疏水基团间并没有发生交联作用,以至于非极性体系中的面筋蛋白相邻分子间不能发生聚合,以至于采用微波辐照法制备的胃复安(metoclopramide)面筋蛋白缓释载体并未能达到缓释的目的。
Weegels等[19]采用传统加热法在面筋蛋白相对湿度13%或以上加热面筋蛋白时,发现面筋蛋白的疏水度呈下降趋势。传统加热法与微波加热所得结果的不同是由于两种加热方式的热量传递方式不同。传统加热时,热量是通过热梯度的形式传递的;而微波加热时,热量是由电磁能转化而来,是热能转化而不是传递[2]。
2.2.3 微波处理对面筋蛋白中游离巯基(—SH)和二硫键(S—S)含量的影响
面筋蛋白中的半胱氨酸通过巯基的氧化作用形成二硫键,这些二硫键对面筋蛋白紧密的结构起到稳定支撑作用。面筋蛋白网络中的二硫键可以是链间的或者链内的。经微波处理后,面筋蛋白链间或链内二硫键含量在显着降低(P<0.05),而游离巯基含量显着提高(表2)。结果还表明,二硫键的断裂与微波功率成正相关关系。微波通过电磁场能引起物料内部分子间发生摩擦,物料原子间的摩擦引起分子间共价键或非共价键的断裂[2]。因此,认为二硫键的断裂也是面筋蛋白分子间摩擦的结果。在二硫键含量的变化上,微波处理与传统热处理[20]所得结果不同。
2.3 微波处理对小麦面筋蛋白微结构的影响
2.3.1 微波处理对小麦面筋蛋白悬液粒径分布的影响
面筋蛋白主要有麦醇蛋白和麦谷蛋白组成,其中麦谷蛋白对小麦粉的烘焙品质非常重要。麦谷蛋白在小麦面团中以大分子聚合体形式存在,其中包裹/交联着麦醇蛋白,因此测量面筋蛋白的粒径分布对于研究麦谷蛋白-麦醇蛋白形成的大分子聚合体的形态非常重要。Don等[21]认为麦谷蛋白聚合体粒径在10-1~102μm之间,这一点与本研究所测结果一致(见表2的D[3,2])。经微波处理后,面筋蛋白的表面积平均粒径D[3,2]显着增大,而体积平均粒径D[4,3]除MW600外都显着减小。根据Dona等[22]对热处理麦谷蛋白大分子聚合体粒径的影响研究结果,当降低麦谷蛋白中高分子质量(high molecular weight,HMW)亚基和低分子质量(low molecular weight,LMW)亚基的比例时,麦谷蛋白大分子聚合体的D[3,2]显着增加。因此推论微波处理后面筋蛋白D[3,2]的显着增大可能是由于麦谷蛋白大分子聚合体中HMW/LMW降低的原因。然而,Farag等[23]在研究微波辐照牛肝蛋白时认为微波辐照使得牛肝蛋白的LMW含量降低,相应的聚合成HMW从而导致HMW含量提高。不一致的结论可能是由于蛋白质本身差异引起的。
2.3.2 微波处理对小麦面筋蛋白静态流变特性的影响
虽然分子质量与面筋蛋白之间的确切关系还不清楚,但是黏度被认为与面筋蛋白的各亚基的结构及其相互作用有关[24]。因此测定了不同剪切速率下微波处理面筋蛋白的表观黏度及应变的变化,结果见图3。

图3 微波处理小麦面筋蛋白的黏度、应变与剪切速率关系图Fig.3 Viscosity and strain of microwave treated WGP as a function of shear rate
如图3所示,经微波处理后面筋蛋白的表观黏度降低,应变增大。表观黏度的降低表明微波引起了面筋蛋白亚基结构的变化,且削弱了亚基间的相互作用。这一点与D[4,3]的降低一致。应变表示物料在力的作用下形变的大小,面筋蛋白经微波处理后应变增大,说明面筋蛋白的形变增大,这也间接说明面筋蛋白聚合体组分间结合程度的减弱,进而面筋蛋白质的紧密结构变得松散。
3 结 论
采用FTIR法测定的微波处理面筋蛋白二级结构,和由2800~3800cm-1处红外羟基伸缩振动峰的强度、疏水结合位点的数量以及二硫键含量表征的三级结构,以及由粒径分布、流变表观黏度反映的微结构的分析,得出微波通过削弱面筋蛋白分子间或分子内的非共价作用以及二硫键的断裂作用,使得面筋蛋白紧密的结构变得松散、原来聚合结构变得伸展。
[1] BANIK S, BANDYOPADHYAY S, GANGULY S. Bioeffects of microwave: a brief review[J]. Bioresource Technology, 2003, 87(2):155-159.
[2] THOSTENSON E T, CHOU T W. Microwave processing: fundamentals and applications[J]. Composites: Part A, 1999, 30(9): 1055-1071.
[3] IWAGUCH S, MATSUMURA K, TOKUOKA Y, et al. Sterilization system using microwave and UV light[J]. Colloids and Surfaces B:Biointerfaces, 2002, 25(4): 299-304.
[4] ZHANG M, TANG J, MUJUMDAR A S, et al. Trends in microwave related drying of fruits and vegetables[J]. Trends in Food Science &Technology, 2006, 17(10): 524-534.
[5] SUMNU G, SAHIN S, SEVIMLI M. Microwave, infrared and infraredmicrowave combination baking of cakes[J]. Journal of Food Engineering,2005, 71(2): 150-155.
[6] ZHONG H Y, MARCUS S L, LI L. Microwave-assisted acid hydrolysis of proteins combined with liquid chromatography MALDI MS/MS for protein identification[J]. Journal of American Society Mass Spectrum,2005, 16(4): 471-481.
[8] YANG Zhendong, ZHAI Weiwei. Optimization of microwave-assisted extraction of anthocyanins from purple corn (Zea mays L.) cob and identification with HPLC-MS[J]. Innovative Food Science & Emerging Technologies, 2010, 11(3): 470-476.
[9] RIVERO I E, BALSAMO V,. Microwave-assisted modification of starch for compatibilizing LLDPE/starch blends[J]. Carbohydrate Polymers, 2009, 75(2): 343-350.
[10] BYARUHANGA Y B, EMMAMBUX M N, BELTON P S, et al.Alteration of kafirin and kafirin film structure by heating with microwave energy and tannin complexation[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12): 4198-4207.
[11] YALCIN E, SAKIYAN O, SUMNU G, et al. Functional properties of microwave-treated wheat gluten[J]. European Food Research and Technology, 2008, 227(5): 1411-1417.
[12] MEJRI M, ROGE B, BENSOUISSI A, et al. Effects of some additives on wheat gluten solubility: A structural approach[J]. Food Chemistry,2005, 92(1): 7-15.
[13] BARAK I, GOLOSOVSKY M, DAVIDOV D. Microwave effect on proteins in solution-fluorescence polarization studies[J]. Piers Online,2009, 5(6): 561-567.
[14] de POMERAIA D I, SMITHA B, DAWEA A, et al. Microwave radiation can alter protein conformation without bulk heating[J]. FEBS Letters,2003, 543(1): 93-97.
[15] STARZAK M, MATHLOUTHI M. Cluster composition of liquid water derived from laser-Raman spectra and molecular simulation data[J]. Food Chemistry, 2003, 82(1): 3-22.
[16] WARCHALEWSKI J R, GRALIK J. Influence of microwave heating on biological activities and electrophoretic pattern of albumin fraction of wheat grain[J]. Cereal Chemistry, 2010, 81(1): 35-41.
[17] UMBACH S L, DAVIS E A, GORDON J, et al. Water self-diffusion coefficients and dielectric properties determined for starch-gluten-water mixtures heated by microwave and by conventional methods[J]. Cereal Chemistry, 1992, 69(6): 637-642.
[18] QASEM R J. The effect of microwave thermal denaturation on release properties of bovine serum albumin and gluten matrices[J]. AAPS Pharmacy Science Technology, 2006, 7(1): E104-E110.
[19] WEEGELS P L, de GROOT A M G, VERHOEK J A, et al. Effects on gluten of heating at different moisture contents. Ⅱ. Changes in physicochemical properties and secondary structure[J]. Journal of Cereal Science,1994, 19(1): 39-47.
[20] STATHOPOULOS C E, TSIAMI A A, SCHOFIELD J D, et al. Effect of heat on rheology, surface hydrophobicity and molecular weight distribution of glutens extracted from flours with different bread-making quality[J]. Journal of Cereal Science, 2008, 47(2): 134-143.
[21] DON C, LICHTENDONK W J, PLIJTER J J, et al. The effect of mixing on glutenin particle properties: aggregation factors that affect gluten function in dough[J]. Journal of Cereal Science, 2005, 41(1): 69-83.
[22] DONA C, LOOKHART G, NAEEM H, et al. Heat stress and genotype affect the glutenin particles of the glutenin macropolymer-gel fraction[J].Journal of Cereal Science, 2005, 42(1): 69-80.
[23] FARAG R S, HEGAZY R A, EL-KHAWAS K H, et al. Electrophoretic patterns of microwaved and γ-irradiated beef liver proteins[J]. Journal of Agricultural and Food Chemistry, 2001, 81(10): 975-982.
[24] THOMSON N H, MILES M J, POPINEAU Y, et al. Small angle X-ray scattering of wheat seed-storage proteins: α-, γ- and ω-gliadins and the high molecular weight (HMW) subunits of glutenin[J]. Biochimica et Biophysica Acta, 1999, 1430(2): 359-366.
Effect of Microwave Treatment on Structure of Wheat Gluten Protein
ZHANG Hai-hua1,ZHU Ke-xue1,CHEN Ye2,ZHOU Hui-ming1,*
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. Guangxi Scientific Research Institute of Cereal and Oil, Nanning 530001, China)
Analysis of the effect of microwave treatment at different levels of power on the secondary structure of wheat gluten protein(WGP) was carried out using FTIR. The results showed that the secondary structure of WGP varied with different levels of microwave power. To indirectly figure out the effect of microwave on the spatial structure of WGP, changes in the hydroxyl stretching intensity,surface hydrophobicity, and free sulfhydryl group and disulphide bond contents of WGP were measured before and after microwave treatment. A decrease in hydroxyl stretching intensity, an increase in surface hydrophobicity, the breaking of disulphide bond and its conversion into sulfhydryl group were observed for WGP after microwave treatment. From these results, it could be concluded that microwave has an impact on the secondary bonds deciding the spatial structure of WGP. Furthermore, the particle distribution and apparent viscosity of microwave treated WGP were determined, and the results of decreases in volume particle size and in apparent viscosity demonstrated that the compact structure of WGPwere disrupted and became incompact.
wheat gluten protein (WGP);microwave;fourier transform infrared spectroscopy(FTIR);surface hydrophobicity;particle distribution;rheological properties
TS201.7
A
1002-6630(2011)05-0065-05
2010-06-19
国家“863”计划项目(2008AA10Z312);江南大学博士基金项目
张海华(1982—),女,博士,研究方向为方便食品及品质改良。E-mail:zhanghaihua2008@yahoo.com.cn
*通信作者:周惠明(1957—),男,教授,博士,研究方向为方便食品及品质改良。E-mail:hmzhou@jiangnan.edu.cn



