熊振宇,杨艳燕,李培武*,张 奇,张 文,丁小霞
(1.湖北大学生命科学学院,湖北 武汉 430062; 2.中国农业科学院油料作物研究所,湖北 武汉 430062;3.农业部油料作物生物学重点开放实验室, 湖北 武汉 430062;4.农业部油料及制品质量监督检验测试中心,湖北 武汉 430062)
两种特异性氰戊菊酯人工抗原的合成与鉴定
熊振宇1,杨艳燕1,李培武2,3,4,*,张 奇2,3,4,张 文2,3,4,丁小霞2,3,4
(1.湖北大学生命科学学院,湖北 武汉 430062; 2.中国农业科学院油料作物研究所,湖北 武汉 430062;3.农业部油料作物生物学重点开放实验室, 湖北 武汉 430062;4.农业部油料及制品质量监督检验测试中心,湖北 武汉 430062)
选择化学结构具有典型研究意义的氰戊菊酯(fenvalerate,Fen)为研究对象,利用有机化学合成法在氰戊菊酯分子的一端分别引入两种不同连接长度的连接臂。通过核磁共振(1H-NMR)、液相色谱-质谱联用仪(LC-MS-MS)鉴定,成功合成两种半抗原Fen1和Fen2,并与牛血清蛋白(bovine serum albumin,BSA)偶联合成了两种氰戊菊酯免疫特异性人工抗原Fen1-BSA、Fen2-BSA,经紫外分光光度仪扫描,人工抗原的紫外图谱相对于半抗原和载体蛋白有明显差异,测得偶联比分别约为9:1和10:1,经SDS-PAGE电泳检测表明偶联成功。
氰戊菊酯;半抗原;人工抗原;合成
氰戊菊酯(fenvalerate,Fen)是拟除虫菊酯类农药的一种,也是目前使用最普遍、蔬菜农药残留检测中检出率和超标率最高的一类[1]。具有高效、低毒、残留少、范围广等特点,被广泛用于茶、果树、农作物的害虫防治,是继有机氯、有机磷之后又一类新型的农药杀虫剂。自2000年7月1日起,欧盟(EU)对茶叶中的农药最高残留限量(MRL)执行新标准,将氰戊菊酯残留限量降低至0.1mg/kg,我国强制性国家标准规定,氰戊菊酯(图1)在叶类菜和水果上的最高残留限量分别是0.5mg/kg和0.2mg/kg[2]。
目前国内外文献[3-5]报道菊酯类的检测方法主要使用气相色谱法、高效液相色谱法、气相色谱-质谱联用(GC-MS)等,这些方法费力、耗时、花费高且不适合大量样品的检测。酶联免疫吸附检测(ELISA)是近年来在环境、食品安全监测领域逐渐广泛应用的一种快速、高通量、低成本的检测技术,已逐渐成为世界各国有毒有害残留物快速筛选检测的主要方法之一[3]。通过合成氰戊菊酯人工抗原,用以制备高质量的单克隆抗体、建立ELISA检测方法并应用于农药残留检测分析显得尤为重要。本实验利用新方法合成具有活性功能团的氰戊菊酯,作为半抗原与蛋白质偶联,以制备出亲和力好、特异性强的高质量单克隆抗体。
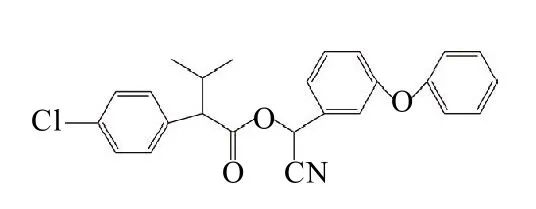
图1 氰戊菊酯的分子结构Fig.1 Moleculer structure of fenvalerate
1 材料与方法
1.1 材料与试剂
氰戊菊酸、3-[(4-硝基苯)氧基]苯甲醛、牛血清白蛋白(BSA)、卵清白蛋白(OVA) 美国Sigma公司;N,N-二甲基甲酰胺(DMF)、N-羟基丁二酰亚胺(NHS)、N,N-二环已基碳二亚胺(DCC) 北京化学试剂公司;所用水均为双蒸水,其他试剂均为分析纯或色谱纯。
1.2 仪器与设备
UV500紫外分光光度计 美国Unicam公司;AS600核磁共振仪 美国Varian公司;B-480旋转蒸发仪 瑞士Buchi公司;液相色谱-质谱联用仪(LC-MS-MS) 美国安捷伦公司。
1.3 方法
1.3.1 氰戊菊酯半抗原的合成
称取1.49g(7mmo1)氰戊菊酸溶于10mL CH2Cl2中,缓慢滴入6mL SOCl2,然后加入40μL DMF到反应瓶中,此混合物在油浴65~70℃ 中搅拌反应90min,溶液减压浓缩后得到淡黄色油状物——氰戊酰氯。
称取1.6g(约8.2mmo1) 3-[(4-硝基苯)氧基]苯甲醛和1.06g(约16.4mmo1)氰化钾置于反应瓶,加入10mL 四氢呋喃(THF)和1mL水将固体物溶解,冰浴搅拌下加入1.5mL浓HC1,缓慢升温,混合物在室温状态下搅拌反应2h。经后处理并纯化得到黄色油状产物,将其溶于2mL 二氯甲烷,在冰浴搅拌的条件下加入预冷的氰戊菊酰氯,立即加入1g碳酸钾,混合物慢慢升温,室温搅拌反应2h,经纯化得到胶状物。
加入36mL无水乙醇,置于油浴锅中,在氮气保护条件下加入2.5g(约11.1mmo1)二水氯化亚锡,70℃磁力搅拌反应2h,无水硫酸钠干燥,蒸去溶剂,纯化得褐红色胶状物。称取104mg丁二酸酐加入反应瓶中并加入5mL 二氯甲烷搅拌溶解,室温搅拌过夜后结束反应。反应终液经减压蒸馏去除二氯甲烷,硅胶柱层析纯化得到淡黄色颗粒状物。将产物进行核磁共振和液相色谱-质谱鉴定。半抗原合成路线如图2所示。
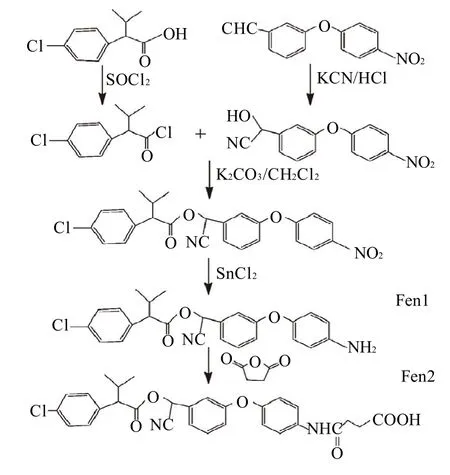
图2 氰戊菊酯半抗原的合成路线Fig.2 Synthetic routes of Fen1 and Fen2
1.3.2 液相色谱-质谱分析条件
将纯化后的样品溶于溶剂(V甲醇:V水=1:1)中,经0.25μm微孔滤膜过滤制得样品。液相色谱-串联质谱鉴定条件:离子源:电喷雾离子源;喷雾电压:4kV;毛细管温度:275℃;鞘气(N2)流速:30L/min;辅助气(N2)流速:5L/min;透镜管电压:100V。
1.3.3 氰戊菊酯人工抗原的合成
1.3.3.1 重氮化法合成Fen1免疫原与包被原[6]
称取半抗原Fen1 50mg于反应瓶中,加入1mL 1mol/L HCl搅拌溶解。冰浴条件下向反应瓶中加入0.3mL DMF,然后缓慢滴加0.5mL 1%亚硝酸钠,搅拌30min,此即重氮化。重氮化后将此溶液分别缓慢滴加到BSA质量分数为67%的PBS缓冲液(0.1mol/L)中与OVA质量分数为67%的PBS缓冲液(0.1mol/L)中。冰浴搅拌反应45min,之后4℃搅拌过夜。反应后装入透析袋中,用4℃、0.01mol/L PBS(pH7.4)溶液透析72h。20℃ 保存。
1.3.3.2 活泼酯法合成Fen2免疫原与包被原[7-8]
在反应瓶中将半抗原Fen2 60mg溶于0.4mL DMF,再加入20mg NHS;称取30mg DCC溶于0.2mL DMF中并滴加到反应瓶中,常温反应4h。将此溶液分别缓慢滴加到BSA质量分数为67%的PBS缓冲液(0.1mol/L)中与OVA质量分数为67%的PBS缓冲液(0.1mol/L)中。最后将混合液装入透析袋中,4℃、0.01mol/L PBS(pH7.4)缓冲液中透析72h。20℃保存。
1.3.4人工抗原的鉴定
1.3.4.1 紫外扫描鉴定及偶联比计算
将Fen1、Fen2、BSA、Fen1-BSA、Fen2-BSA适当稀释,以PBS为空白,进行200~600nm全波段紫外扫描,得到紫外吸收光谱。取同一波长时各自的吸光度和浓度,根据公式(1)计算摩尔吸光系数。

式中:ε为摩尔吸光系数/(L/(mol·cm));A为吸光度;C为样品浓度/(mol/L);L为碤皿厚度(1cm)。
利用式(2)估算半抗原与载体蛋白结合的分子数之比即偶联比[9-10]。

1.3.4.2 SDS-PAGE蛋白鉴定
将Fen1-BSA、Fen2-BSA分别稀释成1mg/mL,10%分离胶,5%浓缩胶。分析样品5μL与等量上样缓冲液混合均匀后上样。浓缩胶电压80V,分离胶电压升至120V。用考马斯亮蓝R-250染色0.5h,乙酸-甲醇脱色过夜。
2 结果与分析
2.1 半抗原核磁共振鉴定分析
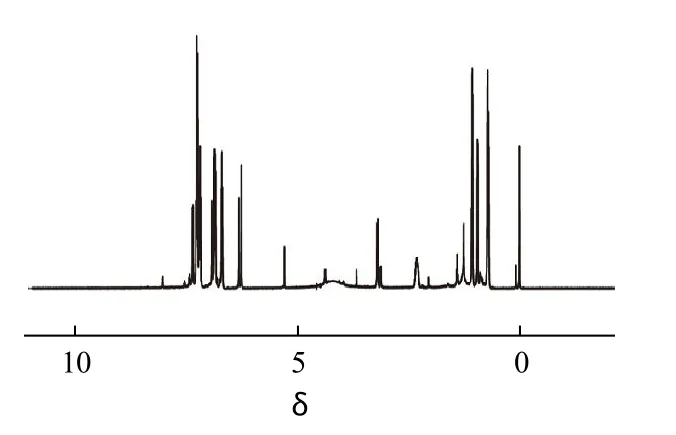
图3 Fen1 的核磁共振图谱Fig.3 1H-NMR spectrum of Fen1
将纯化后制备好的Fen1样品经图31H-NMR(T:300K,SW:7960.2,SF:599.779 MHz,d1:1s,CDCl3、TMS为内标)鉴定可知:δ:0.947(6H,—CH3);2.332 (1H,—CH);3.134~3.242(1H,—CH—CO);5.34 (2H,—NH2);6.25~6.336(1H,—CH—CN);6.705~6.964(4H,PH-H);7.181~7.332(4H,PH-H);7.375~7.397(4H,PH-H)。数据与化合物 Fen1的结构相符,由此确定为目标化合物。
将纯化后制备好的Fen2样品经图41H-NMR(T:300K,SW:10104.8,SF:599.784 MHz,d1:1s,DMSO-d6、TMS为内标)鉴定可知:δ:1.0(6H,—CH3);2.2~2.53(7H,—CH,—CH2);3.32~3.46(1H,—CH—CO);6.65~7.65(12H,PH-H);10.055(1H,—NH);12.196(1H,—OH)。数据与化合物Fen2的结构相符,由此确定为目标化合物。
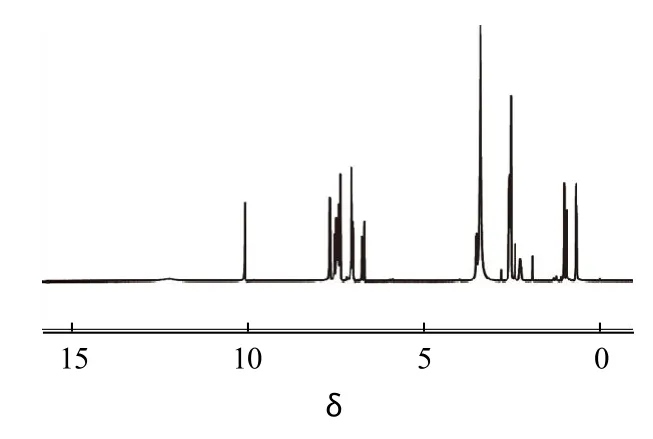
图4 Fen2的核磁共振图谱Fig.4 1H-NMR spectrum of Fen2
2.2 半抗原质谱鉴定分析
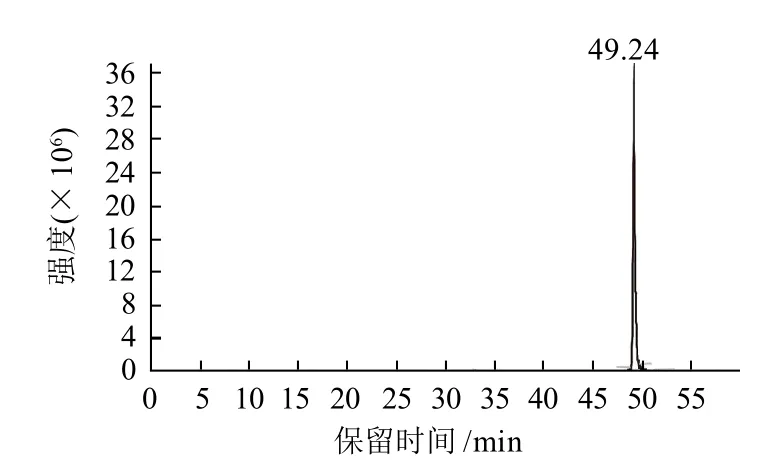
图5 Fen1的总离子流图Fig.5 Total ion current chromatogram of Fen 1

图6 Fen1的二级质谱扫描图Fig.6 Secondary mass spectrum of Fen 1
从图5可知,产物Fen1在液相色谱中的保留时间为49.2min。从图6可知,该物质的分子离子峰[M+H]+为435.4,表明新化合物的相对分子质量为434.4,与目标产物的理论相对分子质量一致。因此可以确定合成的物质为目标产物。
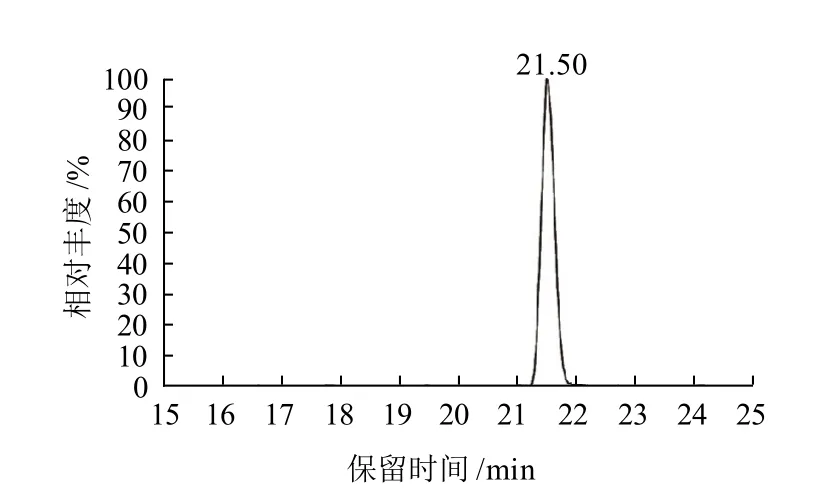
图7 Fen2的总离子流图Fig.7 Total ion current chromatogram of Fen 2
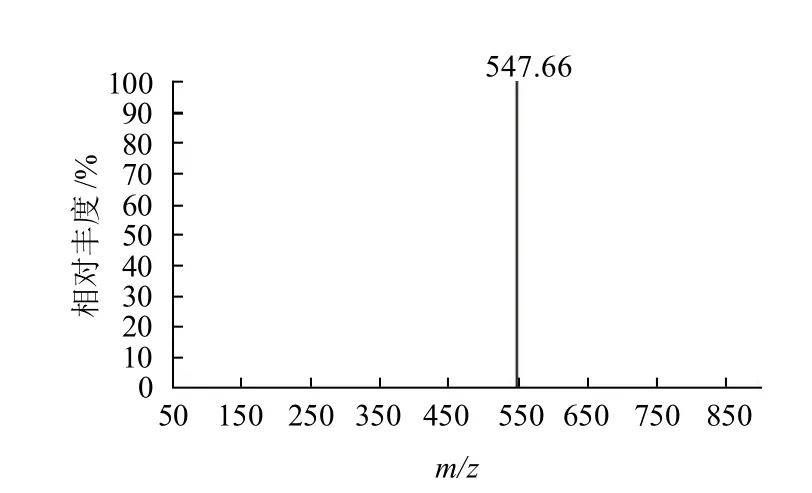
图8 Fen2的二级质谱扫描图Fig.8 Secondary mass spectrum of Fen 2
从图7可知,产物Fen2在液相色谱中的保留时间为21.5min。从图8可知,该物质的分子离子峰[M+H]+为535,表明新化合物的相对分子质量为534,与目标产物的理论相对分子质量一致。m/z 517为[M-H2O+H]+,而m/z 435 为合成该产物的反应物。因此可以确定合成的物质为目标产物。
2.3 人工抗原紫外扫描图谱与偶联比计算
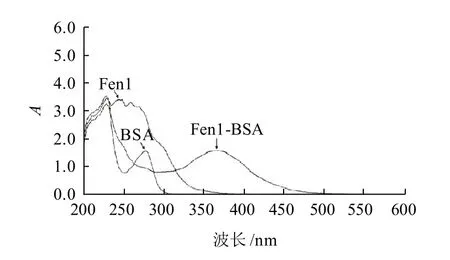
图9 Fen1、BSA和Fen1-BSA紫外扫描光谱图Fig.9 UV scanning spectra of Fen 1, Fen 1-BSA and BSA
由图9可见,Fen1在波长245nm处有特征吸收峰,BSA在波长280nm处有特征吸收峰,而产物在波长365nm处出现了特征吸收峰,较Fen1与BSA的特征吸收峰有明显不同,表明Fen1与BSA成功实现偶联,人工抗原合成成功。反应后测得产物中Fen1与BSA的偶联比约为9:1。

图10 Fen2、BSA和Fen2-BSA紫外扫描光谱图Fig.10 UV scanning spectra of Fen 2, Fen 2-BSA and BSA
由图10可见,Fen2在波长247nm处有特征吸收峰,BSA在波长280nm处有特征吸收峰,而产物在波长255nm处出现了特征吸收峰,较Fen1与BSA偶联产物的特征吸收峰有明显不同,表明Fen2与BSA成功实现偶联,人工抗原合成成功。反应后测得产物中Fen2与BSA的偶联比约为10:1。
2.4 SDS-PAGE电泳鉴定结果
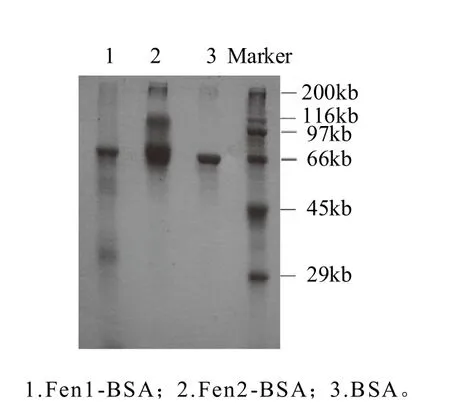
图11 Fen1-BSA、Fen2-BSA、BSA的SDS-PAGE电泳图Fig.11 SDS-PAGE of BAS, Fen 1-BSA, Fen 2-BSA
如图11所示,载体蛋白BSA条带清晰紧凑,而合成的人工抗原稍有杂带且有拖尾现象,两种人工抗原的迁移率均比BSA 的迁移率小,表明两种人工抗原分子质量大于载体蛋白分子质量,人工抗原制备成功。
3 讨 论
要制备高质量的特异性抗体,取决于抗原的设计与合成。Parker[11]和Wing等[12]研究认为,半抗原结构中离载体蛋白最远端的部分对抗体的特异性起决定作用,为使具有特异性的氰戊菊酸结构成为载体蛋白最远端,同时具备能与蛋白质偶联的活性基团氨基,本实验通过5步化学合成法在氰戊菊酯苯氧基的末端引入氨基合成半抗原Fen1。由于在活性位点引入一定长度的连接臂,可以使得化合物的特异位点能够充分暴露而不会被蛋白质所隐藏,增加抗体对靶标化合物的识别能力[13],因此,在Fen1的基础上连接了3个碳的连接臂,合成半抗原Fen2,使其区别于其他拟除虫菊酯类农药的特征性结构,更好地展现了空间结构和暴露特异性位点。目前,国内外针对Fen人工抗原合成的报道并不多,魏新林等[14]以氰戊菊酯的特征部分氰戊菊酸作为半抗原合成人工抗原,姜娟等[15]在氰戊菊酯分子结构中间位置的氰基连接三个碳的手臂作为半抗原合成人工抗原,本方法合成的氰戊菊酯半抗原既能展现氰戊菊酯的空间结构,又能突出氰戊菊酯的特异性结构。
农药小分子只具有抗原性而不具有免疫原性,只有有效地与大分子蛋白质偶联,才能引起小鼠的免疫应答反应。通过重氮法将Fen1与BSA偶联合成了人工抗原Fen1-BSA,通过活泼酯法将Fen2与BSA偶联合成人工抗原Fen2-BSA。研究认为,当半抗原与载体的偶联比为8:1~25:1时免疫原性较强[16-17],经紫外吸收光谱计算出两种人工抗原偶联比分别为9:1和10:1。
目前,尚没有成熟实用的免疫检测试剂盒进入市场。Fen人工抗原的合成成功为建立Fen的快速免疫检测方法,真正实现氰戊菊酯农药残留快速、简便、现场检测奠定了基础。同时,通过对不同长度连接臂抗原制备的抗体对比分析,将为揭示半抗原空间手臂的长短对抗体与目标分子互相作用的影响机制提供参考。
[1]张惠兰, 周建英, 孟淑洁, 等. 蔬菜中菊酯类农药残留量情况调查[J].辽宁农业科学, 2001(3): 15-16.
[2]卫生部食品卫生监督检验所. GB 14928.5—94食品中氰戊菊酯最大残留限量标准[S]. 北京: 中国标准出版社, 1994.
[3]RAMESH A, BALASUBRAMANIAN M. Rapid preconcentration method for the determination of pyrethroid insecticides in vegetable oils and butter fat and simultaneous determination by gas chromatographyelectroncapture detection and gas chromatography-mass spectrometry[J]. Analyst, 1998, 123(9): 1799-1802.
[4]PAVAN F A, DALLAGO R M, ZANELLA R, et a1. Determination of deltamethrin in cattle dipping baths by high-performance liquid chromatography[J]. Agric Food Chem, 1999, 47(1): 174-176.
[5]ANGERER J, RITTER A. Determination of metabolites of pyrethroids in human urine using solid-phase extraction and gas chromatographymass spectrometry[J]. Chromatogr B, 1997, 695(2): 217-226.
[6]LEE J K, AHN K C, PARK O S, et al. Development of an ELISA for the detection of the residues of the insecticide imidacloprid in agricultural and environmental samples[J]. J Agric Food Chem, 2001, 49(5): 2159-2167.
[7]WENGATZ I, STOUTAMIRE D W, GEE S J, et al. Development of an enzyme-linked immunosorbent assay for the detection of the pyrethroid insecticide fenpropathrin[J]. J Agric Food Chem, 1998, 46(6): 2211-2221.
[8]MAK S K, SHAN G M, LEE H J. Development of a class selective immunoassay for the type II pyrethroid insecticides[J]. Analytica Chimica Acta, 2005, 534(1): 109-120.
[9]谢忠良, 李文, 何计国, 等. 氯羟吡啶人工抗原合成和鉴定[J]. 食品科学, 2009, 30(1): 15-16.
[10]孔晔, 李培武, 张奇, 等. 一种新型溴氰菊酯农药半抗原的合成及应用效果[J]. 化学试剂, 2009, 31(4): 10-14.
[11]PARKER C W. Radioimmunoassay of biologically active compounds [M]. Prentice Hall: Englewood Cliffs, 1976.
[12]WING K D, HAMMOCK B D. Stereoselectivity of a radioimmunoassay for the insecticide S-bioallethrin[J]. Experientia, 1979, 35(12): 1619-1620.
[13]尤海芹, 周元元, 刘曙照, 等. 拟除虫菊酯类农药半抗原合成方法进展[J]. 现代农药, 2004, 4(3): 6-9.
[14]魏新林, 刘莹, 张少恩, 等. 氰戊菊酯特异性人工抗原的合成与鉴定[J]. 农产品加工: 学刊, 2009(3): 5-9.
[15]姜娟, 李培武, 张奇, 等. 氰戊菊酯免疫分析关键试剂人工抗原的合成与应用效果[J]. 化学试剂, 2010, 32(6): 484-488.
[16]ERLANGER B F. The preparation of antigenic hapten-carrier conjugates: a survey[J]. Methods Enzymol, 1980, 70(A): 85-104.
[17]LI Qingxiao, ZHAO Mengshu, GEE S J, et al. Development of enzymelinked immunosorbent assays for 4-nitrophenol and substituted 4-nitrophenols[J]. J Agric Food Chem, 1991, 39(9): 1685-1692.
Synthesis and Identification of Two Types of Specific Artificial Antigen for Fenvalerate
XIONG Zhen-yu1,YANG Yan-yan1,LI Pei-wu2,3,4,*,ZHANG Qi2,3,4,ZHANG Wen2,3,4,DING Xiao-xia2,3,4
(1. Faculty of Life Sciences, Hubei University, Wuhan 430062, China;2. Oil Crops Research Institute, Chinese Academy of Agricultural Sciences, Wuhan 430062, China;3. Key Laboratory of Oil Crops Biology, Ministry of Agriculture, Wuhan 430062, China;4. Quality Inspection and Test Center for Oilseeds and Products, Ministry of Agriculture, Wuhan 430062, China)
Fenvalerate, with a typical chemical structure, was selected as the research object in this study. Two types of haptens were synthesized through separately introducing two space arms with different connecting lengths to one end of fenvalerate by organic synthesis.1H-NMR and LC-MS-MS identifications demonstrated the successful synthesis of haptens, which were designated as Fen 1 and Fen 2. Fen 1 and Fen 2 were separately coupled to bovine serum albumin (BSA), and two kinds of specific immunogens were obtained and named as Fen 1-BSA and Fen 2-BSA. UV-visible spectroscopic analysis indicated that the two artificial immunogens differed significantly from their corresponding heptens and the protein carrier. The coupling ratios between Fen 1 or Fen 2 and BSA were around 9:1 and 10:1, respectively. The results of SDS-PAGE showed that both haptens were conjugated to BSA successfully.
fenvalerate;hapten;artificial antigen;synthesis
TS207.3
A
1002-6630(2011)07-0178-05
2010-06-29
国家自然科学基金项目(30800771);国家现代农业(油菜)产业技术体系建设专项(nycytx-005);国家科技支撑计划项目(2010BAD01B07;2011BAD02D02);武汉市晨光青年计划项目(200950431224);武汉市科技研发中心平台项目(200820337086)
熊振宇(1985—),男,研究实习员,硕士研究生,主要从事免疫分析与食品质量安全研究。
E-mail:xiongzhenyu@163.com
*通信作者:李培武(1961—),男,研究员,博士,主要从事农产品质量标准与检测技术研究。E-mail:peiwuli@oilcrops.cn



