高兴喜,姚 强*,宫志远,郎 晓,任鹏飞,刘 岩
(1.鲁东大学菌物科学与技术研究院,山东 烟台 264025;2.山东省农业科学院土壤肥料研究所,山东 济南 250100;3.青岛农业大学生命科学学院,山东 青岛 266109)
不同脂肪酸对桑黄液体发酵的影响
高兴喜1,姚 强2,*,宫志远2,郎 晓1,任鹏飞2,刘 岩3
(1.鲁东大学菌物科学与技术研究院,山东 烟台 264025;2.山东省农业科学院土壤肥料研究所,山东 济南 250100;3.青岛农业大学生命科学学院,山东 青岛 266109)
考察不同种类及质量浓度的脂肪酸对桑黄液体发酵的影响。结果表明:脂肪酸对桑黄菌体生长以及多糖、三萜和黄酮类物质的合成的影响随脂肪酸种类以及质量浓度的不同而表现出不同的变化趋势。油酸有利于桑黄生物量的积累,在质量浓度为2.0g/L时,使桑黄生物量达到1.24g/L,比对照提高了33.33%;而硬脂酸则有利于桑黄胞外多糖的产生,在质量浓度2.0g/L时,使胞外多糖产量达到325.38mg/L,是对照的3.20倍。对胞内多糖而言,油酸和硬脂酸诱导效果较好,分别在质量浓度0.5g/L和1.0g/L时,使产量达到645.79mg/L和655.12mg/L,而亚油酸则在高质量浓度时才表现出较好的诱导效果。对于桑黄三萜的生产而言,油酸无论是对胞外三萜还是胞内三萜,都表现出较好的诱导效果,并分别在质量浓度1.5g/L和2.0g/L时,使胞外三萜和胞内三萜产量达到666.15mg/L和339.32mg/L,分别为对照的1.28倍和2.30倍。此外,亚油酸还对胞内三萜的生产表现出较好的诱导效果。对于黄酮类物质的合成,本实验所考察的这几种脂肪酸均未表现出明显的促进作用。
桑黄;脂肪酸;多糖;三萜类物质;黄酮类物质
桑黄(Phellinus igniarius)俗称桑黄菇、桑臣、桑耳等,是一种珍贵的大型药用真菌。目前,桑黄是国际公认的生物抗癌领域中效果最好的真菌[1]。桑黄具有抗癌、抗炎、抗氧化、提高免疫力、保肝护肝等多种药用功效[2-5],现代药理学研究表明,三萜、多糖和黄酮类物质是其关键药性成分[6]。目前,桑黄在国际市场上供不应求,野生桑黄资源有限,桑黄的人工栽培研究在国内又刚刚起步,因此,采用液体发酵技术进行桑黄的规模化生产具有广阔的前景[7]。
桑黄液体发酵研究已有较多报道[8-10],但活性物质产量偏低仍是限制其应用的主要瓶颈,因此,提高桑黄液体发酵效率成为人们研究的一个热点。有研究表明,向培养基中添加脂肪酸或油脂类物质能够促进牛肝菌、香菇和平菇等菌丝的生长[11-14]。研究人员还发现,脂肪酸或油脂还能促进灵芝、米曲霉等真菌产生多糖和黄曲霉毒素等代谢产物[15-17]。本实验考察几种脂肪酸对桑黄液体发酵的影响,拟为提高桑黄活性物质的液体发酵生产探索一条新的途径。
1 材料与方法
1.1 材料与试剂
棕榈酸、油酸、硬脂酸、亚油酸 上海晶纯实业有限公司;香兰素、芦丁、齐墩果酸 上海生工生物工程服务有限公司;其他试剂均为分析纯。
1.2 菌株与培养基
桑黄(Phellinus igniarius,菌株编号:CGMCC 5.95)购自中国普通微生物菌种保藏管理中心。
菌株活化培养基为PDA培养基,扩大培养和液体发酵培养基均为PDB培养基。
1.3 发酵实验
将于PDA平板上活化好的桑黄菌株,打取直径0.5cm菌块接入PDB培养基(500mL三角瓶装有150mL PDB培养基)于摇床25℃、150r/min振荡培养7d左右制备液体菌种。
设棕榈酸、油酸、硬脂酸、亚油酸4种脂肪酸每种5个质量浓度梯度:0、0.5、1.0、1.5、2.0g/L,每个质量浓度设3个重复,分别配制PDB发酵培养基。按10%的接种量依次接入桑黄液体菌种,置于25℃、150r/min的摇床中进行发酵培养,培养7d左右结束发酵。
1.4 活性物质的提取与检测
多糖的提取与检测参照文献[18]方法进行;三萜的提取与检测参照文献[19]方法进行;黄酮类物质的提取与检测参照文献[20]方法进行。
2 结果与分析
2.1 脂肪酸对桑黄菌体生物量的影响
发酵结束后,过滤收集各处理组桑黄菌体并用去离子水洗涤3次,然后置于60℃烘箱中烘干至质量恒定,测定其生物量,结果见图1。
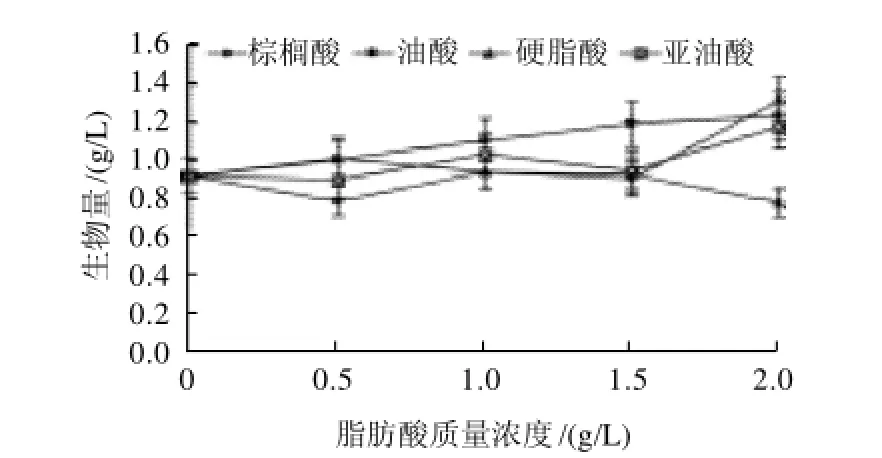
图1 不同脂肪酸对桑黄菌体生物量的影响Fig.1 Effect of different fatty acids on the biomass of Phellinus igniarius
如图1所示,不同脂肪酸对桑黄生物量的影响呈现不同变化趋势,其中油酸在各检测质量浓度都能促进桑黄菌体生物量的增加,且与质量浓度呈正相关性,但当油酸质量浓度达到1.5g/L时,生物量增加趋势变缓,当油酸质量浓度达到2.0g/L时,桑黄生物量达到1.24g/L,比对照(不加脂肪酸,即脂肪酸质量浓度为0时)提高了33.33%。棕榈酸和亚油酸在低质量浓度时(<1.5g/L)对桑黄生物量促进作用不明显,甚至表现为抑制作用,而在质量高浓度时则体现出较强的促进作用,当质量浓度为2.0g/L时,棕榈酸和亚油酸处理组桑黄生物量分别达到1.31g/L和1.18g/L,比对照组分别提高了40.86%和26.88%。而硬脂酸则只在低质量浓度表现为促进作用,当质量浓度达到1.0g/L以上时,则对桑黄生物量表现为抑制作用。
2.2 脂肪酸对桑黄多糖的影响
2.2.1 脂肪酸对桑黄胞外多糖的影响
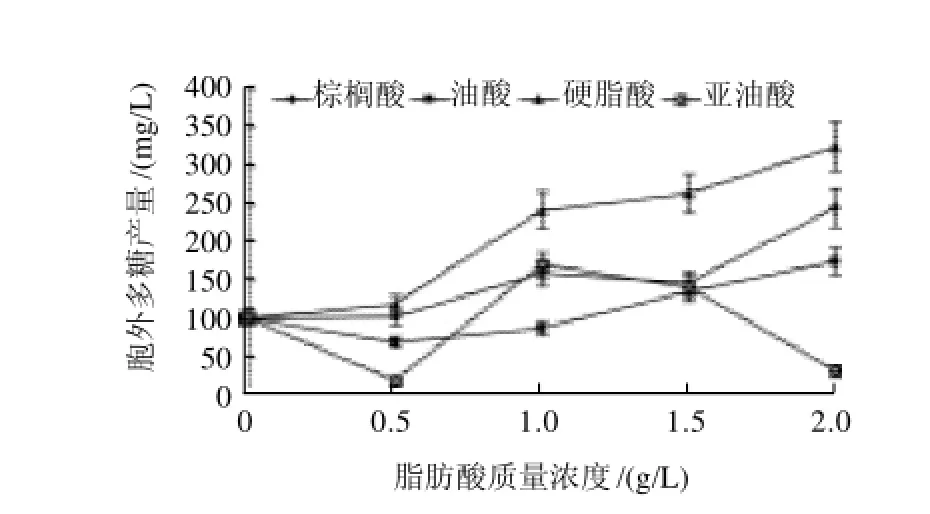
图2 不同脂肪酸对桑黄胞外多糖的影响Fig.2 Effect of different fatty acids on the production of EPS in Phellinus igniarius
脂肪酸不同,对桑黄胞外多糖的作用效果也不同。从图2可以看出,棕榈酸、油酸和硬脂酸都能促进桑黄胞外多糖的产生,且与各脂肪酸的质量浓度呈正相关性,其中对桑黄胞外多糖生产诱导效果最好的是硬脂酸,其次为棕榈酸和油酸,在质量浓度2.0g/L时相应胞外多糖产量分别达到325.38、245.11mg/L和174.58mg/L,为对照组的3.20、2.41倍和1.72倍。而亚油酸对桑黄胞外多糖合成影响的规律性不明显,其最佳诱导质量浓度为1.0g/L,但与其他几种脂肪酸相比,作用效果较弱。
2.2.2 脂肪酸对桑黄胞内多糖的影响
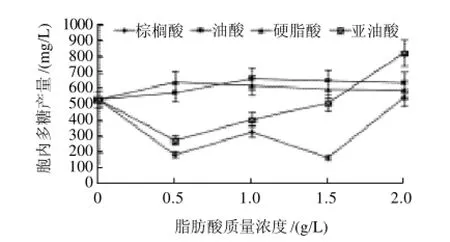
图3 不同脂肪酸对桑黄胞内多糖的影响Fig.3 Effect of different fatty acids on the production of IPS in Phellinus igniarius
脂肪酸对桑黄胞内多糖生产的作用效果与胞外多糖相比,促进作用不十分显着。从图3可以看出,油酸和硬脂酸在低质量浓度(0.5~1.5g/L)时对桑黄胞内多糖的产生表现为一定的诱导作用,分别于质量浓度0.5g/L和1.0g/L时使胞内多糖产量达到645.79mg/L和655.12mg/L,与对照组相比分别提高了20.28%和22.24%,但随着质量浓度的升高,诱导效果逐渐下降;而亚油酸和棕榈酸则在低质量浓度(0.5~1.5g/L)时对胞内多糖的生产表现为强烈的抑制作用,但在高质量浓度(2.0g/L)时则具有一定的促进作用,特别是亚油酸,使桑黄胞内多糖的产量达到820.04mg/L,比对照组提高了52.73%。
2.3 脂肪酸对桑黄三萜类物质的影响
2.3.1 脂肪酸对桑黄胞外三萜类物质的影响
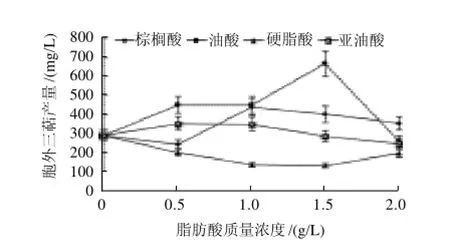
图4 不同脂肪酸对桑黄胞外三萜的影响Fig.4 Effect of different fatty acids on the production of EGT in Phellinus igniarius
除硬脂酸外,其余3种脂肪酸都能在一定程度上促进桑黄胞外三萜的产生,结果见图4。桑黄胞外多糖的产生与油酸、棕榈酸和亚油酸的质量浓度呈现一定的相关性,总体趋势都是随着脂肪酸的质量浓度先升高再降低而变化,其中油酸对桑黄胞外三萜的诱导效果最好,当质量浓度为1.5g/L时,胞外三萜产量最高达666.15mg/L,是对照组的1.28倍;而棕榈酸和亚油酸则在质量浓度为0.5g/L时诱导效果最好,但与油酸相比,其诱导作用要逊色很多。在本实验中,硬脂酸对桑黄三萜的生产不但没有促进作用,反而表现为较强的抑制作用。
2.3.2 脂肪酸对桑黄胞内三萜类物质的影响
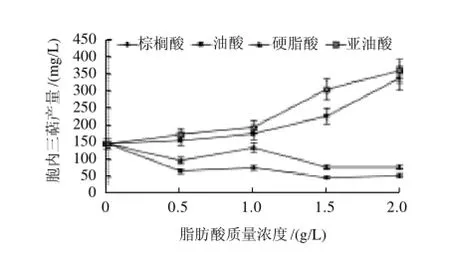
图5 不同脂肪酸对桑黄胞内三萜的影响Fig.5 Effect of different fatty acids on the production of IGT in Phellinus igniarius
不同脂肪酸对桑黄胞内三萜的影响呈现出与胞外三萜不同的变化趋势,结果见图5,对桑黄胞内三萜生产诱导效果较好的脂肪酸是亚油酸和油酸,而且随着两者质量浓度的不断升高,诱导作用不断增强,当质量浓度达到2.0g/L时,桑黄胞内三萜产量分别达到361.07mg/L和339.32mg/L,分别为对照组的2.45倍和2.30倍。而另外两种脂肪酸硬脂酸和棕榈酸则在各检测质量浓度范围内对桑黄胞内三萜的生产表现为抑制作用。
2.4 脂肪酸对桑黄黄酮类物质的影响
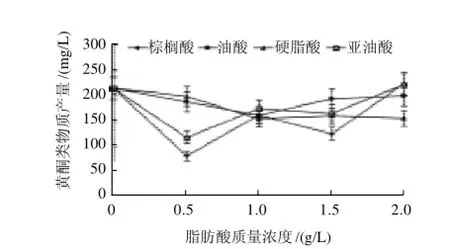
图6 不同脂肪酸对桑黄黄酮类物质的影响Fig.6 Effect of different fatty acids on the production of flavonoids in Phellinus igniarius
桑黄是少有的可产生黄酮类物质的药用真菌。如图6所示,所考察的几种脂肪酸对桑黄黄酮的诱导效果均不理想,在低质量浓度时都表现为抑制作用,只有在较高质量浓度时才表现出一定的促进作用,如亚油酸和棕榈酸质量浓度分别在2.0g/L时,使黄酮的产量达到221.88mg/L和223.82mg/L,分别比对照组提高了3.30%和4.18%;而硬脂酸和油酸这两种脂肪酸即使在高质量浓度时,对桑黄黄酮的诱导作用也极为有限。因此,总体来看,向培养基中添加脂肪酸并不能有效提高桑黄黄酮的产量。
3 结论与讨论
本实验通过考察棕榈酸、油酸、硬脂酸、亚油酸这4种脂肪酸对桑黄液体发酵活性成分生产的影响,得出如下结论:1)硬脂酸可显着促进桑黄胞外多糖的产生,油酸和硬脂酸在一定程度上促进了胞内多糖的产生,但作用效果较弱。2)对于三萜类物质的生产,油酸无论是对胞外三萜还是胞内三萜,都表现出较好的诱导作用。3)对于黄酮类物质的生产,本实验所考察的几种脂肪酸均未表现出明显的促进作用。
近年来,通过液体深层发酵的方法生产真菌多糖、三萜类物质等活性成分的研究方兴未艾。为了提高生产效率,人们广泛采用优化环境条件或者培养基组成等策略[21]。在真菌多糖液体发酵生产中,通常会伴随β-葡聚糖而产生大量的气泡,人们在用一些脂肪酸(植物油)作为消泡剂时却意外地发现这些脂肪酸能够促进多糖的产生[16,22],于是,人们开始尝试用脂肪酸作为一种诱导因子来促进某些真菌特定活性成分的生产。
罗洁等[14]在研究不同脂肪酸对平菇菌丝生长的影响时发现,不饱和脂肪酸更有利于平菇菌丝的生长,和本实验所得结论类似,油酸和亚油酸相对于饱和脂肪酸(硬脂酸)对桑黄菌丝生长具有更好的诱导效果。但各脂肪酸对桑黄多糖和三萜类物质等活性成分生产的影响,却因脂肪酸的种类不同而表现出较为复杂的变化。例如,对于胞外多糖的生产,硬脂酸诱导效果最好,而对于胞内多糖的生产,油酸的诱导效果较好。同样,对于桑黄三萜类物质的生产,也因脂肪酸的种类和浓度不同而体现出不同的变化趋势。Yang等[17]在研究不同脂肪酸对灵芝菌丝生长和多糖生产时,也发现脂肪酸链的长短以及饱和度不同,对灵芝的生长或多糖的生产表现为促进或抑制作用,并推测其可能机制是因为灵芝细胞的膜结构以及渗透性的不同所致,但确切的机制还有待于以后深入研究。另外,本实验所考察的几种脂肪酸对桑黄黄酮类物质的生产没有体现出促进作用,这一方面可能是因为所考察的脂肪酸种类有限,未能找出适宜的脂肪酸,另一方面也可能是因为在培养基中添加脂肪酸不利于黄酮类物质的合成。
[1] 戴玉成. 药用担子菌: 鲍氏层孔菌(桑黄)的新认识[J]. 中草药, 2003, 34(1): 94-95.
[2] LI Ge, KIM D H, KIM T D, et al. Protein-bound polysaccharide from Phellinus linteus induces G2/M phase arrest and apoptosis in SW480 human colon cancer cells[J]. Cancer Letters, 2004, 216(2): 175-181.
[3] SHONE M Y, KIM T H, SUNG N J. Antioxidants and free radical scavenging activityof Phellinus baumii (Phellinus of Hymenochaetaceae) extracts[J]. Food Chemistry, 2003, 82(4): 593-597.
[4] 张万国, 胡晋红, 蔡溱. 桑黄对实验性肝纤维化大鼠血液动力学的影响[J]. 解放军药学学报, 2002, 18(6): 341-343.
[5] 郑立军, 沈业寿, 季俊虬, 等. 桑黄胞外多糖药理活性的初步研究[J].食品科学, 2007, 28(1): 318-321.
[6] 吕英华, 王建芳, 李玉平, 等. 药用真菌桑黄的研究进展[J]. 蚕业科学, 2009, 35(1): 204-210.
[7] 牛广财, 朱丹, 李志江, 等. 响应面法优化桑黄菌产胞外多糖液体发酵培养的研究[J]. 生物数学学报, 2009, 24(3): 523-530.
[8] HWANG H J, KIM S W. Production and characterization of exopolysaccharides from submerged culture of Phellinus linteus KCTC 6190[J]. Enzyme and Microbial Technology, 2003, 33(2/3): 309-319.
[9] KIM D H , YANG B K, JEONG S C, et al. Production of a hypoglycemic, extracellular polysaccharide from the submerged culture of the mushroom, Phellinus linteus[J]. Biotechnology Letters, 2001, 23(7): 513-517.
[10] 杨全, 李艳辉, 严寒静, 等. 药用真菌桑黄液体发酵工艺的研究[J].广东药学院学报, 2004, 20(3): 212-216.
[11] SCHISLER L C, VOLKOFF O. The effect of safflower oil on mycelial growth of Boletaceae in submerged liquid cultures[J]. Mycologia, 1977, 69(1): 118-125.
[12] 赵明亮, 邓世瑜. 油与香菇菌丝生长的关系[J]. 食用菌, 1987(6): 26-27.
[13] 罗洁, 刘玉环, 罗爱香, 等. 乌桕油脂对香菇菌丝生长的影响[J]. 食品科学, 2007, 28(9): 422-424.
[14] 罗洁, 刘玉环. 不同脂肪酸对平菇菌丝生长的影响[J]. 食品科学, 2008, 29(8): 453-455.
[15] FUKUSHIMA Y, ITOH H, FUKASE T, et al. Stimulation of protease production by Aspergillus oryzae with oils in continuous culture[J]. Applied Microbiology and Biotechnology, 1991, 34(5): 586-590.
[16] STASINOPOULOS S J, SEVIOUR R J. Stimulation of exopolysaccharide production in the fungus Acremonium persicinum with fatty acids[J]. Biotechnology and Bioengineering, 1990, 36(8): 778-782.
[17] YANG F C, KE Y F, KUO S S. Effect of fatty acids on the mycelial growth and polysaccharide formation by Ganoderma lucidum in shake flask cultures[J]. Enzyme and Microbial Technology, 2000, 27(3/5): 295-301.
[18] 欧阳小丽, 张晓昱, 王宏勋, 等. 桑黄菌丝体多糖提取方法的研究[J].中国食用菌, 2004, 24(5): 35-37.
[19] 张志军, 朱越, 罗莹, 等. 灵芝中三萜化合物提取工艺[J]. 食品研究与开发, 2009, 30(9): 81-83.
[20] 刘艳芳, 杨焱, 贾薇, 等. 药用真菌桑黄总黄酮测定方法研究[J]. 食用菌学报, 2006, 13(2): 45-48.
[21] YANG F C, LIAU C B. The influence of environmental conditions on polysaccharide formation by Ganoderma lucidum in submerged cultures [J]. Process Biochemistry, 1998, 33(5): 547-553.
[22] REESE E T, MAGUIRE A. Surfactants as stimulants of enzyme production by microorganisms[J]. Applied Microbiology, 1969, 17(2): 242-245.
Effect of Different Fatty Acids on Liquid-state Fermentation of Phellinus igniarius
GAO Xing-xi1,YAO Qiang2,*,GONG Zhi-yuan2,LANG Xiao1,REN Peng-fei2,LIU Yan3
(1. Institute of Mycological Science and Technology, Ludong University, Yantai 264025, China;2. Soil and Fertilizer Institute, Shandong Academy of Agricultural Sciences, Jinan 250100, China;3. School of Life Sciences, Qingdao Agricultural University, Qingdao 266109, China)
The fatty acids palmitic acid, oleic acid, stearic acid and linoleic acid were separately added to the liquid culture medium for Phellinus igniarius to investigate their effects on the production of biomass, polysaccharides, triterpenoids and flavonoids during shake culture. The results indicated that the extent of stimulation or inhibition on the production of biomass, polysaccharides, triterpenoids and flavonoids were associated with the types and levels of added fatty acids. Oleic acid at the concentration of 2.0 g/L led to a significant increase in biomass to 1.24 g/L, which was 33.33% higher than that of the control. Stearic acid was of great advantage for extracellular polysaccharide (EPS) production, and increased the yield to 325.38 mg/L, which was 3.20 times higher than that of the control. As for intracellular polysaccharide (IPS) production, oleic acid and stearic acid were both good elicitors, and increased the yield to 645.79 mg/L and 655.12 mg/L, respectively, and a much better stimulation was observed from linoleic acid at a higher concentration of 2.0 g/L. In addition, oleic acid was beneficial to the production of either extracellular triterpenoids (EGT) at 1.5 g/L concentration or intracellular triterpenoids (IGT) at 2.0 g/L concentration, and increased their yields to 666.15 mg/L and 339.32 mg/L, respectively. However, linoleic acid showed positive effect only on the production of IGT. In contrast, no satisfied results were gotten for the production of flavonoids from P. igniarius in this study.
Phellinus igniarius;fatty acids;polysaccharide;triterpenoids;total flavonoids
Q93.335
A
1002-6630(2011)07-0198-04
2010-07-25
山东省自然科学基金项目(Q2008D02;ZR2010CL020);“十一五”国家科技支撑计划项目(2007BAD89B09-11);山东省农业良种工程项目(2007LZ06-3);“泰山学者”建设工程专项经费项目;鲁东大学食(药)用真菌创新团队项目
高兴喜(1972—),男,副教授,博士,主要从事高等真菌分子生物学与代谢生理研究。E-mail:gaoxingxi@yahoo.com.cn
*通信作者:姚强(1979—),男,助理研究员,博士,主要从事分子育种、微生物生理生化研究。E-mail:qyaomail@163.com



